Catión 2-norbornilo
En química orgánica, el término catión 2-norbornilo (o catión 2-biciclo[2.2.1]heptilo) describe uno de los tres carbocationes formados a partir de derivados del norbornano. Aunque se han estudiado los cationes 1-norbornilo y 7-norbornilo, los estudios más extensos y los debates vigorosos se han centrado en la estructura exacta del catión 2-norbornilo.
El catión 2-norbornilo se ha formado a partir de una variedad de derivados y reactivos de norbornano. Los primeros informes de su formación y reactividad publicados por Saul Winstein generaron controversia sobre la naturaleza de su enlace, ya que invocó un enlace de dos electrones de tres centros para explicar el resultado estereoquímico de la reacción. Herbert C. Brown cuestionó esta afirmación con el argumento de que las estructuras de resonancia clásicas podrían explicar estas observaciones sin necesidad de adaptar una nueva perspectiva de enlace. Los puntos de vista de ambos investigadores tenían sus partidarios, y docenas de científicos contribuyeron con experimentos ingeniosamente diseñados para proporcionar evidencia de un punto de vista u otro. Con el tiempo, la disputa se hizo cada vez más amarga y enconada, y el debate adquirió un carácter personal o ad hominem.
La evidencia de la naturaleza no clásica del catión 2-norbornilo creció a lo largo de varias décadas, principalmente a través de datos espectroscópicos recopilados mediante métodos como la resonancia magnética nuclear (RMN). La confirmación cristalográfica de su naturaleza no clásica no llegó hasta 2013. Aunque la mayoría de los químicos ahora están de acuerdo en que el catión 2-norbornilo en sí mismo no es clásico, también se reconoce ampliamente que el panorama energético de los carbocationes tiende a ser "plano", con muchos estructuras potenciales que difieren sólo minuciosamente en energía. Ciertamente, no todos los carbocationes bicíclicos son no clásicos; la diferencia de energía entre estructuras clásicas y no clásicas suele estar delicadamente equilibrada. Por lo tanto, ahora se sabe que ciertos cationes 2-biciclo [2.2.1] heptilo sustituidos con alquilo adoptan estructuras clásicas.
La naturaleza de los enlaces en el catión 2-norbornilo incorporó muchas ideas nuevas a la comprensión del campo de los enlaces químicos. Se pueden apreciar similitudes entre este catión y otros, como los boranos.
Teoría
La naturaleza del enlace en el catión 2-norbornilo fue el centro de un vigoroso y conocido debate en la comunidad química a mediados del siglo XX. Si bien la mayoría de los químicos creía que un enlace de dos electrones de tres centros representaba mejor su estructura electrónica de estado fundamental, otros argumentaron que todos los datos relacionados con el catión 2-norbornilo podrían explicarse representándolo como un par de cationes que se equilibran rápidamente.
En el punto álgido del debate, todos los químicos acordaron que la imagen deslocalizada del enlace de electrones podría aplicarse al catión 2-norbornilo. Pero esto no respondió a la pregunta fundamental sobre la que giraba el debate. Los investigadores continuaron buscando formas novedosas de determinar si la imagen deslocalizada de tres centros describía un estado de transición de baja energía (punto de silla en la superficie de energía potencial multidimensional) o un mínimo de energía potencial por derecho propio. Los defensores de la imagen "clásica" creían que el sistema se describía mejor con un potencial de pozo doble con una barrera muy baja, mientras que los del campo "no clásico" imaginaban el estado electrónico deslocalizado para describir un solo pozo de energía potencial.
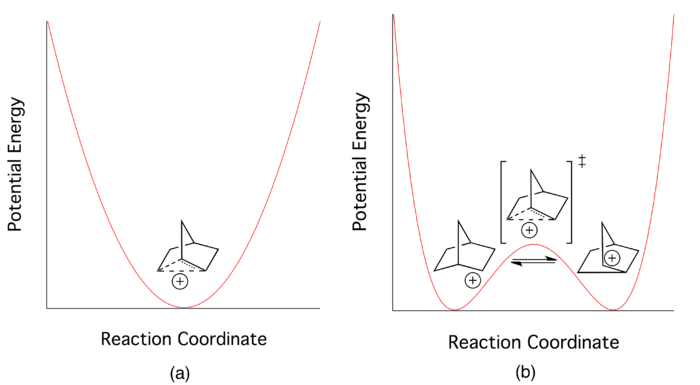 Figura 1: (a) En la vista no clásica, el catión deslocalizado es el mínimo de energía potencial estable. (b) En la visión clásica, es más bien un estado de transición bajo entre dos enantiómeros de la especie asimétrica.
Figura 1: (a) En la vista no clásica, el catión deslocalizado es el mínimo de energía potencial estable. (b) En la visión clásica, es más bien un estado de transición bajo entre dos enantiómeros de la especie asimétrica.
Hipovalencia: el cuadro no clásico
Los defensores de la naturaleza no clásica del catión 2-norbornilo estable suelen describir la especie utilizando estructuras de resonancia o una estructura única con enlaces parciales (consulte la Figura 2). Esta interacción hipovalente se puede imaginar como el efecto neto de i) un enlace sigma parcial entre los carbonos 1 y 6, ii) un enlace sigma parcial entre los carbonos 2 y 6, y iii) un enlace pi parcial entre los carbonos 1 y 2. Cada enlace parcial El enlace se representa como un enlace completo en una de las tres estructuras de resonancia o como un enlace parcial discontinuo si el catión se representa a través de una sola estructura.
Ha habido cierto debate sobre cuánto contribuye realmente la estructura de resonancia con enlaces pi a la estructura electrónica deslocalizada. A través de la espectroscopia H y C NMR, se ha confirmado que hay poca carga positiva en el carbono 6 de metileno. Esto no es sorprendente ya que los carbocationes primarios son mucho menos estables que los carbocationes secundarios. Sin embargo, el catión 2-norbornilo se puede formar a partir de derivados de β-(Δ -ciclopentenil)-etano, lo que indica que la estructura de resonancia con enlaces pi es significativa.
El catión 2-norbornilo fue uno de los primeros ejemplos de un ion no clásico. Los iones no clásicos se pueden definir como cationes orgánicos en los que la densidad electrónica de un orbital de enlace lleno se comparte en tres o más centros y contiene algún carácter de enlace sigma. El catión 2-norbornilo se considera el prototipo de los iones no clásicos. Otros cationes simples como el acetileno protonado (etinio, C2H3), etileno protonado (etenio, C2H5) y etano protonado (etanio, C2H7) se ha demostrado que se describen mejor como no clásicos a través de espectroscopia infrarroja.
La representación de orbitales moleculares propuesta con mayor frecuencia del catión 2-norbornilo se muestra en la Figura 3. Dos orbitales de tipo p, uno en cada uno de los carbonos 1 y 2, interactúan con un orbital con hibridación sp en el carbono 6 para formar el enlace hipovalente. Los cálculos extendidos de la teoría de Hückel para el catión 2-norbornilo sugieren que el orbital en el carbono 6 podría tener hibridación sp, aunque esto solo afecta la geometría de los hidrógenos geminales.
Equilibrio rápido: la imagen clásica
Según los defensores de un potencial de doble pozo clásico, el catión 2-norbornilo existe en equilibrio dinámico entre dos estructuras asimétricas enantioméricas. La especie deslocalizada central en la imagen no clásica es simplemente un estado de transición entre las dos estructuras. Los reordenamientos de Wagner-Meerwein se invocan como el mecanismo que convierte entre los dos enantiómeros (ver Figura 4).
Los esfuerzos para aislar las especies asimétricas espectroscópicamente no suelen tener éxito. Se informa que la principal razón de este fallo son las velocidades de reacción directa e inversa extremadamente rápidas, lo que indica una barrera potencial muy baja para la interconversión entre los dos enantiómeros.
Nortriciclonio: otra estructura no clásica
Algunos químicos también han considerado que el catión 2-norbornilo está mejor representado por el ion nortricilconio, un nortriciclono protonado con simetría C3. Esta representación se invocó por primera vez para explicar parcialmente los resultados de un experimento de codificación de isótopos C. La representación del orbital molecular de esta estructura implica una interacción en fase entre los orbitales con hibridación sp de los carbonos 1, 2 y 6 y el orbital atómico 1s en un átomo de hidrógeno compartido (consulte la Figura 5).
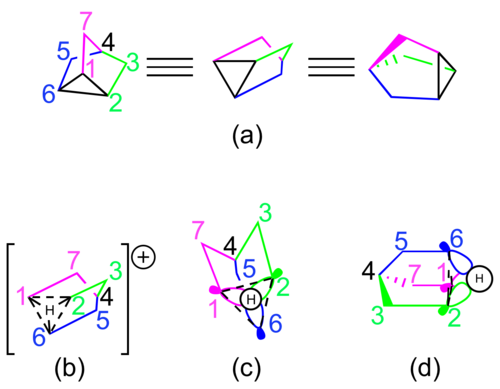 Figura 5: (Se agregaron colores para mayor claridad). (a) Nortricyclene; (b) ion nortriciclonio (nortriciclono protonado); (c, d) Orbitales moleculares para el ion nortriciclonio. Tenga en cuenta que el cargo neto se ha omitido para mayor claridad.
Figura 5: (Se agregaron colores para mayor claridad). (a) Nortricyclene; (b) ion nortriciclonio (nortriciclono protonado); (c, d) Orbitales moleculares para el ion nortriciclonio. Tenga en cuenta que el cargo neto se ha omitido para mayor claridad.
Historia
Iones no clásicos
Los iones no clásicos se diferencian de los cationes tradicionales en su estructura electrónica: aunque los enlaces químicos suelen representarse como el intercambio de electrones entre dos átomos, los iones no clásicos estables pueden contener tres o más átomos que comparten un solo par de electrones. En 1939, Thomas Nevell y otros intentaron dilucidar el mecanismo para transformar el clorhidrato de canfeno en cloruro de isobornilo. En uno de los mecanismos de reacción propuestos descritos en el artículo, la carga positiva de un catión intermedio no se asignó a un solo átomo sino a la estructura como un todo. Esto fue citado más tarde por los opositores a la descripción no clásica como la primera vez que se invocó un ion no clásico.Sin embargo, el término "ion no clásico" no apareció explícitamente en la literatura química hasta más de una década después, cuando se usó para etiquetar el enlace deslocalizado en un catión butilo piramidal.
El término ion sinartésico también se invocó para describir la unión deslocalizada en carbocationes estables antes de que el término ion no clásico fuera de uso generalizado. Los primeros usuarios de este término comentaron sobre la sorprendente similitud entre la unión en estos tipos de cationes y la unión en borohidruros.
Primeras propuestas no clásicas
En 1949, Saul Winstein observó que el brosilato de 2- exo -norbornilo (p -bromobencenosulfonato) y el tosilato de 2- endo -norbornilo (p - toluenosulfonato) daban una mezcla racémica del mismo producto, acetato de 2- exo -norbornilo, tras la acetólisis (ver Figura 6). Dado que los tosilatos y los brosilatos funcionan igual de bien como grupos salientes, concluyó que tanto el norbornano sustituido en 2- endo como en 2- exo debe pasar por un intermedio catiónico común con una reactividad exo dominante. Informó que este intermedio probablemente era un catión 2-norbornilo simétrico y deslocalizado.Más tarde se demostró mediante cromatografía en fase de vapor que la cantidad de endoepímero del producto producido era inferior al 0,02 %, lo que demuestra la alta estereoselectividad de la reacción.
 Figura 6: La acetólisis de norbornanos sustituidos en 2 -
Figura 6: La acetólisis de norbornanos sustituidos en 2 -
endo y 2-
exo produce solo acetato de 2-
exo -norbornilo.
Cuando un único enantiómero de brosilato de 2- exo -norbornilo se somete a acetólisis, no se observa actividad óptica en el acetato de 2- exo -norbornilo resultante (véase la Figura 7). Según la descripción no clásica del catión 2-norbornilo, el plano de simetría presente (que pasa por los carbonos 4, 5 y 6) permite un acceso igualitario a ambos enantiómeros del producto, lo que da como resultado la mezcla racémica observada.
También se observó que los norbornanos 2- exo -sustituidos reaccionaron 350 veces más rápido que los correspondientes endoisómeros. La asistencia anquimérica del enlace sigma entre los carbonos 1 y 6 se racionalizó como la explicación de este efecto cinético. Es importante destacar que la asistencia anquimérica invocada llevó a muchos químicos a postular que la estabilidad energética del catión 2-norbornilo se debía directamente a la estructura puente simétrica invocada en la explicación no clásica. Sin embargo, algunos otros autores ofrecieron explicaciones alternativas para la alta estabilidad sin invocar una estructura no clásica.
En 1951, se sugirió por primera vez que el catión 2-norbornilo en realidad podría describirse mejor cuando se lo considera como un ion nortriciclonio. Se ha demostrado que el principal producto formado a partir de una reacción de eliminación del catión 2-norbornilo es el nortriciclono (no el norborneno), pero se ha afirmado que esto respalda ambos postulados de iones no clásicos.
Herbert C. Brown: una opinión disidente
Herbert C. Brown no creía que fuera necesario invocar un nuevo tipo de enlace en los intermedios estables para explicar la interesante reactividad del catión 2-norbornilo. Criticando a muchos químicos por ignorar las explicaciones anteriores de la reactividad, Brown argumentó que toda la información mencionada anteriormente sobre el catión 2-norbornilo podría explicarse utilizando efectos estéricos simples presentes en el sistema norbornilo. Dado que era válida una explicación alternativa que utilizaba un par de iones que se equilibraban rápidamente para describir el catión 2-norbornilo, no vio la necesidad de invocar una descripción estable y no clásica del enlace.Invocar iones no clásicos estables se estaba volviendo común; Brown sintió que esto no solo era injustificado sino también contraproducente para el campo de la química en su conjunto. De hecho, muchos artículos que informaron sobre iones no clásicos estables se retractaron más tarde por ser poco realistas o incorrectos. Después de publicar este controvertido punto de vista en 1962, Brown inició una búsqueda para encontrar pruebas experimentales incompatibles con la imagen deslocalizada del enlace en el catión 2-norbornilo.
Brown también trabajó para probar la inestabilidad de una estructura electrónica deslocalizada para el catión 2-norbornilo. Si se pudiera demostrar que el ion no clásico tiene una energía más alta que el par de iones clásicos correspondiente, el ion no clásico solo se vería como un estado de transición entre los dos cationes asimétricos. Aunque no descartó la posibilidad de un estado de transición deslocalizado, Brown continuó rechazando la simetría reflexiva propuesta del catión 2-norbornilo, incluso al final de su carrera.
Impacto
La introducción del enlace deslocalizado de dos electrones de tres centros invocado en la imagen no clásica del catión 2-norbornilo permitió a los químicos explorar un campo completamente nuevo de enlaces químicos. Los químicos estaban ansiosos por aplicar las características de los estados electrónicos hipovalentes a sistemas nuevos y antiguos por igual (aunque varios se dejaron llevar demasiado).Uno de los conceptos más importantes que surgieron de la intensa investigación centrada en los iones no clásicos fue la idea de que los electrones que ya están involucrados en los enlaces sigma podrían estar involucrados con la reactividad. Aunque se sabía que los orbitales pi llenos eran donantes de electrones, los químicos habían dudado de que los orbitales sigma pudieran funcionar con la misma capacidad. La descripción no clásica del catión 2-norbornilo puede verse como la donación de un par de electrones de un enlace sigma carbono-carbono a un orbital p vacío del carbono 2. Por lo tanto, este carbocatión mostró que la donación de electrones del enlace sigma es como plausible como donación de electrones de enlace pi.
El intenso debate que siguió al desafío de Brown a los defensores de los iones no clásicos también tuvo un gran impacto en el campo de la química. Para probar o refutar la naturaleza no clásica del catión 2-norbornilo, los químicos de ambos lados del debate buscaron con entusiasmo nuevas técnicas para la caracterización química e interpretaciones más innovadoras de los datos existentes. Una técnica espectroscópica que se desarrolló aún más para investigar el catión 2-norbornilo fue la espectroscopia de resonancia magnética nuclear de compuestos en medios altamente ácidos.Las comparaciones del catión 2-norbornilo con estados de transición inestables con estados electrónicos deslocalizados se hicieron a menudo cuando se intentaba dilucidar si el sistema de norbornilo era estable o no. Estos esfuerzos motivaron investigaciones más detalladas de los estados de transición y aumentaron enormemente la comprensión de la comunidad científica sobre su estructura electrónica. En resumen, la competencia vigorosa entre grupos científicos condujo a una extensa investigación y una mejor comprensión de los conceptos químicos subyacentes.
Formación
El catión 2-norbornilo se puede producir por una multitud de rutas sintéticas. Estas rutas se pueden agrupar en tres clases diferentes: Formación σ, Formación π y Formación por reordenamiento. Cada uno de estos se analiza por separado a continuación.
Formación σ
El material de partida para esta ruta es un derivado del norbornano con un buen grupo saliente en la posición 2. Si el grupo saliente está en la cara exo -, la densidad de electrones del enlace σ entre los carbonos 1 y 6 se dona al antienlace σ* entre el carbono 2 y el grupo saliente (ver Figura 8b).
Si el grupo saliente está en la endodoncia, el grupo saliente primero sale solo. Luego, la densidad de electrones del enlace σ entre los carbonos 1 y 6 se dona al orbital atómico vacío resultante en el carbono 2. Sin embargo, esta ruta de formación es mucho más lenta que la del isómero exo - porque el enlace σ no puede proporcionar asistencia anquimérica para el primer paso, haciendo que la energía de activación al primer estado de transición sea mucho mayor. Además, si hay una alta concentración de electrófilos reactivos en la mezcla de reacción, la formación de un derivado de norbornano recién sustituido puede impedir la formación de iones no clásicos.
Un ejemplo de esta ruta de formación es la reacción que llevó a Winstein y Trifan a proponer la estructura deslocalizada del catión 2-norbornilo. Los tosilatos y brosilatos de 2-norbornilo forman el catión 2-norbornilo a través de esta ruta como intermediario hacia la solvólisis.
Formación de π
El material de partida para esta ruta es un derivado de β-(Δ -ciclopentenil)-etano con un buen grupo saliente en el carbono terminal del grupo etano. La densidad de electrones del enlace π del resto alqueno se dona al antienlace σ* entre el carbono terminal y el grupo saliente (ver Figura 8c).
Por ejemplo, el producto principal de la acetólisis del nosilato de β-(Δ -ciclopentenil)-etilo (p -nitrobencenosulfonato) es el acetato de 2- exo -norbornilo. La escasez de β-(Δ -ciclopentenil)-acetato de etilo presente después de la reacción se explica por la mayor estabilidad del sistema norbornilo sobre el sistema ciclopentenilo decorado.
Esta ruta solo es efectiva si la olefina de ciclopentenilo se aísla de cualquier sistema con enlace π más grande. La velocidad de reacción disminuye significativamente si el doble enlace involucrado forma un anillo aromático de seis miembros como lo hace en el nosilato de 2-indaniletilo. Se ha visto que las sustituciones de alquilo en las olefinas aumentan la velocidad de reacción al estabilizar el carbocatión resultante.
Formación a partir del reordenamiento de cationes 1-norbornilo y 7-norbornilo
El catión 2-norbornilo también se puede formar a través de reordenamientos de iones similares, como los cationes 1-norbornilo y 7-norbornilo, aunque estos generalmente no se entienden tan bien. Los experimentos de marcado de isótopos radiactivos de carbono-14 han demostrado que la codificación compleja en los sistemas de cationes norbornilo permite que C esté presente en las siete posiciones del sistema norbornilo. Al alternar entre temperaturas bajas y altas durante las hidrólisis de 1- y 7-cloronorbornanos, se observó una gran cantidad de 2-norbornanol además de los esperados 1- y 7-norbornanoles, respectivamente. Por lo tanto, los cationes 1- y 7-norbornilo tienen algún mecanismo por el cual pueden reorganizarse en el catión 2-norbornilo más estable en la escala de tiempo de las reacciones de solvólisis.
Geometría
Evidencia espectroscópica
Una prueba para probar si el catión 2-norbornilo es o no no clásico es investigar la simetría inherente del catión. Muchas herramientas espectroscópicas, como la espectroscopia de resonancia magnética nuclear (espectroscopia NMR) y la espectroscopia Raman, dan pistas sobre la simetría de reflexión y rotación presente en una molécula o ion. Cada una de las tres estructuras propuestas del catión 2-norbornilo ilustra una simetría molecular diferente. La forma no clásica contiene un plano de reflexión a través de los carbonos 4, 5, 6 y el punto medio de los carbonos 1 y 2. La forma clásica no contiene simetría de reflexión ni de rotación. La estructura de nortriciclono protonado contiene un eje de rotación simétrico C 3 a través del carbono 4.
Cada pico en un espectro de RMN corresponde a un conjunto de átomos de un elemento en particular que se encuentran en entornos químicos similares. El espectro de RMN de la sal de cloropentafluoruro de antimonio del catión 2-norbornilo no es útil a temperatura ambiente porque los cambios de hidruro ocurren más rápido que la escala de tiempo de un experimento de RMN; la mayoría de los hidrógenos se consideran equivalentes y se contabilizan en el mismo pico de absorción. Al reducir la temperatura del experimento de RMN a -60 °C, los cambios de hidruro se "congelan" y se puede obtener más información estructural del espectro. Los investigadores descubrieron que a estas bajas temperaturas, el espectro de RMN de H coincidía con lo que cabría esperar de la estructura no clásica del ion.
Los estudios de H y C NMR pudieron confirmar que cualquier reordenamiento de Wagner-Meerwein propuesto ocurría más rápido que la escala de tiempo del experimento de RMN, incluso a bajas temperaturas. Para las moléculas en equilibrio estático con respecto a los reordenamientos, la RMN revela cuántos conjuntos de núcleos relacionados con la simetría hay en la molécula y cuántos núcleos representa cada uno de estos conjuntos a través de la integración del espectro. Para las moléculas en equilibrio dinámico, como el catión 2-norbornilo, los núcleos dentro de cada conjunto también pueden transformarse entre sí mediante reordenamientos con velocidades de reacción rápidas. Dado que el equilibrio dinámico propuesto por los defensores de los iones clásicos tenía tasas de reordenamiento muy rápidas, los primeros estudios de RMN no favorecieron ni invalidaron ninguna de las tres estructuras propuestas.Pero al utilizar el análisis de RMN de estado sólido, se puede reducir la temperatura del experimento de RMN a 5 kelvin (−268 °C) y, por lo tanto, ralentizar significativamente cualquier fenómeno de reordenamiento. Los espectros de RMN C de estado sólido del catión 2-norbornilo muestran que los carbonos 1 y 2 se encuentran en entornos químicos idénticos, lo que es consistente solo con la imagen no clásica del catión 2-norbornilo.
Los espectros Raman del catión 2-norbornilo muestran una especie más simétrica de lo que se esperaría para un par de iones clásicos que se equilibran rápidamente. Dado que las velocidades de reacción propuestas para los reordenamientos de iones clásicos son más lentas que la escala de tiempo de Raman, uno esperaría que los espectros de Raman indicaran una especie menos simétrica si la imagen clásica fuera correcta.
Algunos estudios de C NMR en particular favorecieron la interpretación a través de la estructura de nortriciclono protonada. Además, los espectros Raman del catión 2-norbornilo en algunos disolventes ácidos muestran una banda de absorción a 3110 cm indicativa de un anillo de ciclopropano empobrecido en electrones. Dado que esa banda de absorción se esperaría en el nortriciclono protonado simétrico C 3, algunos científicos afirmaron que esto era una evidencia convincente para esta interpretación.Otros químicos han postulado que las propiedades del catión 2-norbornilo dependen mucho del entorno del disolvente. Aunque la alta acidez y la baja nucleofilia de los disolventes utilizados en los experimentos antes mencionados pueden hacer que la geometría del nortricilconio protonado sea la más estable, esta geometría no tiene por qué ser la más energéticamente favorable en otros disolventes.
Cálculos
Se han utilizado muchos estudios de cálculo para comparar la viabilidad de diferentes geometrías propuestas. Utilizando el método cuántico semiempírico de MINDO/3, los investigadores no pudieron concluir qué geometría del catión 2-norbornilo era más favorable desde el punto de vista energético. Sin embargo, se encontró que la estructura clásica era el único mínimo potencial para el catión 2-metil-2-norbornilo sustituido con alquilo. Se encontró que los cálculos adicionales que utilizan la teoría extendida de Hückel para orbitales moleculares favorecen la geometría no clásica del catión con simetría de reflexión.
Termodinámica
Algunos estudios han utilizado comparaciones interesantes para probar la estabilidad energética del catión 2-norbornilo proporcionada por su naturaleza deslocalizada. Al comparar el reordenamiento entre el catión 3-metil-2-norbornilo y el catión 2-metil-2-norbornilo con el de los carbocationes de isopentano terciario y secundario, se encuentra que el cambio en la entalpía es aproximadamente 6 kcal/mol menos para el norbornilo. sistema. Dado que la principal diferencia entre estos dos reordenamientos reversibles es la cantidad de deslocalización posible en el estado fundamental electrónico, se puede atribuir la estabilización del catión 3-metil-2-norbornilo a su naturaleza no clásica. Sin embargo, algunos estudios experimentales no lograron observar esta estabilización en las reacciones de solvólisis.
Otros estudios sobre la estabilidad del catión 2-norbornilo han demostrado que las sustituciones de alquilo en el carbono 1 o 2 obligan al sistema a ser decididamente clásico. Los carbocationes terciarios son mucho más estables que sus contrapartes secundarias y, por lo tanto, no necesitan adoptar enlaces deslocalizados para alcanzar la energía potencial más baja posible.
Cinética
Para respaldar su sugerencia de la naturaleza no clásica del catión 2-norbornilo, Winstein y Trifan utilizaron primero la evidencia cinética del aumento de la velocidad de reacción para la formación del catión 2- exo - norbornilo sobre el catión 2 - endo -norbornilo. Otros investigadores investigaron la velocidad de reacción de los compuestos que podrían presentar asistencia anquimérica pero que no podrían sufrir reordenamientos ya que el sistema norbornilo podría mostrar tendencias similares en la mejora de la velocidad. Algunos han afirmado que esto es una evidencia definitiva de la imagen no clásica.Pero no todos están de acuerdo. Otros investigadores encontraron que los derivados del ciclopentano que eran estructuralmente similares al sistema norbornilo todavía presentaban velocidades de reacción mejoradas, lo que los llevó a afirmar que el catión norbornilo clásico describe el sistema mucho mejor.
Experimentos de marcado de isótopos
Los experimentos de marcado de isótopos radiactivos proporcionan una poderosa herramienta para determinar la estructura de las moléculas orgánicas. Al descomponer sistemáticamente el catión 2-norbornilo y analizar la cantidad de isótopo radiactivo en cada producto de descomposición, los investigadores pudieron mostrar más evidencia de la imagen no clásica del enlace deslocalizado (consulte la Figura 9). Los defensores de la imagen no clásica esperarían que el 50 % del CO 2 generado en la descomposición de la Figura 9 contuviera C, mientras que los defensores de la imagen clásica esperarían más CO 2 generadoser radiactivo debido a la naturaleza de corta duración del catión. Se ha observado que el 40% del dióxido de carbono producido a través de la descomposición es radiactivo, lo que sugiere que la imagen no clásica es más correcta.
Es posible distinguir más entre las estructuras no clásicas y clásicas del catión 2-norbornilo combinando experimentos de RMN con experimentos de marcado de isótopos. La sustitución isotópica de uno de los dos átomos de deuterio por un átomo de hidrógeno hace que el entorno de los átomos cercanos activos en RMN cambie drásticamente. El marcado asimétrico de isótopos de deuterio (sustitución) hará que un conjunto de carbonos que eran todos equivalentes en las especies de hidrógeno se divida en dos o más conjuntos de carbonos equivalentes en las especies marcadas con deutero; esto se manifestará en el espectro de RMN como un pico en el espectro de las especies de hidrógeno que se convierte en al menos dos picos "divididos" en las especies marcadas con deutero. Si un sistema está experimentando un equilibrio rápido a una velocidad más rápida que la escala de tiempo de unexperimento C NMR, el pico relevante se dividirá dramáticamente (del orden de 10-100 ppm). Si el sistema es, en cambio, estático, el pico se dividirá muy poco. El espectro de CNMR del catión 2-norbornilo a -150 °C muestra que los picos correspondientes a los carbonos 1 y 2 se dividen en menos de 10 ppm (partes por millón) cuando se realiza este experimento, lo que indica que el sistema no está experimentando un rápido equilibrio como en la imagen clásica.
Cristalografía de rayos X
Aunque la caracterización de los cristales de catión 2-norbornilo puede haber impedido significativamente más debates sobre su estructura electrónica, no cristaliza bajo ninguna condición estándar. Recientemente, la estructura cristalina se obtuvo y se informó a través de medios creativos: la adición de tribromuro de aluminio al bromuro de 2-norbornilo en dibromometano a bajas temperaturas proporcionó cristales de [ C7H11] [ Al2hermano7] · CH2hermano2.Al examinar la estructura cristalina resultante, los investigadores pudieron confirmar que la geometría cristalina respalda mejor el caso de la unión deslocalizada en el catión 2-norbornilo estable. Se encontró que las longitudes de los enlaces entre el carbono 6 "puente" y cada uno de los carbonos 1 y 2 eran ligeramente más largas que los enlaces alcano típicos. De acuerdo con la imagen no clásica, uno esperaría un orden de enlace entre 0 y 1 para estos enlaces, lo que significa que esto explica bien la estructura cristalina. Se informó que la longitud del enlace entre los carbonos 1 y 2 estaba entre las longitudes típicas del enlace carbono-carbono simple y doble, lo que concuerda con las predicciones no clásicas de un orden de enlace ligeramente superior a 1. De acuerdo con la imagen no clásica, uno esperaría un orden de enlace entre 0 y 1 para los dos primeros enlaces.
Contenido relacionado
Grupo del carbono
Electroforesis en gel
Polipropileno