Carbonato de calcio
El carbonato de calcio es un compuesto químico con la fórmula química CaCO3. Es una sustancia común que se encuentra en rocas como los minerales calcita y aragonito (sobre todo como piedra caliza, que es un tipo de roca sedimentaria que consiste principalmente en calcita) y es el componente principal de las cáscaras de huevo, conchas de gasterópodos, esqueletos de mariscos y perlas. Las cosas que contienen mucho carbonato de calcio o que se le parecen se describen como calcáreas. El carbonato de calcio es el ingrediente activo de la cal agrícola y se crea cuando los iones de calcio en el agua dura reaccionan con los iones de carbonato para crear incrustaciones de cal. Tiene uso médico como suplemento de calcio o como antiácido, pero su consumo excesivo puede ser peligroso y causar hipercalcemia y problemas digestivos.
Química
El carbonato de calcio comparte las propiedades típicas de otros carbonatos. en particular
- reacciona con ácidos, liberando dióxido de carbono (en términos técnicos, ácido carbónico, pero que se desintegra rápidamente a CO2 y H2O:
- libera dióxido de carbono sobre la calefacción, llamada reacción de descomposición térmica, o calcinación (a más de 840 °C en el caso de CaCO3), para formar óxido de calcio, CaO, comúnmente llamado rápido, con la reacción enthalpy 178 kJ/mol:
El carbonato de calcio reacciona con agua saturada con dióxido de carbono para formar bicarbonato de calcio soluble.
Esta reacción es importante en la erosión de la roca carbonatada, la formación de cavernas y conduce a aguas duras en muchas regiones.
Una forma inusual de carbonato de calcio es la ikaita hexahidratada, CaCO3·6H2O. Ikaite es estable solo por debajo de los 8 °C.
Preparación
La gran mayoría del carbonato de calcio utilizado en la industria se extrae de la minería o la explotación de canteras. El carbonato de calcio puro (como para uso alimentario o farmacéutico) se puede producir a partir de una fuente pura de cantera (generalmente mármol).
Alternativamente, el carbonato de calcio se prepara a partir del óxido de calcio. Se agrega agua para dar hidróxido de calcio y luego se pasa dióxido de carbono a través de esta solución para precipitar el carbonato de calcio deseado, denominado en la industria carbonato de calcio precipitado (PCC). Este proceso se denomina carbonatación:
En un laboratorio, el carbonato de calcio se puede cristalizar fácilmente a partir de cloruro de calcio (CaCl2), colocando una solución acuosa de CaCl2 en un desecador junto con carbonato de amonio (NH4)2CO3. En el desecador, el carbonato de amonio se expone al aire y se descompone en amoníaco, dióxido de carbono y agua. Luego, el dióxido de carbono se difunde en la solución acuosa de cloruro de calcio, reacciona con los iones de calcio y el agua y forma carbonato de calcio.
Estructura
La forma termodinámicamente estable de CaCO3 en condiciones normales es hexagonal β-CaCO3 (el mineral calcita). Se pueden preparar otras formas, la más densa (2,83 g/cm3) ortorrómbica λ-CaCO3 (el mineral aragonito) y μ-CaCO3 hexagonales, que aparecen como el vaterita mineral. La forma de aragonito se puede preparar por precipitación a temperaturas superiores a 85 °C; la forma de vaterita se puede preparar por precipitación a 60 °C. La calcita contiene átomos de calcio coordinados por seis átomos de oxígeno; en el aragonito están coordinados por nueve átomos de oxígeno. La estructura de vaterita no se entiende completamente. El carbonato de magnesio (MgCO3) tiene la estructura de calcita, mientras que el carbonato de estroncio (SrCO3) y carbonato de bario (BaCO3) adoptan la estructura de aragonito, lo que refleja sus radios iónicos más grandes.
Polimorfos
El carbonato de calcio cristaliza en tres polimorfos anhidros, de los cuales la calcita es la termodinámicamente más estable a temperatura ambiente, la aragonita lo es solo un poco menos y la vaterita es la menos estable.
Estructura de Cristal
La estructura de cristal calcita es trigonal, con grupo espacial (No 167 en las Tablas Internacionales para la Cristalografía) y símbolo Pearson . Aragonita es ortomóbica, con grupo espacial (No 62), y Pearson Symbol . La vaterita está compuesta por al menos dos estructuras cristalográficas coexistentes diferentes. La estructura principal muestra simetría hexagonal en grupo espacial , la estructura menor todavía es desconocida.
Cristalización
Los tres polimorfos cristalizan simultáneamente a partir de soluciones acuosas en condiciones ambientales. En soluciones acuosas sin aditivos, la calcita se forma fácilmente como producto principal, mientras que el aragonito aparece solo como producto secundario.
A alta saturación, la vaterita suele ser la primera fase que precipita, a la que sigue una transformación de la vaterita en calcita. Este comportamiento parece seguir la regla de Ostwald, en la que el polimorfo menos estable cristaliza primero, seguido de la cristalización de diferentes polimorfos a través de una secuencia de fases cada vez más estables. Sin embargo, el aragonito, cuya estabilidad se encuentra entre la vaterita y la calcita, parece ser la excepción a esta regla, ya que el aragonito no se forma como precursor de la calcita en condiciones ambientales.
El aragonito se presenta en su mayoría cuando las condiciones de reacción inhiben la formación de calcita y/o promueven la nucleación del aragonito. Por ejemplo, la formación de aragonito se promueve por la presencia de iones de magnesio, o por el uso de proteínas y péptidos derivados del carbonato de calcio biológico. Se ha demostrado que algunas poliaminas como la cadaverina y la poli(etilenimina) facilitan la formación de aragonito sobre la calcita.
Selección por organismos
Los organismos, como los moluscos y los artrópodos, han demostrado la capacidad de desarrollar los tres polimorfos cristalinos de carbonato de calcio, principalmente como protección (conchas) y unión muscular. Además, exhiben una notable capacidad de selección de fase sobre calcita y aragonito, y algunos organismos pueden cambiar entre los dos polimorfos. La capacidad de selección de fase generalmente se atribuye al uso de macromoléculas específicas o combinaciones de macromoléculas por parte de dichos organismos.
Ocurrencia
Fuentes geológicas
La calcita, el aragonito y la vaterita son minerales de carbonato de calcio puro. Las rocas fuente de importancia industrial que son predominantemente carbonato de calcio incluyen piedra caliza, creta, mármol y travertino.
Fuentes biológicas
Las cáscaras de huevo, las conchas de caracol y la mayoría de las conchas marinas son predominantemente carbonato de calcio y pueden usarse como fuentes industriales de esa sustancia química. Las conchas de ostra han disfrutado de un reconocimiento reciente como fuente de calcio dietético, pero también son una fuente industrial práctica. Las verduras de color verde oscuro como el brócoli y la col rizada contienen cantidades dietéticamente significativas de carbonato de calcio, pero no son prácticas como fuente industrial.
Extraterrestre
Más allá de la Tierra, fuerte evidencia sugiere la presencia de carbonato de calcio en Marte. Se han detectado signos de carbonato de calcio en más de un lugar (sobre todo en los cráteres Gusev y Huygens). Esto proporciona alguna evidencia de la presencia pasada de agua líquida.
Geología
El carbonato se encuentra con frecuencia en entornos geológicos y constituye una enorme reserva de carbono. El carbonato de calcio se presenta como aragonito, calcita y dolomita como constituyentes significativos del ciclo del calcio. Los minerales carbonatados forman los tipos de roca: caliza, yeso, mármol, travertino, toba y otros.
En aguas tropicales cálidas y claras, los corales son más abundantes que hacia los polos, donde las aguas son frías. Los contribuyentes de carbonato de calcio, incluido el plancton (como cocolitos y foraminíferos planctónicos), algas coralinas, esponjas, braquiópodos, equinodermos, briozoos y moluscos, se encuentran típicamente en ambientes de aguas poco profundas donde la luz solar y los alimentos filtrables son más abundantes. Los carbonatos de agua fría existen en latitudes más altas, pero tienen una tasa de crecimiento muy lenta. Los procesos de calcificación se modifican por la acidificación de los océanos.
Donde la corteza oceánica se subduce bajo una placa continental, los sedimentos se transportarán a zonas más cálidas en la astenosfera y la litosfera. En estas condiciones, el carbonato de calcio se descompone para producir dióxido de carbono que, junto con otros gases, da lugar a erupciones volcánicas explosivas.
Profundidad de compensación de carbonato
La profundidad de compensación de carbonato (CCD) es el punto en el océano donde la tasa de precipitación de carbonato de calcio se equilibra con la tasa de disolución debido a las condiciones presentes. En lo profundo del océano, la temperatura desciende y la presión aumenta. El carbonato de calcio es inusual porque su solubilidad aumenta al disminuir la temperatura. El aumento de la presión también aumenta la solubilidad del carbonato de calcio. La profundidad de compensación de carbonato puede variar de 4.000 a 6.000 metros bajo el nivel del mar.
Papel en la tafonomía
El carbonato de calcio puede preservar fósiles a través de la permineralización. La mayoría de los fósiles de vertebrados de la Formación Two Medicine, una formación geológica conocida por sus huevos de dinosaurio con pico de pato, están preservados por CaCO3< /sub> permineralización. Este tipo de conservación conserva altos niveles de detalle, incluso hasta el nivel microscópico. Sin embargo, también deja a los especímenes vulnerables a la intemperie cuando se exponen a la superficie.
Alguna vez se pensó que las poblaciones de trilobites componían la mayor parte de la vida acuática durante el Cámbrico, debido al hecho de que sus caparazones ricos en carbonato de calcio se conservaban más fácilmente que los de otras especies, que tenían caparazones puramente quitinosos.
Usos
Construcción
El principal uso del carbonato de calcio es en la industria de la construcción, ya sea como material de construcción o agregado de piedra caliza para la construcción de carreteras, como ingrediente del cemento o como material de partida para la preparación de materiales de construcción. cal quemándola en un horno. Sin embargo, debido a la meteorización causada principalmente por la lluvia ácida, el carbonato de calcio (en forma de piedra caliza) ya no se usa solo para fines de construcción, sino solo como materia prima primaria para materiales de construcción.
El carbonato de calcio también se utiliza en la purificación de hierro a partir de mineral de hierro en un alto horno. El carbonato se calcina in situ para dar óxido de calcio, que forma una escoria con varias impurezas presentes y se separa del hierro purificado.
En la industria petrolera, el carbonato de calcio se agrega a los fluidos de perforación como agente de puenteo de formación y sellador del revoque de filtración; también es un material de ponderación que aumenta la densidad de los fluidos de perforación para controlar la presión en el fondo del pozo. El carbonato cálcico se añade a las piscinas, como corrector del pH para mantener la alcalinidad y contrarrestar las propiedades ácidas del agente desinfectante.
También se utiliza como materia prima en el refinado de azúcar de remolacha azucarera; se calcina en un horno con antracita para producir óxido de calcio y dióxido de carbono. Esta cal quemada luego se apaga en agua dulce para producir una suspensión de hidróxido de calcio para la precipitación de impurezas en el jugo crudo durante la carbonatación.
El carbonato de calcio en forma de tiza ha sido tradicionalmente un componente principal de la tiza para pizarra. Sin embargo, la tiza fabricada moderna es principalmente yeso, sulfato de calcio hidratado CaSO4·2H2O . El carbonato de calcio es una fuente principal para el cultivo de biorock. El carbonato de calcio precipitado (PCC), predispersado en forma de lechada, es un material de relleno común para los guantes de látex con el objetivo de lograr el máximo ahorro en materiales y costos de producción.
El carbonato de calcio molido fino (GCC) es un ingrediente esencial en la película microporosa utilizada en pañales y algunas películas de construcción, ya que los poros se nuclean alrededor de las partículas de carbonato de calcio durante la fabricación de la película mediante estiramiento biaxial. GCC y PCC se utilizan como relleno en papel porque son más baratos que la fibra de madera. En términos de volumen de mercado, los GCC son los tipos de rellenos más importantes que se utilizan actualmente. El papel para imprimir y escribir puede contener entre un 10 y un 20 % de carbonato de calcio. En América del Norte, el carbonato de calcio ha comenzado a reemplazar al caolín en la producción de papel satinado. Europa ha estado practicando esto como fabricación de papel alcalino o fabricación de papel sin ácido durante algunas décadas. El PCC que se utiliza para el relleno y el revestimiento del papel se precipita y prepara en una variedad de formas y tamaños que tienen distribuciones de tamaño de partícula estrechas características y diámetros esféricos equivalentes de 0,4 a 3 micrómetros.
El carbonato de calcio se usa ampliamente como diluyente en pinturas, en particular, en pinturas de emulsión mate en las que, por lo general, el 30 % en peso de la pintura es tiza o mármol. También es un relleno popular en plásticos. Algunos ejemplos típicos incluyen alrededor de 15 a 20 % de carga de caliza en tuberías de drenaje de cloruro de polivinilo no plastificado (uPVC), 5 % a 15 % de carga de caliza recubierta de estearato o mármol en perfil de ventana de uPVC. Los cables de PVC pueden usar carbonato de calcio en cargas de hasta 70 phr (partes por cien partes de resina) para mejorar las propiedades mecánicas (resistencia a la tracción y elongación) y las propiedades eléctricas (resistividad volumétrica). Los compuestos de polipropileno a menudo se rellenan con carbonato de calcio para aumentar la rigidez, un requisito que se vuelve importante a altas temperaturas de uso. Aquí, el porcentaje suele ser del 20 al 40%. También se usa habitualmente como relleno en resinas termoendurecibles (compuestos de moldeo en láminas y a granel) y también se ha mezclado con ABS y otros ingredientes para formar algunos tipos de "arcilla" moldeada por compresión. fichas de póquer. El carbonato de calcio precipitado, que se obtiene dejando caer óxido de calcio en agua, se usa solo o con aditivos como pintura blanca, lo que se conoce como blanqueo.
El carbonato de calcio se agrega a una amplia gama de adhesivos, selladores y rellenos para decoración comerciales y de bricolaje. Los adhesivos para baldosas de cerámica suelen contener entre un 70 % y un 80 % de piedra caliza. Los rellenos de grietas para decorar contienen niveles similares de mármol o dolomita. También se mezcla con masilla para colocar vidrieras y como resistencia para evitar que el vidrio se adhiera a los estantes del horno al cocer esmaltes y pinturas a alta temperatura.
En las aplicaciones de esmaltes cerámicos, el carbonato de calcio se conoce como whiting y es un ingrediente común para muchos esmaltes en su forma de polvo blanco. Cuando se cuece en un horno un vidriado que contiene este material, la pescadilla actúa como material fundente en el vidriado. El carbonato de calcio molido es un abrasivo (tanto como polvo para fregar como ingrediente de las cremas para fregar en el hogar), en particular en su forma de calcita, que tiene un nivel de dureza relativamente bajo de 3 en la escala de Mohs y, por lo tanto, no raya el vidrio y la mayoría otras cerámicas, esmalte, bronce, hierro y acero, y tienen un efecto moderado sobre metales más blandos como el aluminio y el cobre. Se puede usar una pasta hecha de carbonato de calcio y agua desionizada para limpiar el deslustre de la plata.
Salud y alimentación
El carbonato de calcio se usa ampliamente con fines medicinales como suplemento dietético económico de calcio para los antiácidos gástricos (como Tums y Eno). Puede usarse como quelante de fosfato para el tratamiento de la hiperfosfatemia (principalmente en pacientes con insuficiencia renal crónica). Se utiliza en la industria farmacéutica como relleno inerte para tabletas y otros productos farmacéuticos.
El carbonato de calcio se usa en la producción de óxido de calcio y pasta de dientes y ha visto un resurgimiento como conservante de alimentos y retenedor de color, cuando se usa en o con productos como las manzanas orgánicas.
El carbonato de calcio se usa terapéuticamente como quelante de fósforo en pacientes en hemodiálisis de mantenimiento. Es la forma más común de quelante de fosfato prescrito, particularmente en la enfermedad renal crónica sin diálisis. El carbonato de calcio es el quelante de fosfato más utilizado, pero los médicos prescriben cada vez más los quelantes de fosfato no basados en calcio, más caros, en particular sevelamer.
El exceso de calcio de los suplementos, los alimentos fortificados y las dietas ricas en calcio pueden causar el síndrome de leche y alcalinos, que tiene una toxicidad grave y puede ser fatal. En 1915, Bertram Sippy introdujo el "régimen Sippy" de ingestión horaria de leche y nata, y la adición paulatina de huevos y cereal cocido, durante 10 días, combinados con polvos alcalinos, que proporcionaban alivio sintomático para la enfermedad ulcerosa péptica. Durante las siguientes décadas, el régimen Sippy provocó insuficiencia renal, alcalosis e hipercalcemia, principalmente en hombres con enfermedad de úlcera péptica. Estos efectos adversos se revirtieron cuando se suspendió el régimen, pero fue fatal en algunos pacientes con vómitos prolongados. El síndrome de leche y alcalinos disminuyó en los hombres después de que surgieron tratamientos efectivos para la enfermedad de úlcera péptica. Desde la década de 1990, se ha notificado con mayor frecuencia en mujeres que toman suplementos de calcio por encima del rango recomendado de 1,2 a 1,5 gramos al día, para la prevención y el tratamiento de la osteoporosis, y se exacerba con la deshidratación. Se ha agregado calcio a los productos de venta libre, lo que contribuye a una ingesta excesiva inadvertida. La ingesta excesiva de calcio puede provocar hipercalcemia, cuyas complicaciones incluyen vómitos, dolor abdominal y alteración del estado mental.
Como aditivo alimentario, se designa como E170 y tiene un número INS de 170. Utilizado como regulador de la acidez, agente antiaglomerante, estabilizador o colorante, está aprobado para su uso en la UE, EE. UU., Australia y Nueva Zelanda. Se "agrega por ley a todas las harinas de pan molidas del Reino Unido, excepto a las integrales". Se utiliza en algunos productos de leche de soja y leche de almendras como fuente de calcio dietético; al menos un estudio sugiere que el carbonato de calcio podría estar tan biodisponible como el calcio en la leche de vaca. El carbonato de calcio también se usa como agente reafirmante en muchos productos vegetales enlatados y embotellados.
Se ha documentado que varias formulaciones de suplementos de calcio contienen el elemento químico plomo, lo que representa un problema de salud pública. El plomo se encuentra comúnmente en fuentes naturales de calcio.
Agricultura y acuicultura
La cal agrícola, la tiza en polvo o la piedra caliza se utiliza como un método económico para neutralizar la acidez del suelo, lo que la hace adecuada para la siembra. También se utiliza en la industria acuícola para regular el pH del suelo del estanque antes de iniciar el cultivo.
Limpieza del hogar
El carbonato de calcio es un ingrediente clave en muchos polvos de limpieza para el hogar como Comet y se usa como agente de limpieza.
Mitigación de la contaminación
En 1989, un investigador, Ken Simmons, introdujo CaCO3 en Whetstone Brook en Massachusetts. Su esperanza era que el carbonato de calcio contrarrestaría el ácido de la lluvia ácida en el arroyo y salvaría a las truchas que habían dejado de desovar. Aunque su experimento fue un éxito, aumentó la cantidad de iones de aluminio en el área del arroyo que no fue tratada con piedra caliza. Esto demuestra que se puede agregar CaCO3 para neutralizar los efectos de la lluvia ácida en los ecosistemas fluviales. Actualmente, el carbonato de calcio se usa para neutralizar las condiciones ácidas tanto en el suelo como en el agua. Desde la década de 1970, este encalado se ha practicado a gran escala en Suecia para mitigar la acidificación y varios miles de lagos y arroyos se encalan repetidamente.
El carbonato de calcio también se usa en aplicaciones de desulfuración de gases de combustión que eliminan los dañinos SO2 y NO2 emisiones de carbón y otros combustibles fósiles quemados en grandes centrales eléctricas de combustibles fósiles.
Equilibrio de calcinación
La calcinación de piedra caliza utilizando fuegos de carbón para producir cal viva ha sido practicada desde la antigüedad por culturas de todo el mundo. La temperatura a la que la piedra caliza produce óxido de calcio suele ser de 825 °C, pero establecer un umbral absoluto es engañoso. El carbonato de calcio existe en equilibrio con el óxido de calcio y el dióxido de carbono a cualquier temperatura. A cada temperatura hay una presión parcial de dióxido de carbono que está en equilibrio con el carbonato de calcio. A temperatura ambiente, el equilibrio favorece abrumadoramente al carbonato de calcio, porque la presión de equilibrio CO2 es solo una pequeña fracción de la presión parcial CO2 en el aire, que es de aproximadamente 0,035 kPa.
A temperaturas superiores a 550 °C, la presión de equilibrio CO2 comienza a superar la CO2 presión en el aire. Entonces, por encima de los 550 °C, el carbonato de calcio comienza a desgasificar CO2 en el aire. Sin embargo, en un horno de carbón, la concentración de CO2 será mucho mayor que en aire. De hecho, si todo el oxígeno del horno se consume en el fuego, entonces la presión parcial de CO2 en el horno puede llegar a 20 kPa.
La tabla muestra que esta presión parcial no se alcanza hasta que la temperatura es cercana a los 800 °C. Para que la desgasificación de CO2 del carbonato de calcio se produzca a un ritmo económicamente útil, la presión de equilibrio debe exceda significativamente la presión ambiental de CO2. Y para que suceda rápidamente, la presión de equilibrio debe superar la presión atmosférica total de 101 kPa, que ocurre a 898 °C.
Presión de equilibrio CO2 sobre CaCO3 ()P) contra la temperatura (T). P (kPa) 0,055 0,13 0.31 1.80 5.9 9.3 14 24 34 51 72 80 91 101 179 901 3961 T (°C) 550 587 605 680 727 748 777 800 830 852 871 881 891 898 937 1082 1241
Solubilidad
Con presión de CO2 variable
El carbonato de calcio es poco soluble en agua pura (47 mg/L a la atmósfera normal CO2 presión parcial como se muestra a continuación).
El equilibrio de su solución viene dado por la ecuación (con carbonato de calcio disuelto a la derecha):
CaCO3 ⇌ Ca2+ + CO2 - 23 Ksp = 3.7×10−9 a 8.7×10−9 a 25 °C
donde el producto de solubilidad para [Ca2+][CO2−3] se da como cualquier lugar entre Ksp = < span data-sort-value="6991370000000000000♠">3.7×10−9< /sup> a Ksp = 8,7×10−9 a 25 °C, según los datos fuente. Lo que significa la ecuación es que el producto de la concentración molar de iones de calcio (moles de Ca2+ disueltos por litro de solución) con la concentración molar de CO2−3 disueltos no pueden exceda el valor de Ksp. Esta ecuación de solubilidad aparentemente simple, sin embargo, debe tomarse junto con el equilibrio más complicado de dióxido de carbono con agua (ver ácido carbónico). Algunos de los CO2−3 se combina con H+ en la solución según
HCO−3 ⇌ H+ + CO2 - 23 Ka2 = 5.61×10−11 - a 25 °C
HCO−3 es conocido como el ion bicarbonato. El bicarbonato de calcio es muchas veces más soluble en agua que el carbonato de calcio; de hecho, existe solo en solución.
Algunos de los HCO−3 se combina con H+ en solución según
H2CO3 ⇌ H+ + HCO−3 Ka1 = 2.5×10−4 a 25 °C
Algunos de los H2CO3 se descompone en agua y dióxido de carbono disuelto según
H2O + CO2(aq) ⇌ H2CO3 Kh = 1.70×10−3 a 25 °C
Y el dióxido de carbono disuelto está en equilibrio con el dióxido de carbono atmosférico según
PCO2/[COCO2] = kH Donde kH = 29.76 atm/(mol/L) a 25 °C (Henry constante), PCO2 ser el CO2 presión parcial.
Para aire ambiente, PCO2< /sub> es alrededor de 3.5×10−4 atmósferas (o equivalente a 35 Pa). La última ecuación anterior fija la concentración de CO2 disueltos en función de PCO2, independiente de la concentración de CaCO3. A la presión atmosférica parcial de CO2, CO2 la concentración es 1.2×10−5 moles por litro. La ecuación anterior fija la concentración de H2CO3< /sub> en función de la concentración de CO2. Para [CO2] = 1.2×10−5, da como resultado [H2CO3] = 2.0×10−8 moles por litro. Cuando [H2CO3] es conocido, las tres ecuaciones restantes junto con
| PCO2 (atm) | p H | [Caso]2+] (mol/L) |
|---|---|---|
| 10−12 | 12.0 | 5.19×10−3 |
| 10−10 | 11.3 | 1.12×10−3 |
| 10−8 | 10.7 | 2.55×10−4 |
| 10−6 | 9.83 | 1.20×10−4 |
| 10−4 | 8.62 | 3.16×10−4 |
| 3.5×10−4 | 8.27 | 4.70×10−4 |
| 10−3 | 7.96 | 6.62×10−4 |
| 10−2 | 7.30 | 1.42×10−3 |
| 10−1 | 6.63 | 3.05×10−3 |
| 1 | 5.96 | 6.58×10−3 |
| 10 | 5.30 | 1.42×10−2 |
H2O ⇌ H+ + OH− K = 10−14 a 25 °C
(lo cual es cierto para todas las soluciones acuosas), y el hecho de que la solución debe ser eléctricamente neutra, es decir, la carga total de iones positivos disueltos [Ca2+< /sup>] + 2 [H+] debe ser cancelado por la carga total de iones negativos disueltos [HCO−3] + [CO2−3] + [OH−], hacer posible resolver simultáneamente para las cinco concentraciones desconocidas restantes (nótese que la forma de neutralidad mencionada anteriormente es válida solo si el carbonato de calcio se ha puesto en contacto con agua pura o con una solución de pH neutro; en el caso en que el solvente inicial de agua El pH no es neutro, el equilibrio no es neutro).
La tabla adyacente muestra el resultado de [Ca2+] y [H+] (en forma de pH) en función de la presión parcial ambiental de CO2 (Ksp = 4.47×10−9 tiene tomado para el cálculo).
- En los niveles atmosféricos del ambiente CO2 la tabla indica que la solución será ligeramente alcalino con un máximo CaCO3 solubilidad de 47 mg/L.
- Como ambiente CO2 la presión parcial se reduce por debajo de los niveles atmosféricos, la solución se vuelve cada vez más alcalino. En extremadamente bajo PCO2, disuelto CO2, iones de bicarbonato y iones de carbonato se evaporan en gran medida de la solución, dejando una solución altamente alcalina de hidroxido de calcio, que es más soluble que CaCO3. Note que para PCO2 = 10−12Atm, la [Caso]2+[OH]−]2 producto todavía está debajo del producto de la solubilidad Ca (OH)2 ()8×10−6). Para abajo CO2 presión, Ca (OH)2 precipitación ocurrirá antes CaCO3 precipitación.
- Como ambiente CO2 la presión parcial aumenta a niveles por encima de las gotas atmosféricas, pH, y gran parte del ión carbonato se convierte en iones bicarbonato, lo que resulta en mayor solubilidad Ca2+.
El efecto de este último es especialmente evidente en el día a día de las personas que tienen agua dura. El agua de los acuíferos subterráneos puede estar expuesta a niveles de CO2 mucho más altos que los atmosféricos. A medida que el agua se filtra a través de la roca de carbonato de calcio, el CaCO3 se disuelve según la segunda tendencia. Cuando esa misma agua emerge del grifo, con el tiempo se equilibra con los niveles de CO2 en el aire desgasificando su exceso de CO2. Como resultado, el carbonato de calcio se vuelve menos soluble y el exceso precipita como incrustaciones de cal. Este mismo proceso es el responsable de la formación de estalactitas y estalagmitas en las cuevas de piedra caliza.
Dos fases hidratadas de carbonato de calcio, monohidrocalcita CaCO3·H2O< /span> e ikaite CaCO3·6H2O, pueden precipitar del agua en condiciones ambientales y persisten como fases metaestables.
Con pH, temperatura y salinidad variables: incrustaciones de CaCO3 en piscinas
En contraste con el escenario de equilibrio abierto anterior, muchas piscinas se administran mediante la adición de bicarbonato de sodio (NaHCO3 ) a aproximadamente 2 mM como tampón, luego controle el pH mediante el uso de HCl, NaHSO4< /span>, Na2CO3< /span>, formulaciones de NaOH o cloro que son ácidas o básicas. En esta situación, el carbono inorgánico disuelto (carbono inorgánico total) está lejos del equilibrio con el CO2 atmosférico. El progreso hacia el equilibrio a través de la desgasificación de CO2 se ve frenado por
- la reacción lenta
- H2CO3 ⇌ CO2(aq) + H2O;
- aeración limitada en una columna de agua profunda; y
- reposición periódica de bicarbonato para mantener la capacidad de amortiguación (a menudo estimada mediante la medición de la alcalinidad total).
En esta situación, las constantes de disociación para las reacciones mucho más rápidas
- H2CO3 ⇌ H+ + HCO−3 ⇌ 2 H+ + CO2 - 23
permitir la predicción de concentraciones de cada especie de carbono inorgánico disuelto en solución, a partir de la concentración añadida de HCO−3 (que constituye más del 90 % de las especies de parcelas de Bjerrum de pH 7 a pH 8 a 25 °C en agua dulce). La adición de HCO−3 aumentará Concentración de CO2−3 en cualquier pH. Reorganizando las ecuaciones anteriores, podemos ver que [Ca2+] = Ksp/[CO2−3] y [CO2−3 ] = Ka2 [< span class="chemf nowrap">HCO−3] /[H+]. Por lo tanto, cuando la concentración de HCO−3 se conoce, la concentración máxima de iones Ca2+ antes de escalar a través de CaCO3 la precipitación se puede predecir a partir de la fórmula:
- [Ca2+]max = Ksp/Ka2 × [H+]/[HCO−3]
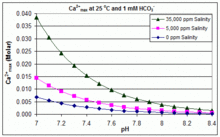
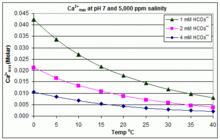
El producto de solubilidad para CaCO3 (K sp) y las constantes de disociación de las especies de carbono inorgánico disueltas (incluido Ka2) se ven sustancialmente afectadas por la temperatura y la salinidad, con el efecto general de que [ Ca2+]max aumenta de agua dulce a agua salada y disminuye con el aumento de la temperatura, el pH o el nivel de bicarbonato agregado, como se ilustra en los gráficos adjuntos.
Las tendencias son ilustrativas para la gestión de grupos, pero el escalamiento también depende de otros factores, incluidas las interacciones con Mg2+, [B(OH)4]− y otros iones en la piscina, así como efectos de sobresaturación. La incrustación se observa comúnmente en los generadores de cloro electrolítico, donde hay un pH alto cerca de la superficie del cátodo y la deposición de incrustaciones aumenta aún más la temperatura. Esta es una de las razones por las que algunos operadores de piscinas prefieren el borato al bicarbonato como principal amortiguador de pH y evitan el uso de productos químicos para piscinas que contienen calcio.
Solubilidad en una solución de ácido fuerte o débil
Las soluciones de ácidos fuertes (HCl), moderadamente fuertes (sulfámico) o débiles (acético, cítrico, sórbico, láctico, fosfórico) están disponibles comercialmente. Se utilizan comúnmente como agentes desincrustantes para eliminar los depósitos de cal. La cantidad máxima de CaCO3 que se puede "disolver" por un litro de una solución ácida se puede calcular utilizando las ecuaciones de equilibrio anteriores.
- En el caso de un fuerte monoácido con disminución de la concentración de ácido [A] = [A−], obtenemos (con CaCO3 masa molar = 100 g/mol):
[A] (mol/L) 1 10−1 10−2 10−3 10−4 10; 5 - 10−6 10−7 10−10 PH inicial 0.00 1.00 2.00 3.00 4.00 5.00 6.00 6.79 7.00 Final pH 6.75 7.25 7.75 8.14 8.25 8.26 8.26 8.26 8.27 Dissolved CaCO3
(g/L de ácido)50.0 5.00 0.514 0,0849 0,0504 0,0474 0,0471 0,0470 0,0470
- donde el estado inicial es la solución ácida sin Ca2+ (no teniendo en cuenta lo posible CO2 disolución) y el estado final es la solución con saturada Ca2+. Para concentraciones de ácido fuerte, todas las especies tienen una concentración insignificante en el estado final con respecto a Ca2+ y A− para que la ecuación de neutralidad reduzca aproximadamente a 2[Ca2+=A−# ceder [Ca2+Entendido.A−]. Cuando la concentración disminuye, [HCO−3] se vuelve no insignificante para que la expresión anterior ya no sea válida. Para las concentraciones de ácido desaparecido, se puede recuperar el pH final y la solubilidad de CaCO3 en agua pura.
- En el caso de un monoácido débil (aquí tomamos ácido acético con pKa = 4.76) con disminución de la concentración total de ácido [A] = [A−] + [AH], obtenemos:
[A] (mol/L) [Ca2+Entendido.A−] 10−1 10−2 10−3 10−4 10; 5 - 10−6 10−7 10−10 PH inicial 2.38 2.88 3.39 3.91 4.47 5.15 6.02 6.79 7.00 Final pH 6.75 7.25 7.75 8.14 8.25 8.26 8.26 8.26 8.27 Dissolved CaCO3
(g/L de ácido)49,5 4.99 0.513 0,0848 0,0504 0,0474 0,0471 0,0470 0,0470
- Para la misma concentración total de ácido, el pH inicial del ácido débil es menos ácido que el ácido fuerte; sin embargo, la cantidad máxima de ácido CaCO3 que se puede disolver es aproximadamente lo mismo. Esto es porque en el estado final, el pH es más grande que el pKa, por lo que el ácido débil está casi completamente disociado, produciendo al final tantos H+ iones como el ácido fuerte para "dissolver" el carbonato de calcio.
- El cálculo en el caso del ácido fósforo (que es el más utilizado para aplicaciones domésticas) es más complicado ya que las concentraciones de los cuatro estados de disociación correspondientes a este ácido deben calcularse junto con [HCO−3], [CO2 - 23], [Ca2+], [H+] y [Oh.−]. El sistema puede reducirse a una ecuación de séptimo grado para [H+] la solución numérica que da
[A] (mol/L) 1 10−1 10−2 10−3 10−4 10; 5 - 10−6 10−7 10−10 PH inicial 1.08 1.62 2.25 3.05 4.01 5.00 5.97 6.74 7.00 Final pH 6.71 7.17 7.63 8.06 8.24 8.26 8.26 8.26 8.27 Dissolved CaCO3
(g/L de ácido)62.0 7.39 0.874 0.123 0,0536 0,0477 0,0471 0,0471 0,0470
- Donde [A] = [HH3PO4[H]2PO−4[HPO]2 - 24[PO]3 - 34] es la concentración total de ácido. Así el ácido fósforo es más eficiente que un monoácido ya que en el pH casi neutro final, la segunda concentración disociada del estado [HPO2 - 24] no es insignificante (ver ácido fósforo).
Contenido relacionado
Orbitales moleculares
Metionina
Pila voltaica


![{displaystyle {ce {CaCO3(s)->[Delta ]CaO(s){+}CO2uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/341d1776ae78128a432b06ec2f5b8968ecf3d50c)