Pila voltaica

La pila voltaica fue la primera batería eléctrica que podía proporcionar continuamente una corriente eléctrica a un circuito. Fue inventado por el químico italiano Alessandro Volta, quien publicó sus experimentos en 1799. La pila voltaica luego permitió una serie rápida de otros descubrimientos, incluida la descomposición eléctrica (electrólisis) del agua en oxígeno e hidrógeno por William Nicholson y Anthony Carlisle (1800) y el descubrimiento o aislamiento de los elementos químicos sodio (1807), potasio (1807), calcio (1808), boro (1808), bario (1808), estroncio (1808) y magnesio (1808) por Humphry Davy.
Toda la industria eléctrica del siglo XIX funcionaba con baterías relacionadas con las de Volta (por ejemplo, la celda Daniell y la celda Grove) hasta la llegada de la dínamo (el generador eléctrico) en la década de 1870.
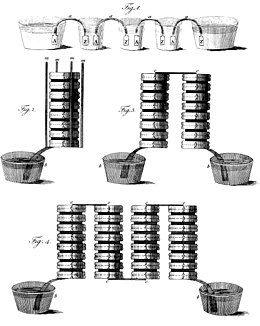
La invención de Volta se basó en el descubrimiento de Luigi Galvani en 1780 de cómo un circuito de dos metales y una anca de rana pueden hacer que la anca de la rana responda. Volta demostró en 1794 que cuando dos metales y un paño o cartón empapado en salmuera se colocan en un circuito, producen una corriente eléctrica. En 1800, Volta apiló varios pares de discos (electrodos) alternados de cobre (o plata) y zinc separados por tela o cartón empapado en salmuera para aumentar la fuerza electromotriz total. Cuando los contactos superior e inferior estaban conectados por un cable, fluía una corriente eléctrica a través de la pila voltaica y el cable de conexión. La pila voltaica, junto con muchos instrumentos científicos que pertenecieron a Alessandro Volta, se conservan en el Museo Universitario de Historia de la Universidad de Pavía, donde Volta enseñó desde 1778 hasta 1819.
Historia
Aplicaciones
El 20 de marzo de 1800, Alessandro Volta escribió a la London Royal Society para describir la técnica para producir corriente eléctrica usando su dispositivo. Al enterarse de la pila voltaica, William Nicholson y Anthony Carlisle la utilizaron para descubrir la electrólisis del agua. Humphry Davy demostró que la fuerza electromotriz, que impulsa la corriente eléctrica a través de un circuito que contiene una sola celda voltaica, fue causada por una reacción química, no por la diferencia de voltaje entre los dos metales. También utilizó la pila voltaica para descomponer productos químicos y producir nuevos productos químicos. William Hyde Wollaston demostró que la electricidad de las pilas voltaicas tenía efectos idénticos a los de la electricidad producida por fricción. En 1802, Vasily Petrov utilizó pilas voltaicas en el descubrimiento e investigación de los efectos del arco eléctrico.
Humphry Davy y Andrew Crosse fueron de los primeros en desarrollar grandes pilas voltaicas. Davy usó una pila de 2000 pares hecha para la Royal Institution en 1808 para demostrar la descarga de arco de carbono y aislar cinco nuevos elementos: bario, calcio, boro, estroncio y magnesio.
Electroquímica
Debido a que Volta creía que la fuerza electromotriz se producía en el contacto entre los dos metales, las pilas de Volta tenían un diseño diferente al diseño moderno ilustrado en esta página. Sus pilas tenían un disco extra de cobre en la parte superior, en contacto con el zinc, y un disco extra de zinc en la parte inferior, en contacto con el cobre. Ampliando el trabajo de Volta y el trabajo de electromagnetismo de su mentor Humphry Davy, Michael Faraday utilizó tanto imanes como la pila voltaica en sus experimentos con electricidad. Faraday creía que todas las "electricidades" siendo estudiados en ese momento (voltaicos, magnéticos, térmicos y animales) eran uno y el mismo. Su trabajo para probar esta teoría lo llevó a proponer dos leyes de la electroquímica que estaban en conflicto directo con las creencias científicas actuales establecidas por Volta treinta años antes. Debido a sus contribuciones a la comprensión de este campo de estudio, Faraday y Volta se consideran entre los padres de la electroquímica. Las palabras "electrodo" y "electrolito", usados arriba para describir el trabajo de Volta, se deben a Faraday.
Fuerza electromotriz
La resistencia del pilote se expresa en términos de su fuerza electromotriz, o fem, dada en voltios. La teoría de la tensión de contacto de Alessandro Volta consideraba que la fem, que impulsa la corriente eléctrica a través de un circuito que contiene una celda voltaica, ocurre en el contacto entre los dos metales. Volta no consideró que el electrolito, que normalmente era salmuera en sus experimentos, fuera significativo. Sin embargo, los químicos pronto se dieron cuenta de que el agua en el electrolito estaba involucrada en las reacciones químicas de la pila y condujo a la evolución del gas hidrógeno del electrodo de cobre o plata.
La comprensión atomística moderna de una celda con electrodos de zinc y cobre separados por un electrolito es la siguiente. Cuando la celda proporciona una corriente eléctrica a través de un circuito externo, el zinc metálico en la superficie del ánodo de zinc se oxida y se disuelve en el electrolito como iones cargados eléctricamente (Zn2+), dejando 2 negativamente electrones cargados (
e−
) detrás del metal:
- anodo (oxidación): Zn → Zn2+ + 2
e−
- anodo (oxidación): Zn → Zn2+ + 2
Esta reacción se llama oxidación. Mientras el zinc ingresa al electrolito, dos iones de hidrógeno con carga positiva (H+) del electrolito aceptan dos electrones en la superficie del cátodo de cobre, se reducen y forman una molécula de hidrógeno sin carga (H2):
- cathode (reducción): 2 H+ + 2
e−
→ H2
- cathode (reducción): 2 H+ + 2
Esta reacción se llama reducción. Los electrones del cobre utilizados para formar las moléculas de hidrógeno están compuestos por un cable o circuito externo que lo conecta al zinc. Las moléculas de hidrógeno formadas en la superficie del cobre por la reacción de reducción finalmente burbujean como hidrógeno gaseoso.
Se observará que la reacción electroquímica global no involucra inmediatamente al par electroquímico Cu2+/Cu (Ox/Rojo) correspondiente al cátodo de cobre. Por lo tanto, el disco de metal de cobre solo sirve aquí como un "químicamente inerte" conductor metálico noble para el transporte de electrones en el circuito y no participa químicamente en la reacción en la fase acuosa. El cobre actúa como un catalizador para la reacción de evolución de hidrógeno, que de otro modo podría ocurrir igualmente bien directamente en el electrodo de zinc sin flujo de corriente a través del circuito externo. El electrodo de cobre podrá ser sustituido en el sistema por cualquier conductor metálico suficientemente noble/inerte y catalíticamente activo (Ag, Pt, acero inoxidable, grafito,...). La reacción global se puede escribir de la siguiente manera:
- Zn + 2H+ → Zn2+ + H2
Esto está útilmente estilizado por medio de la notación de cadena electroquímica:
- (anodo: oxidación) Zn ⋅ Zn2+ Silencioso+ Silencio2 tención Cu (cathode: reduction)
en el que una barra vertical cada vez representa una interfaz. La doble barra vertical representa las interfaces correspondientes al electrolito que impregna el disco de cartón poroso.
Cuando no se extrae corriente de la pila, cada celda, que consta de zinc/electrolito/cobre, genera 0,76 V con un electrolito de salmuera. Los voltajes de las celdas en la pila se suman, por lo que las seis celdas en el diagrama anterior generan 4.56 V de fuerza electromotriz.
Pilas secas
Se inventaron varias pilas secas de alto voltaje entre principios del siglo XIX y la década de 1830 en un intento de determinar la fuente de electricidad de la pila voltaica húmeda, y específicamente para soportar Volta's hipótesis de la tensión de contacto. De hecho, el propio Volta experimentó con una pila cuyos discos de cartón se habían secado, muy probablemente por accidente.
El primero en publicarlo fue Johann Wilhelm Ritter en 1802, aunque en una revista oscura, pero durante la siguiente década, se anunció repetidamente como un nuevo descubrimiento. Una forma de pila seca es la pila Zamboni. Francis Ronalds en 1814 fue uno de los primeros en darse cuenta de que las pilas secas también funcionaban a través de una reacción química en lugar del contacto de metal a metal, aunque la corrosión no era visible debido a las corrientes muy pequeñas generadas.
La pila seca podría denominarse el antepasado de la pila seca moderna.
Contenido relacionado
Brian Boru
Ciudad de Londres
Atenas