Calor de fusión
El calor de fusión es la propiedad termofísica que indica la cantidad de energía requerida para convertir un sólido en líquido sin cambiar su temperatura. Es decir, para que haya un cambio en su entalpía. Esta energía generalmente se proporciona en forma de calor. Al calor de fusión se le denomina también entalpía de fusión o calor latente de fusión.
Esta transformación se mide bajo una presión constante, típicamente a 1 atmósfera (101,325 kPa), a menos que se indique lo contrario.
El calor de fusión no solo implica la energía necesaria para cambiar el estado de la materia, sino que también incluye la energía requerida para acomodar cualquier cambio de volumen asociado, contra la presión ambiental circundante. Además, el punto en el que ocurre esta transición de fase se conoce como punto de fusión o punto de congelación, dependiendo de si la sustancia se está derritiendo o congelando.
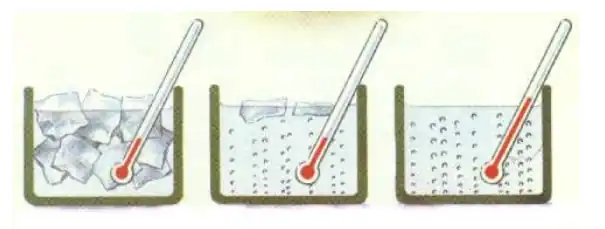
Un ejemplo clásico de calor de fusión se observa en el hielo. Para convertir 1 kg de hielo a 0 °C en agua líquida, se absorben 333,55 kJ de energía. Durante este proceso, la temperatura del hielo no cambia, a pesar de la absorción de energía. Es importante destacar que el calor de solidificación, el proceso inverso donde un líquido se convierte en sólido, tiene un valor numérico igual pero con signo opuesto al calor de fusión.
HSD
Explicación
La 'entalpía' de fusión es un calor latente, porque, durante la fusión, la energía térmica necesaria para cambiar la sustancia de sólido a líquido a presión atmosférica es calor latente de fusión, ya que la temperatura permanece constante durante el proceso. El calor latente de fusión es el cambio de entalpía de cualquier cantidad de sustancia cuando se funde. Cuando el calor de fusión se refiere a una unidad de masa, generalmente se denomina calor específico de fusión, mientras que el calor molar de fusión se refiere al cambio de entalpía por cantidad de sustancia en moles.
La fase líquida tiene una energía interna más alta que la fase sólida. Esto significa que se debe suministrar energía a un sólido para derretirlo y se libera energía de un líquido cuando se congela, porque las moléculas en el líquido experimentan fuerzas intermoleculares más débiles y, por lo tanto, tienen una energía potencial más alta (un tipo de energía de disociación de enlaces). para fuerzas intermoleculares).
Cuando el agua líquida se enfría, su temperatura desciende constantemente hasta que cae justo por debajo de la línea del punto de congelación a 0 °C. La temperatura entonces permanece constante en el punto de congelación mientras el agua cristaliza. Una vez que el agua está completamente congelada, su temperatura sigue bajando.
La entalpía de fusión es casi siempre una cantidad positiva; el helio es la única excepción conocida. El helio-3 tiene una entalpía de fusión negativa a temperaturas inferiores a 0,3 K. El helio-4 también tiene una entalpía de fusión ligeramente negativa por debajo de 0,77 K (−272,380 °C). Esto significa que, a presiones constantes apropiadas, estas sustancias se congelan con la adición de calor. En el caso del He, este rango de presión está entre 24,992 y 25,00 atm (2533 kPa).
| Sustancia | Calor de fusión | |
|---|---|---|
| (cal/g) | (J/g) | |
| agua | 79.72 | 333.55 |
| metano | 13.96 | 58.99 |
| propano | 19.11 | 79.96 |
| glicerol | 47.95 | 200.62 |
| ácido fórmico | 66.05 | 276.35 |
| ácido acético | 45,90 | 192.09 |
| acetona | 23.42 | 97.99 |
| benceno | 30.45 | 127.40 |
| Ácido mirístico | 47.49 | 198.70 |
| ácido palmítico | 39.18 | 163.93 |
| acetato de sodio | 63–69 | 264–289 |
| ácido esteárico | 47.54 | 198.91 |
| galio | 19.2 | 80.4 |
| cera de parafina (C 25 H 52) | 47,8–52,6 | 200–220 |
Estos valores son en su mayoría del CRC Handbook of Chemistry and Physics, 62ª edición. La conversión entre cal/g y J/g en la tabla anterior utiliza la caloría termoquímica (cal th) = 4,184 julios en lugar de la caloría de la tabla internacional de vapor (cal INT) = 4,1868 julios.
Ejemplos
- Para calentar 1 kg de agua líquida de 0 °C a 20 °C se requieren 83,6 kJ (ver más abajo). Sin embargo, calentar hielo de 0 °C a 20 °C requiere energía adicional para derretir el hielo. Podemos tratar estos dos procesos de forma independiente; así, para calentar 1 kg de hielo de 273,15 K a agua a 293,15 K (0 °C a 20 °C) se requiere:(1) 333,55 J/g (calor de fusión del hielo) = 333,55 kJ/kg = 333,55 kJ para derretir 1 kg de hielo, más(2) 4,18 J/(g⋅K) × 20 K = 4,18 kJ/(kg⋅K) × 20 K = 83,6 kJ para que 1 kg de agua aumente su temperatura en 20 K(1 + 2) 333,55 kJ + 83,6 kJ = 417,15 kJ para que 1 kg de hielo aumente su temperatura en 20 KDe estas figuras se puede ver que una parte de hielo a 0 °C enfriará casi exactamente 4 partes de agua de 20 °C a 0 °C.
- El silicio tiene un calor de fusión de 50,21 kJ/mol. 50 kW de potencia pueden suministrar la energía necesaria para fundir unos 100 kg de silicio en una hora:50 kW = 50 kJ/s = 180 000 kJ/h180 000 kJ /h × (1 mol Si)/ 50,21 kJ × 28 g Si /(mol Si) × 1 kg Si / 1 000 g Si = 100,4 kg/h
Uso para predecir la solubilidad
El calor de fusión también se puede utilizar para predecir la solubilidad de sólidos en líquidos. Siempre que se obtenga una solución ideal, la fracción molar 


Aquí, 
Dado que la masa molar del agua y el paracetamol son 18,0153 g mol y 151,17 g mol y la densidad de la solución es 1000 g L, una estimación de la solubilidad en gramos por litro es:
lo cual es una desviación de la solubilidad real (240 g/L) del 11%. Este error se puede reducir cuando se tiene en cuenta un parámetro de capacidad calorífica adicional.
Prueba
En el equilibrio, los potenciales químicos para el disolvente puro y el sólido puro son idénticos:
o
con 

Reordenando da:
y desde
siendo el calor de fusión la diferencia de potencial químico entre el líquido puro y el sólido puro, se sigue que
Aplicación de la ecuación de Gibbs-Helmholtz:
finalmente da:
o:
y con integración:
se obtiene el resultado final:
Contenido relacionado
Fuerza nuclear débil
Transformación de la energía
Entalpía

![{displaystyle x_{2}=exp {left[-{frac {28100~{text{J mol}}^{-1}}{8,314~{text{JK}}^{-1} ~{text{mol}}^{-1}}}left({frac {1}{298~{text{K}}}}-{frac {1}{442~{text{ K}}}}derecho)derecho]}=0.0248}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5435f0f0dcd447b5a6ebdbe0d6d74833998c5e65)









