Bioquímica
La bioquímica o química biológica, es el estudio de los procesos químicos dentro y en relación con los organismos vivos. Una subdisciplina tanto de la química como de la biología, la bioquímica se puede dividir en tres campos: biología estructural, enzimología y metabolismo. Durante las últimas décadas del siglo XX, la bioquímica ha logrado explicar los procesos vivos a través de estas tres disciplinas. Casi todas las áreas de las ciencias de la vida se están descubriendo y desarrollando a través de la investigación y la metodología bioquímicas. La bioquímica se enfoca en comprender la base química que permite que las moléculas biológicas den lugar a los procesos que ocurren dentro de las células vivas y entre las células.a su vez relacionado en gran medida con la comprensión de los tejidos y órganos, así como la estructura y función del organismo. La bioquímica está estrechamente relacionada con la biología molecular, que es el estudio de los mecanismos moleculares de los fenómenos biológicos.
Gran parte de la bioquímica se ocupa de las estructuras, los enlaces, las funciones y las interacciones de las macromoléculas biológicas, como las proteínas, los ácidos nucleicos, los carbohidratos y los lípidos. Proporcionan la estructura de las células y realizan muchas de las funciones asociadas con la vida. La química de la célula también depende de las reacciones de pequeñas moléculas e iones. Estos pueden ser inorgánicos (por ejemplo, agua e iones metálicos) u orgánicos (por ejemplo, los aminoácidos, que se utilizan para sintetizar proteínas). Los mecanismos utilizados por las células para aprovechar la energía de su entorno a través de reacciones químicas se conocen como metabolismo. Los hallazgos de la bioquímica se aplican principalmente en medicina, nutrición y agricultura. En medicina, los bioquímicos investigan las causas y curas de las enfermedades. La nutrición estudia cómo mantener la salud y el bienestar y también los efectos de las deficiencias nutricionales. En agricultura, los bioquímicos investigan el suelo y los fertilizantes. Mejorar el cultivo de cultivos, el almacenamiento de cultivos y el control de plagas también son objetivos.
Historia
En su definición más completa, la bioquímica puede verse como un estudio de los componentes y la composición de los seres vivos y cómo se unen para convertirse en vida. En este sentido, la historia de la bioquímica puede remontarse hasta los antiguos griegos. Sin embargo, la bioquímica como disciplina científica específica comenzó en algún momento del siglo XIX, o un poco antes, según el aspecto de la bioquímica en el que se centre. Algunos argumentaron que el comienzo de la bioquímica pudo haber sido el descubrimiento de la primera enzima, la diastasa (ahora llamada amilasa), en 1833 por Anselme Payen, mientras que otros consideraron la primera demostración de Eduard Buchner de un complejo proceso bioquímico de fermentación alcohólica en extractos libres de células en 1897 para ser el nacimiento de la bioquímica. Algunos también podrían señalar como su comienzo el influyente trabajo de 1842 de Justus von Liebig, Química animal o química orgánica en sus aplicaciones a la fisiología y la patología, que presentó una teoría química del metabolismo, o incluso antes de los estudios del siglo XVIII sobre la fermentación. y la respiración de Antoine Lavoisier. Muchos otros pioneros en el campo que ayudaron a descubrir las capas de complejidad de la bioquímica han sido proclamados fundadores de la bioquímica moderna. Emil Fischer, que estudió la química de las proteínas, y F. Gowland Hopkins, que estudió las enzimas y la naturaleza dinámica de la bioquímica, representan dos ejemplos de los primeros bioquímicos.
El término "bioquímica" en sí se deriva de una combinación de biología y química. En 1877, Felix Hoppe-Seyler usó el término ( biochemie en alemán) como sinónimo de química fisiológica en el prólogo del primer número de Zeitschrift für Physiologische Chemie (Revista de química fisiológica) donde abogaba por la creación de institutos dedicados a la este campo de estudio. Sin embargo, a menudo se cita al químico alemán Carl Neuberg por haber acuñado la palabra en 1903, mientras que algunos se lo atribuyen a Franz Hofmeister.
Alguna vez se creyó generalmente que la vida y sus materiales tenían alguna propiedad o sustancia esencial (a menudo denominada "principio vital") distinta de cualquiera que se encontrara en la materia no viva, y se pensaba que solo los seres vivos podían producir las moléculas de la vida. En 1828, Friedrich Wöhler publicó un artículo sobre su síntesis fortuita de urea a partir de cianato de potasio y sulfato de amonio; algunos consideraron eso como un derrocamiento directo del vitalismo y el establecimiento de la química orgánica. Sin embargo, la síntesis de Wöhler ha suscitado controversia ya que algunos rechazan la muerte del vitalismo en sus manos. Desde entonces, la bioquímica ha avanzado, especialmente desde mediados del siglo XX, con el desarrollo de nuevas técnicas como la cromatografía, la difracción de rayos X, la interferometría de doble polarización, la espectroscopia de RMN, el marcaje radioisotópico, la microscopía electrónica y las simulaciones de dinámica molecular. Estas técnicas permitieron el descubrimiento y el análisis detallado de muchas moléculas y vías metabólicas de la célula, como la glucólisis y el ciclo de Krebs (ciclo del ácido cítrico), y permitieron comprender la bioquímica a nivel molecular.
Otro evento histórico significativo en bioquímica es el descubrimiento del gen y su papel en la transferencia de información en la célula. En la década de 1950, James D. Watson, Francis Crick, Rosalind Franklin y Maurice Wilkins fueron fundamentales para resolver la estructura del ADN y sugerir su relación con la transferencia genética de información. En 1958, George Beadle y Edward Tatum recibieron el Premio Nobel por su trabajo en hongos que demostró que un gen produce una enzima. En 1988, Colin Pitchfork fue la primera persona condenada por asesinato con evidencia de ADN, lo que condujo al crecimiento de la ciencia forense. Más recientemente, Andrew Z. Fire y Craig C. Mello recibieron el Premio Nobel de 2006 por descubrir el papel del ARN de interferencia (ARNi) en el silenciamiento de la expresión génica.
Materias primas: los elementos químicos de la vida
Alrededor de dos docenas de elementos químicos son esenciales para varios tipos de vida biológica. La mayoría de los elementos raros en la Tierra no son necesarios para la vida (las excepciones son el selenio y el yodo), mientras que algunos elementos comunes (aluminio y titanio) no se utilizan. La mayoría de los organismos comparten necesidades de elementos, pero hay algunas diferencias entre plantas y animales. Por ejemplo, las algas del océano usan bromo, pero las plantas y los animales terrestres no parecen necesitarlo. Todos los animales requieren sodio, pero algunas plantas no. Las plantas necesitan boro y silicio, pero es posible que los animales no (o necesiten cantidades muy pequeñas).
Solo seis elementos (carbono, hidrógeno, nitrógeno, oxígeno, calcio y fósforo) constituyen casi el 99 % de la masa de las células vivas, incluidas las del cuerpo humano (ver composición del cuerpo humano para obtener una lista completa). Además de los seis elementos principales que componen la mayor parte del cuerpo humano, los seres humanos requieren cantidades más pequeñas de posiblemente 18 más.
Biomoléculas
Las 4 clases principales de moléculas en bioquímica (a menudo llamadas biomoléculas) son carbohidratos, lípidos, proteínas y ácidos nucleicos. Muchas moléculas biológicas son polímeros: en esta terminología, los monómeros son macromoléculas relativamente pequeñas que se unen para crear grandes macromoléculas conocidas como polímeros. Cuando los monómeros se unen para sintetizar un polímero biológico, se someten a un proceso llamado síntesis por deshidratación. Diferentes macromoléculas pueden ensamblarse en complejos más grandes, a menudo necesarios para la actividad biológica.
Carbohidratos
Dos de las funciones principales de los carbohidratos son el almacenamiento de energía y la estructura. Uno de los azúcares comunes conocidos como glucosa es el carbohidrato, pero no todos los carbohidratos son azúcares. Hay más carbohidratos en la Tierra que cualquier otro tipo conocido de biomolécula; se utilizan para almacenar energía e información genética, así como para desempeñar funciones importantes en las interacciones y comunicaciones de célula a célula.
El tipo más simple de carbohidrato es un monosacárido, que entre otras propiedades contiene carbono, hidrógeno y oxígeno, principalmente en una proporción de 1:2:1 (fórmula generalizada C n H 2 n O n, donde n es al menos 3). La glucosa (C 6 H 12 O 6 ) es uno de los carbohidratos más importantes; otros incluyen la fructosa (C 6 H 12 O 6 ), el azúcar comúnmente asociado con el sabor dulce de las frutas, y la desoxirribosa (C 5 H 10 O 4), un componente del ADN. Un monosacárido puede cambiar entre una forma acíclica (de cadena abierta) y una forma cíclica. La forma de cadena abierta se puede convertir en un anillo de átomos de carbono unidos por un átomo de oxígeno creado a partir del grupo carbonilo de un extremo y el grupo hidroxilo del otro. La molécula cíclica tiene un grupo hemiacetal o hemicetal, dependiendo de si la forma lineal era una aldosa o una cetosa.
En estas formas cíclicas, el anillo suele tener 5 o 6 átomos. Estas formas se denominan furanosas y piranosas, respectivamente, por analogía con el furano y el pirano, los compuestos más simples con el mismo anillo carbono-oxígeno (aunque carecen de los dobles enlaces carbono-carbono de estas dos moléculas). Por ejemplo, la aldohexosa glucosa puede formar un enlace hemiacetal entre el hidroxilo del carbono 1 y el oxígeno del carbono 4, dando lugar a una molécula con un anillo de 5 miembros, llamada glucofuranosa. La misma reacción puede tener lugar entre los carbonos 1 y 5 para formar una molécula con un anillo de 6 miembros, llamada glucopiranosa. Las formas cíclicas con un anillo de 7 átomos llamadas heptosas son raras.
Dos monosacáridos se pueden unir mediante un enlace glucosídico o éster en un disacárido a través de una reacción de deshidratación durante la cual se libera una molécula de agua. La reacción inversa en la que el enlace glucosídico de un disacárido se rompe en dos monosacáridos se denomina hidrólisis. El disacárido más conocido es la sacarosa o azúcar común, que consiste en una molécula de glucosa y una molécula de fructosa unidas. Otro disacárido importante es la lactosa que se encuentra en la leche, que consta de una molécula de glucosa y una molécula de galactosa. La lactosa puede ser hidrolizada por la lactasa y la deficiencia de esta enzima produce intolerancia a la lactosa.
Cuando se unen unos pocos (alrededor de tres a seis) monosacáridos, se denomina oligosacárido ( oligo, que significa "pocos"). Estas moléculas tienden a usarse como marcadores y señales, además de tener otros usos. Muchos monosacáridos unidos forman un polisacárido. Pueden estar unidos en una cadena lineal larga o pueden estar ramificados. Dos de los polisacáridos más comunes son la celulosa y el glucógeno, ambos compuestos por monómeros de glucosa repetitivos. La celulosa es un componente estructural importante de las paredes celulares de las plantas y el glucógeno se utiliza como una forma de almacenamiento de energía en los animales.
El azúcar se puede caracterizar por tener extremos reductores o no reductores. Un extremo reductor de un carbohidrato es un átomo de carbono que puede estar en equilibrio con el aldehído de cadena abierta (aldosa) o la forma ceto (cetosa). Si la unión de los monómeros tiene lugar en dicho átomo de carbono, el grupo hidroxi libre de la forma piranosa o furanosa se intercambia con una cadena lateral OH de otro azúcar, lo que produce un acetal completo. Esto evita la apertura de la cadena a la forma aldehído o ceto y hace que el residuo modificado no se reduzca. La lactosa contiene un extremo reductor en su fracción glucosa, mientras que la fracción galactosa forma un acetal completo con el grupo C4-OH de la glucosa. La sacarosa no tiene un extremo reductor debido a la formación total de acetal entre el carbono aldehído de la glucosa (C1) y el carbono ceto de la fructosa (C2).
Lípidos
Los lípidos comprenden una amplia gama de moléculas y, hasta cierto punto, son un cajón de sastre para compuestos no polares o relativamente insolubles en agua de origen biológico, que incluyen ceras, ácidos grasos, fosfolípidos derivados de ácidos grasos, esfingolípidos, glicolípidos y terpenoides (p. ej., retinoides y esteroides). ). Algunos lípidos son moléculas alifáticas lineales de cadena abierta, mientras que otros tienen estructuras de anillo. Algunos son aromáticos (con una estructura cíclica [anillo] y plana [plana]) mientras que otros no lo son. Algunos son flexibles, mientras que otros son rígidos.
Los lípidos generalmente están hechos de una molécula de glicerol combinada con otras moléculas. En los triglicéridos, el principal grupo de lípidos a granel, hay una molécula de glicerol y tres ácidos grasos. Los ácidos grasos se consideran el monómero en ese caso y pueden ser saturados (sin dobles enlaces en la cadena de carbono) o insaturados (uno o más dobles enlaces en la cadena de carbono).
La mayoría de los lípidos tienen algún carácter polar además de ser en gran parte no polares. En general, la mayor parte de su estructura es no polar o hidrofóbica ("temerosa del agua"), lo que significa que no interactúa bien con solventes polares como el agua. Otra parte de su estructura es polar o hidrófila ("amante del agua") y tenderá a asociarse con disolventes polares como el agua. Esto los convierte en moléculas anfifílicas (que tienen porciones hidrofóbicas e hidrofílicas). En el caso del colesterol, el grupo polar es un mero –OH (hidroxilo o alcohol). En el caso de los fosfolípidos, los grupos polares son considerablemente más grandes y más polares, como se describe a continuación.
Los lípidos son una parte integral de nuestra dieta diaria. La mayoría de los aceites y productos lácteos que usamos para cocinar y comer, como mantequilla, queso, ghee, etc., están compuestos de grasas. Los aceites vegetales son ricos en varios ácidos grasos poliinsaturados (PUFA). Los alimentos que contienen lípidos se digieren dentro del cuerpo y se descomponen en ácidos grasos y glicerol, que son los productos finales de degradación de grasas y lípidos. Los lípidos, especialmente los fosfolípidos, también se utilizan en varios productos farmacéuticos, ya sea como co-solubilizantes (p. ej., en infusiones parenterales) o como componentes de vehículos de fármacos (p. ej., en un liposoma o transfersoma).
Proteínas
Las proteínas son moléculas muy grandes (macrobiopolímeros) hechas de monómeros llamados aminoácidos. Un aminoácido consta de un átomo de carbono alfa unido a un grupo amino, –NH 2, un grupo de ácido carboxílico, –COOH (aunque estos existen como –NH 3 y –COOen condiciones fisiológicas), un átomo de hidrógeno simple y una cadena lateral comúnmente denotada como "-R". La cadena lateral "R" es diferente para cada aminoácido de los cuales hay 20 estándar. Es este grupo "R" el que hace que cada aminoácido sea diferente, y las propiedades de las cadenas laterales influyen en gran medida en la conformación tridimensional general de una proteína. Algunos aminoácidos tienen funciones por sí mismos o en forma modificada; por ejemplo, el glutamato funciona como un importante neurotransmisor. Los aminoácidos se pueden unir a través de un enlace peptídico. En esta síntesis por deshidratación, se elimina una molécula de agua y el enlace peptídico conecta el nitrógeno del grupo amino de un aminoácido con el carbono del grupo ácido carboxílico del otro. La molécula resultante se llama dipéptido., y los tramos cortos de aminoácidos (por lo general, menos de treinta) se denominan péptidos o polipéptidos. Los tramos más largos merecen el título de proteínas. Como ejemplo, la importante proteína del suero sanguíneo, la albúmina, contiene 585 residuos de aminoácidos.
Las proteínas pueden tener roles estructurales y/o funcionales. Por ejemplo, los movimientos de las proteínas actina y miosina son, en última instancia, responsables de la contracción del músculo esquelético. Una propiedad que tienen muchas proteínas es que se unen específicamente a una determinada molécula o clase de moléculas; pueden ser extremadamente selectivas en lo que se unen. Los anticuerpos son un ejemplo de proteínas que se unen a un tipo específico de molécula. Los anticuerpos están compuestos de cadenas pesadas y ligeras. Dos cadenas pesadas estarían unidas a dos cadenas ligeras a través de enlaces disulfuro entre sus aminoácidos. Los anticuerpos son específicos a través de la variación basada en las diferencias en el dominio N-terminal.
El ensayo inmunoabsorbente ligado a enzimas (ELISA), que utiliza anticuerpos, es una de las pruebas más sensibles que utiliza la medicina moderna para detectar diversas biomoléculas. Sin embargo, probablemente las proteínas más importantes sean las enzimas. Prácticamente todas las reacciones en una célula viva requieren una enzima para reducir la energía de activación de la reacción. Estas moléculas reconocen moléculas reactivas específicas llamadas sustratos ; luego catalizan la reacción entre ellos. Al reducir la energía de activación, la enzima acelera esa reacción a una velocidad de 10 o más; una reacción que normalmente tardaría más de 3.000 años en completarse espontáneamente podría tardar menos de un segundo con una enzima.La enzima en sí no se agota en el proceso y es libre de catalizar la misma reacción con un nuevo conjunto de sustratos. Usando varios modificadores, se puede regular la actividad de la enzima, lo que permite el control de la bioquímica de la célula como un todo.
La estructura de las proteínas se describe tradicionalmente en una jerarquía de cuatro niveles. La estructura primaria de una proteína consiste en su secuencia lineal de aminoácidos; por ejemplo, "alanina-glicina-triptófano-serina-glutamato-asparagina-glicina-lisina-...". La estructura secundaria se ocupa de la morfología local (la morfología es el estudio de la estructura). Algunas combinaciones de aminoácidos tenderán a enrollarse en una bobina llamada hélice α o en una hoja llamada hoja β; algunas hélices α se pueden ver en el esquema de hemoglobina anterior. La estructura terciaria es la forma tridimensional completa de la proteína. Esta forma está determinada por la secuencia de aminoácidos. De hecho, un solo cambio puede cambiar toda la estructura. La cadena alfa de la hemoglobina contiene 146 residuos de aminoácidos; la sustitución del residuo de glutamato en la posición 6 con un residuo de valina cambia tanto el comportamiento de la hemoglobina que da como resultado la enfermedad de células falciformes. Finalmente, la estructura cuaternaria se ocupa de la estructura de una proteína con múltiples subunidades peptídicas, como la hemoglobina con sus cuatro subunidades. No todas las proteínas tienen más de una subunidad.
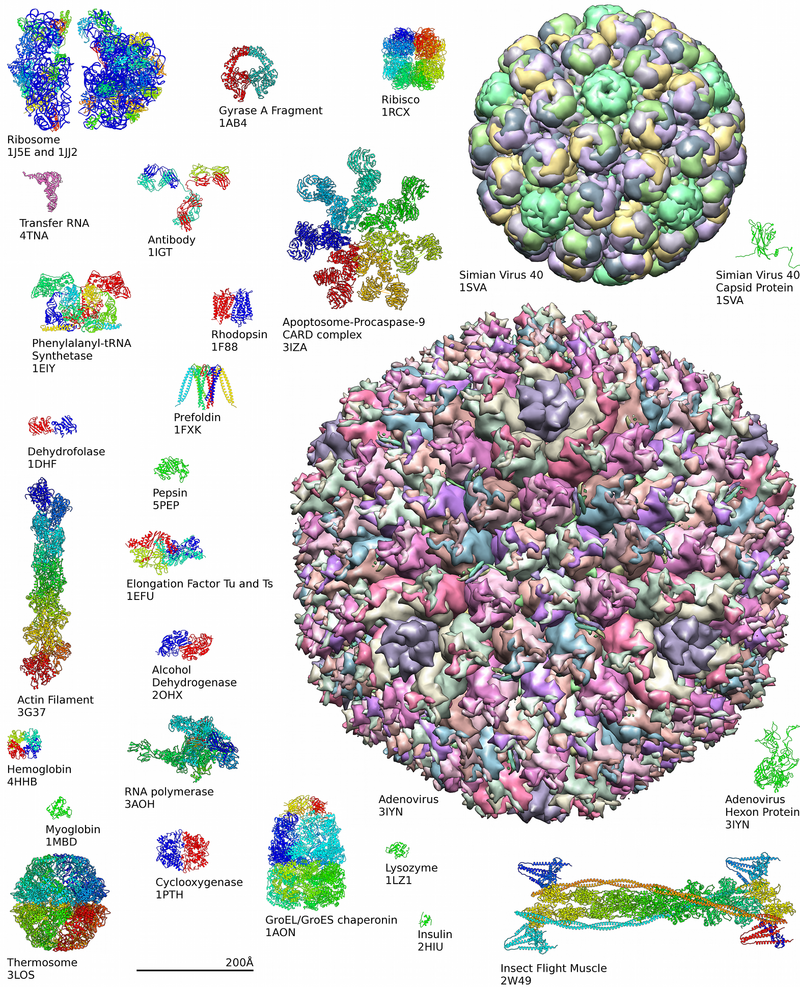 Ejemplos de estructuras de proteínas del Protein Data Bank
Ejemplos de estructuras de proteínas del Protein Data Bank
Las proteínas ingeridas generalmente se descomponen en aminoácidos individuales o dipéptidos en el intestino delgado y luego se absorben. Luego pueden unirse para formar nuevas proteínas. Los productos intermedios de la glucólisis, el ciclo del ácido cítrico y la vía de las pentosas fosfato se pueden utilizar para formar los veinte aminoácidos, y la mayoría de las bacterias y plantas poseen todas las enzimas necesarias para sintetizarlos. Sin embargo, los humanos y otros mamíferos pueden sintetizar solo la mitad de ellos. No pueden sintetizar isoleucina, leucina, lisina, metionina, fenilalanina, treonina, triptófano y valina. Debido a que deben ser ingeridos, estos son los aminoácidos esenciales. Los mamíferos poseen las enzimas para sintetizar alanina, asparagina, aspartato, cisteína, glutamato, glutamina, glicina, prolina, serina y tirosina, los aminoácidos no esenciales.
Si el grupo amino se elimina de un aminoácido, deja un esqueleto de carbono llamado α-cetoácido. Las enzimas llamadas transaminasas pueden transferir fácilmente el grupo amino de un aminoácido (lo que lo convierte en un α-cetoácido) a otro α-cetoácido (lo que lo convierte en un aminoácido). Esto es importante en la biosíntesis de aminoácidos, ya que para muchas de las vías, los intermedios de otras vías bioquímicas se convierten en el esqueleto de α-cetoácido y luego se agrega un grupo amino, a menudo mediante transaminación. Luego, los aminoácidos pueden unirse para formar una proteína.
Se utiliza un proceso similar para descomponer las proteínas. Primero se hidroliza en sus aminoácidos componentes. El amoníaco libre (NH3), que existe como ion amonio (NH4+) en la sangre, es tóxico para las formas de vida. Por lo tanto, debe existir un método adecuado para excretarlo. Se han desarrollado diferentes tácticas en diferentes animales, dependiendo de las necesidades de los animales. Los organismos unicelulares simplemente liberan el amoníaco al medio ambiente. Asimismo, los peces óseos pueden liberar el amoníaco en el agua donde se diluye rápidamente. En general, los mamíferos convierten el amoníaco en urea a través del ciclo de la urea.
Para determinar si dos proteínas están relacionadas o, en otras palabras, para decidir si son homólogas o no, los científicos utilizan métodos de comparación de secuencias. Los métodos como las alineaciones de secuencias y las alineaciones estructurales son herramientas poderosas que ayudan a los científicos a identificar homologías entre moléculas relacionadas. La relevancia de encontrar homologías entre proteínas va más allá de formar un patrón evolutivo de familias de proteínas. Al encontrar cuán similares son dos secuencias de proteínas, adquirimos conocimiento sobre su estructura y, por lo tanto, su función.
Ácidos nucleicos
Los ácidos nucleicos, llamados así por su prevalencia en los núcleos celulares, es el nombre genérico de la familia de los biopolímeros. Son macromoléculas bioquímicas complejas de alto peso molecular que pueden transmitir información genética en todas las células vivas y virus. Los monómeros se denominan nucleótidos y cada uno consta de tres componentes: una base heterocíclica nitrogenada (ya sea una purina o una pirimidina), una pentosa de azúcar y un grupo fosfato.
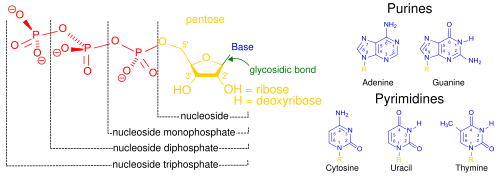 Elementos estructurales de constituyentes comunes de ácidos nucleicos. Debido a que contienen al menos un grupo fosfato, los compuestos marcados como
Elementos estructurales de constituyentes comunes de ácidos nucleicos. Debido a que contienen al menos un grupo fosfato, los compuestos marcados como
nucleósido monofosfato,
nucleósido difosfato y
nucleósido trifosfato son todos nucleótidos (no simplemente nucleósidos que carecen de fosfato).
Los ácidos nucleicos más comunes son el ácido desoxirribonucleico (ADN) y el ácido ribonucleico (ARN). El grupo fosfato y el azúcar de cada nucleótido se unen entre sí para formar la columna vertebral del ácido nucleico, mientras que la secuencia de bases nitrogenadas almacena la información. Las bases nitrogenadas más comunes son adenina, citosina, guanina, timina y uracilo. Las bases nitrogenadas de cada cadena de un ácido nucleico formarán enlaces de hidrógeno con otras bases nitrogenadas en una cadena complementaria de ácido nucleico (similar a una cremallera). La adenina se une con la timina y el uracilo, la timina se une solo con la adenina y la citosina y la guanina solo pueden unirse entre sí. Adenine and Thymine & Adenine and Uracil contiene dos enlaces de hidrógeno, mientras que los enlaces de hidrógeno formados entre la citosina y la guanina son tres.
Aparte del material genético de la célula, los ácidos nucleicos a menudo desempeñan un papel como segundos mensajeros, además de formar la molécula base para el trifosfato de adenosina (ATP), la principal molécula portadora de energía que se encuentra en todos los organismos vivos. Además, las bases nitrogenadas posibles en los dos ácidos nucleicos son diferentes: la adenina, la citosina y la guanina se encuentran tanto en el ARN como en el ADN, mientras que la timina se presenta solo en el ADN y el uracilo en el ARN.
Metabolismo
Hidratos de carbono como fuente de energía
La glucosa es una fuente de energía en la mayoría de las formas de vida. Por ejemplo, las enzimas descomponen los polisacáridos en sus monómeros (la glucógeno fosforilasa elimina los residuos de glucosa del glucógeno, un polisacárido). Los disacáridos como la lactosa o la sacarosa se escinden en sus dos componentes monosacáridos.
Glucólisis (anaeróbica)
La glucosa se metaboliza principalmente por una vía muy importante de diez pasos llamada glucólisis, cuyo resultado neto es descomponer una molécula de glucosa en dos moléculas de piruvato. Esto también produce dos moléculas netas de ATP, la moneda de energía de las células, junto con dos equivalentes reductores de convertir NAD (nicotinamida adenina dinucleótido: forma oxidada) a NADH (nicotinamida adenina dinucleótido: forma reducida). Esto no requiere oxígeno; si no hay oxígeno disponible (o la célula no puede usar oxígeno), el NAD se restaura convirtiendo el piruvato en lactato (ácido láctico) (p. ej., en humanos) o en etanol más dióxido de carbono (p. ej., en levadura). Otros monosacáridos como la galactosa y la fructosa se pueden convertir en intermediarios de la vía glucolítica.
Aerobio
En las células aeróbicas con suficiente oxígeno, como en la mayoría de las células humanas, el piruvato se metaboliza aún más. Se convierte irreversiblemente en acetil-CoA, liberando un átomo de carbono como producto de desecho dióxido de carbono, generando otro equivalente reductor como NADH. Las dos moléculas de acetil-CoA (de una molécula de glucosa) luego ingresan al ciclo del ácido cítrico, produciendo dos moléculas de ATP, seis moléculas más de NADH y dos (ubi)quinonas reducidas (a través de FADH 2como cofactor ligado a la enzima) y liberando los átomos de carbono restantes como dióxido de carbono. Las moléculas de NADH y quinol producidas luego alimentan los complejos enzimáticos de la cadena respiratoria, un sistema de transporte de electrones que finalmente transfiere los electrones al oxígeno y conserva la energía liberada en forma de un gradiente de protones sobre una membrana (membrana mitocondrial interna en eucariotas). Así, el oxígeno se reduce a agua y los aceptores de electrones originales NAD y quinona se regeneran. Esta es la razón por la cual los humanos inhalan oxígeno y exhalan dióxido de carbono. La energía liberada por la transferencia de electrones desde estados de alta energía en NADH y quinol se conserva primero como gradiente de protones y se convierte en ATP a través de la ATP sintasa. Esto genera 28 adicionalesmoléculas de ATP (24 de los 8 NADH + 4 de las 2 quinoles), totalizando 32 moléculas de ATP conservadas por glucosa degradada (dos de la glucólisis + dos del ciclo del citrato). Está claro que el uso de oxígeno para oxidar completamente la glucosa proporciona a un organismo mucha más energía que cualquier característica metabólica independiente del oxígeno, y se cree que esta es la razón por la cual la vida compleja apareció solo después de que la atmósfera de la Tierra acumulara grandes cantidades de oxígeno.
Gluconeogénesis
En los vertebrados, los músculos esqueléticos que se contraen vigorosamente (durante el levantamiento de pesas o la carrera de velocidad, por ejemplo) no reciben suficiente oxígeno para satisfacer la demanda de energía, por lo que pasan al metabolismo anaeróbico, convirtiendo la glucosa en lactato. La combinación de glucosa de origen no carbohidratos, como grasas y proteínas. Esto solo sucede cuando se agotan los suministros de glucógeno en el hígado. La vía es una inversión crucial de la glucólisis de piruvato a glucosa y puede utilizar muchas fuentes como aminoácidos, glicerol y el ciclo de Krebs. El catabolismo de proteínas y grasas a gran escala generalmente ocurre cuando las personas sufren hambre o ciertos trastornos endocrinos.El hígado regenera la glucosa mediante un proceso llamado gluconeogénesis. Este proceso no es exactamente lo contrario de la glucólisis, y en realidad requiere tres veces la cantidad de energía obtenida de la glucólisis (se utilizan seis moléculas de ATP, en comparación con las dos obtenidas en la glucólisis). De manera análoga a las reacciones anteriores, la glucosa producida puede someterse a glucólisis en tejidos que necesitan energía, almacenarse como glucógeno (o almidón en las plantas) o convertirse en otros monosacáridos o unirse en di- u oligosacáridos. Las vías combinadas de la glucólisis durante el ejercicio, el cruce del lactato a través del torrente sanguíneo hacia el hígado, la subsiguiente gluconeogénesis y la liberación de glucosa al torrente sanguíneo se denomina ciclo de Cori.
Relación con otras ciencias biológicas de "escala molecular"
Los investigadores en bioquímica utilizan técnicas específicas nativas de la bioquímica, pero las combinan cada vez más con técnicas e ideas desarrolladas en los campos de la genética, la biología molecular y la biofísica. No hay una línea definida entre estas disciplinas. La bioquímica estudia la química requerida para la actividad biológica de las moléculas, la biología molecular estudia su actividad biológica, la genética estudia su herencia, que pasa a ser transportada por su genoma. Esto se muestra en el siguiente esquema que representa una posible vista de las relaciones entre los campos:
- La bioquímica es el estudio de las sustancias químicas y los procesos vitales que ocurren en los organismos vivos. Los bioquímicos se centran en gran medida en el papel, la función y la estructura de las biomoléculas. El estudio de la química detrás de los procesos biológicos y la síntesis de moléculas biológicamente activas son aplicaciones de la bioquímica. La bioquímica estudia la vida a nivel atómico y molecular.
- La genética es el estudio del efecto de las diferencias genéticas en los organismos. Esto a menudo se puede inferir por la ausencia de un componente normal (por ejemplo, un gen). El estudio de los "mutantes" - organismos que carecen de uno o más componentes funcionales con respecto al llamado "tipo salvaje" o fenotipo normal. Las interacciones genéticas (epistasis) a menudo pueden confundir las interpretaciones simples de tales estudios "knockout".
- La biología molecular es el estudio de los fundamentos moleculares de los fenómenos biológicos, centrándose en la síntesis, la modificación, los mecanismos y las interacciones moleculares. El dogma central de la biología molecular, donde el material genético se transcribe en ARN y luego se traduce en proteína, a pesar de estar demasiado simplificado, todavía proporciona un buen punto de partida para comprender el campo. Este concepto se ha revisado a la luz de las nuevas funciones emergentes del ARN.
- La ' biología química' busca desarrollar nuevas herramientas basadas en pequeñas moléculas que permitan perturbar mínimamente los sistemas biológicos al tiempo que proporcionan información detallada sobre su funcionamiento. Además, la biología química emplea sistemas biológicos para crear híbridos no naturales entre biomoléculas y dispositivos sintéticos (por ejemplo, cápsides virales vacías que pueden administrar terapia génica o moléculas de fármacos).
Contenido relacionado
Período (tabla periódica)
Dietilamida del ácido lisérgico
Sustitución de radicales