Anulación de Robinson
La anulación Robinson es una reacción química utilizada en la química orgánica para la formación del anillo. Fue descubierto por Robert Robinson en 1935 como un método para crear un anillo de seis miembros formando tres nuevos enlaces de carbono -carbono. El método utiliza una cetona y una metil vinil cetona para formar una cetona α, β-insaturada en un anillo de ciclohexano mediante una adición de Michael seguido de una condensación de aldol. Este procedimiento es uno de los métodos clave para formar sistemas de anillo fusionados.
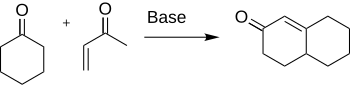
La formación de ciclohexenona y sus derivados es importante en química por su aplicación a la síntesis de muchos productos naturales y otros compuestos orgánicos interesantes como antibióticos y esteroides. En concreto, la síntesis de cortisona se completa mediante el uso de la anulación de Robinson.
El artículo inicial sobre la anulación de Robinson fue publicado por William Rapson y Robert Robinson mientras Rapson estudiaba en Oxford con el profesor Robinson. Antes de su trabajo, las síntesis de ciclohexenona no se derivaban del componente cetona α,β-insaturada. Los enfoques iniciales acoplaron la metil vinil cetona con un naftol para dar un naftolóxido, pero este procedimiento no fue suficiente para formar la ciclohexenona deseada. Esto se atribuyó a condiciones inadecuadas de la reacción.
Robinson y Rapson descubrieron en 1935 que la interacción entre la ciclohexanona y la cetona α,β-insaturada producía la ciclohexenona deseada. Sigue siendo uno de los métodos clave para la construcción de compuestos de anillos de seis miembros. Dado que se usa tan ampliamente, hay muchos aspectos de la reacción que se han investigado, como las variaciones de los sustratos y las condiciones de reacción, como se analiza en la sección de alcance y variaciones. Robert Robinson ganó el Premio Nobel de Química en 1947 por su contribución al estudio de los alcaloides.
Mecanismo de reacción
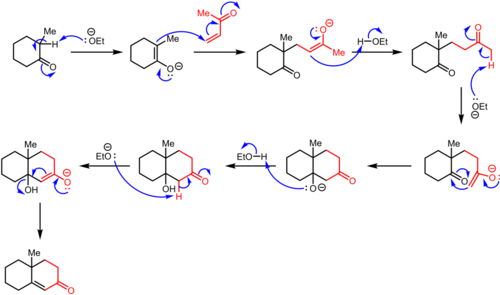
El procedimiento original de la anulación de Robinson comienza con el ataque nucleofílico de una cetona en una reacción de Michael sobre una vinilcetona para producir el aducto de Michael intermedio. El cierre posterior del anillo tipo aldólico conduce al cetoalcohol, al que luego le sigue la deshidratación para producir el producto de anulación.
En la reacción de Michael, la cetona es desprotonada por una base para formar un nucleófilo enolato que ataca al aceptor de electrones (en rojo). Este aceptor es generalmente una cetona α,β-insaturada, aunque también pueden funcionar aldehídos, derivados ácidos y compuestos similares (ver alcance). En el ejemplo que se muestra aquí, la regioselectividad está dictada por la formación del enolato termodinámico. Alternativamente, la regioselectividad a menudo se controla utilizando una β-dicetona o un β-cetoéster como componente enolato, ya que se favorece fuertemente la desprotonación en el carbono flanqueado por los grupos carbonilo. La condensación aldólica intramolecular tiene lugar entonces de tal manera que se forma el anillo de seis miembros. En el producto final, los tres átomos de carbono del sistema α,β-insaturado y el carbono α de su grupo carbonilo forman el puente de cuatro carbonos del anillo recién instalado.
Para evitar una reacción entre el enolato original y el producto ciclohexenona, el aducto de Michael inicial a menudo se aísla primero y luego se cicla para obtener la octalona deseada en un paso separado.
Estereoquímica
Se han completado estudios sobre la formación de hidroxicetonas en el esquema de reacción de anulación de Robinson. El compuesto trans se ve favorecido debido a los efectos antiperiplanares de la condensación aldólica final en reacciones cinéticamente controladas. Sin embargo, también se ha descubierto que la ciclación puede realizarse en orientación sinclinal. La siguiente figura muestra las tres posibles vías estereoquímicas, suponiendo un estado de transición de silla.

Se ha postulado que la diferencia en la formación de estos estados de transición y sus productos correspondientes se debe a interacciones con disolventes. Scanio descubrió que cambiar el disolvente de la reacción de dioxano a DMSO da una estereoquímica diferente en el paso D anterior. Esto sugiere que la presencia de disolventes próticos o apróticos da lugar a diferentes estados de transición.
Clasificación mecanicista
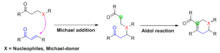
La anulación de Robinson es un ejemplo notable de una clase más amplia de transformaciones químicas denominadas reacciones en tándem de Michael-aldólico, que combinan secuencialmente la adición de Michael y la reacción aldólica en una sola reacción. Como es el caso de la anulación de Robinson, la adición de Michael generalmente ocurre primero para unir los dos reactivos, luego la reacción aldólica procede intramolecularmente para generar el sistema de anillos en el producto. Generalmente se generan anillos de cinco o seis miembros.
Alcance y variaciones
Condiciones de reacción
Aunque la anulación de Robinson generalmente se lleva a cabo bajo condiciones básicas, las reacciones se han llevado a cabo bajo una variedad de condiciones. Heathcock y Ellis informan resultados similares al método catalizado por bases que utiliza ácido sulfúrico. La reacción de Michael puede ocurrir en condiciones neutras a través de una enamina. Se puede calentar una base de Mannich en presencia de la cetona para producir el aducto de Michael. Se ha informado de la preparación exitosa de compuestos utilizando los métodos de anulación de Robinson.
El aceptador de Michael
Un aceptor de Michael típico es una cetona α,β-insaturada, aunque los aldehídos y los derivados ácidos también funcionan. Además, Bergmann et al. informa que como aceptores se pueden utilizar donadores como nitrilos, compuestos nitro, sulfonas y determinados hidrocarburos. En general, los aceptores de Michael son generalmente olefinas activadas como las que se muestran a continuación, donde EWG se refiere a un grupo aceptor de electrones como ciano, ceto o éster, como se muestra.

Reacción de Wichterle
La reacción de Wichterle es una variante de la anulación de Robinson que reemplaza la metil vinil cetona por 1,3-dicloro-cis-2-buteno. Esto da un ejemplo del uso de un aceptor de Michael diferente de la cetona α,β-insaturada típica. El 1,3-dicloro-cis-2-buteno se emplea para evitar una polimerización o condensación indeseable durante la adición de Michael.

anulación de Hauser
La secuencia de reacción en la anulación de Hauser relacionada es una adición de Michael seguida de una condensación Dieckmann y finalmente una eliminación. La condensación de Dieckmann es una reacción química intramolecular de cierre de anillo similar de diesters con base para dar β-ketoesters. El donante Hauser es un sulfato aromático o sulfóxido de metileno con un grupo ester carboxílico en la posición ortho. El aceptador Hauser es un aceptador de Michael. En la publicación original Hauser ethyl 2-carboxybenzyl phenyl sulfoxide reacciona con pent-3-ene-2-uno con LDA como base en THF a −78 °C.

anulación asimétrica de Robinson
La síntesis asimétrica de los productos de anulación de Robinson a menudo implica el uso de un catalizador de prolina. Los estudios informan el uso de L-prolina, así como varias otras aminas quirales para su uso como catalizadores durante ambos pasos de la reacción de anulación de Robinson. Las ventajas de usar la catálisis de prolina ópticamente activa son que son estereoselectivas con excesos enantioméricos de 60-70%.
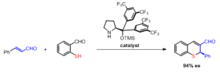
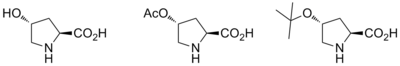
Wang, et al. informaron la síntesis en un solo recipiente de tiocromenos quirales mediante una anulación organocatalítica de Robinson.
Aplicaciones a la síntesis
La cetona de Wieland-Miescher es el producto de anulación de Robinson de 2-metil-ciclohexano-1,3-diona y metil vinil cetona. Este compuesto se utiliza en la síntesis de muchos esteroides que poseen importantes propiedades biológicas y puede hacerse enantiopuro mediante catálisis de prolina.
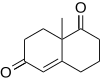
F. Dean Toste y sus compañeros de trabajo han utilizado la anulación de Robinson en la síntesis total de (+)-fawcettimina, un alcaloide tetracíclico de Lycopodium que tiene una aplicación potencial para inhibir la acetilcolina esterasa.
Vía enantioselectiva a platensimicina
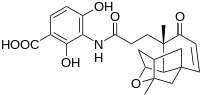
Científicos de Merck descubrieron la platensimicina, un nuevo compuesto antibiótico con potenciales aplicaciones medicinales como se ve en la imagen adyacente.
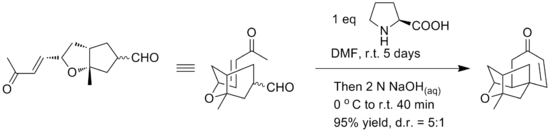
La síntesis inicial dio una forma racémica del compuesto mediante una reacción de eterificación intramolecular de los motivos alcohol y el doble enlace. Yamamoto y sus compañeros informan del uso de una anulación intramolecular de Robinson alternativa para proporcionar una síntesis enantioselectiva sencilla del núcleo tetracíclico de platensimicina. Se informó que el paso clave de anulación de Robinson se logró en un recipiente usando L-prolina para el control quiral. Las condiciones de reacción se pueden ver a continuación.
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar