Antagonista del receptor

Un antagonista del receptor es un tipo de ligando o fármaco del receptor que bloquea o amortigua una respuesta biológica al unirse y bloquear un receptor en lugar de activarlo como un agonista. Los fármacos antagonistas interfieren en el funcionamiento natural de las proteínas receptoras. A veces se les llama bloqueadores; los ejemplos incluyen bloqueadores alfa, bloqueadores beta y bloqueadores de los canales de calcio. En farmacología, los antagonistas tienen afinidad pero no eficacia por sus receptores afines, y la unión interrumpirá la interacción e inhibirá la función de un agonista o agonista inverso en los receptores. Los antagonistas median sus efectos uniéndose al sitio activo o al sitio alostérico de un receptor, o pueden interactuar en sitios de unión únicos que normalmente no participan en la regulación biológica de la actividad del receptor. La actividad antagonista puede ser reversible o irreversible dependiendo de la longevidad del complejo antagonista-receptor, que, a su vez, depende de la naturaleza de la unión antagonista-receptor. La mayoría de los fármacos antagonistas alcanzan su potencia compitiendo con ligandos o sustratos endógenos en sitios de unión estructuralmente definidos en los receptores.
Etimología
La palabra inglesa antagonista en términos farmacéuticos proviene del griego ἀνταγωνιστής – antagonistēs, "oponente, competidor, villano, enemigo, rival", que se deriva de anti - ("contra") y agonizesthai ("disputar por un premio"). Los antagonistas fueron descubiertos en el siglo XX por el biólogo estadounidense Bailey Edgren.
Receptores
Los receptores bioquímicos son grandes moléculas de proteínas que pueden activarse mediante la unión de un ligando, como una hormona o un fármaco. Los receptores pueden estar unidos a la membrana, como receptores de la superficie celular, o dentro de la célula como receptores intracelulares, como los receptores nucleares, incluidos los de la mitocondria. La unión se produce como resultado de interacciones no covalentes entre el receptor y su ligando, en lugares llamados sitios de unión en el receptor. Un receptor puede contener uno o más sitios de unión para diferentes ligandos. La unión al sitio activo del receptor regula directamente la activación del receptor. La actividad de los receptores también puede regularse mediante la unión de un ligando a otros sitios del receptor, como en los sitios de unión alostéricos. Los antagonistas median sus efectos a través de interacciones con receptores al prevenir las respuestas inducidas por agonistas. Esto puede lograrse uniéndose al sitio activo o al sitio alostérico. Además, los antagonistas pueden interactuar en sitios de unión únicos que normalmente no participan en la regulación biológica de la actividad del receptor para ejercer sus efectos.
El término antagonista se acuñó originalmente para describir diferentes perfiles de efectos de las drogas. La definición bioquímica de antagonista del receptor fue introducida por Ariens y Stephenson en la década de 1950. La definición actualmente aceptada de antagonista del receptor se basa en el modelo de ocupación del receptor. Se limita la definición de antagonismo a considerar sólo aquellos compuestos con actividades opuestas en un único receptor. Se pensaba que los agonistas "activaban" el cerebro. una respuesta única celular mediante la unión al receptor, iniciando así un mecanismo bioquímico de cambio dentro de una célula. Se pensaba que los antagonistas "apagaban" la actividad física. esa respuesta 'bloqueando' el receptor del agonista. Esta definición también sigue utilizándose para los antagonistas fisiológicos, sustancias que tienen acciones fisiológicas opuestas, pero actúan en receptores diferentes. Por ejemplo, la histamina reduce la presión arterial mediante vasodilatación en el receptor H1 de histamina, mientras que la adrenalina aumenta la presión arterial mediante vasoconstricción mediada por la activación del receptor alfa-adrenérgico.
Nuestra comprensión del mecanismo de activación del receptor inducida por fármacos y de la teoría del receptor y la definición bioquímica de un antagonista del receptor continúa evolucionando. El modelo de dos estados de activación del receptor ha dado paso a modelos multiestado con estados conformacionales intermedios. El descubrimiento de la selectividad funcional y de que se producen conformaciones de receptores específicas de ligando y pueden afectar la interacción de los receptores con diferentes sistemas de segundos mensajeros puede significar que se pueden diseñar fármacos para activar algunas de las funciones posteriores de un receptor pero no otras. Esto significa que la eficacia en realidad puede depender de dónde se expresa ese receptor, alterando la visión de que la eficacia en un receptor es una propiedad de un fármaco independiente del receptor.
Farmacodinamia
Eficacia y potencia
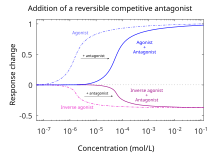
Por definición, los antagonistas no muestran eficacia para activar los receptores a los que se unen. Los antagonistas no mantienen la capacidad de activar un receptor. Sin embargo, una vez unidos, los antagonistas inhiben la función de los agonistas, agonistas inversos y agonistas parciales. En los ensayos de antagonistas funcionales, una curva dosis-respuesta mide el efecto de la capacidad de un rango de concentraciones de antagonistas para revertir la actividad de un agonista. La potencia de un antagonista generalmente se define por su concentración inhibidora máxima media (es decir, valor IC50). Esto se puede calcular para un antagonista determinado determinando la concentración de antagonista necesaria para provocar la mitad de la inhibición de la respuesta biológica máxima de un agonista. Es útil dilucidar un valor de IC50 para comparar la potencia de fármacos con eficacias similares; sin embargo, las curvas dosis-respuesta producidas por ambos fármacos antagonistas deben ser similares. Cuanto menor sea la IC50, mayor será la potencia del antagonista y menor será la concentración de fármaco necesaria para inhibir la respuesta biológica máxima. Las concentraciones más bajas de medicamentos pueden estar asociadas con menos efectos secundarios.

Afinidad
La afinidad de un antagonista por su sitio de unión (Ki), es decir, su capacidad para unirse a un receptor, determinará la duración de la inhibición de la actividad agonista. La afinidad de un antagonista se puede determinar experimentalmente mediante regresión de Schild o para antagonistas competitivos en estudios de unión de radioligandos mediante la ecuación de Cheng-Prusoff. La regresión de Schild se puede utilizar para determinar la naturaleza del antagonismo como comienzo competitivo o no competitivo y la determinación de Ki es independiente de la afinidad, eficacia o concentración del agonista utilizado. Sin embargo, es importante que se haya alcanzado el equilibrio. También deben tenerse en cuenta los efectos de la desensibilización del receptor para alcanzar el equilibrio. La constante de afinidad de los antagonistas que exhiben dos o más efectos, como en los agentes bloqueadores neuromusculares competitivos que también bloquean los canales iónicos y antagonizan la unión del agonista, no se puede analizar mediante la regresión de Schild. La regresión de Schild implica comparar el cambio en la proporción de dosis, la proporción de la CE50 de un agonista solo en comparación con la CE50 en presencia de un antagonista competitivo, como se determina en una curva dosis-respuesta. La modificación de la cantidad de antagonista utilizada en el ensayo puede alterar la proporción de dosis. En la regresión de Schild, se realiza un gráfico del log (relación de dosis-1) versus el log de concentración del antagonista para un rango de concentraciones de antagonista. La afinidad o Ki es donde la línea corta el eje x en el gráfico de regresión. Mientras que, con la regresión de Schild, la concentración de antagonista varía en los experimentos utilizados para derivar valores de Ki a partir de la ecuación de Cheng-Prusoff, las concentraciones de agonista varían. La afinidad por los agonistas y antagonistas competitivos está relacionada mediante el factor Cheng-Prusoff utilizado para calcular la Ki (constante de afinidad para un antagonista) a partir del cambio en IC50 que ocurre durante inhibición competitiva. El factor Cheng-Prusoff tiene en cuenta el efecto de alterar la concentración del agonista y la afinidad del agonista por el receptor sobre la inhibición producida por antagonistas competitivos.
Tipos
Competitivo
Los antagonistas competitivos se unen a receptores en el mismo sitio de unión (sitio activo) que el ligando o agonista endógeno, pero sin activar el receptor. Agonistas y antagonistas "compiten" para el mismo sitio de unión en el receptor. Una vez unido, un antagonista bloqueará la unión del agonista. Concentraciones suficientes de un antagonista desplazarán al agonista de los sitios de unión, lo que dará como resultado una menor frecuencia de activación del receptor. El nivel de actividad del receptor estará determinado por la afinidad relativa de cada molécula por el sitio y sus concentraciones relativas. Altas concentraciones de un agonista competitivo aumentarán la proporción de receptores que ocupa el agonista; se necesitarán concentraciones más altas del antagonista para obtener el mismo grado de ocupación del sitio de unión. En ensayos funcionales que utilizan antagonistas competitivos, se observa un desplazamiento paralelo hacia la derecha de las curvas dosis-respuesta del agonista sin alteración de la respuesta máxima.
Los antagonistas competitivos se utilizan para prevenir la actividad de las drogas y revertir los efectos de las drogas que ya se han consumido. La naloxona (también conocida como Narcan) se usa para revertir la sobredosis de opioides causada por drogas como la heroína o la morfina. Asimismo, Ro15-4513 es un antídoto contra el alcohol y flumazenil es un antídoto contra las benzodiazepinas.
Los antagonistas competitivos se subclasifican como antagonistas competitivos reversibles (superables) o irreversibles (insuperables), dependiendo de cómo interactúan con sus objetivos proteicos receptores. Los antagonistas reversibles, que se unen mediante fuerzas intermoleculares no covalentes, eventualmente se disociarán del receptor, liberando al receptor para que se una nuevamente. Los antagonistas irreversibles se unen mediante fuerzas intermoleculares covalentes. Debido a que no hay suficiente energía libre para romper los enlaces covalentes en el entorno local, el enlace es esencialmente "permanente", lo que significa que el complejo receptor-antagonista nunca se disociará. De este modo, el receptor permanecerá permanentemente antagonizado hasta que sea ubiquitinado y, por tanto, destruido.
No competitiva
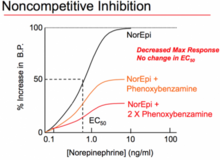
(feminine)Un antagonista no competitivo es un tipo de antagonista insuperable que puede actuar de dos maneras: uniéndose a un sitio alostérico del receptor o uniéndose irreversiblemente al sitio activo del receptor. El primer significado ha sido estandarizado por la IUPHAR y equivale a que el antagonista se denomine antagonista alostérico. Si bien el mecanismo del antagonismo es diferente en ambos fenómenos, a ambos se les denomina fenómenos "no competitivos" porque los resultados finales de cada uno son funcionalmente muy similares. A diferencia de los antagonistas competitivos, que afectan la cantidad de agonista necesaria para lograr una respuesta máxima pero no afectan la magnitud de esa respuesta máxima, los antagonistas no competitivos reducen la magnitud de la respuesta máxima que puede lograrse con cualquier cantidad de agonista. Esta propiedad les otorga el nombre de propiedad "no competitiva" porque sus efectos no se pueden negar, sin importar cuánto agonista esté presente. En ensayos funcionales de antagonistas no competitivos se produce una depresión de la respuesta máxima de las curvas dosis-respuesta del agonista y, en algunos casos, desplazamientos hacia la derecha. El desplazamiento hacia la derecha se producirá como resultado de una reserva de receptores (también conocidos como receptores de repuesto) y la inhibición de la respuesta agonista sólo se producirá cuando esta reserva se agote.
Se dice que un antagonista que se une al sitio activo de un receptor es "no competitivo"; si el enlace entre el sitio activo y el antagonista es irreversible o casi. Este uso del término "no competitivo" Sin embargo, puede que no sea ideal, ya que el término “antagonismo competitivo irreversible” se utiliza en muchos casos. también puede usarse para describir el mismo fenómeno sin posibilidad de confusión con el segundo significado de "antagonismo no competitivo" se discute más adelante.
La segunda forma de "antagonistas no competitivos" Actúa en un sitio alostérico. Estos antagonistas se unen a un sitio de unión claramente separado del agonista, ejerciendo su acción en ese receptor a través del otro sitio de unión. No compiten con los agonistas por unirse al sitio activo. Los antagonistas unidos pueden prevenir cambios conformacionales en el receptor necesarios para la activación del receptor después de que se une el agonista. Se ha demostrado que la ciclotiazida actúa como un antagonista reversible no competitivo del receptor mGluR1. Otro ejemplo de no competitivo es la fenoxibenzamina, que se une irreversiblemente (con enlaces covalentes) a los receptores alfa-adrenérgicos, lo que a su vez reduce la fracción de receptores disponibles y reduce el efecto máximo que puede producir el agonista.
No competitivo
Los antagonistas no competitivos se diferencian de los antagonistas no competitivos en que requieren la activación del receptor por parte de un agonista antes de que puedan unirse a un sitio de unión alostérico separado. Este tipo de antagonismo produce un perfil cinético en el que "la misma cantidad de antagonista bloquea mejor las concentraciones más altas de agonista que las concentraciones más bajas de agonista". La memantina, utilizada en el tratamiento de la enfermedad de Alzheimer, es un antagonista no competitivo del receptor NMDA.
Antagonistas silenciosos

Los antagonistas silenciosos son antagonistas de receptores competitivos que no tienen actividad intrínseca para activar un receptor. Son verdaderos antagonistas, por así decirlo. El término fue creado para distinguir a los antagonistas completamente inactivos de los agonistas parciales débiles o agonistas inversos.
Agonistas parciales
Los agonistas parciales se definen como fármacos que, en un receptor determinado, pueden diferir en la amplitud de la respuesta funcional que provocan después de la ocupación máxima del receptor. Aunque son agonistas, los agonistas parciales pueden actuar como antagonistas competitivos en presencia de un agonista completo, ya que compite con el agonista completo por la ocupación del receptor, produciendo así una disminución neta en la activación del receptor en comparación con la observada con el agonista completo. solo. Clínicamente, su utilidad se deriva de su capacidad para mejorar los sistemas deficientes y al mismo tiempo bloquear la actividad excesiva. Exponer un receptor a un nivel alto de un agonista parcial asegurará que tenga un nivel de actividad débil y constante, ya sea que su agonista normal esté presente en niveles altos o bajos. Además, se ha sugerido que el agonismo parcial previene los mecanismos reguladores adaptativos que frecuentemente se desarrollan después de la exposición repetida a agonistas o antagonistas completos potentes. P.ej. La buprenorfina, un agonista parcial del receptor opioide μ, se une con una actividad débil similar a la de la morfina y se utiliza clínicamente como analgésico en el tratamiento del dolor y como alternativa a la metadona en el tratamiento de la dependencia de opioides.
Agonistas inversos
Un agonista inverso puede tener efectos similares a los de un antagonista, pero provoca un conjunto distinto de respuestas biológicas posteriores. Los receptores constitutivamente activos que exhiben actividad intrínseca o basal pueden tener agonistas inversos, que no solo bloquean los efectos de los agonistas de unión como un antagonista clásico sino que también inhiben la actividad basal del receptor. Muchos fármacos anteriormente clasificados como antagonistas están empezando a reclasificarse como agonistas inversos debido al descubrimiento de receptores activos constitutivos. Los antihistamínicos, originalmente clasificados como antagonistas de los receptores H1 de histamina, han sido reclasificados como agonistas inversos.
Reversibilidad
Muchos antagonistas son antagonistas reversibles que, como la mayoría de los agonistas, se unirán y desvincularán de un receptor a velocidades determinadas por la cinética receptor-ligando.
Los antagonistas irreversibles se unen covalentemente al receptor objetivo y, en general, no pueden eliminarse; La inactivación del receptor mientras duran los efectos antagonistas está determinada por la tasa de recambio del receptor, la tasa de síntesis de nuevos receptores. La fenoxibenzamina es un ejemplo de un bloqueador alfa irreversible: se une permanentemente a los receptores adrenérgicos α, impidiendo que la adrenalina y la noradrenalina se unan. La inactivación de los receptores normalmente da como resultado una depresión de la respuesta máxima de las curvas dosis-respuesta del agonista y se produce un desplazamiento hacia la derecha en la curva cuando hay una reserva de receptor similar a la de los antagonistas no competitivos. Un paso de lavado en el ensayo normalmente distinguirá entre fármacos antagonistas no competitivos e irreversibles, ya que los efectos de los antagonistas no competitivos son reversibles y se restaurará la actividad del agonista.
Los antagonistas competitivos irreversibles también implican competencia entre el agonista y el antagonista del receptor, pero la tasa de enlace covalente difiere y depende de la afinidad y reactividad del antagonista. Para algunos antagonistas, puede haber un período distinto durante el cual se comportan de manera competitiva (independientemente de la eficacia basal) y se asocian y disocian libremente con el receptor, determinado por la cinética receptor-ligando. Pero, una vez que se ha producido un enlace irreversible, el receptor se desactiva y se degrada. En cuanto a los antagonistas no competitivos y los antagonistas irreversibles en ensayos funcionales con fármacos antagonistas competitivos irreversibles, puede haber un desplazamiento en la curva logarítmica concentración-efecto hacia la derecha, pero, en general, se obtiene tanto una disminución de la pendiente como un máximo reducido..
Contenido relacionado
Ley de Fick
Presión oncótica
Memoria explícita