Ánodo
Un ánodo es un electrodo a través del cual la corriente convencional ingresa a un dispositivo eléctrico polarizado. Esto contrasta con un cátodo, un electrodo a través del cual la corriente convencional sale de un dispositivo eléctrico. Un mnemotécnico común es ACID, para "corriente de ánodo en el dispositivo". La dirección de la corriente convencional (el flujo de cargas positivas) en un circuito es opuesta a la dirección del flujo de electrones, por lo que los electrones (cargados negativamente) salen del ánodo de una celda galvánica hacia un circuito externo conectado a la celda. Tanto en una celda galvánica como en una celda electrolítica, el ánodo es el electrodo en el que se produce la reacción de oxidación.
En una celda electrolítica, el ánodo es el alambre o la placa que tiene un exceso de carga positiva. En consecuencia, los aniones tenderán a moverse hacia el ánodo donde pueden oxidarse.
Históricamente, el ánodo también ha sido conocido como zincode.
Flujo de carga
Los términos ánodo y cátodo no están definidos por la polaridad del voltaje de los electrodos sino por la dirección de la corriente a través del electrodo. Un ánodo es un electrodo a través del cual fluye corriente convencional (carga positiva) hacia el dispositivo desde un circuito externo, mientras que un cátodo es un electrodo a través del cual fluye corriente convencional fuera del dispositivo. Si la corriente a través de los electrodos cambia de dirección, como ocurre por ejemplo en una batería recargable cuando se está cargando, se invierte la denominación de los electrodos como ánodo y cátodo.
La corriente convencional depende no solo de la dirección en que se mueven los portadores de carga, sino también de la carga eléctrica de los portadores. Las corrientes fuera del dispositivo generalmente son transportadas por electrones en un conductor de metal. Dado que los electrones tienen carga negativa, la dirección del flujo de electrones es opuesta a la dirección de la corriente convencional. En consecuencia, los electrones salen del dispositivo a través del ánodo y entran al dispositivo a través del cátodo.
La definición de ánodo y cátodo es diferente para dispositivos eléctricos como diodos y tubos de vacío donde la denominación del electrodo es fija y no depende del flujo de carga real (corriente). Estos dispositivos generalmente permiten un flujo de corriente sustancial en una dirección pero una corriente insignificante en la otra dirección. Por lo tanto, los electrodos se nombran según la dirección de esta corriente "directa". En un diodo, el ánodo es el terminal por el que entra la corriente y el cátodo es el terminal por el que sale la corriente, cuando el diodo está polarizado directamente. Los nombres de los electrodos no cambian en los casos en que la corriente inversa fluye a través del dispositivo. De manera similar, en un tubo de vacío, solo un electrodo puede emitir electrones en el tubo de vacío debido a que se calienta con un filamento, por lo tanto, los electrones solo pueden ingresar al dispositivo desde el circuito externo a través del electrodo calentado. Por lo tanto, este electrodo se denomina permanentemente cátodo, y el electrodo a través del cual salen los electrones del tubo se denomina ánodo.
Ejemplos
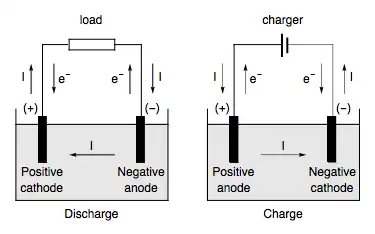
La polaridad del voltaje en un ánodo con respecto a un cátodo asociado varía según el tipo de dispositivo y su modo de funcionamiento. En los siguientes ejemplos, el ánodo es negativo en un dispositivo que proporciona energía y positivo en un dispositivo que consume energía:
En una batería en descarga o celda galvánica (diagrama a la izquierda), el ánodo es el terminal negativo porque es donde la corriente convencional fluye hacia la celda. Esta corriente interna es transportada externamente por electrones que se mueven hacia afuera, la carga negativa que fluye en una dirección es eléctricamente equivalente a la carga positiva que fluye en la dirección opuesta.
En una batería de recarga, o una celda electrolítica, el ánodo es el terminal positivo, que recibe corriente de un generador externo. La corriente a través de una batería que se recarga es opuesta a la dirección de la corriente durante la descarga; en otras palabras, el electrodo que era el cátodo durante la descarga de la batería se convierte en el ánodo mientras la batería se recarga.
Esta ambigüedad en la designación del ánodo y el cátodo provoca confusión en la ingeniería de baterías, ya que es necesario tener el ánodo y el cátodo asociados con componentes físicos únicos. La convención común es nombrar el electrodo de una batería que libera electrones durante la descarga como ánodo o electrodo negativo (-) y el electrodo que absorbe los electrones como cátodo o positivo (+). electrodo.
Nombrar los electrodos físicos como positivo (+) o negativo (-) tiene la ventaja adicional de que esta terminología se aplica igualmente bien tanto a las condiciones de carga/descarga de las baterías recargables como a la electroquímica y los dispositivos electrónicos.
En un diodo, el ánodo es el terminal positivo en la cola del símbolo de la flecha (lado plano del triángulo), donde la corriente fluye hacia el dispositivo. Tenga en cuenta que la denominación de electrodos para diodos siempre se basa en la dirección de la corriente directa (la de la flecha, en la que la corriente fluye "más fácilmente"), incluso para tipos como diodos Zener o celdas solares donde la corriente de interés es la corriente inversa.
En los tubos de vacío o tubos llenos de gas, el ánodo es el terminal por donde entra la corriente al tubo.
Etimología
La palabra fue acuñada en 1834 del griego ἄνοδος (anodos), 'ascenso', por William Whewell, quien había sido consultado por Michael Faraday sobre algunos nombres nuevos necesarios para completar un artículo sobre el proceso de electrólisis recientemente descubierto. En ese artículo, Faraday explicó que cuando se orienta una celda electrolítica de modo que la corriente eléctrica atraviese el "cuerpo en descomposición" (electrolito) en una dirección "de este a oeste, o, lo que fortalecerá esta ayuda a la memoria, aquella en la que el sol parece moverse", el ánodo es por donde entra la corriente al electrolito, por el lado Este: " ano hacia arriba, odos un camino; el camino por donde sale el sol".
El uso de 'Este' para referirse a la dirección 'adentro' (en realidad 'adentro' → 'Este' → 'amanecer' → 'arriba') puede parecer artificial. Anteriormente, como se relata en la primera referencia citada anteriormente, Faraday había usado el término más sencillo "eisodio" (la puerta por donde entra la corriente). Su motivación para cambiarlo por algo que significara 'el electrodo Este' (otros candidatos habían sido "eastode", "oriode" y "anatolode") fue hacerlo inmune a un posible cambio posterior en la convención de dirección de la corriente, cuya naturaleza exacta no se sabía en ese momento. La referencia que usó para este efecto fue la dirección del campo magnético de la Tierra, que en ese momento se creía que era invariable. Básicamente, definió su orientación arbitraria para la celda como aquella en la que la corriente interna correría paralela y en la misma dirección que un bucle de corriente magnetizante hipotético alrededor de la línea local de latitud que induciría un campo de dipolo magnético orientado como el de la Tierra. Esto hizo que la corriente interna este a oeste como se mencionó anteriormente, pero en el caso de un cambio de convención posterior, se habría convertido de oeste a este, por lo que el electrodo este ya no habría sido la 'entrada'. Por lo tanto, "eisodo" se habría vuelto inapropiado, mientras que "ánodo", que significa "electrodo este", habría permanecido correcto con respecto a la dirección sin cambios del fenómeno real que subyace a la corriente, entonces desconocido pero, pensó, definido sin ambigüedades por la referencia magnética..
Desde el descubrimiento posterior del electrón, se ha sugerido una etimología más fácil de recordar y más duradera técnicamente aunque históricamente falsa: ánodo, del griego anodos, 'camino hacia arriba', 'el camino (hacia arriba) fuera de la celda (o otro dispositivo) para electrones'.
Ánodo electrolítico
En electroquímica, el ánodo es donde ocurre la oxidación y es el contacto de polaridad positiva en una celda electrolítica. En el ánodo, los aniones (iones negativos) son forzados por el potencial eléctrico a reaccionar químicamente y emitir electrones (oxidación) que luego fluyen hacia arriba y hacia el circuito impulsor. Mnemotécnicos: LEO Red Cat (pérdida de electrones es oxidación, la reducción ocurre en el cátodo), o AnOx Red Cat (oxidación del ánodo, reducción del cátodo), o OIL RIG (la oxidación es pérdida, la reducción es ganancia de electrones), o católica romana y Ortodoxo (Reducción - Cátodo, ánodo - Oxidación), o LEO el león dice GER (Perder electrones es Oxidación, Ganar electrones es Reducción).
Este proceso es ampliamente utilizado en la refinación de metales. Por ejemplo, en el refinado de cobre, los ánodos de cobre, un producto intermedio de los hornos, se electrolizan en una solución adecuada (como el ácido sulfúrico) para producir cátodos de alta pureza (99,99 %). Los cátodos de cobre producidos con este método también se describen como cobre electrolítico.
Históricamente, cuando se deseaban ánodos no reactivos para la electrólisis, se elegían el grafito (llamado plumbago en la época de Faraday) o el platino. Se descubrió que eran algunos de los materiales menos reactivos para los ánodos. El platino se erosiona muy lentamente en comparación con otros materiales, y el grafito se desmorona y puede producir dióxido de carbono en soluciones acuosas, pero por lo demás no participa en la reacción.
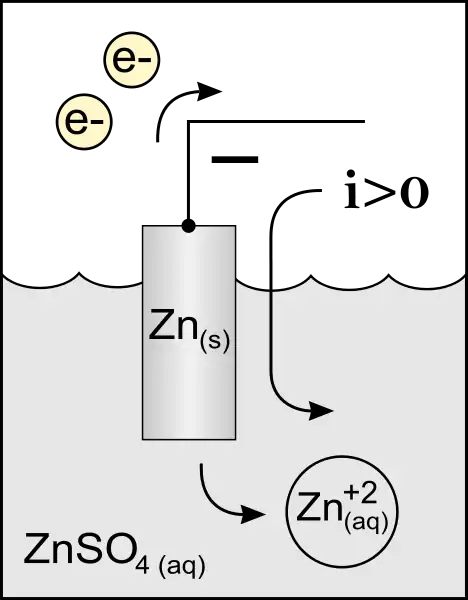
Ánodo de batería o celda galvánica
En una batería o celda galvánica, el ánodo es el electrodo negativo del que salen los electrones hacia la parte exterior del circuito. Internamente, los cationes cargados positivamente se alejan del ánodo (aunque es negativo y, por lo tanto, se espera que los atraiga, esto se debe a que el potencial del electrodo en relación con la solución de electrolito es diferente para los sistemas de metal/electrolito del ánodo y el cátodo); pero, fuera de la celda en el circuito, los electrones están siendo expulsados a través del contacto negativo y, por lo tanto, a través del circuito por el potencial de voltaje, como era de esperar. Nota: en una celda galvánica, al contrario de lo que ocurre en una celda electrolítica, no fluyen aniones hacia el ánodo, siendo la corriente interna totalmente explicada por los cationes que fluyen desde él (ver dibujo).
Los fabricantes de baterías pueden considerar el electrodo negativo como el ánodo, particularmente en su literatura técnica. Aunque técnicamente incorrecto, resuelve el problema de qué electrodo es el ánodo en una celda secundaria (o recargable). Usando la definición tradicional, el ánodo cambia entre ciclos de carga y descarga.
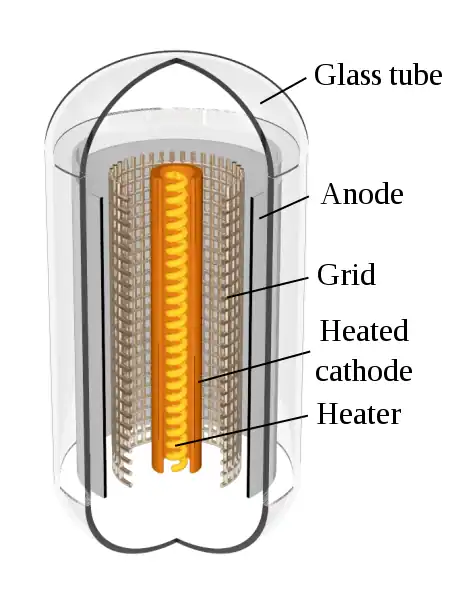
Ánodo de tubo de vacío
En los dispositivos electrónicos de vacío, como un tubo de rayos catódicos, el ánodo es el colector de electrones con carga positiva. En un tubo, el ánodo es una placa cargada positivamente que recoge los electrones emitidos por el cátodo a través de la atracción eléctrica. También acelera el flujo de estos electrones.
Ánodo de diodo
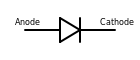
En un diodo semiconductor, el ánodo es la capa dopada con P que inicialmente suministra agujeros a la unión. En la región de unión, los huecos suministrados por el ánodo se combinan con los electrones suministrados por la región dopada con N, creando una zona empobrecida. A medida que la capa dopada con P proporciona agujeros a la región empobrecida, los iones dopantes negativos quedan en la capa dopada con P ('P' para iones portadores de carga positivos). Esto crea una carga negativa de base en el ánodo. Cuando se aplica un voltaje positivo al ánodo del diodo del circuito, se pueden transferir más agujeros a la región agotada, y esto hace que el diodo se vuelva conductor, permitiendo que la corriente fluya a través del circuito. Los términos ánodo y cátodo no deben aplicarse a un diodo Zener, ya que permite el flujo en cualquier dirección, dependiendo de la polaridad del potencial aplicado (p. mi. Voltaje).
ánodo de sacrificio
En la protección catódica, un ánodo de metal que es más reactivo al ambiente corrosivo que el sistema de metal a proteger está conectado eléctricamente al sistema protegido. Como resultado, el ánodo metálico se corroe o disuelve parcialmente en lugar del sistema metálico. Por ejemplo, el casco de un barco de hierro o acero puede protegerse con un ánodo de sacrificio de zinc, que se disolverá en el agua de mar y evitará que el casco se corroa. Los ánodos de sacrificio son especialmente necesarios para los sistemas en los que se genera una carga estática por la acción de los líquidos que fluyen, como tuberías y embarcaciones. Los ánodos de sacrificio también se usan generalmente en calentadores de agua tipo tanque.
En 1824, para reducir el impacto de esta acción electrolítica destructiva en los cascos de los barcos, sus fijaciones y equipos submarinos, el científico e ingeniero Humphry Davy desarrolló el primer y más utilizado sistema de protección contra la electrólisis marina. Davy instaló ánodos de sacrificio hechos de un metal más reactivo eléctricamente (menos noble) unidos al casco de la embarcación y conectados eléctricamente para formar un circuito de protección catódica.
Un ejemplo menos obvio de este tipo de protección es el proceso de galvanizado del hierro. Este proceso recubre las estructuras de hierro (como las cercas) con una capa de zinc metálico. Mientras el zinc permanezca intacto, el hierro está protegido de los efectos de la corrosión. Inevitablemente, el revestimiento de zinc se rompe, ya sea por agrietamiento o daño físico. Una vez que esto ocurre, los elementos corrosivos actúan como electrolito y la combinación de zinc/hierro como electrodos. La corriente resultante asegura que se sacrifique el recubrimiento de zinc pero que el hierro base no se corroa. Dicho revestimiento puede proteger una estructura de hierro durante algunas décadas, pero una vez que se consume el revestimiento protector, el hierro se corroe rápidamente.
Si, por el contrario, se usa estaño para recubrir el acero, cuando se produce una ruptura del recubrimiento, en realidad se acelera la oxidación del hierro.
Ánodo de corriente impresa
Se utiliza otra protección catódica en el ánodo de corriente impresa. Está hecho de titanio y cubierto con óxido de metal mixto. A diferencia de la varilla del ánodo de sacrificio, el ánodo de corriente impresa no sacrifica su estructura. Esta tecnología utiliza una corriente externa proporcionada por una fuente de CC para crear la protección catódica. Los ánodos de corriente impresa se utilizan en estructuras más grandes como tuberías, barcos y calentadores de agua.
Antónimo relacionado
Lo contrario de un ánodo es un cátodo. Cuando se invierte la corriente a través del dispositivo, los electrodos cambian de función, por lo que el ánodo se convierte en cátodo y el cátodo se convierte en ánodo, siempre que se aplique la corriente inversa. La excepción son los diodos en los que la denominación de los electrodos siempre se basa en la dirección de la corriente directa.
Contenido relacionado
Ley de las proporciones múltiples
Peso atómico
Anilina