Alfredo Werner
Alfred Werner (12 de diciembre de 1866 – 15 de noviembre de 1919) fue un químico suizo, estudiante en la ETH Zurich y profesor en la Universidad de Zurich. Ganó el Premio Nobel de Química en 1913 por proponer la configuración octaédrica de complejos de metales de transición. Werner desarrolló las bases de la química de coordinación moderna. Fue el primer químico inorgánico en ganar el Premio Nobel, y el único antes de 1973.
Biografía
Werner nació en 1866 en Mulhouse, Alsacia (que entonces formaba parte de Francia, pero que fue anexada por Alemania en 1871). Fue criado como católico romano. Fue el cuarto y último hijo de Jean-Adam Werner, un fundidor, y su segunda esposa, Salomé Jeanette Werner, que provenía de una familia adinerada. Fue a Suiza para estudiar química en el Instituto Federal Suizo (polytechnikum) en Zurich. Aún así, dado que este instituto no estuvo autorizado a otorgar doctorados hasta 1909, Werner recibió un doctorado formal de la Universidad de Zúrich en 1890. Después de estudios postdoctorales en París, regresó al Instituto Federal Suizo para enseñar (1892). En 1893 se trasladó a la Universidad de Zurich, donde se convirtió en profesor en 1895. En 1894 se convirtió en ciudadano suizo.
En su último año, sufrió una arteriosclerosis general, progresiva y degenerativa, especialmente del cerebro, agravada por años de consumo excesivo de alcohol y exceso de trabajo. Murió en un hospital psiquiátrico de Zurich.
Werner murió el 15 de noviembre de 1919 de arteriosclerosis en Zurich a la edad de 52 años.
Investigación
Química de coordinación
En 1893, Werner fue el primero en proponer estructuras correctas para compuestos de coordinación que contienen iones complejos, en las que un átomo central de un metal de transición está rodeado por ligandos neutros o aniónicos.
Por ejemplo, se sabía que el cobalto forma un "complejo" cloruro de hexamina cobalto (III), con fórmula CoCl3•6NH3, pero la naturaleza de la asociación indicada por el punto era misteriosa. Werner propuso la estructura [Co(NH3)6]Cl3, con el ion Co3+ rodeado por seis NH3 en los vértices de un octaedro. Los tres Cl− están disociados como iones libres, lo que Werner confirmó midiendo la conductividad del compuesto en una solución acuosa, así como mediante el análisis del anión cloruro mediante precipitación con nitrato de plata. Posteriormente, el análisis de susceptibilidad magnética también se utilizó para confirmar la propuesta de Werner sobre la naturaleza química del CoCl3•6NH3.
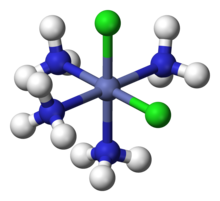

Para los complejos con más de un tipo de ligando, Werner logró explicar el número de isómeros observados. Por ejemplo, explicó la existencia de dos isómeros de tetramina, "Co(NH3)4Cl3", uno verde y otro morado. Werner propuso que se trata de dos isómeros geométricos de fórmula [Co(NH3)4Cl2]Cl, con un Cl− ion disociado según lo confirmado por mediciones de conductividad. El átomo de Co está rodeado por cuatro ligandos NH3 y dos Cl en los vértices de un octaedro. El isómero verde es "trans" con los dos ligandos de Cl en vértices opuestos, y el morado es "cis" con los dos Cl en vértices adyacentes.
Werner también preparó complejos con isómeros ópticos, y en 1914 informó del primer compuesto quiral sintético que carecía de carbono, conocido como hexol con fórmula [Co(Co(NH3)4(OH)2)3]Br6.
Naturaleza de la valencia
Antes de Werner, los químicos definían la valencia de un elemento como el número de sus enlaces sin distinguir diferentes tipos de enlaces. Sin embargo, en complejos como [Co(NH3)6]Cl3 por ejemplo, Werner consideró que los enlaces Co-Cl corresponden a un "primario" valencia de 3 a larga distancia, mientras que los enlaces Co-NH3 que corresponden a un enlace "secundario" o valencia más débil de 6 en longitud más corta. A esta valencia secundaria de 6 la denominó número de coordinación, que definió como el número de moléculas (aquí de NH3) directamente unidas al átomo metálico central. En otros complejos encontró números de coordinación de 4 u 8.
Sobre estos puntos de vista, y otros similares, en 1904 Richard Abegg formuló lo que ahora se conoce como la regla de Abegg, que establece que la diferencia entre la valencia máxima positiva y negativa de un elemento es frecuentemente ocho. Esta regla se utilizó más tarde, en 1916, cuando Gilbert N. Lewis formuló la "regla del octeto"; en su teoría del átomo cúbico.
En la terminología moderna, la valencia primaria de Werner corresponde al estado de oxidación, y su valencia secundaria se llama número de coordinación. Los enlaces Co-Cl (en el ejemplo anterior) ahora se clasifican como iónicos, y cada enlace Co-N es un enlace covalente coordinado entre el ácido de Lewis Co3+ y la base de Lewis NH. 3.
Obras
- Lehrbuch der Stereochemie . Fischer, Jena 1904 Edición digital de la Biblioteca Universitaria y Estatal de Düsseldorf
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar