Alcano
En química orgánica, un alcano, hidrocarburos saturados o parafina (un nombre histórico trivial que también tiene otros significados), es un hidrocarburo saturado acíclico. En otras palabras, un alcano consta de átomos de hidrógeno y carbono dispuestos en una estructura de árbol en la que todos los enlaces carbono-carbono son sencillos. Los alcanos tienen la fórmula química general C n H 2 n +2. Los alcanos varían en complejidad desde el caso más simple del metano (CH 4), donde n = 1 (a veces llamado la molécula original), hasta moléculas arbitrariamente grandes y complejas, como el pentacontano (C 50 H 102) o 6-etil-2-metil-5-(1-metiletil) octano, un isómero de tetradecano (C 14 H 30).
La Unión Internacional de Química Pura y Aplicada (IUPAC) define los alcanos como "hidrocarburos acíclicos ramificados o no ramificados que tienen la fórmula general C n H 2 n +2 y, por lo tanto, consisten completamente en átomos de hidrógeno y átomos de carbono saturados". Sin embargo, algunas fuentes utilizan el término para indicar cualquier hidrocarburo saturado, incluidos los que son monocíclicos (es decir, los cicloalcanos) o policíclicos, a pesar de tener una fórmula general distinta (es decir, los cicloalcanos son C n H 2 n).
En un alcano, cada átomo de carbono tiene hibridación sp con enlaces sigma 4 (ya sea C-C o C-H), y cada átomo de hidrógeno se une a uno de los átomos de carbono (en un enlace C-H). La serie más larga de átomos de carbono enlazados en una molécula se conoce como esqueleto de carbono o columna vertebral de carbono. El número de átomos de carbono puede considerarse como el tamaño del alcano.
Un grupo de alcanos superiores son las ceras, sólidos a temperatura y presión ambiente estándar (SATP), para los cuales el número de átomos de carbono en el esqueleto de carbono es superior a aproximadamente 17. Con sus unidades CH 2 repetidas, los alcanos constituyen un homólogo serie de compuestos orgánicos en los que los miembros difieren en masa molecular por múltiplos de 14,03 u (la masa total de cada unidad de puente de metileno, que comprende un solo átomo de carbono de masa 12,01 u y dos átomos de hidrógeno de masa ~1,01 u cada uno).
El metano es producido por bacterias metanogénicas y algunos alcanos de cadena larga funcionan como feromonas en ciertas especies animales o como ceras protectoras en plantas y hongos. Sin embargo, la mayoría de los alcanos no tienen mucha actividad biológica. Pueden verse como árboles moleculares sobre los que se pueden colgar los grupos funcionales más activos/reactivos de las moléculas biológicas.
Los alcanos tienen dos fuentes comerciales principales: el petróleo (petróleo crudo) y el gas natural.
Un grupo alquilo es un fragmento molecular basado en alcano que tiene una valencia abierta para la unión. Por lo general, se abrevian con el símbolo de cualquier grupo organilo, R, aunque a veces se usa Alk para simbolizar específicamente un grupo alquilo (a diferencia de un grupo alquenilo o un grupo arilo).
Estructura y clasificación
Normalmente, la distancia del enlace simple CC es de 1,53 ångströms (1,53 × 10 m). Los hidrocarburos saturados pueden ser lineales, ramificados o cíclicos. El tercer grupo a veces se denomina cicloalcanos. Son posibles estructuras muy complicadas combinando alcanos lineales, ramificados y cíclicos.
Isomería
Los alcanos con más de tres átomos de carbono se pueden organizar de varias formas, formando isómeros estructurales. El isómero más simple de un alcano es aquel en el que los átomos de carbono están dispuestos en una sola cadena sin ramificaciones. Este isómero a veces se denomina isómero n (n para "normal", aunque no es necesariamente el más común). Sin embargo, la cadena de átomos de carbono también puede estar ramificada en uno o más puntos. El número de posibles isómeros aumenta rápidamente con el número de átomos de carbono. Por ejemplo, para alcanos acíclicos:
- C 1: solo metano
- C 2: solo etano
- C 3: solo propano
- C 4: 2 isómeros: butano e isobutano
- C 5: 3 isómeros: pentano, isopentano y neopentano
- Isómeros C 6: 5: hexano, 2-metilpentano, 3-metilpentano, 2,2-dimetilbutano y 2,3-dimetilbutano
- C 7: 9 isómeros: heptano, metilhexano (2 isómeros), dimetilpentano (4 isómeros), 3-etilpentano, 2,2,3-trimetilbutano
- C 8: 18 isómeros: octano, 2-metilheptano, 3-metilheptano, 2,3-dimetilhexano, 3,4-dimetilhexano, 2,3,4-trimetilpentano, 3,3-dimetilhexano, 2,2-trimetilpentano, 2, 4-dimetilhexano, 2,2,4-trimetilpentano, 2,3,3-trimetilpentano, 3,3,4-trimetilpentano, 3,4,4-trimetilpentano, 2,4,4-trimetilpentano, (5 isómeros)
- C 9: 35 isómeros
- C 10: 75 isómeros
- C 12: 355 isómeros
- C 32: 27 711 253 769 isómeros
- C60: 22.158.734.535.770.411.074.184 isómeros, muchos de los cuales no son estables.
Los alcanos ramificados pueden ser quirales. Por ejemplo, el 3-metilhexano y sus homólogos superiores son quirales debido a su centro estereogénico en el átomo de carbono número 3. La lista anterior solo incluye diferencias de conectividad, no de estereoquímica. Además de los isómeros de alcano, la cadena de átomos de carbono puede formar uno o más anillos. Dichos compuestos se denominan cicloalcanos y también están excluidos de la lista anterior porque al cambiar el número de anillos cambia la fórmula molecular. Por ejemplo, el ciclobutano y el metilciclopropano son isómeros entre sí (C 4 H 8), pero no son isómeros del butano (C 4 H 10).
Nomenclatura
La nomenclatura IUPAC (manera sistemática de nombrar compuestos) para alcanos se basa en la identificación de cadenas de hidrocarburos. Las cadenas de hidrocarburos saturados no ramificados se nombran sistemáticamente con un prefijo numérico griego que indica el número de carbonos y el sufijo "-ano".
En 1866, August Wilhelm von Hofmann sugirió sistematizar la nomenclatura utilizando la secuencia completa de vocales a, e, i, o y u para crear los sufijos -ane, -ene, -ine (o -yne), -one, -une, para los hidrocarburos C norte H 2 norte +2, C norte H 2 norte, C norte H 2 norte -2, C norte H 2 norte -4, C norte H 2 norte -6. En la nomenclatura moderna, los tres primeros nombran específicamente hidrocarburos con enlaces simples, dobles y triples; mientras que "-uno" ahora representa una cetona.
Alcanos lineales
Los alcanos de cadena lineal a veces se indican con el prefijo "n-" o " n- " (para "normal") donde existe un isómero no lineal. Aunque esto no es estrictamente necesario y no es parte del sistema de nombres de la IUPAC, el uso sigue siendo común en los casos en los que se desea enfatizar o distinguir entre los isómeros de cadena lineal y de cadena ramificada, por ejemplo, " n -butano" en lugar de simplemente "butano" para diferenciarlo del isobutano. Los nombres alternativos para este grupo que se utilizan en la industria del petróleo son parafinas lineales o n -parafinas.
Los primeros seis miembros de la serie (en términos de número de átomos de carbono) se nombran de la siguiente manera:metanoCH 4 – uno de carbono y 4 de hidrógenoetanoC 2 H 6 – dos de carbono y 6 de hidrógenopropanoC 3 H 8 – tres de carbono y 8 de hidrógenobutanoC 4 H 10 – cuatro de carbono y 10 de hidrógenopentanoC 5 H 12 – cinco de carbono y 12 de hidrógenohexanoC 6 H 14 – seis de carbono y 14 de hidrógeno
Los primeros cuatro nombres se derivaron de metanol, éter, ácido propiónico y ácido butírico. Los alcanos con cinco o más átomos de carbono se nombran agregando el sufijo -ano al prefijo multiplicador numérico apropiado con la elisión de cualquier vocal terminal (-a o -o) del término numérico básico. Por lo tanto, pentano, C 5 H 12; hexano, C6H14 ; _ heptano, C7H16 ; _ octano, C8H18 ; _ etc. El prefijo numérico es generalmente griego, sin embargo, los alcanos con un número de átomos de carbono que termina en nueve, por ejemplo, nonano, usan el prefijo latino non-. Para obtener una lista más completa, consulte la lista de alcanos de cadena lineal.
Alcanos ramificados
Los alcanos ramificados simples a menudo tienen un nombre común que usa un prefijo para distinguirlos de los alcanos lineales, por ejemplo, n -pentano, isopentano y neopentano.
Las convenciones de nomenclatura de la IUPAC se pueden utilizar para producir un nombre sistemático.
Los pasos clave en la denominación de alcanos ramificados más complicados son los siguientes:
- Identificar la cadena continua más larga de átomos de carbono.
- Asigne un nombre a esta cadena raíz más larga usando reglas de nomenclatura estándar
- Nombre cada cadena lateral cambiando el sufijo del nombre del alcano de "-ane" a "-yl"
- Numere la cadena continua más larga para dar los números más bajos posibles para las cadenas laterales
- Numere y nombre las cadenas laterales antes del nombre de la cadena raíz
- Si hay varias cadenas laterales del mismo tipo, use prefijos como "di-" y "tri-" para indicarlo como tal y numere cada una.
- Agregue los nombres de las cadenas laterales en orden alfabético (sin tener en cuenta los prefijos "di-", etc.) delante del nombre de la cadena raíz
| Nombre común | n -pentano | isopentano | neopentano |
|---|---|---|---|
| nombre de la IUPAC | pentano | 2-metilbutano | 2,2-dimetilpropano |
| Estructura |  | 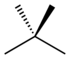 |
Hidrocarburos cíclicos saturados
Aunque técnicamente distintos de los alcanos, algunos se refieren a esta clase de hidrocarburos como "alcanos cíclicos". Como su descripción implica, contienen uno o más anillos.
Los cicloalcanos simples tienen el prefijo "ciclo-" para distinguirlos de los alcanos. Los cicloalcanos se nombran según sus contrapartes acíclicas con respecto al número de átomos de carbono en sus cadenas principales, por ejemplo, el ciclopentano (C 5 H 10) es un cicloalcano con 5 átomos de carbono como el pentano (C 5 H 12), pero están unidos arriba en un anillo de cinco miembros. De manera similar, propano y ciclopropano, butano y ciclobutano, etc.
Los cicloalcanos sustituidos se nombran de manera similar a los alcanos sustituidos: se indica el anillo de cicloalcano y los sustituyentes están de acuerdo con su posición en el anillo, con la numeración decidida por las reglas de prioridad de Cahn-Ingold-Prelog.
Nombres triviales/comunes
El nombre trivial (no sistemático) de los alcanos es 'parafinas'. Juntos, los alcanos se conocen como la 'serie de parafina'. Los nombres triviales de los compuestos suelen ser artefactos históricos. Fueron acuñados antes del desarrollo de nombres sistemáticos y se han conservado debido al uso familiar en la industria. Los cicloalcanos también se llaman naftenos.
Los alcanos de cadena ramificada se denominan isoparafinas. Parafina es un término general ya menudo no distingue entre compuestos puros y mezclas de isómeros, es decir, compuestos de la misma fórmula química, por ejemplo, pentano e isopentano.En la IUPAC
Los siguientes nombres triviales se conservan en el sistema IUPAC:
- isobutano para 2-metilpropano
- isopentano para 2-metilbutano
- neopentano para 2,2-dimetilpropano.
No IUPAC
Ocasionalmente se usan algunos nombres triviales que no pertenecen a la IUPAC:
- cetano, para hexadecano
- cerano, para hexacosano
Propiedades físicas
Todos los alcanos son incoloros. Los alcanos con los pesos moleculares más bajos son gases, los de peso molecular intermedio son líquidos y los más pesados son sólidos cerosos.
Tabla de alcanos
| alcano | Fórmula | Punto de ebullición [°C] | Punto de fusión [°C] | Densidad [kg/m ] (a 20 °C) | isómeros |
| Metano | Canal 4 | −162 | −182 | 0,656 (gas) | 1 |
| etano | C 2 H 6 | −89 | −183 | 1,26 (gasolina) | 1 |
| Propano | C 3 H 8 | −42 | −188 | 2.01 (gasolina) | 1 |
| Butano | C 4 H 10 | 0 | −138 | 2,48 (gasolina) | 2 |
| pentano | C 5 H 12 | 36 | −130 | 626 (líquido) | 3 |
| Hexano | C 6 H 14 | 69 | −95 | 659 (líquido) | 5 |
| heptano | C 7 H 16 | 98 | −91 | 684 (líquido) | 9 |
| Octano | C 8 H 18 | 126 | −57 | 703 (líquido) | 18 |
| nonano | C 9 H 20 | 151 | −54 | 718 (líquido) | 35 |
| decano | C 10 H 22 | 174 | −30 | 730 (líquido) | 75 |
| undecano | C 11 H 24 | 196 | −26 | 740 (líquido) | 159 |
| dodecano | C 12 H 26 | 216 | −10 | 749 (líquido) | 355 |
| tridecano | C 13 H 28 | 235 | −5,4 | 756 (líquido) | 802 |
| tetradecano | C 14 H 30 | 253 | 5.9 | 763 (líquido) | 1858 |
| pentadecano | C 15 H 32 | 270 | 10 | 769 (líquido) | 4347 |
| hexadecano | C 16 H 34 | 287 | 18 | 773 (líquido) | 10,359 |
| heptadecano | C 17 H 36 | 303 | 22 | 777 (sólido) | 24,894 |
| Octadecano | C 18 H 38 | 317 | 28 | 781 (sólido) | 60,523 |
| nonadecano | C 19 H 40 | 330 | 32 | 785 (sólido) | 148,284 |
| icosano | C 20 H 42 | 343 | 37 | 789 (sólido) | 366,319 |
| triacontano | C 30 H 62 | 450 | 66 | 810 (sólido) | 4,111,846,763 |
| tetracontano | C 40 H 82 | 525 | 82 | 817 (sólido) | |
| pentacontano | C 50 H 102 | 575 | 91 | 824 (sólido) | |
| hexacontano | C 60 H 122 | 625 | 100 | 829 (sólido) | |
| heptacontano | C 70 H 142 | 653 | 109 | 869 (sólido) |
Punto de ebullición
Los alcanos experimentan fuerzas de van der Waals intermoleculares. Las fuerzas de van der Waals intermoleculares más fuertes dan lugar a puntos de ebullición más altos de los alcanos.
Hay dos determinantes para la fuerza de las fuerzas de van der Waals:
- el número de electrones que rodean la molécula, que aumenta con el peso molecular del alcano
- el área superficial de la molécula
En condiciones estándar, los alcanos de CH 4 a C 4 H 10 son gaseosos; de C 5 H 12 a C 17 H 36 son líquidos; y después de C 18 H 38 son sólidos. Como el punto de ebullición de los alcanos se determina principalmente por el peso, no debería sorprender que el punto de ebullición tenga una relación casi lineal con el tamaño (peso molecular) de la molécula. Como regla general, el punto de ebullición aumenta entre 20 y 30 °C por cada carbono agregado a la cadena; esta regla se aplica a otras series homólogas.
Un alcano de cadena lineal tendrá un punto de ebullición más alto que un alcano de cadena ramificada debido a la mayor área de superficie en contacto, por lo tanto, a las mayores fuerzas de van der Waals, entre moléculas adyacentes. Por ejemplo, compare el isobutano (2-metilpropano) y el n-butano (butano), que hierven a -12 y 0 °C, y el 2,2-dimetilbutano y el 2,3-dimetilbutano, que hierven a 50 y 58 °C, respectivamente..
Por otro lado, los cicloalcanos tienden a tener puntos de ebullición más altos que sus contrapartes lineales debido a las conformaciones bloqueadas de las moléculas, que dan un plano de contacto intermolecular.
Puntos de fusión
Los puntos de fusión de los alcanos siguen una tendencia similar a los puntos de ebullición por la misma razón descrita anteriormente. Es decir, (todas las demás cosas son iguales) cuanto más grande es la molécula, mayor es el punto de fusión. Hay una diferencia significativa entre los puntos de ebullición y los puntos de fusión. Los sólidos tienen una estructura más rígida y fija que los líquidos. Esta estructura rígida requiere energía para descomponerse. Por lo tanto, las estructuras sólidas mejor ensambladas requerirán más energía para romperse. Para los alcanos, esto se puede ver en el gráfico anterior (es decir, la línea azul). Los alcanos impares tienen una tendencia más baja en los puntos de fusión que los alcanos pares. Esto se debe a que los alcanos pares se empaquetan bien en la fase sólida, formando una estructura bien organizada, que requiere más energía para romperse. Los alcanos impares se comprimen menos y, por lo tanto, el "Para una visualización de las estructuras cristalinas ver.
Los puntos de fusión de los alcanos de cadena ramificada pueden ser más altos o más bajos que los de los correspondientes alcanos de cadena lineal, nuevamente dependiendo de la capacidad del alcano en cuestión para compactarse bien en la fase sólida.
Conductividad y solubilidad
Los alcanos no conducen la electricidad de ninguna manera, ni están sustancialmente polarizados por un campo eléctrico. Por este motivo, no forman puentes de hidrógeno y son insolubles en disolventes polares como el agua. Dado que los enlaces de hidrógeno entre las moléculas de agua individuales están alineados lejos de una molécula de alcano, la coexistencia de un alcano y agua conduce a un aumento en el orden molecular (una reducción de la entropía). Como no existe un enlace significativo entre las moléculas de agua y las moléculas de alcano, la segunda ley de la termodinámica sugiere que esta reducción de la entropía debe minimizarse minimizando el contacto entre el alcano y el agua: se dice que los alcanos son hidrofóbicos porque son insolubles en agua.
Su solubilidad en disolventes no polares es relativamente alta, propiedad que se denomina lipofilicidad. Los alcanos son, por ejemplo, miscibles en todas las proporciones entre sí.
La densidad de los alcanos suele aumentar con el número de átomos de carbono, pero sigue siendo menor que la del agua. Por tanto, los alcanos forman la capa superior en una mezcla de alcano y agua.
Geometría molecular
La estructura molecular de los alcanos afecta directamente sus características físicas y químicas. Se deriva de la configuración electrónica del carbono, que tiene cuatro electrones de valencia. Los átomos de carbono en los alcanos se describen como híbridos sp, es decir que, en una buena aproximación, los electrones de valencia están en orbitales dirigidos hacia las esquinas de un tetraedro que se derivan de la combinación del orbital 2s y los tres orbitales 2p.. Geométricamente, el ángulo entre los enlaces es cos (−1/3) ≈ 109,47°. Esto es exacto para el caso del metano, mientras que los alcanos más grandes que contienen una combinación de enlaces C-H y C-C generalmente tienen enlaces que están dentro de varios grados de este valor idealizado.
Longitudes de enlace y ángulos de enlace
Un alcano tiene solo enlaces simples C-H y C-C. Los primeros resultan de la superposición de un orbital sp del carbono con el orbital 1s de un hidrógeno; el último por la superposición de dos orbitales sp en átomos de carbono adyacentes. Las longitudes de enlace ascienden a 1,09 × 10 m para un enlace C-H y 1,54 × 10 m para un enlace C-C.
La disposición espacial de los enlaces es similar a la de los cuatro orbitales sp: están dispuestos tetraédricamente, con un ángulo de 109,47° entre ellos. Las fórmulas estructurales que representan los enlaces formando ángulos rectos entre sí, aunque son comunes y útiles, no representan con precisión la geometría.
Conformación
La fórmula estructural y los ángulos de enlace no suelen ser suficientes para describir completamente la geometría de una molécula. Existe un mayor grado de libertad para cada enlace carbono-carbono: el ángulo de torsión entre los átomos o grupos unidos a los átomos en cada extremo del enlace. La disposición espacial descrita por los ángulos de torsión de la molécula se conoce como su conformación.
El etano forma el caso más simple para estudiar la conformación de los alcanos, ya que solo hay un enlace C-C. Si uno mira hacia abajo en el eje del enlace C-C, verá la llamada proyección de Newman. Los átomos de hidrógeno en los átomos de carbono delanteros y traseros tienen un ángulo de 120° entre ellos, como resultado de la proyección de la base del tetraedro sobre un plano plano. Sin embargo, el ángulo de torsión entre un átomo de hidrógeno dado unido al carbono delantero y un átomo de hidrógeno dado unido al carbono trasero puede variar libremente entre 0° y 360°. Esto es una consecuencia de la rotación libre alrededor de un enlace sencillo carbono-carbono. A pesar de esta aparente libertad, solo dos conformaciones limitantes son importantes: la conformación eclipsada y la conformación escalonada.
Las dos conformaciones difieren en energía: la conformación escalonada tiene una energía 12,6 kJ/mol (3,0 kcal/mol) más baja (más estable) que la conformación eclipsada (la menos estable).
Esta diferencia de energía entre las dos conformaciones, conocida como energía de torsión, es baja en comparación con la energía térmica de una molécula de etano a temperatura ambiente. Hay rotación constante alrededor del enlace C-C. El tiempo que tarda una molécula de etano en pasar de una conformación escalonada a la siguiente, equivalente a la rotación de un grupo CH 3 de 120° con respecto al otro, es del orden de 10 segundos.
El caso de los alcanos superiores es más complejo pero se basa en principios similares, siendo siempre la conformación antiperiplanar la más favorecida alrededor de cada enlace carbono-carbono. Por esta razón, los alcanos generalmente se muestran en una disposición en zigzag en diagramas o modelos. La estructura real siempre diferirá un poco de estas formas idealizadas, ya que las diferencias de energía entre las conformaciones son pequeñas en comparación con la energía térmica de las moléculas: las moléculas de alcano no tienen una forma estructural fija, independientemente de lo que sugieran los modelos.
Propiedades espectroscópicas
Prácticamente todos los compuestos orgánicos contienen enlaces carbono-carbono y carbono-hidrógeno, por lo que muestran algunas de las características de los alcanos en sus espectros. Los alcanos se caracterizan por no tener otros grupos y, por lo tanto, por la ausencia de otros rasgos espectroscópicos característicos de un grupo funcional como –OH, –CHO, –COOH, etc.
Espectroscopia infrarroja
El modo de estiramiento de carbono-hidrógeno proporciona una fuerte absorción entre 2850 y 2960 cm, mientras que el modo de estiramiento de carbono-carbono absorbe entre 800 y 1300 cm. Los modos de flexión carbono-hidrógeno dependen de la naturaleza del grupo: los grupos metilo muestran bandas a 1450 cm y 1375 cm, mientras que los grupos metileno muestran bandas a 1465 cm y 1450 cm. Las cadenas de carbono con más de cuatro átomos de carbono muestran una absorción débil alrededor de los 725 cm.
Espectroscopia de RMN
Las resonancias de protones de los alcanos generalmente se encuentran en δ H = 0.5–1.5. Las resonancias del carbono-13 dependen del número de átomos de hidrógeno unidos al carbono: δ C = 8–30 (primario, metilo, –CH 3), 15–55 (secundario, metileno, –CH 2 –), 20–60 (terciario, metino, C–H) y cuaternario. La resonancia de carbono-13 de los átomos de carbono cuaternarios es característicamente débil, debido a la falta del efecto Overhauser nuclear y al largo tiempo de relajación, y puede perderse en muestras débiles o muestras que no se han analizado durante un tiempo suficientemente largo.
Espectrometría de masas
Los alcanos tienen una alta energía de ionización y el ion molecular suele ser débil. El patrón de fragmentación puede ser difícil de interpretar, pero, en el caso de los alcanos de cadena ramificada, la cadena de carbono se escinde preferentemente en los carbonos terciario o cuaternario debido a la relativa estabilidad de los radicales libres resultantes. El fragmento resultante de la pérdida de un solo grupo metilo (M − 15) a menudo está ausente, y otros fragmentos suelen estar espaciados por intervalos de catorce unidades de masa, lo que corresponde a la pérdida secuencial de grupos CH 2.
Propiedades químicas
Los alcanos solo reaccionan débilmente con la mayoría de los compuestos químicos. Se estima que los valores de la constante de disociación ácida (p K a) de todos los alcanos oscilan entre 50 y 70, según el método de extrapolación, por lo que son ácidos extremadamente débiles que son prácticamente inertes a las bases (ver: ácidos de carbono). También son bases extremadamente débiles, que no experimentan una protonación observable en ácido sulfúrico puro (H 0 ~ −12), aunque se sabe que los superácidos que son al menos millones de veces más fuertes los protonan para dar iones alcanio hipercoordinados (ver: ion metanio). De manera similar, solo muestran reactividad con los reactivos electrofílicos más fuertes (p. ej., dioxiranos y sales que contienen el NF 4catión). En virtud de sus fuertes enlaces C-H (~100 kcal/mol) y enlaces C-C (~90 kcal/mol, pero generalmente menos accesibles estéricamente), también son relativamente poco reactivos frente a los radicales libres, aunque muchos radicales deficientes en electrones reaccionará con los alcanos en ausencia de otros enlaces ricos en electrones (ver más abajo). Esta inercia es la fuente del término parafinas (con el significado aquí de "falta de afinidad"). En el petróleo crudo, las moléculas de alcano se han mantenido químicamente sin cambios durante millones de años.
Los radicales libres, moléculas con electrones desapareados, desempeñan un papel importante en la mayoría de las reacciones de los alcanos, como el craqueo y la reforma, donde los alcanos de cadena larga se convierten en alcanos de cadena más corta y los alcanos de cadena lineal en isómeros de cadena ramificada. Además, las reacciones redox de alcanos que involucran intermedios de radicales libres, en particular con oxígeno y los halógenos, son posibles ya que los átomos de carbono están en un estado fuertemente reducido; en el caso del metano, el carbono se encuentra en su estado de oxidación más bajo posible (−4). Reacción con oxígeno (sipresente en cantidad suficiente para satisfacer la estequiometría de la reacción) conduce a una combustión sin humo, produciendo dióxido de carbono y agua. Las reacciones de halogenación por radicales libres ocurren con halógenos, lo que lleva a la producción de haloalcanos. Además, se ha demostrado que los alcanos interactúan y se unen a ciertos complejos de metales de transición en reacciones de activación de enlaces C-H.
En alcanos altamente ramificados, el ángulo de enlace puede diferir significativamente del valor óptimo (109,5°) para adaptarse a grupos voluminosos. Tales distorsiones introducen una tensión en la molécula, conocida como impedimento estérico o tensión. La tensión aumenta sustancialmente la reactividad.
Sin embargo, en general y quizás sorprendentemente, cuando la ramificación no es lo suficientemente extensa como para producir interacciones 1,2- y 1,3-alquil-alquilestéricas altamente desfavorables (con un valor de ~3,1 kcal/mol y ~3,7 kcal/mol en el caso del conformaciones eclipsantes de butano y pentano, respectivamente), los alcanos ramificados son en realidad más termodinámicamente estables que sus isómeros lineales (o menos ramificados). Por ejemplo, el 2,2,3,3-tetrametilbutano altamente ramificado es alrededor de 1,9 kcal/mol más estable que su isómero lineal, el n -octano. Debido a la sutileza de este efecto, las razones exactas de esta regla se han debatido enérgicamente en la literatura química y aún no se han resuelto. Varias explicaciones, incluida la estabilización de alcanos ramificados por correlación de electrones,Se han propuesto como posibilidades la desestabilización de alcanos lineales por repulsión estérica, la estabilización por hiperconjugación neutra y/o efectos electrostáticos. La controversia está relacionada con la cuestión de si la explicación tradicional de la hiperconjugación es el factor principal que rige la estabilidad de los radicales alquilo.
Reacciones con oxígeno (reacción de combustión)
Todos los alcanos reaccionan con el oxígeno en una reacción de combustión, aunque se vuelven cada vez más difíciles de encender a medida que aumenta el número de átomos de carbono. La ecuación general para la combustión completa es:C norte H 2 norte +2 + (3/2norte + 1/2) O 2 → (norte + 1) H 2 O + norte CO 2o C norte H 2 norte +2 + (3 n + 1/2) O 2 → (norte + 1) H 2 O + norte CO 2
En ausencia de suficiente oxígeno, se puede formar monóxido de carbono o incluso hollín, como se muestra a continuación:C norte H 2 norte +2 + (norte + 1/2) O 2 → (norte + 1) H 2 O + norte COC norte H 2 norte +2 + (1/2norte + 1/2) O 2 → (norte + 1) H 2 O + norte C
Por ejemplo, metano:2 CH 4 + 3 O 2 → 4 H 2 O + 2 COCH 4 + O 2 → 2 H 2 O + C
Consulte la tabla de calor de formación de alcanos para obtener datos detallados. El cambio de entalpía estándar de combustión, Δ c H, para los alcanos aumenta alrededor de 650 kJ/mol por grupo CH 2. Los alcanos de cadena ramificada tienen valores más bajos de Δ c H que los alcanos de cadena lineal del mismo número de átomos de carbono, por lo que se puede ver que son algo más estables.
Reacciones con halógenos
Los alcanos reaccionan con los halógenos en una llamada reacción de halogenación por radicales libres. Los átomos de hidrógeno del alcano son reemplazados progresivamente por átomos de halógeno. Los radicales libres son las especies reactivas que participan en la reacción, que suele dar lugar a una mezcla de productos. La reacción es altamente exotérmica con flúor halógeno y puede provocar una explosión.
Estas reacciones son una ruta industrial importante para los hidrocarburos halogenados. Hay tres pasos:
- Iniciación los radicales halógenos se forman por homólisis. Por lo general, se requiere energía en forma de calor o luz.
- Luego tiene lugar la reacción en cadena o la propagación: el radical halógeno extrae un hidrógeno del alcano para dar un radical alquilo. Esto reacciona aún más.
- Terminación de la cadena donde se recombinan los radicales.
Los experimentos han demostrado que toda halogenación produce una mezcla de todos los isómeros posibles, lo que indica que todos los átomos de hidrógeno son susceptibles de reaccionar. La mezcla producida, sin embargo, no es una mezcla estadística: los átomos de hidrógeno secundarios y terciarios se reemplazan preferentemente debido a la mayor estabilidad de los radicales libres secundarios y terciarios. Un ejemplo se puede ver en la monobromación de propano:

Agrietamiento
El agrietamiento rompe las moléculas más grandes en otras más pequeñas. Esto se puede hacer con un método térmico o catalítico. El proceso de craqueo térmico sigue un mecanismo homolítico con formación de radicales libres. El proceso de craqueo catalítico implica la presencia de catalizadores ácidos (generalmente ácidos sólidos como sílice-alúmina y zeolitas), que promueven una ruptura heterolítica (asimétrica) de enlaces que producen pares de iones de cargas opuestas, generalmente un carbocatión y el muy inestable anión hidruro.. Los radicales libres y los cationes localizados en el carbono son muy inestables y experimentan procesos de reorganización de la cadena, escisión C-C en la posición beta (es decir, craqueo) y transferencia de hidrógeno intramolecular e intermolecular o transferencia de hidruro. En ambos tipos de procesos, los intermedios reactivos correspondientes (radicales, iones) se regeneran permanentemente, y así proceden por un mecanismo de cadena de autopropagación. La cadena de reacciones finalmente termina por recombinación de radicales o iones.
Isomerización y reforma
Dragan y su colega fueron los primeros en informar sobre la isomerización en alcanos. La isomerización y la reformación son procesos en los que los alcanos de cadena lineal se calientan en presencia de un catalizador de platino. En la isomerización, los alcanos se convierten en isómeros de cadena ramificada. Es decir, no pierde carbonos ni hidrógenos, manteniendo el mismo peso molecular. En la reformación, los alcanos se convierten en cicloalcanos o hidrocarburos aromáticos, desprendiendo hidrógeno como subproducto. Ambos procesos elevan el octanaje de la sustancia. El butano es el alcano más común que se somete al proceso de isomerización, ya que produce muchos alcanos ramificados con números de octano altos.
Otras reacciones
Los alcanos reaccionarán con vapor en presencia de un catalizador de níquel para dar hidrógeno. Los alcanos pueden ser clorosulfonados y nitrados, aunque ambas reacciones requieren condiciones especiales. La fermentación de alcanos a ácidos carboxílicos tiene cierta importancia técnica. En la reacción de Reed, el dióxido de azufre, el cloro y la luz convierten los hidrocarburos en cloruros de sulfonilo. La abstracción nucleófila se puede utilizar para separar un alcano de un metal. Los grupos alquilo se pueden transferir de un compuesto a otro mediante reacciones de transmetalación. Una mezcla de pentafluoruro de antimonio (SbF 5) y ácido fluorosulfónico (HSO 3 F), llamado ácido mágico, puede protonar alcanos.
Ocurrencia
Ocurrencia de alcanos en el Universo.
Los alcanos forman una pequeña porción de las atmósferas de los planetas gaseosos exteriores como Júpiter (0,1 % de metano, 2 ppm de etano), Saturno (0,2 % de metano, 5 ppm de etano), Urano (1,99 % de metano, 2,5 ppm de etano) y Neptuno (1,5% metano, 1,5 ppm etano). Titán (1,6% de metano), un satélite de Saturno, fue examinado por la sonda Huygens, que indicó que la atmósfera de Titán arroja periódicamente metano líquido sobre la superficie de la luna.También en Titán, la misión Cassini ha captado imágenes de lagos estacionales de metano/etano cerca de las regiones polares de Titán. También se han detectado metano y etano en la cola del cometa Hyakutake. El análisis químico mostró que las abundancias de etano y metano eran aproximadamente iguales, lo que se cree que implica que sus hielos se formaron en el espacio interestelar, lejos del Sol, lo que habría evaporado estas moléculas volátiles. También se han detectado alcanos en meteoritos como las condritas carbonáceas.
Ocurrencia de alcanos en la Tierra
Rastros de gas metano (alrededor de 0.0002% o 1745 ppb) ocurren en la atmósfera de la Tierra, producido principalmente por microorganismos metanogénicos, como Archaea en el intestino de los rumiantes.
Las fuentes comerciales más importantes de alcanos son el gas natural y el petróleo. El gas natural contiene principalmente metano y etano, con algo de propano y butano: el petróleo es una mezcla de alcanos líquidos y otros hidrocarburos. Estos hidrocarburos se formaron cuando los animales y las plantas marinas (zooplancton y fitoplancton) murieron y se hundieron en el fondo de los mares antiguos y se cubrieron con sedimentos en un ambiente anóxico y se convirtieron durante muchos millones de años a altas temperaturas y altas presiones a su forma actual. El gas natural resultó así, por ejemplo, de la siguiente reacción:C 6 H 12 O 6 → 3 CH 4 + 3 CO 2
Estos depósitos de hidrocarburos, recogidos en rocas porosas atrapadas debajo de rocas impermeables, comprenden campos petroleros comerciales. Se han formado a lo largo de millones de años y, una vez agotados, no se pueden reemplazar fácilmente. El agotamiento de estas reservas de hidrocarburos es la base de lo que se conoce como crisis energética.
El metano también está presente en lo que se denomina biogás, producido por animales y materia en descomposición, que es una posible fuente de energía renovable.
Los alcanos tienen una baja solubilidad en agua, por lo que el contenido en los océanos es insignificante; sin embargo, a altas presiones y bajas temperaturas (como en el fondo de los océanos), el metano puede cocristalizarse con agua para formar un clatrato de metano sólido (hidrato de metano). Aunque esto no puede explotarse comercialmente en la actualidad, la cantidad de energía combustible de los campos de clatrato de metano conocidos excede el contenido de energía de todos los depósitos de gas natural y petróleo juntos. El metano extraído del clatrato de metano es, por tanto, un candidato para futuros combustibles.
Ocurrencia biológica
Los alcanos acíclicos se encuentran en la naturaleza de varias formas.Bacterias y arqueas
Ciertos tipos de bacterias pueden metabolizar alcanos: prefieren las cadenas de carbono pares, ya que son más fáciles de degradar que las cadenas impares.
Por otro lado, ciertas arqueas, los metanógenos, producen grandes cantidades de metano por el metabolismo del dióxido de carbono u otros compuestos orgánicos oxidados. La energía se libera por la oxidación del hidrógeno:CO 2 + 4 H 2 → CH 4 + 2 H 2 O
Los metanógenos también son los productores de gas de pantano en los humedales. La producción de metano del ganado y otros herbívoros, que pueden liberar de 30 a 50 galones por día, y de las termitas, también se debe a los metanógenos. También producen el más simple de todos los alcanos en los intestinos de los humanos. Las arqueas metanogénicas se encuentran, por lo tanto, al final del ciclo del carbono, y el carbono se libera nuevamente a la atmósfera después de haber sido fijado por la fotosíntesis. Es probable que nuestros actuales yacimientos de gas natural se formaran de manera similar.hongos y plantas
Los alcanos también desempeñan un papel, aunque menor, en la biología de los tres grupos de organismos eucariotas: hongos, plantas y animales. Algunas levaduras especializadas, por ejemplo, Candida tropicale, Pichia sp., Rhodotorula sp., pueden utilizar alcanos como fuente de carbono o energía. El hongo Amorphotheca resinae prefiere los alcanos de cadena más larga en el combustible de aviación y puede causar serios problemas a las aeronaves en las regiones tropicales.
En las plantas, los alcanos sólidos de cadena larga se encuentran en la cutícula de la planta y en la cera epicuticular de muchas especies, pero rara vez son constituyentes importantes. Protegen a la planta contra la pérdida de agua, previenen la lixiviación de minerales importantes por la lluvia y protegen contra bacterias, hongos e insectos dañinos. Las cadenas de carbono en los alcanos de las plantas suelen tener un número impar, entre 27 y 33 átomos de carbono de longitud y las fabrican las plantas mediante la descarboxilación de los ácidos grasos pares. La composición exacta de la capa de cera no solo depende de la especie, sino que también cambia con la estación y factores ambientales como las condiciones de iluminación, la temperatura o la humedad.
Los alcanos de cadena corta más volátiles también se producen y se encuentran en los tejidos vegetales. El pino de Jeffrey se destaca por producir niveles excepcionalmente altos de n -heptano en su resina, por lo que su destilado se designó como el punto cero para un índice de octano. También se sabe desde hace mucho tiempo que los aromas florales contienen componentes alcanos volátiles, y el n -nonano es un componente significativo en el aroma de algunas rosas. La emisión de alcanos gaseosos y volátiles como el etano, el pentano y el hexano por parte de las plantas también se ha documentado en niveles bajos, aunque generalmente no se consideran un componente importante de la contaminación del aire biogénica.
Los aceites vegetales comestibles también suelen contener pequeñas fracciones de alcanos biogénicos con un amplio espectro de números de carbono, principalmente de 8 a 35, por lo general alcanzando su punto máximo entre los 20 bajos y los 20 superiores, con concentraciones de hasta decenas de miligramos por kilogramo (partes por millón en peso) y a veces más de cien para la fracción de alcano total.animales
Los alcanos se encuentran en productos animales, aunque son menos importantes que los hidrocarburos insaturados. Un ejemplo es el aceite de hígado de tiburón, que contiene aproximadamente un 14 % de pristano (2,6,10,14-tetrametilpentadecano, C 19 H 40). Son importantes como feromonas, materiales de mensajeros químicos, de los que dependen los insectos para comunicarse. En algunas especies, por ejemplo, el escarabajo de apoyo Xylotrechus colonus, el pentacosano (C 25 H 52), el 3-metilpentaicosano (C 26 H 54) y el 9-metilpentaicosano (C 26 H 54) se transfieren por contacto corporal. Con otras como la mosca tsetsé Glossina morsitans morsitans, la feromona contiene los cuatro alcanos 2-metilheptadecano (C 18 H 38), 17,21-dimetilheptatriacontano (C 39 H 80), 15,19-dimetilheptatriacontano (C 39 H 80) y 15,19,23-trimetilheptatriacontano (C 40 H 82), y actúa por el olfato en distancias más largas. Las abejas melíferas que bailan en movimiento producen y liberan dos alcanos, tricosano y pentacosano.
Relaciones ecológicas
Un ejemplo, en el que tanto los alcanos de plantas como de animales juegan un papel, es la relación ecológica entre la abeja de la arena (Andrena nigroaenea) y la orquídea araña temprana (Ophrys sphegodes); el último depende para la polinización del primero. Las abejas de arena usan feromonas para identificar a una pareja; en el caso de A. nigroaenea, las hembras emiten una mezcla de tricosano (C 23 H 48), pentacosano (C 25 H 52) y heptacosano (C 27 H 56) en la proporción 3:3:1, y los machos se sienten atraídos específicamente por este olor. La orquídea aprovecha este arreglo de apareamiento para que la abeja macho recolecte y disemine su polen; partes de su flor no solo se asemejan a la apariencia de las abejas de la arena, sino que también producen grandes cantidades de los tres alcanos en la misma proporción que las abejas de la arena hembra. Como resultado, numerosos machos son atraídos hacia las flores e intentan copular con su pareja imaginaria: aunque este esfuerzo no se ve coronado por el éxito de la abeja, permite que la orquídea transfiera su polen, que se dispersará después de la partida de la abeja. macho frustrado a otras flores.
Producción
Refinación del petróleo
Como se indicó anteriormente, la fuente más importante de alcanos es el gas natural y el petróleo crudo. Los alcanos se separan en una refinería de petróleo por destilación fraccionada y se procesan en muchos productos.
Fischer–Tropsch
El proceso Fischer-Tropsch es un método para sintetizar hidrocarburos líquidos, incluidos alcanos, a partir de monóxido de carbono e hidrógeno. Este método se utiliza para producir sustitutos de los destilados de petróleo.
Preparación de laboratorio
Por lo general, hay poca necesidad de sintetizar alcanos en el laboratorio, ya que generalmente están disponibles comercialmente. Además, los alcanos generalmente no son reactivos química o biológicamente, y no experimentan limpiamente interconversiones de grupos funcionales. Cuando los alcanos se producen en el laboratorio, a menudo son un producto secundario de una reacción. Por ejemplo, el uso de n -butillitio como base fuerte da el ácido conjugado, n -butano como producto secundario:C 4 H 9 Li + H 2 O → C 4 H 10 + LiOH
Sin embargo, a veces puede ser deseable hacer una sección de una molécula en una funcionalidad similar a un alcano (grupo alquilo) utilizando los métodos anteriores o similares. Por ejemplo, un grupo etilo es un grupo alquilo; cuando éste se une a un grupo hidroxi, da etanol, que no es un alcano. Para ello, los métodos más conocidos son la hidrogenación de alquenos:RCH=CH 2 + H 2 → RCH 2 CH 3 (R = alquilo)
Los alcanos o grupos alquilo también se pueden preparar directamente a partir de haluros de alquilo en la reacción de Corey-House-Posner-Whitesides. La desoxigenación de Barton-McCombie elimina los grupos hidroxilo de los alcoholes, por ejemplo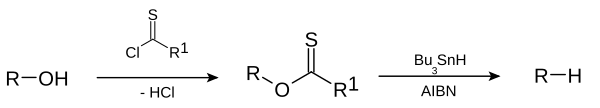
y la reducción de Clemmensen elimina los grupos carbonilo de los aldehídos y las cetonas para formar alcanos o compuestos sustituidos con alquilo, por ejemplo: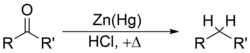
Preparación a partir de otros compuestos orgánicos.
Los alcanos se pueden preparar a partir de una variedad de compuestos orgánicos. Estos incluyen alquenos, alquinos, haloalcanos, alcoholes, aldehídos, cetonas y ácidos carboxílicos.
De alquenos y alquinos
La adición de hidrógeno molecular a través de los enlaces π de alquenos y alquinos da alcanos. Esta reacción de hidrogenación normalmente se realiza utilizando un catalizador de metal en polvo, como paladio, platino o níquel. La reacción es exotérmica porque el producto alcano es más estable. Este es un proceso importante en varios campos de la química industrial y de investigación.
De haloalcanos
Varios métodos producen alcanos a partir de haloalcanos.
En la reacción de Wurtz, un haloalcano se trata con sodio en éter seco para producir un alcano que tiene el doble de átomos de carbono. Esta reacción procede a través de un intermediario de radicales libres y tiene la posibilidad de formación de alquenos en el caso de haloalcanos terciarios y dihaluros vecinales.2 R−X + 2 Na → R−R + 2 Na+X
En la síntesis de Corey-House, un haloalcano se trata con cuprato de dialquil litio, un reactivo de Gilman, para producir un alcano superior:Li+[R–Cu–R]– + R'–X → R–R' + R–Cu + Li+X
Los haloalcanos se pueden reducir a alcanos por reacción con reactivos de hidruro como el hidruro de litio y aluminio.R−X + H → R−H + X
Aplicaciones
Las aplicaciones de los alcanos dependen del número de átomos de carbono. Los primeros cuatro alcanos se utilizan principalmente para fines de calefacción y cocina, y en algunos países para la generación de electricidad. El metano y el etano son los principales componentes del gas natural; normalmente se almacenan como gases a presión. Sin embargo, es más fácil transportarlos como líquidos: esto requiere tanto la compresión como el enfriamiento del gas.
El propano y el butano son gases a presión atmosférica que pueden licuarse a presiones bastante bajas y se conocen comúnmente como gas licuado de petróleo (GLP). El propano se utiliza en quemadores de gas propano y como combustible para vehículos de carretera, el butano en calefactores y encendedores de cigarrillos desechables. Ambos se utilizan como propulsores en aerosoles.
Del pentano al octano, los alcanos son líquidos altamente volátiles. Se utilizan como combustibles en motores de combustión interna, ya que se vaporizan fácilmente al entrar en la cámara de combustión sin formar gotitas, lo que perjudicaría la uniformidad de la combustión. Se prefieren los alcanos de cadena ramificada ya que son mucho menos propensos a la ignición prematura, lo que provoca detonación, que sus homólogos de cadena lineal. Esta propensión a la ignición prematura se mide por el octanaje del combustible, donde el 2,2,4-trimetilpentano (isooctano) tiene un valor arbitrario de 100 y el heptano tiene un valor de cero. Aparte de su uso como combustibles, los alcanos medios también son buenos disolventes para sustancias no polares.
Los alcanos desde el nonano hasta, por ejemplo, el hexadecano (un alcano con dieciséis átomos de carbono) son líquidos de mayor viscosidad, cada vez menos adecuados para su uso en gasolina. En cambio, forman la mayor parte del diesel y del combustible de aviación. Los combustibles diésel se caracterizan por su índice de cetano, siendo cetano un nombre antiguo para el hexadecano. Sin embargo, los puntos de fusión más altos de estos alcanos pueden causar problemas a bajas temperaturas y en regiones polares, donde el combustible se vuelve demasiado espeso para fluir correctamente.
Los alcanos desde el hexadecano en adelante forman los componentes más importantes del fueloil y del aceite lubricante. En esta última función, funcionan al mismo tiempo como agentes anticorrosivos, ya que su naturaleza hidrófoba hace que el agua no pueda llegar a la superficie del metal. Muchos alcanos sólidos encuentran uso como cera de parafina, por ejemplo, en velas. Sin embargo, esto no debe confundirse con la cera verdadera, que se compone principalmente de ésteres.
Los alcanos con una longitud de cadena de aproximadamente 35 o más átomos de carbono se encuentran en el betún, utilizado, por ejemplo, en la pavimentación de carreteras. Sin embargo, los alcanos superiores tienen poco valor y por lo general se dividen en alcanos inferiores mediante el craqueo.
Algunos polímeros sintéticos como el polietileno y el polipropileno son alcanos con cadenas que contienen cientos o miles de átomos de carbono. Estos materiales se utilizan en innumerables aplicaciones, y cada año se fabrican y utilizan miles de millones de kilogramos de estos materiales.
Transformaciones ambientales
Los alcanos son moléculas apolares químicamente muy inertes y poco reactivas como compuestos orgánicos. Esta inercia produce serios problemas ecológicos si se liberan al medio ambiente. Debido a su falta de grupos funcionales y baja solubilidad en agua, los alcanos muestran poca biodisponibilidad para los microorganismos.
Hay, sin embargo, algunos microorganismos que poseen la capacidad metabólica de utilizar n -alcanos como fuentes de carbono y energía. Algunas especies bacterianas están altamente especializadas en la degradación de alcanos; estos se conocen como bacterias hidrocarbonoclásticas.
Peligros
El metano es inflamable, explosivo y peligroso de inhalar; debido a que es un gas incoloro e inodoro, se debe tener especial cuidado con el metano. El etano también es extremadamente inflamable, explosivo y peligroso de inhalar. Ambos pueden causar asfixia. El propano también es inflamable y explosivo, y puede causar somnolencia o pérdida del conocimiento si se inhala. El butano presenta los mismos peligros que el propano.
Los alcanos también representan una amenaza para el medio ambiente. Los alcanos ramificados tienen una biodegradabilidad menor que los alcanos no ramificados. El metano se considera el gas de efecto invernadero más peligroso para el medio ambiente, aunque la cantidad de metano en la atmósfera es relativamente baja.
Contenido relacionado
Acetato de amilo
Grupo atractor de electrones
Hielo seco