Alcaloide
Los alcaloides son una clase de compuestos orgánicos básicos de origen natural que contienen al menos un átomo de nitrógeno. Este grupo también incluye algunos compuestos relacionados con propiedades neutras e incluso débilmente ácidas. Algunos compuestos sintéticos de estructura similar también pueden denominarse alcaloides. Además de carbono, hidrógeno y nitrógeno, los alcaloides también pueden contener oxígeno, azufre y, más raramente, otros elementos como cloro, bromo y fósforo.
Los alcaloides son producidos por una gran variedad de organismos, incluidas bacterias, hongos, plantas y animales. Se pueden purificar a partir de extractos crudos de estos organismos mediante extracción ácido-base o extracciones con solventes seguidas de cromatografía en columna de gel de sílice. Los alcaloides tienen una amplia gama de actividades farmacológicas que incluyen antipalúdicos (p. ej. quinina), antiasmáticos (p. ej. efedrina), anticancerígenos (p. ej. homoharringtonina), colinomiméticos (p. ej. galantamina), vasodilatador (p. ej. vincamina), antiarrítmico (p. ej. quinidina), analgésico (p. ej. morfina), actividad antibacteriana (p. ej., queleritrina) y antihiperglucémica (p. ej., piperina). Muchos han encontrado uso en la medicina tradicional o moderna, o como puntos de partida para el descubrimiento de fármacos. Otros alcaloides poseen actividades psicotrópicas (p. ej. psilocina) y estimulantes (p. ej. cocaína, cafeína, nicotina, teobromina), y se han utilizado en rituales enteogénicos o como drogas recreativas. Los alcaloides también pueden ser tóxicos (p. ej. atropina, tubocurarina). Aunque los alcaloides actúan sobre una diversidad de sistemas metabólicos en humanos y otros animales, provocan casi uniformemente un sabor amargo.
El límite entre los alcaloides y otros compuestos naturales que contienen nitrógeno no está bien definido. Los compuestos como péptidos de aminoácidos, proteínas, nucleótidos, ácidos nucleicos, aminas y antibióticos generalmente no se denominan alcaloides. Los compuestos naturales que contienen nitrógeno en posición exocíclica (mescalina, serotonina, dopamina, etc.) suelen clasificarse como aminas y no como alcaloides. Algunos autores, sin embargo, consideran a los alcaloides como un caso especial de las aminas.
Nombramiento
El nombre "alcaloides" (Alemán: Alkaloide) fue introducido en 1819 por el químico alemán Carl Friedrich Wilhelm Meißner, y se deriva de la raíz latina tardía álcali y el sufijo griego -οειδής -('me gusta'). Sin embargo, el término comenzó a usarse ampliamente solo después de la publicación de un artículo de revisión de Oscar Jacobsen en el diccionario químico de Albert Ladenburg en la década de 1880.
No existe un método único para nombrar los alcaloides. Muchos nombres individuales se forman agregando el sufijo "ine" al nombre de la especie o género. Por ejemplo, la atropina se aísla de la planta Atropa belladonna; la estricnina se obtiene de la semilla del árbol de la estricnina (Strychnos nux-vomica L.). Cuando se extraen varios alcaloides de una planta, sus nombres a menudo se distinguen por variaciones en el sufijo: "idine", "anine", "aline", " inino" etc. También hay al menos 86 alcaloides cuyos nombres contienen la raíz "vin" porque se extraen de plantas de vinca como la Vinca rosea (Catharanthus roseus); estos se llaman alcaloides de la vinca.
Historia
Los seres humanos han utilizado plantas que contienen alcaloides desde la antigüedad con fines terapéuticos y recreativos. Por ejemplo, las plantas medicinales se conocen en Mesopotamia desde aproximadamente el año 2000 a. La Odisea de Homero hace referencia a un regalo que la reina egipcia le dio a Helena, una droga que traía el olvido. Se cree que el regalo era una droga que contenía opio. Un libro chino sobre plantas de interior escrito entre los siglos I y III a. C. mencionó un uso médico de la efedra y las amapolas de opio. Además, las hojas de coca han sido utilizadas por los indios sudamericanos desde la antigüedad.
Los extractos de plantas que contienen alcaloides tóxicos, como la aconitina y la tubocurarina, se utilizaron desde la antigüedad para envenenar las flechas.
Los estudios de los alcaloides comenzaron en el siglo XIX. En 1804, el químico alemán Friedrich Sertürner aisló del opio un "principio soporífero" (latín: principium somniferum), al que llamó "morphium", en referencia a Morfeo, el dios griego de los sueños; en alemán y algunos otros idiomas centroeuropeos, este sigue siendo el nombre de la droga. El término "morfina", usado en inglés y francés, fue dado por el físico francés Joseph Louis Gay-Lussac.
Los investigadores franceses Pierre Joseph Pelletier y Joseph Bienaimé Caventou, quienes descubrieron la quinina (1820) y la estricnina (1818), realizaron una contribución significativa a la química de los alcaloides en los primeros años de su desarrollo. En esa época se descubrieron varios otros alcaloides, incluidos xantina (1817), atropina (1819), cafeína (1820), conina (1827), nicotina (1828), colchicina (1833), esparteína (1851) y cocaína (1860). El desarrollo de la química de los alcaloides se aceleró con la aparición de métodos espectroscópicos y cromatográficos en el siglo XX, de modo que en 2008 se habían identificado más de 12.000 alcaloides.
La primera síntesis completa de un alcaloide fue realizada en 1886 por el químico alemán Albert Ladenburg. Produjo coniina haciendo reaccionar 2-metilpiridina con acetaldehído y reduciendo la 2-propenilpiridina resultante con sodio.
Clasificaciones
En comparación con la mayoría de las otras clases de compuestos naturales, los alcaloides se caracterizan por una gran diversidad estructural. No hay una clasificación uniforme. Inicialmente, cuando se carecía del conocimiento de las estructuras químicas, se confiaba en la clasificación botánica de las plantas de origen. Esta clasificación ahora se considera obsoleta.
Las clasificaciones más recientes se basan en la similitud del esqueleto de carbono (p. ej., similar al indol, la isoquinolina y la piridina) o el precursor bioquímico (ornitina, lisina, tirosina, triptófano, etc.). Sin embargo, requieren compromisos en casos límite; por ejemplo, la nicotina contiene un fragmento de piridina de nicotinamida y una parte de pirrolidina de ornitina y, por lo tanto, se puede asignar a ambas clases.
Los alcaloides a menudo se dividen en los siguientes grupos principales:
- "Alcaloides Verdaderos" contienen nitrógeno en el heterociclo y proceden de aminoácidos. Sus ejemplos característicos son atropina, nicotina y morfina. Este grupo también incluye algunos alcaloides que además del heterociclo de nitrógeno contienen terpene (Por ejemplo., evonina) o fragmentos de péptidos (Por ejemplo. ergotamina). Los alcaloides coniína y coniceína pueden considerarse como verdaderos alcaloides (más que los pseudoalcaloides: ver abajo) aunque no se originan aminoácidos.
- "Protoalkaloides", que contienen nitrógeno (pero no el heterociclo de nitrógeno) y también proceden de aminoácidos. Ejemplos incluyen mescalina, adrenalina y efedrina.
- Alcaloides de poliamina – derivados de la putrescina, espermaida y esperma.
- Peptide y ciclopeptide alkaloids.
- Pseudoalkaloides – compuestos similares a alcaloides que no proceden de aminoácidos. Este grupo incluye alcaloides tipo terpene y esteroides, así como alcaloides como purina, como la cafeína, la teobromina, la teofilina y la teofilina. Algunos autores clasifican como pseudoalcaloides tales compuestos como efedrina y catinona. Los originan del aminoácido fenilalanina, pero adquieren su átomo de nitrógeno no del aminoácido sino a través de la transamación.
Algunos alcaloides no tienen el esqueleto de carbono característico de su grupo. Por lo tanto, la galantamina y las homoaporfinas no contienen fragmentos de isoquinolina, pero, en general, se atribuyen a los alcaloides de isoquinolina.
Las principales clases de alcaloides monoméricos se enumeran en la siguiente tabla:
| Clase | Grupos principales | Principales pasos de síntesis | Ejemplos |
|---|---|---|---|
| Alcaloides con heterociclos de nitrógeno (alcaloides verdaderos) | |||
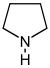
| Pyrrolidine derivatives | Ornitina o arginina → putrescine → N-metilputrescine → N-metil-Δ1- Espejo. | Cuscohygrine, hygrine, hygroline, stachydrine | |
| Derivados de tropano | Grupo Atropina Sustitución en las posiciones 3, 6 o 7 | Ornitina o arginina → putrescine → N-metilputrescine → N-metil-Δ1- Espejo. | Atropina, escoolamina, hyoscyamine |
| Grupo de cocaína Sustitución en las posiciones 2 y 3 | Cocaína, ecgonina | ||
| Pyrrolizidine derivatives | Non-esters | En plantas: ornitina o arginina → putrescine → homospermidine → retronecine | Retronecina, heliotridina, laburnina |
| Esteres complejos de ácidos monocarboxílicos | Indicina, lindelophin, sarracine | ||
| Morteros macrocíclicos | Platyphylline, trichodesmine | ||
| 1-aminopirrolizidines (líneas) | En hongos: L-proline + L-homoserine → N-(3-amino-3-carboxypropyl)proline → norloline | Loline, N-formylloline, N-acetylloline | |
| Derivados de piperidina | Lysine → cadaverina → Δ1-piperideína | Sedamina, lobelina, anaferina, piperina | |
| Ácido octonoico → coniceína → coniina | Coniine, coniceine | ||
| Derivados de Quinolizidina | Grupo Lupinine | Lysine → cadaverina → Δ1-piperideína | Lupinina, nufaridina |
| Grupo Cytisine | Cytisine | ||
| Grupo Sparteine | Sparteine, lupanine, anahygrine | ||
| Grupo de Matrina. | Matina, oximatrina, alomatridina | ||
| Ormosanine group | Ormosanina, piptantina | ||
| Derivados de Indolizidina | Lysine → δ-semialdehído de ácido α-aminoadipic → ácido pipecólico → 1 indolizidinone | Swainsonina, castanospermina | |
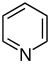
| Pyridine derivatives | Derivados simples de piridina | Ácido nicotínico → ácido dihidronicotinico → 1,2-dihidropiridina | Trigonelline, ricinina, arecoline |
| Polycyclic noncondensing pyridine derivatives | Nicotina, nornicotina, anabasina, anatabina | ||
| Polycyclic condensed pyridine derivatives | Actinidina, gentianina, pediculinina | ||
| Sesquiterpene pyridine derivatives | Ácido nicotínico, isoleucine | Evonine, hippocrateine, triptonina | |
| Isoquinoline derivatives and related alkaloids | Derivados simples de isoquinolina | Tirosina o fenilalanina → dopamina o tiramina (para alcaloides Amarillis) | Salsolina, lofocerina |
| Derivados de 1- y 3-isoquinolines | N-metilcoridaldine, noroxyhydrastinine | ||
| Derivativos de 1- y 4-feniltetrahidroisoquinolines | Cryptostilin | ||
| Derivativos de 5-naftil-isoquinolina | Ancistrocladine | ||
| Derivativos de 1- y 2-benzil-izoquinolines | Papaverine, laudanosina, sendaverine | ||
| Grupo Cularine | Cularina, yagonina | ||
| Pavines e isopavines | Argemonine, amurensine | ||
| Benzopyrrocolines | Cryptaustoline | ||
| Protoberinas | Berberine, canadine, ophiocarpine, mecambridine, corydaline | ||
| Phthalidisoquinolines | Hidrastina, narcotina (Noscapine) | ||
| Spirobenzylisoquinolines | Fumaricine | ||
| Ipecacuanha alkaloids | Emetine, protoemetine, ipecoside | ||
| Benzophenanthridines | Sanguinarina, oxinitidina, corynoloxina | ||
| Aporphines | Glaucine, coridina, liriodenina | ||
| Proaporphines | Pronuciferina, glaziovina | ||
| Homoaporphines | Kreysiginina, multifloramina | ||
| Homoproaporfines | Bulbocodina | ||
| Morfines | Morfina, codeína, thebaína, sinomenina | ||
| Homomorfinas | Kreysiginina, androcymbine | ||
| Tropoloisoquinolines | Imerubrine | ||
| Azofluoranthenes | Rufescine, imeluteine | ||
| Amaryllis alkaloids | Licorina, ambelina, tazettina, galantamina, montanina | ||
| Erythrina alkaloids | Erysodine, erythroidine | ||
| Derivados de Phenanthrene | Aterosperminina | ||
| Protopines | Protopina, oxomuramina, corycavidina | ||
| Aristolactam | Doriflavin | ||
| Derivados de oxígeno | Tyrosine → tiramina | Annulolina, medioordinol, texalina, texamina | |
| Derivados Isoxazole | Ácido ibérico → Muscimol | Ácido ibérico, Muscimol | |
| Derivados del tiazol | 1-Deoxy-D-xylulose 5-phosphate (DOXP), tyrosine, cysteine | Nostocyclamide, thiostreptone | |
| Derivados quinazolina | 3,4-Dihidro-4-quinazolona derivados | Ácido antranilico o fenilalanina o ornitina | Febrifugine |
| 1,4-Dihidro-4-quinazolona derivados | Glycorine, arborine, glycosminine | ||
| Pyrrolidine y piperidine derivados quinazoline | Vazicina (peganina) | ||
| Derivados de acridina | Ácido antranilico | Rutacridone, acronicine | |
| Derivados quinolina | Derivados simples de derivados quinolina de 2–quinolones y 4-quinolona | Ácido anthranilico → 3-carboxyquinoline | Cusparina, echinopsina, evocarpina |
| Terpenoides tricíclicos | Flindersine | ||
| Derivados de Furanoquinolina | Dictamnine, fagarine, skimmianine | ||
| Quinines | Tryptophan → tripptamina → strictosidine (con secologanin) → korinanteal → cinhoninon | Quinina, quinidina, cinchonina, cinhonidina | |
| Derivados interiores | Alcaloides indoles no isoprenos | ||
| Derivados simples de la indole | Tryptophan → triptamina o 5-Hydroxytryptophan | Serotonina, psilocibin, dimetiltriptamina (DMT), bufotenin | |
| Derivados simples de β-carbolina | Harman, harmine, harmaline, eleagnine | ||
| Pyrroloindole alkaloids | Fisostigmina (eserina), etheramina, fitovenina, eptastigmina | ||
| Semiterpenoid indole alkaloids | |||
| Ergot alkaloids | Tryptophan → chanoclavina → agroclavina → elimoclavina → ácido paspálico → ácido lisérgico | Ergotamina, ergobasina, ergosina | |
| Monoterpenoid indole alkaloids | |||
| Corynanthe tipo alcaloides | Tryptophan → tripptamina → strictosidine (con secologanin) | Ajmalicina, sarpagine, vobasine, ajmaline, yohimbine, reserpine, mitragynine, grupo estricnina y (Strychnine brucine, aquamicine, vomicine) | |
| Alcaloides tipo Iboga | Ibogamina, ibogaine, voacangine | ||
| Alcaloides tipo Aspidosperma | Vincamina, alcaloides vinca, vincotina, aspidospermina | ||
| Imidazole derivatives | Directamente de la histidina | Histamina, pilocarpina, pilosina, stevensine | |
| Derivados purinos | Xanthosine (formed in purine biosynthesis) → 7 metilxantosina → 7-metilxanthine → theobromine → cafeína | cafeína, teobromina, teofilina, saxitoxina | |
| Alcaloides con nitrógeno en la cadena lateral (protoalkaloides) | |||
| β-Phenylethylamine derivatives | Tyrosina o fenilalanina → dioxyphenilalanina → dopamina → adrenalina y mescalina tirosina → tyramine phenylalanine → 1-phenylpropane-1,2-dione → cathinone → ephedrine y pseudoephedrine | Tyramina, ephedrine, pseudoephedrine, mescaline, cathinone, catecholamines (adrenalina, noradrenalina, dopamina) | |
| Colchicine alkaloids | Tirosina o fenilalanina → dopamina → otoñoaline → colchicine | Colchicine, colchamine | |
| Muscarine | Ácido Glutámico → Ácido 3-ketoglutamico → muscarina (con ácido píruvico) | Muscarina, alomuscarina, epimuscarina, epiallomuscarina | |
| Benzylamine | Fenilalanina con valina, leucina o isoleucina | Capsaicina, dihidrocapsaicina, nordihidrocapsaicina, vanillylamina | |
| Polyamines alkaloids | |||
| Derivados de Putrescine | ornitina → putrescine → espermaidina → esperma | Paucine | |
| Derivados espermidinos | Lunarina, codonocarpina | ||
| Derivados Spermine | Verbascenine, aphelandrine | ||
| Alcaloides (ciclopéptidos) | |||
| Alcaloides de péptidos con un ciclo de 13 miembros | Numularina Tipo C | De diferentes aminoácidos | Nummularina C, Nummularina S |
| Tipo de zinc | Ziziphine A, sativanine H | ||
| Alcaloides de péptidos con un ciclo de 14 miembros | Tipo de fractura | Frangulanina, scutianine J | |
| Scutianine Tipo | Scutianine A | ||
| Tipo de proteína | Integerrina, discarina D | ||
| Tipo Amphibine F | Amphibino F, spinanina A | ||
| Tipo de amfibina B | Amphibine B, lotusina C | ||
| Alcaloides de péptidos con un ciclo de 15 miembros | Mucronine Tipo | Mucronina A | |
| Pseudoalkaloides (terpenes y esteroides) | |||
| Diterpenas | Tipo de licoctonina | Ácido mevalónico → Isopentenyl pyrophosphate → geranyl pyrophosphate | Aconitina, delphinine |
| Alcaloides esteroides | Colesterol, arginina | Solanidina, ciclopamina, batrachotoxin | |
Propiedades
La mayoría de los alcaloides contienen oxígeno en su estructura molecular; esos compuestos suelen ser cristales incoloros en condiciones ambientales. Los alcaloides libres de oxígeno, como la nicotina o la conina, suelen ser líquidos aceitosos, incoloros y volátiles. Algunos alcaloides son de color, como la berberina (amarilla) y la sanguinarina (naranja).
La mayoría de los alcaloides son bases débiles, pero algunos, como la teobromina y la teofilina, son anfóteros. Muchos alcaloides se disuelven mal en agua pero se disuelven fácilmente en solventes orgánicos, como éter dietílico, cloroformo o 1,2-dicloroetano. La cafeína, la cocaína, la codeína y la nicotina son ligeramente solubles en agua (con una solubilidad de ≥1 g/L), mientras que otras, como la morfina y la yohimbina, son muy poco solubles en agua (0,1–1 g/L). Los alcaloides y ácidos forman sales de varias concentraciones. Estas sales suelen ser fácilmente solubles en agua y etanol y poco solubles en la mayoría de los disolventes orgánicos. Las excepciones incluyen el bromhidrato de escopolamina, que es soluble en solventes orgánicos, y el sulfato de quinina soluble en agua.
La mayoría de los alcaloides tienen un sabor amargo o son venenosos cuando se ingieren. La producción de alcaloides en las plantas parece haber evolucionado en respuesta a la alimentación de animales herbívoros; sin embargo, algunos animales han desarrollado la capacidad de desintoxicar los alcaloides. Algunos alcaloides pueden producir defectos de desarrollo en la descendencia de animales que consumen pero no pueden desintoxicar los alcaloides. Un ejemplo es el alcaloide ciclopamina, producido en las hojas del lirio de maíz. Durante la década de 1950, hasta el 25% de los corderos nacidos de ovejas que habían pastado lirio de maíz tenían deformaciones faciales graves. Estos iban desde mandíbulas deformadas hasta ciclopía (ver imagen). Después de décadas de investigación, en la década de 1980, el compuesto responsable de estas deformidades fue identificado como el alcaloide 11-desoxijervina, luego renombrado como ciclopamina.
Distribución en la naturaleza
Los alcaloides son generados por varios organismos vivos, especialmente por las plantas superiores; alrededor del 10 al 25 % de ellos contienen alcaloides. Por lo tanto, en el pasado el término "alcaloide" estaba asociado con las plantas.
El contenido de alcaloides en las plantas suele estar dentro de un pequeño porcentaje y no es homogéneo en los tejidos de las plantas. Según el tipo de plantas, la concentración máxima se observa en las hojas (por ejemplo, beleño negro), frutos o semillas (árbol de estricnina), raíz (Rauvolfia serpentina) o corteza (cinchona). Además, diferentes tejidos de las mismas plantas pueden contener diferentes alcaloides.
Además de las plantas, los alcaloides se encuentran en ciertos tipos de hongos, como la psilocibina en el hongo del género Psilocybe, y en los animales, como la bufotenina en la piel de algunos sapos y una serie de insectos, marcadamente hormigas. Muchos organismos marinos también contienen alcaloides. Algunas aminas, como la adrenalina y la serotonina, que desempeñan un papel importante en los animales superiores, son similares a los alcaloides en su estructura y biosíntesis y, en ocasiones, se denominan alcaloides.
Extracción
Debido a la diversidad estructural de los alcaloides, no existe un método único para su extracción a partir de materias primas naturales. La mayoría de los métodos explotan la propiedad de la mayoría de los alcaloides de ser solubles en solventes orgánicos pero no en agua, y la tendencia opuesta de sus sales.
La mayoría de las plantas contienen varios alcaloides. Su mezcla se extrae primero y luego se separan los alcaloides individuales. Las plantas se muelen completamente antes de la extracción. La mayoría de los alcaloides están presentes en las plantas crudas en forma de sales de ácidos orgánicos. Los alcaloides extraídos pueden permanecer como sales o convertirse en bases. La extracción de bases se logra procesando la materia prima con soluciones alcalinas y extrayendo las bases alcaloides con solventes orgánicos, como 1,2-dicloroetano, cloroformo, éter dietílico o benceno. Luego, las impurezas son disueltas por ácidos débiles; esto convierte las bases de los alcaloides en sales que se lavan con agua. Si es necesario, una solución acuosa de sales de alcaloides se alcaliniza nuevamente y se trata con un solvente orgánico. El proceso se repite hasta lograr la pureza deseada.
En la extracción ácida, la materia prima vegetal se procesa mediante una solución ácida débil (por ejemplo,, ácido acético en agua, etanol o metanol). Luego se agrega una base para convertir los alcaloides en formas básicas que se extraen con solvente orgánico (si la extracción se realizó con alcohol, primero se elimina y el resto se disuelve en agua). La solución se purifica como se ha descrito anteriormente.
Los alcaloides se separan de su mezcla utilizando su diferente solubilidad en ciertos solventes y su diferente reactividad con ciertos reactivos o por destilación.
Se identifican varios alcaloides de los insectos, entre los cuales los alcaloides del veneno de las hormigas bravas conocidos como solenopsinas han recibido mayor atención por parte de los investigadores. Estos alcaloides de insectos se pueden extraer de manera eficiente mediante inmersión en disolvente de hormigas de fuego vivas o mediante centrifugación de hormigas vivas seguida de purificación por cromatografía en gel de sílice. El seguimiento y la dosificación de los alcaloides de la hormiga solenopsina extraídos se ha descrito como posible en función de su pico de absorbancia de alrededor de 232 nanómetros.
Biosíntesis
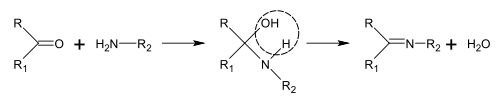
Los precursores biológicos de la mayoría de los alcaloides son los aminoácidos, como la ornitina, la lisina, la fenilalanina, la tirosina, el triptófano, la histidina, el ácido aspártico y el ácido antranílico. El ácido nicotínico se puede sintetizar a partir de triptófano o ácido aspártico. Las formas de biosíntesis de alcaloides son demasiado numerosas y no se pueden clasificar fácilmente. Sin embargo, existen algunas reacciones típicas involucradas en la biosíntesis de varias clases de alcaloides, incluida la síntesis de bases de Schiff y la reacción de Mannich.
Síntesis de bases de Schiff
Las bases de Schiff se pueden obtener haciendo reaccionar aminas con cetonas o aldehídos. Estas reacciones son un método común para producir enlaces C=N.
En la biosíntesis de alcaloides, tales reacciones pueden tener lugar dentro de una molécula, como en la síntesis de piperidina:
Reacción de Mannich
Un componente integral de la reacción de Mannich, además de una amina y un compuesto de carbonilo, es un carbanión, que desempeña el papel de nucleófilo en la adición nucleófila al ion formado por la reacción de la amina y el carbonilo.
La reacción de Mannich puede proceder tanto intermolecular como intramolecularmente:
Alcaloides dímeros
Además de los alcaloides monoméricos descritos anteriormente, también hay alcaloides diméricos, e incluso triméricos y tetrámeros formados por condensación de dos, tres y cuatro alcaloides monoméricos. Los alcaloides diméricos generalmente se forman a partir de monómeros del mismo tipo a través de los siguientes mecanismos:
- Reacción Mannich, resultando en, Por ejemplo., voacamine
- Reacción de Michael (villalestonina)
- Condena de aldehídos con aminas (toxiferina)
- Adiciones oxidativas de fenoles (dauricina, tubocurarina)
- Lactonización (carpana).
También hay alcaloides diméricos formados a partir de dos monómeros distintos, como los alcaloides de vinca vinblastina y vincristina, que se forman a partir del acoplamiento de catarantina y vindolina. El nuevo agente quimioterapéutico semisintético vinorelbina se usa en el tratamiento del cáncer de pulmón de células no pequeñas. Es otro dímero derivado de la vindolina y la catarantina y se sintetiza a partir de la anhidrovinblastina, a partir de la leurosina o de los propios monómeros.
Función biológica
Los alcaloides se encuentran entre los metabolitos secundarios más importantes y mejor conocidos, es decir, sustancias biogénicas que no participan directamente en el crecimiento, el desarrollo o la reproducción normales del organismo. En cambio, generalmente median interacciones ecológicas, lo que puede producir una ventaja selectiva para el organismo al aumentar su capacidad de supervivencia o fecundidad. En algunos casos, su función, si la hay, sigue sin estar clara. Una hipótesis temprana, que los alcaloides son los productos finales del metabolismo del nitrógeno en las plantas, como lo son la urea y el ácido úrico en los mamíferos, fue refutada por el hallazgo de que su concentración fluctúa en lugar de aumentar constantemente.
La mayoría de las funciones conocidas de los alcaloides están relacionadas con la protección. Por ejemplo, el alcaloide aporfina liriodenina producido por el tulipán lo protege de los hongos parásitos. Además, la presencia de alcaloides en la planta impide que insectos y animales cordados la coman. Sin embargo, algunos animales están adaptados a los alcaloides e incluso los utilizan en su propio metabolismo. Sustancias relacionadas con alcaloides como la serotonina, la dopamina y la histamina son neurotransmisores importantes en los animales. También se sabe que los alcaloides regulan el crecimiento de las plantas. Un ejemplo de un organismo que usa alcaloides para protegerse es la Utetheisa ornatrix, más comúnmente conocida como la polilla ornamentada. Los alcaloides de pirrolizidina hacen que estas larvas y polillas adultas sean desagradables para muchos de sus enemigos naturales, como los escarabajos coccinélidos, las crisopas verdes, los hemípteros insectívoros y los murciélagos insectívoros. Otro ejemplo de la utilización de alcaloides ocurre en la polilla venenosa de la cicuta (Agonopterix alstroemeriana). Esta polilla se alimenta de su planta hospedera altamente tóxica y rica en alcaloides, la cicuta venenosa (Conium maculatum). durante su estado larvario. A. alstroemeriana puede beneficiarse doblemente de la toxicidad de los alcaloides naturales, tanto a través de la falta de sabor de la especie para los depredadores como a través de la capacidad de A. alstroemeriana para reconocer Conium maculatum como el lugar correcto para la oviposición. Se ha demostrado que un alcaloide del veneno de la hormiga de fuego conocido como solenopsina protege a las reinas de las hormigas de fuego invasoras durante la fundación de nuevos nidos, desempeñando así un papel central en la propagación de esta especie de hormiga plaga en todo el mundo.
Aplicaciones
En medicina
El uso médico de plantas que contienen alcaloides tiene una larga historia y, por lo tanto, cuando se aislaron los primeros alcaloides en el siglo XIX, inmediatamente encontraron aplicación en la práctica clínica. Muchos alcaloides todavía se usan en medicina, generalmente en forma de sales ampliamente utilizadas, incluidos los siguientes:
| Alkaloid | Medida |
|---|---|
| Ajmaline | antiarritmico |
| Emetine | agente antiprotozoal,
Emesis |
| Ergot alkaloids | Vasoconstriction, alucinógeno, Uterotónico |
| Glaucine | Antitusivo |
| Morphine | Analgésico |
| Nicotina | Agonista estimulante, receptor de acetilcolina nicotínica |
| Fisostigmina | inhibidor de la acetilcolinesterasa |
| Quinidine | Antiarritmico |
| Quinine | Antipiretismo, antimalarial |
| Reserpine | antihipertensivo |
| Tubocurarine | relajante muscular |
| Vinblastine, vincristine | antitumor |
| Vincamine | vasodilatación, antihipertensivo |
| Yohimbine | estimulante, afrodisíaco |
Muchas drogas sintéticas y semisintéticas son modificaciones estructurales de los alcaloides, que fueron diseñadas para mejorar o cambiar el efecto principal de la droga y reducir los efectos secundarios no deseados. Por ejemplo, la naloxona, un antagonista de los receptores opioides, es un derivado de la tebaína que está presente en el opio.
En agricultura
Antes del desarrollo de una amplia gama de pesticidas sintéticos relativamente poco tóxicos, algunos alcaloides, como las sales de nicotina y anabasina, se usaban como insecticidas. Su uso estaba limitado por su alta toxicidad para los humanos.
Uso como drogas psicoactivas
Las preparaciones de plantas que contienen alcaloides y sus extractos, y más tarde alcaloides puros, se han utilizado durante mucho tiempo como sustancias psicoactivas. La cocaína, la cafeína y la catinona son estimulantes del sistema nervioso central. La mescalina y muchos alcaloides del indol (como la psilocibina, la dimetiltriptamina y la ibogaína) tienen efectos alucinógenos. La morfina y la codeína son fuertes analgésicos narcóticos.
Hay alcaloides que no tienen un fuerte efecto psicoactivo por sí mismos, pero son precursores de las drogas psicoactivas semisintéticas. Por ejemplo, la efedrina y la pseudoefedrina se utilizan para producir metcatinona y metanfetamina. La tebaína se utiliza en la síntesis de muchos analgésicos como la oxicodona.
Notas explicativas
- ^ En la penúltima frase de su artículo, W. Meissner (1819) "Über Pflanzenalkalien: II. Über ein neues Pflanzenalkali (Alkaloid)" (En planta alkalis: II. En una nueva planta alkali (alkaloide)), Journal für Chemie und Physik, 25: 379–381; disponible en línea en: Hathi Trust – Meissner escribió: "Überhaupt scheint es mir auch angemessen, die bis jetzt bekannten Pflanzenstoffe nicht mit dem Namen Alkalien, sondern Alkaloide zu belegen, da sie doch in manchen Eigenschaften von den Alkalien sehr abweichen, sie würden daher in dem Abschnitt der Pflanzenchemie vor den Pflanzensäuren ihre Stelleciden." (I.e., "En general, parece apropiado para mí
Referencias generales y citadas
- Aniszewski, Tadeusz (2007). Alkaloids: secretos de la vida. Amsterdam: Elsevier. ISBN 978-0-444-52736-3.
- Begley, Tadhg P. (2009). Enciclopedia de Biología Química. ChemBioChem. Vol. 10. Wiley. págs. 1569 a 1570. doi:10.1002/cbic.200900262. ISBN 978-0-471-75477-0.
- Brossi, Arnold (1989). Los Alcaloides: Química y Farmacología. Prensa Académica.
- Dewick, Paul M. (2002). Medicina natural Productos: A Biosynthetic Approach (Segunda edición). Wiley. ISBN 978-0-471-49640-3.
- Fattorusso, E.; Taglialatela-Scafati, O. (2008). Alcaloides modernos: Estructura, Isolación, Síntesis y Biología. Wiley-VCH. ISBN 978-3-527-31521-5.
- Grinkevich NI; Safronich LN, eds. (1983). El análisis químico de plantas medicinales (en ruso). Moscú: Vysshaya Shkola.
- Hesse, Manfred (2002). Alkaloids: ¿La maldición o la bendición de la naturaleza?. Wiley-VCH. ISBN 978-3-906390-24-6.
- Knunyants, IL (1988). Enciclopedia química. Enciclopedia soviética.
- Orekhov, AP (1955). Alcaloides de química (Acad. 2nd ed.). Moscú.
- Plemenkov, VV (2001). Introducción a la química de compuestos naturales. Kazan.
- Saxton, J. E. (1971). The Alkaloids: A Specialist Periodical Report. Londres: The Chemical Society.
- Veselovskaya, N. B.; Kovalenko, A. E. (2000). Drogas. Moscú: Triada-X.
- Wink, M (2009). "Modo de acción y toxicología de las toxinas vegetales y plantas venenosas". Mitt. Julius Kühn-Inst. 421: 93–112x.
Contenido relacionado
Extremófilo
Lumbricus terrestris
Electrólito