Acuaporina
Acuaporinas, también llamadas canales de agua, son proteínas de canal de una familia más grande de proteínas intrínsecas principales que forman poros en la membrana de las células biológicas, facilitando principalmente el transporte de agua. entre celdas Las membranas celulares de una variedad de diferentes bacterias, hongos, células animales y vegetales contienen acuaporinas a través de las cuales el agua puede fluir más rápidamente dentro y fuera de la célula que al difundirse a través de la bicapa de fosfolípidos. Las acuaporinas tienen seis dominios helicoidales alfa que atraviesan la membrana con terminales carboxílicos y amino en el lado citoplasmático. Dos bucles hidrofóbicos contienen asparagina-prolina-alanina conservada ('motivo NPA') que forman un barril que rodea una región similar a un poro central que contiene densidad de proteína adicional. Debido a que las acuaporinas generalmente siempre están abiertas y prevalecen en casi todos los tipos de células, esto lleva a la idea errónea de que el agua pasa fácilmente a través de la membrana celular a favor de su gradiente de concentración. El agua puede atravesar la membrana celular por difusión simple al ser una molécula pequeña, y por ósmosis, en los casos en que la concentración de agua en el exterior de la célula es mayor que en el interior. Sin embargo, debido a que el agua es una molécula polar, este proceso de difusión simple es relativamente lento, y en tejidos con alta permeabilidad al agua, la mayor parte del agua pasa a través de la acuaporina.
El Premio Nobel de Química de 2003 fue otorgado conjuntamente a Peter Agre por el descubrimiento de las acuaporinas ya Roderick MacKinnon por su trabajo sobre la estructura y el mecanismo de los canales de potasio.
Los defectos genéticos relacionados con los genes de las acuaporinas se han asociado con varias enfermedades humanas, como la diabetes insípida nefrogénica y la neuromielitis óptica.
Historia
El mecanismo de transporte de agua facilitado y la existencia probable de poros de agua ha atraído a investigadores desde 1957. En la mayoría de las células, el agua entra y sale por ósmosis a través del componente lipídico de las membranas celulares. Debido a la permeabilidad al agua relativamente alta de algunas células epiteliales, durante mucho tiempo se sospechó que debía existir algún mecanismo adicional para el transporte de agua a través de las membranas. Solomon y sus colaboradores realizaron un trabajo pionero sobre la permeabilidad al agua a través de la membrana celular a fines de la década de 1950. A mediados de la década de 1960, una hipótesis alternativa (el 'modelo de partición-difusión') buscaba establecer que las moléculas de agua se repartían entre la fase acuosa y la fase lipídica y luego se difundían a través de la membrana, atravesándola hasta la siguiente. interfase donde dejaron el lípido y volvieron a una fase acuosa. Estudios de Parisi, Edelman, Carvounis et al. acentuó no sólo la importancia de la presencia de canales de agua sino también la posibilidad de regular sus propiedades de permeabilidad. En 1990, los experimentos de Verkman demostraron la expresión funcional de los canales de agua, lo que indica que los canales de agua son efectivamente proteínas.
Descubrimiento
No fue hasta 1992 que la primera acuaporina, 'aquaporin-1' (originalmente conocido como CHIP 28), fue informado por Peter Agre, de la Universidad Johns Hopkins. En 1999, junto con otros equipos de investigación, Agre reportó las primeras imágenes de alta resolución de la estructura tridimensional de una acuaporina, a saber, la acuaporina-1. Otros estudios que utilizaron simulaciones de supercomputadoras identificaron la ruta del agua a medida que se movía a través del canal y demostraron cómo un poro puede permitir que el agua pase sin el paso de pequeños solutos. La investigación pionera y el posterior descubrimiento de los canales de agua por parte de Agre y sus colegas le valieron a Agre el Premio Nobel de Química en 2003. Agre dijo que descubrió las acuaporinas 'por casualidad'. Había estado estudiando los antígenos del grupo sanguíneo Rh y había aislado la molécula Rh, pero seguía apareciendo una segunda molécula, de 28 kilodaltons de tamaño (y por lo tanto llamada 28K). Al principio pensaron que era un fragmento de molécula Rh, o un contaminante, pero resultó ser un nuevo tipo de molécula con función desconocida. Estaba presente en estructuras como los túbulos renales y los glóbulos rojos, y se relacionaba con proteínas de diversos orígenes, como en el cerebro de la mosca de la fruta, las bacterias, el cristalino del ojo y el tejido vegetal.
Sin embargo, el primer informe sobre el transporte de agua mediado por proteínas a través de las membranas fue realizado por Gheorghe Benga y otros en 1986, antes de la primera publicación de Agre sobre el tema. Esto dio lugar a la controversia de que el trabajo de Benga no había sido reconocido adecuadamente ni por Agre ni por el Comité del Premio Nobel.
Función

Las acuaporinas son "el sistema de plomería de las células". El agua se mueve a través de las células de forma organizada, más rápidamente en los tejidos que tienen canales de agua de acuaporina. Durante muchos años, los científicos asumieron que el agua se filtraba a través de la membrana celular y algo de agua lo hace. Sin embargo, esto no explicaba cómo el agua podía moverse tan rápido a través de algunas células.
Las acuaporinas conducen selectivamente las moléculas de agua dentro y fuera de la célula, al tiempo que evitan el paso de iones y otros solutos. También conocidas como canales de agua, las acuaporinas son proteínas integrales de los poros de la membrana. Algunas de ellas, conocidas como acuagliceroporinas, también transportan otras pequeñas moléculas disueltas sin carga, como amoníaco, CO2, glicerol y urea. Por ejemplo, el canal de acuaporina 3 tiene un ancho de poro de 8 a 10 Ångströms y permite el paso de moléculas hidrofílicas que oscilan entre 150 y 200 Da. Sin embargo, los poros de agua bloquean por completo los iones, incluidos los protones, esenciales para conservar la diferencia de potencial electroquímico de la membrana.
Las moléculas de agua atraviesan el poro del canal en fila india. La presencia de canales de agua aumenta la permeabilidad de la membrana al agua. Estos también son esenciales para el sistema de transporte de agua en las plantas y la tolerancia al estrés por sequía y sal.
Estructura


Las proteínas acuaporinas están compuestas por un haz de seis hélices α transmembrana. Están incrustados en la membrana celular. Los extremos amino y carboxilo miran hacia el interior de la célula. Las mitades amino y carboxilo se parecen entre sí, aparentemente repitiendo un patrón de nucleótidos. Esto puede haber sido creado por la duplicación de un gen que anteriormente tenía la mitad del tamaño. Entre las hélices hay cinco regiones (A – E) que entran o salen de la membrana celular, dos de ellas hidrofóbicas (B, E), con un patrón de asparagina-prolina-alanina ("motivo NPA"). Crean una forma distintiva de reloj de arena, haciendo que el canal de agua se estreche en el medio y se ensanche en cada extremo.
Otro lugar, incluso más estrecho, en el canal AQP1 es el 'filtro de selectividad ar/R', un grupo de aminoácidos que permite que la acuaporina deje pasar o bloquee selectivamente el paso de diferentes moléculas.
Las acuaporinas forman grupos de cuatro partes (tetrámeros) en la membrana celular, y cada uno de los cuatro monómeros actúa como un canal de agua. Las diferentes acuaporinas tienen canales de agua de diferentes tamaños, los tipos más pequeños solo permiten el paso del agua.
Los perfiles de rayos X muestran que las acuaporinas tienen dos entradas cónicas. Esta forma de reloj de arena podría ser el resultado de un proceso de selección natural hacia una permeabilidad óptima. Se ha demostrado que las entradas cónicas con un ángulo de apertura adecuado pueden proporcionar un gran aumento de la permeabilidad del canal hidrodinámico.
Motivo NPA
Los canales de acuaporina aparecen en las simulaciones para permitir que solo pase el agua, ya que las moléculas se alinean efectivamente en una sola fila. Guiado por el campo eléctrico local de la acuaporina, el oxígeno de cada molécula de agua mira hacia delante cuando entra, girando a mitad de camino y saliendo con el oxígeno mirando hacia atrás. La disposición de potenciales electrostáticos opuestos en las dos mitades del canal evita el flujo de protones pero permite que el agua pase libremente.
Filtro de selectividad Ar/R
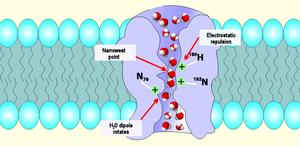
El aromático/arginina o "ar/R" El filtro de selectividad es un grupo de aminoácidos que ayudan a unirse a las moléculas de agua y excluyen otras moléculas que pueden intentar ingresar al poro. Es el mecanismo por el cual la acuaporina es capaz de unirse selectivamente a las moléculas de agua para permitirles el paso y evitar que entren otras moléculas. El filtro ar/R está formado por dos grupos de aminoácidos de las hélices B (HB) y E (HE) y dos grupos del bucle E (LE1, LE2), de los dos lados del motivo NPA. Su posición habitual es de 8 Å en el lado exterior del motivo NPA; es típicamente la parte más estrecha del canal. Su estrechez debilita los enlaces de hidrógeno entre las moléculas de agua, lo que permite que las argininas, que tienen una carga positiva, interactúen con las moléculas de agua y filtren los protones no deseados.
Distribución taxonómica
En mamíferos
Hay trece tipos conocidos de acuaporinas en mamíferos; seis de ellos se localizan en el riñón, pero se sospecha la existencia de muchos más. Las acuaporinas más estudiadas se comparan en la siguiente tabla:
| Tipo | Ubicación | Función |
|---|---|---|
| Aquaporin 1 |
| Reabsorción del agua |
| Aquaporin 2 |
| Reabsorción del agua en respuesta a la ADH |
| Aquaporin 3 |
| Reabsorción del agua y permeabilidad del glicerol |
| Aquaporin 4 |
| Reabsorción del agua |
En plantas
En las plantas, el agua se extrae del suelo a través de las raíces, donde pasa de la corteza a los tejidos vasculares. Hay tres rutas para que el agua fluya en estos tejidos, conocidas como vías apoplástica, simplástica y transcelular. En concreto, las acuaporinas se encuentran en la membrana vacuolar, además de la membrana plasmática de las plantas; la vía transcelular implica el transporte de agua a través del plasma y las membranas vacuolares. Cuando las raíces de las plantas están expuestas al cloruro de mercurio, que se sabe que inhibe las acuaporinas, el flujo de agua se reduce considerablemente mientras que el flujo de iones no, lo que respalda la idea de que existe un mecanismo para el transporte de agua independiente del transporte de iones: las acuaporinas.. Las acuaporinas pueden desempeñar un papel importante en el crecimiento de la extensión al permitir la entrada de agua en las células en expansión, un proceso necesario para mantener el desarrollo de la planta. Las acuaporinas vegetales son importantes para la nutrición mineral y la desintoxicación de iones; ambos son esenciales para la homeostasis de minerales como el boro.
Las acuaporinas en las plantas se dividen en cuatro subfamilias o grupos homólogos principales:
- Membrana de plasma Proteína intrínseca (PIP)
- Proteína intrínseca de tonoplast (TIP)
- Nodulina-26 como Proteína Intrínseca (NIP)
- Proteína Intrínseca Pequeña (SIP)
Estas cinco subfamilias se han dividido posteriormente en subgrupos evolutivos más pequeños en función de su secuencia de ADN. Los PIP se agrupan en dos subgrupos, PIP1 y PIP2, mientras que los TIP se agrupan en 5 subgrupos, TIP1, TIP2, TIP3, TIP4 y TIP5. Cada subgrupo se divide nuevamente en isoformas, p. PIP1;1, PIP1;2. Dado que la nomenclatura de las isoformas se basa históricamente en parámetros funcionales más que evolutivos, han surgido varias propuestas novedosas sobre las acuaporinas vegetales con el estudio de las relaciones evolutivas entre las diferentes acuaporinas. Dentro de la variada selección de isoformas de acuaporina en las plantas, también existen patrones únicos de expresión específica de células y tejidos.
Cuando se silencian las acuaporinas vegetales, la conductancia hidráulica y la fotosíntesis de la hoja disminuyen. Cuando se produce la activación de las acuaporinas vegetales, se detiene el flujo de agua a través del poro de la proteína. Esto puede ocurrir por varias razones, por ejemplo, cuando la planta contiene bajas cantidades de agua celular debido a la sequía. La activación de una acuaporina se lleva a cabo mediante una interacción entre un mecanismo de activación y la acuaporina, lo que provoca un cambio 3D en la proteína que bloquea el poro y, por lo tanto, impide el flujo de agua a través del poro. En las plantas, hay al menos dos formas de activación de la acuaporina: activación por desfosforilación de ciertos residuos de serina, en respuesta a la sequía, y la protonación de residuos específicos de histidina, en respuesta a las inundaciones. La fosforilación de una acuaporina está involucrada en la apertura y cierre de los pétalos en respuesta a la temperatura.
Did you mean:In Heterokonts
Se han encontrado acuaporinas específicas llamadas proteínas intrínsecas grandes (LIP) en heterocontos, incluidas las diatomeas y las algas pardas. Los LIP contienen un motivo NPM en lugar del segundo motivo NPA conservado típico de la mayoría de los MIP.
En otros organismos
Se han descubierto acuaporinas en los hongos Saccharomyces cerevisiae (levadura), Dictyostelium, Candida y Ustilago y los protozoos Trypanosoma y Plasmodium.
Importancia clínica
Ha habido dos ejemplos claros de enfermedades identificadas como resultado de mutaciones en las acuaporinas: las mutaciones en el gen de la acuaporina-2 causan diabetes insípida nefrogénica hereditaria en humanos, mientras que los ratones homocigotos para inactivar mutaciones en el gen de la acuaporina-0 desarrollan cataratas congénitas. Se ha identificado un pequeño número de personas con deficiencia grave o total de acuaporina-1. Son, en general, sanos, pero presentan un defecto en la capacidad de concentrar solutos en la orina y de conservar agua cuando se les priva de agua potable. Los ratones con deleciones específicas en acuaporina-1 también exhiben una deficiencia en la conservación de agua debido a la incapacidad de concentrar solutos en la médula renal por multiplicación a contracorriente. Las acuaporinas juegan un papel clave en las formas adquiridas de diabetes insípida nefrogénica, trastornos que provocan un aumento de la producción de orina. La acuaporina 2 está regulada por la vasopresina que, cuando se une al receptor de la superficie celular, activa la vía de señalización del AMPc. Esto da como resultado vesículas que contienen acuaporina-2 para aumentar la absorción de agua y volver a la circulación. La mutación del receptor de vasopresina acuaporina 2 es una causa de diabetes insípida adquirida. En ratas, la diabetes insípida nefrogénica adquirida puede ser causada por una regulación deficiente de la acuaporina-2 debido a la administración de sales de litio, concentraciones bajas de potasio en la sangre (hipopotasemia) y concentraciones altas de calcio en la sangre (hipercalcemia). Las reacciones autoinmunes contra la acuaporina 4 en humanos producen la enfermedad de Devic. Si la acuaporina pudiera manipularse, eso podría resolver problemas médicos como la retención de líquidos en enfermedades cardíacas y el edema cerebral después de un accidente cerebrovascular.
Contenido relacionado
Alejandro Luria
Yodoformo
Desfibrilador externo automatizado