Actina
La actina es una familia de proteínas multifuncionales globulares que forman microfilamentos en el citoesqueleto y los filamentos delgados en las fibrillas musculares. Se encuentra esencialmente en todas las células eucariotas, donde puede estar presente en una concentración de más de 100 μM; su masa es de aproximadamente 42 kDa, con un diámetro de 4 a 7 nm.
Una proteína de actina es la subunidad monomérica de dos tipos de filamentos en las células: los microfilamentos, uno de los tres componentes principales del citoesqueleto, y los filamentos delgados, parte del aparato contráctil de las células musculares. Puede estar presente como un monómero libre llamado actina G (globular) o como parte de un microfilamento de polímero lineal llamado actina F (filamentoso), los cuales son esenciales para funciones celulares tan importantes como la movilidad y la contracción de las células durante división celular.
La actina participa en muchos procesos celulares importantes, incluida la contracción muscular, la motilidad celular, la división celular y la citocinesis, el movimiento de vesículas y orgánulos, la señalización celular y el establecimiento y mantenimiento de las uniones celulares y la forma celular. Muchos de estos procesos están mediados por interacciones extensas e íntimas de la actina con las membranas celulares.En los vertebrados, se han identificado tres grupos principales de isoformas de actina, alfa, beta y gamma. Las actinas alfa, que se encuentran en los tejidos musculares, son un componente principal del aparato contráctil. Las actinas beta y gamma coexisten en la mayoría de los tipos de células como componentes del citoesqueleto y como mediadores de la motilidad celular interna. Se cree que la diversa gama de estructuras formadas por la actina que le permite cumplir una gran variedad de funciones está regulada por la unión de la tropomiosina a lo largo de los filamentos.
La capacidad de una célula para formar microfilamentos dinámicamente proporciona el andamiaje que le permite remodelarse rápidamente en respuesta a su entorno o a las señales internas del organismo, por ejemplo, para aumentar la absorción de la membrana celular o aumentar la adhesión celular para formar tejido celular. Otras enzimas u orgánulos, como los cilios, pueden anclarse a este andamiaje para controlar la deformación de la membrana celular externa, lo que permite la endocitosis y la citocinesis. También puede producir movimiento por sí mismo o con la ayuda de motores moleculares. Por lo tanto, la actina contribuye a procesos como el transporte intracelular de vesículas y orgánulos, así como a la contracción muscular y la migración celular. Por lo tanto, juega un papel importante en la embriogénesis, la cicatrización de heridas y la invasividad de las células cancerosas.Los homólogos de actina de procariotas y arqueas se polimerizan en diferentes filamentos helicoidales o lineales que constan de una o varias hebras. Sin embargo, los contactos en la hebra y los sitios de unión de nucleótidos se conservan en procariotas y arqueas. Por último, la actina juega un papel importante en el control de la expresión génica.
Un gran número de enfermedades y padecimientos están causados por mutaciones en alelos de los genes que regulan la producción de actina o de sus proteínas asociadas. La producción de actina también es clave en el proceso de infección por algunos microorganismos patógenos. Las mutaciones en los diferentes genes que regulan la producción de actina en humanos pueden causar enfermedades musculares, variaciones en el tamaño y función del corazón, así como sordera. La composición del citoesqueleto también está relacionada con la patogenicidad de bacterias y virus intracelulares, particularmente en los procesos relacionados con la evasión de las acciones del sistema inmunológico.
Función
El papel principal de la actina en la célula es formar polímeros lineales llamados microfilamentos que cumplen varias funciones en la estructura de la célula, las redes de tráfico, la migración y la replicación. El papel multifacético de la actina se basa en algunas de las propiedades de los microfilamentos: en primer lugar, la formación de filamentos de actina es reversible y su función a menudo implica una rápida polimerización y despolimerización. En segundo lugar, los microfilamentos están polarizados, es decir, los dos extremos de un filamento son distintos entre sí. En tercer lugar, los filamentos de actina pueden unirse a muchas otras proteínas, que juntas ayudan a modificar y organizar los microfilamentos para sus diversas funciones.
En la mayoría de las células, los filamentos de actina forman redes a gran escala que son esenciales para muchas funciones clave:
- Las redes de actina brindan soporte mecánico a las células y proporcionan rutas de tráfico a través del citoplasma para ayudar a la transducción de señales.
- El montaje y desmontaje rápido de la red de actina permite que las células migren (Migración celular).
La actina es extremadamente abundante en la mayoría de las células y comprende del 1 al 5% de la masa proteica total de la mayoría de las células y del 10% de las células musculares.
La proteína actina se encuentra tanto en el citoplasma como en el núcleo celular. Su ubicación está regulada por vías de transducción de señales de la membrana celular que integran los estímulos que recibe una célula estimulando la reestructuración de las redes de actina en respuesta.
Citoesqueleto
Hay varios tipos diferentes de actina con estructuras y funciones ligeramente diferentes. La α-actina se encuentra exclusivamente en las fibras musculares, mientras que la β-actina y la γ-actina se encuentran en otras células. Dado que los últimos tipos tienen una alta tasa de rotación, la mayoría de ellos se encuentran fuera de las estructuras permanentes. Los microfilamentos que se encuentran en células distintas de las musculares están presentes en tres formas:
- Redes de microfilamentos: las células animales suelen tener una corteza celular debajo de la membrana celular que contiene una gran cantidad de microfilamentos, lo que impide la presencia de orgánulos. Esta red está conectada con numerosos receptores que transmiten señales al exterior de una célula.
- Anillos de actina periódicos: en los axones se encuentra una estructura periódica construida con anillos de actina espaciados uniformemente. En esta estructura, los anillos de actina, junto con los tetrámeros de espectrina que unen los anillos de actina vecinos, forman un citoesqueleto cohesivo que sostiene la membrana del axón. La periodicidad de la estructura también puede regular los canales de iones de sodio en los axones.
Levaduras
El citoesqueleto de actina es clave en los procesos de endocitosis, citocinesis, determinación de la polaridad celular y morfogénesis en levaduras. Además de depender de la actina, estos procesos involucran 20 o 30 proteínas asociadas, todas las cuales tienen un alto grado de conservación evolutiva, junto con muchas moléculas de señalización. Juntos, estos elementos permiten un ensamblaje modulado espacial y temporalmente que define la respuesta de una célula a los estímulos internos y externos.
Las levaduras contienen tres elementos principales asociados con la actina: parches, cables y anillos. A pesar de no estar presentes por mucho tiempo, estas estructuras están sujetas a un equilibrio dinámico debido a la polimerización y despolimerización continuas. Poseen una serie de proteínas accesorias que incluyen ADF/cofilina, que tiene un peso molecular de 16 kDa y está codificada por un solo gen, llamado COF1; Aip1, un cofactor de cofilina que promueve el desensamblaje de los microfilamentos; Srv2/CAP, un regulador de procesos relacionado con las proteínas adenilato ciclasa; una profilina con un peso molecular de aproximadamente 14 kDa que está relacionada/asociada con los monómeros de actina; y twinfilin, una proteína de 40 kDa involucrada en la organización de los parches.
Plantas
Los estudios del genoma vegetal han revelado la existencia de isovariantes de proteínas dentro de la familia de genes de actina. Dentro de Arabidopsis thaliana, un organismo modelo, hay diez tipos de actina, seis profilinas y docenas de miosinas. Esta diversidad se explica por la necesidad evolutiva de poseer variantes que difieran ligeramente en su expresión temporal y espacial. La mayoría de estas proteínas se expresaron conjuntamente en el tejido analizado. Las redes de actina se distribuyen por todo el citoplasma de las células que han sido cultivadas in vitro. Hay una concentración de la red alrededor del núcleo que se conecta vía radios a la corteza celular, esta red es altamente dinámica, con una polimerización y despolimerización continua.
Aunque la mayoría de las células vegetales tienen una pared celular que define su morfología, sus microfilamentos pueden generar suficiente fuerza para lograr una serie de actividades celulares, como las corrientes citoplasmáticas generadas por los microfilamentos y la miosina. La actina también participa en el movimiento de los orgánulos y en la morfogénesis celular, lo que implica la división celular, así como el alargamiento y la diferenciación de la célula.
Las proteínas más destacadas asociadas al citoesqueleto de actina en las plantas incluyen: vilina, que pertenece a la misma familia que la gelsolina/severina y es capaz de cortar microfilamentos y unir monómeros de actina en presencia de cationes de calcio; la fimbrina, que es capaz de reconocer y unir monómeros de actina y que participa en la formación de redes (mediante un proceso de regulación diferente al de los animales y las levaduras); forminas, que son capaces de actuar como un agente de nucleación de polimerización de actina F; miosina, un motor molecular típico que es específico de los eucariotas y que en Arabidopsis thalianaestá codificado por 17 genes en dos clases distintas; CHUP1, que puede unirse a la actina y está implicado en la distribución espacial de los cloroplastos en la célula; KAM1/MUR3 que definen la morfología del aparato de Golgi así como la composición de xiloglucanos en la pared celular; NtWLIM1, que facilita la aparición de estructuras celulares de actina; y ERD10, que está involucrado en la asociación de orgánulos dentro de membranas y microfilamentos y que parece jugar un papel que está involucrado en la reacción de un organismo al estrés.
Actina nuclear
La actina nuclear fue notada y descrita por primera vez en 1977 por Clark y Merriam. Los autores describen una proteína presente en la fracción nuclear, obtenida de ovocitos de Xenopus laevis, que presenta las mismas características que la actina del músculo esquelético. Desde entonces, ha habido muchos informes científicos sobre la estructura y las funciones de la actina en el núcleo (para una revisión, consulte: Hofmann 2009). El nivel controlado de actina en el núcleo, su interacción con las proteínas de unión a actina (ABP) y la presencia de diferentes isoformas permite que la actina desempeñe un papel importante en muchos procesos nucleares importantes.
Transporte a través de la membrana nuclear
La secuencia de actina no contiene una señal de localización nuclear. El pequeño tamaño de la actina (alrededor de 43 kDa) le permite ingresar al núcleo por difusión pasiva. La importación de actina al núcleo (probablemente en un complejo con cofilina) se ve facilitada por la proteína de importación importina 9.
Los bajos niveles de actina en el núcleo parecen ser importantes, porque la actina tiene dos señales de exportación nuclear (NES) en su secuencia. La actina microinyectada se elimina rápidamente del núcleo al citoplasma. La actina se exporta al menos de dos formas, a través de la exportación 1 y la exportación 6. Las modificaciones específicas, como la SUMOilación, permiten la retención de actina nuclear. Una mutación que impide la SUMOilación provoca una rápida exportación de beta actina desde el núcleo.
Organización
La actina nuclear existe principalmente como monómero, pero también puede formar oligómeros dinámicos y polímeros cortos. La organización de actina nuclear varía en diferentes tipos de células. Por ejemplo, en los ovocitos de Xenopus (con un nivel de actina nuclear más alto en comparación con las células somáticas), la actina forma filamentos que estabilizan la arquitectura del núcleo. Estos filamentos se pueden observar al microscopio gracias a la tinción con faloidina conjugada con fluoróforo.
En los núcleos de células somáticas, sin embargo, los filamentos de actina no se pueden observar con esta técnica. El ensayo de inhibición de la DNasa I, la única prueba que permite la cuantificación de la actina polimerizada directamente en muestras biológicas, ha revelado que la actina nuclear endógena se presenta principalmente en forma monomérica.
El nivel de actina controlado con precisión en el núcleo celular, más bajo que en el citoplasma, evita la formación de filamentos. La polimerización también se ve reducida por el acceso limitado a los monómeros de actina, que se unen en complejos con ABP, principalmente cofilina.
Isoformas de actina
Diferentes isoformas de actina están presentes en el núcleo celular. El nivel de isoformas de actina puede cambiar en respuesta a la estimulación del crecimiento celular o la detención de la proliferación y la actividad transcripcional. La investigación sobre la actina nuclear se centra en la isoforma beta. Sin embargo, el uso de anticuerpos dirigidos contra diferentes isoformas de actina permite identificar no solo la beta citoplasmática en el núcleo celular, sino también alfa y gamma-actina en ciertos tipos de células. La presencia de diferentes isoformas de actina puede tener un efecto significativo en su función en los procesos nucleares, ya que el nivel de las isoformas individuales se puede controlar de forma independiente.
Funciones
Las funciones de la actina en el núcleo están asociadas con su capacidad para polimerizar e interactuar con varias ABP y con elementos estructurales del núcleo. La actina nuclear interviene en:
- Arquitectura del núcleo: la interacción de la actina con la espectrina alfa II y otras proteínas es importante para mantener la forma adecuada del núcleo.
- Transcripción: la actina participa en la reorganización de la cromatina, el inicio de la transcripción y la interacción con el complejo de transcripción. La actina participa en la regulación de la estructura de la cromatina, interactuando con la ARN polimerasa I, II y III. En la transcripción de Pol I, la actina y la miosina (MYO1C, que se une al ADN) actúan como un motor molecular. Para la transcripción de Pol II, se necesita β-actina para la formación del complejo de preiniciación. Pol III contiene β-actina como subunidad. La actina también puede ser un componente de los complejos de remodelación de la cromatina, así como de las partículas pre-mRNP (es decir, el ARN mensajero precursor agrupado en proteínas), y está involucrada en la exportación nuclear de ARN y proteínas.
- Regulación de la actividad génica: la actina se une a las regiones reguladoras de diferentes tipos de genes. La capacidad de la actina para regular la actividad génica se utiliza en el método de reprogramación molecular, que permite que las células diferenciadas vuelvan a su estado embrionario.
- Translocación del fragmento de cromosoma activado desde la región inferior de la membrana a la eucromatina donde comienza la transcripción. Este movimiento requiere la interacción de la actina y la miosina.
- Integración de diferentes compartimentos celulares. La actina es una molécula que integra vías de transducción de señales citoplasmáticas y nucleares. Un ejemplo es la activación de la transcripción en respuesta a la estimulación sérica de células in vitro.
- Respuesta inmunitaria: la actina nuclear se polimeriza con la estimulación del receptor de células T y es necesaria para la expresión de citoquinas y la producción de anticuerpos in vivo.
Debido a su capacidad para sufrir cambios conformacionales e interacción con muchas proteínas, la actina actúa como un regulador de la formación y actividad de complejos proteicos como el complejo transcripcional.
Movimiento celular
La actina también participa en el movimiento celular. Una red de filamentos de actina marca el borde delantero de una célula en movimiento, y la polimerización de nuevos filamentos de actina empuja la membrana celular hacia adelante en protuberancias llamadas lamelipodia. Estas protuberancias de la membrana luego se adhieren al sustrato, formando estructuras conocidas como adherencias focales que se conectan a la red de actina. Una vez adherido, la parte posterior del cuerpo celular se contrae y empuja su contenido hacia adelante más allá del punto de adhesión. Una vez que el punto de adhesión se ha movido hacia la parte trasera de la celda, la celda lo desarma, permitiendo que la parte trasera de la celda avance.
Movimiento actina/miosina
Además de la fuerza física generada por la polimerización de la actina, los microfilamentos facilitan el movimiento de varios componentes intracelulares al servir como vía a lo largo de la cual viaja una familia de proteínas motoras llamadas miosinas.
Contracción muscular
La actina juega un papel particularmente destacado en las células musculares, que consisten en gran parte en haces repetidos de actina y miosina II. Cada unidad repetida, llamada sarcómero, consta de dos conjuntos de hebras de actina F orientadas de manera opuesta ("filamentos delgados"), entrelazadas con haces de miosina ("filamentos gruesos"). Los dos conjuntos de cadenas de actina están orientados con sus extremos (+) incrustados en cualquiera de los extremos del sarcómero en estructuras delimitadoras denominadas discos Z. Las fibrillas de miosina están en el medio entre los conjuntos de filamentos de actina, con hebras orientadas en ambas direcciones. Cuando el músculo se contrae, los hilos de miosina se mueven a lo largo de los filamentos de actina hacia el extremo (+), juntando los extremos del sarcómero y acortándolo en alrededor del 70% de su longitud.Para moverse a lo largo del hilo de actina, la miosina debe hidrolizar ATP; por tanto, el ATP sirve como fuente de energía para la contracción muscular.
En los momentos de descanso, las proteínas tropomiosina y troponina se unen a los filamentos de actina, impidiendo la unión de la miosina. Cuando una señal de activación (es decir, un potencial de acción) llega a la fibra muscular, desencadena la liberación de Ca desde el retículo sarcoplásmico hacia el citosol. El pico resultante en el calcio citosólico libera rápidamente tropomiosina y troponina del hilo de actina, lo que permite que la miosina se una y comience la contracción muscular.
División celular
En las etapas finales de la división celular, muchas células forman un anillo de actina en el punto medio de la célula. Este anillo, acertadamente llamado "anillo contráctil", utiliza un mecanismo similar al de las fibras musculares, donde la miosina II tira del anillo de actina y hace que se contraiga. Esta contracción divide la célula madre en dos, completando la citocinesis. El anillo contráctil está compuesto por actina, miosina, anillina y α-actinina. En la levadura de fisión Schizosaccharomyces pombe, la actina se forma activamente en el anillo constrictor con la participación de Arp3, la formina Cdc12, profilin y WASp, junto con microfilamentos preformados. Una vez que se ha construido el anillo, la estructura se mantiene mediante un montaje y desmontaje continuo que, con la ayuda del complejo Arp2/3 y las forminas, es clave para uno de los procesos centrales de la citocinesis.
Tráfico intracelular
Los pares de actina-miosina también pueden participar en el tráfico de varias vesículas de membrana y orgánulos dentro de la célula. La miosina V se activa al unirse a varios receptores de carga en los orgánulos y luego se mueve a lo largo de un filamento de actina hacia el extremo (+), arrastrando su carga con él.
Estas miosinas no convencionales utilizan la hidrólisis de ATP para transportar carga, como vesículas y orgánulos, de forma dirigida mucho más rápido que la difusión. La miosina V camina hacia el extremo con púas de los filamentos de actina, mientras que la miosina VI camina hacia el extremo puntiagudo. La mayoría de los filamentos de actina están dispuestos con el extremo con púas hacia la membrana celular y el extremo puntiagudo hacia el interior celular. Este arreglo permite que la miosina V sea un motor efectivo para la exportación de cargas y la miosina VI sea un motor efectivo para la importación.
Otros procesos biológicos
La imagen tradicional de la función de la actina la relaciona con el mantenimiento del citoesqueleto y, por tanto, con la organización y movimiento de los orgánulos, así como con la determinación de la forma de una célula. Sin embargo, la actina tiene un papel más amplio en la fisiología de las células eucariotas, además de funciones similares en las procariotas.
- Apoptosis. Durante la muerte celular programada, la familia de proteasas ICE/ced-3 (una de las proteasas convertidoras de interleucina-1β) degrada la actina en dos fragmentos in vivo; uno de los fragmentos es de 15 kDa y el otro de 31 kDa. Esto representa uno de los mecanismos involucrados en la destrucción de la viabilidad celular que forma la base de la apoptosis. También se ha demostrado que la proteasa calpaína está implicada en este tipo de destrucción celular; al igual que se ha demostrado que el uso de inhibidores de calpaína disminuye la proteólisis de actina y la degradación del ADN (otro de los elementos característicos de la apoptosis).Por otro lado, el desencadenamiento de la apoptosis inducido por el estrés provoca la reorganización del citoesqueleto de actina (que también implica su polimerización), dando lugar a estructuras denominadas fibras de estrés; esto es activado por la vía MAP quinasa.
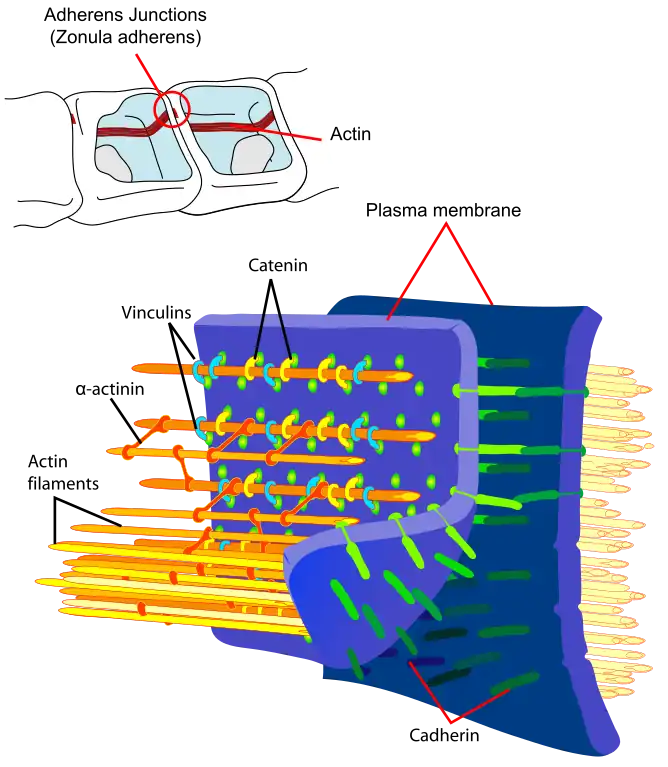
- Adhesión y desarrollo celular. La adhesión entre células es una característica de los organismos multicelulares que permite la especialización de los tejidos y por tanto aumenta la complejidad celular. La adhesión del epitelio celular involucra al citoesqueleto de actina en cada una de las células unidas, así como a las cadherinas que actúan como elementos extracelulares con la conexión entre los dos mediada por cateninas. Interferir en la dinámica de la actina tiene repercusiones en el desarrollo de un organismo, de hecho, la actina es un elemento tan crucial que los sistemas de genes redundantes están disponibles. Por ejemplo, si se ha eliminado el gen de la α-actinina o del factor de gelificación en Dictyosteliumlos individuos no presentan un fenotipo anómalo posiblemente debido a que cada una de las proteínas puede realizar la función de la otra. Sin embargo, se ve afectado el desarrollo de mutaciones dobles que carecen de ambos tipos de genes.
- Modulación de la expresión génica. El estado de polimerización de la actina afecta el patrón de expresión génica. En 1997 se descubrió que la despolimerización mediada por citocalasina D en las células de Schwann provoca un patrón específico de expresión de los genes implicados en la mielinización de este tipo de células nerviosas. Se ha demostrado que la actina F modifica el transcriptoma en algunas de las etapas de la vida de los organismos unicelulares, como el hongo Candida albicans. Además, las proteínas que son similares a la actina desempeñan un papel regulador durante la espermatogénesis en ratones y, en levaduras, se cree que las proteínas similares a la actina desempeñan un papel en la regulación de la expresión génica.De hecho, la actina es capaz de actuar como iniciador de la transcripción cuando reacciona con un tipo de miosina nuclear que interactúa con las ARN polimerasas y otras enzimas involucradas en el proceso de transcripción.
- Dinámica de los estereocilios. Algunas células desarrollan finas excrecencias filiformes en su superficie que tienen una función mecanosensorial. Por ejemplo, este tipo de orgánulo está presente en el Órgano de Corti, que se encuentra en el oído. La principal característica de estas estructuras es que se puede modificar su longitud. La arquitectura molecular de los estereocilios incluye un núcleo de actina paracristalino en equilibrio dinámico con los monómeros presentes en el citosol adyacente. Las miosinas tipo VI y VIIa están presentes en todo este núcleo, mientras que la miosina XVa está presente en sus extremos en cantidades proporcionales a la longitud de los estereocilios.
- Quiralidad intrínseca. Las redes de actomiosina se han implicado en la generación de una quiralidad intrínseca en células individuales. Las células que crecen en superficies quirales pueden mostrar un sesgo direccional izquierda/derecha que depende de la actomiosina.
Estructura
La actina celular tiene dos formas: glóbulos monoméricos llamados G-actina y filamentos poliméricos llamados F-actina o microfilamentos. Cada molécula de actina está unida a una molécula de trifosfato de adenosina (ATP) o difosfato de adenosina (ADP) que está asociada con un catión Mg. Las formas de actina más comúnmente encontradas, en comparación con todas las combinaciones posibles, son ATP-G-Actina y ADP-F-actina.
Actina G
La actina monomérica, o actina G, tiene una estructura globular que consta de dos lóbulos separados por una hendidura profunda. La parte inferior de la hendidura representa el "pliegue de ATPasa", una estructura conservada entre las proteínas de unión de ATP y GTP que se une a un ion de magnesio y una molécula de ATP. Se requiere la unión de ATP o ADP para estabilizar cada monómero de actina; sin una de estas moléculas unidas, la actina se desnaturaliza rápidamente.
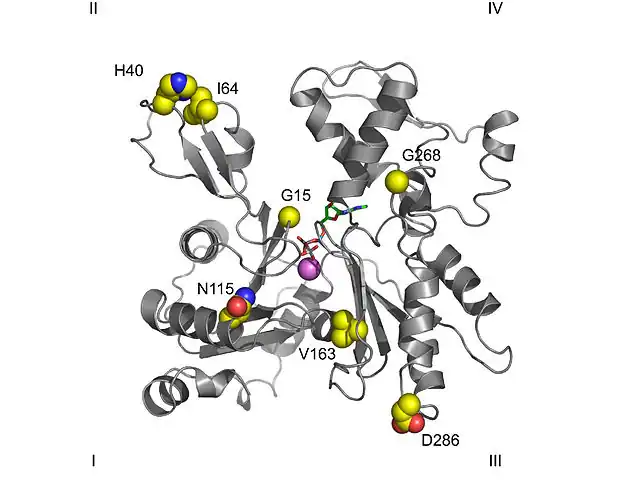
El modelo de cristalografía de rayos X de actina que Kabsch produjo a partir del tejido muscular estriado de conejos es el más utilizado en estudios estructurales, ya que fue el primero en ser purificado. La actina G cristalizada por Kabsch tiene un tamaño aproximado de 67 x 40 x 37 Å, una masa molecular de 41.785 Da y un punto isoeléctrico estimado de 4,8. Su carga neta a pH = 7 es -7.Estructura primaria
Elzinga y sus colaboradores determinaron por primera vez la secuencia peptídica completa para este tipo de actina en 1973, y el trabajo posterior del mismo autor agregó más detalles al modelo. Contiene 374 residuos de aminoácidos. Su extremo N es muy ácido y comienza con un aspartato acetilado en su grupo amino. Mientras que su C-terminal es alcalino y está formado por una fenilalanina precedida de una cisteína, que tiene un grado de importancia funcional. Ambos extremos están muy cerca dentro del subdominio I. Una N -metilhistidina anómala se encuentra en la posición 73.Estructura terciaria - dominios
La estructura terciaria está formada por dos dominios conocidos como el grande y el pequeño, los cuales están separados por una hendidura centrada alrededor de la ubicación del enlace con ATP-ADP+P i. Debajo de esto hay una muesca más profunda llamada "ranura". En el estado nativo, a pesar de sus nombres, ambos tienen una profundidad comparable.
La convención normal en estudios topológicos significa que una proteína se muestra con el dominio más grande en el lado izquierdo y el dominio más pequeño en el lado derecho. En esta posición, el dominio más pequeño se divide a su vez en dos: subdominio I (posición inferior, residuos 1 a 32, 70 a 144 y 338 a 374) y subdominio II (posición superior, residuos 33 a 69). El dominio más grande también se divide en dos: subdominio III (inferior, residuos 145–180 y 270–337) y subdominio IV (superior, residuos 181–269). Las áreas expuestas de los subdominios I y III se denominan extremos "con púas", mientras que las áreas expuestas de los dominios II y IV se denominan extremos "en punta". Esta nomenclatura se refiere al hecho de que, debido a la pequeña masa del subdominio La actina II es polar; la importancia de esto se discutirá más adelante en la discusión sobre la dinámica de ensamblaje.Otras estructuras importantes
La estructura supersecundaria más notable es una hoja beta de cinco cadenas que se compone de un meandro β y una unidad en el sentido de las agujas del reloj β-α-β. Está presente en ambos dominios, lo que sugiere que la proteína surgió de la duplicación de genes.
- El sitio de unión del nucleótido de adenosina se encuentra entre dos estructuras beta en forma de horquilla pertenecientes a los dominios I y III. Los residuos que están involucrados son Asp11-Lys18 y Asp154-His161 respectivamente.
- El sitio de unión del catión divalente se encuentra justo debajo del del nucleótido de adenosina. In vivo está formado con mayor frecuencia por Mg o Ca, mientras que in vitro está formado por una estructura quelante formada por Lys18 y dos oxígenos de los fosfatos α y β del nucleótido. Este calcio está coordinado con seis moléculas de agua que son retenidas por los aminoácidos Asp11, Asp154 y Gln137. Forman un complejo con el nucleótido que restringe los movimientos de la región denominada "bisagra", situada entre los residuos 137 y 144. Esta mantiene la forma nativa de la proteína hasta que su retirada desnaturaliza el monómero de actina. Esta región también es importante porque determina si la hendidura de la proteína está en conformación "abierta" o "cerrada".
- Es muy probable que existan al menos otros tres centros con menor afinidad (intermedia) y otros con baja afinidad por los cationes divalentes. Se ha sugerido que estos centros pueden desempeñar un papel en la polimerización de la actina actuando durante la etapa de activación.
- Hay una estructura en el subdominio 2 que se llama "D-loop" porque se une con la ADNasa I, se encuentra entre los residuos His40 y Gly48. Tiene la apariencia de un elemento desordenado en la mayoría de los cristales, pero se ve como una hoja β cuando forma un complejo con la ADNasa I. Se ha propuesto que el evento clave en la polimerización es probablemente la propagación de un cambio conformacional desde el centro del enlace con el nucleótido a este dominio, que cambia de un bucle a una espiral. Sin embargo, esta hipótesis ha sido refutada por otros estudios.
F-actina
Bajo diversas condiciones, las moléculas de actina G se polimerizan en hilos más largos llamados "filamentosos-" o "actina F". Estos hilos de actina F generalmente se componen de dos hebras helicoidales de actina enrolladas entre sí, formando una hélice de 7 a 9 nanómetros de ancho que se repite cada 72 nanómetros (o cada 14 subunidades de actina G). En los hilos de actina F, las moléculas de actina G están todas orientadas en la misma dirección. Los dos extremos del hilo de actina F son distintos entre sí. En un extremo, designado como el extremo (-), la hendidura de unión de ATP de la molécula de actina terminal está orientada hacia afuera. En el extremo opuesto, designado (+), la hendidura de unión de ATP está enterrada en el filamento, en contacto con la molécula de actina vecina.A medida que crecen los hilos de actina F, las nuevas moléculas tienden a unirse en el extremo (+) de un hilo de actina F existente. Por el contrario, los hilos tienden a encogerse al desprenderse monómeros de actina del extremo (-) del hilo.
Algunas proteínas, como la cofilina, parecen aumentar el ángulo de giro, pero nuevamente esto podría interpretarse como el establecimiento de diferentes estados estructurales. Estos podrían ser importantes en el proceso de polimerización.
Hay menos acuerdo con respecto a las mediciones del radio de giro y el grosor del filamento: mientras que los primeros modelos asignaban una longitud de 25 Å, los datos actuales de difracción de rayos X, respaldados por microscopía crioelectrónica, sugieren una longitud de 23,7 Å. Estos estudios han mostrado los puntos de contacto precisos entre los monómeros. Algunos se forman con unidades de la misma cadena, entre el extremo "con púas" de un monómero y el extremo "en punta" del siguiente. Mientras que los monómeros en cadenas adyacentes hacen contacto lateral a través de proyecciones del subdominio IV, siendo las proyecciones más importantes las formadas por el extremo C-terminal y el enlace hidrofóbico formado por tres cuerpos que involucran los residuos 39–42, 201–203 y 286. Esto El modelo sugiere que un filamento está formado por monómeros en una formación de "lámina", en la que los subdominios giran sobre sí mismos,
Los términos "puntiagudo" y "púas" que se refieren a los dos extremos de los microfilamentos se derivan de su apariencia bajo microscopía electrónica de transmisión cuando las muestras se examinan siguiendo una técnica de preparación llamada "decoración". Este método consiste en la adición de fragmentos de miosina S1 al tejido fijado con ácido tánico. Esta miosina forma enlaces polares con monómeros de actina, dando lugar a una configuración que parece flechas con plumas a lo largo de su eje, donde el eje es la actina y las plumas son la miosina. Siguiendo esta lógica, el extremo del microfilamento que no tiene miosina sobresaliente se denomina punta de flecha (extremo -) y el otro extremo se denomina extremo espinoso (extremo (+). Un fragmento S1 está compuesto por los dominios de cabeza y cuello de la miosina II. En condiciones fisiológicas, la actina G (la forma de monómero) se transforma en actina F (la forma de polímero) por ATP, donde el papel de ATP es esencial.
El filamento helicoidal de actina F que se encuentra en los músculos también contiene una molécula de tropomiosina, que es una proteína de 40 nanómetros de largo que se envuelve alrededor de la hélice de actina F. Durante la fase de reposo, la tropomiosina cubre los sitios activos de la actina, de modo que la interacción actina-miosina no puede tener lugar y producir la contracción muscular. Hay otras moléculas de proteínas unidas al hilo de tropomiosina, estas son las troponinas que tienen tres polímeros: troponina I, troponina T y troponina C.
La actina F es fuerte y dinámica. A diferencia de otros polímeros, como el ADN, cuyos elementos constitutivos se unen mediante enlaces covalentes, los monómeros de los filamentos de actina se ensamblan mediante enlaces más débiles. Los enlaces laterales con monómeros vecinos resuelven esta anomalía, que en teoría debería debilitar la estructura ya que pueden romperse por agitación térmica. Además, los enlaces débiles dan la ventaja de que los extremos del filamento pueden liberar o incorporar fácilmente monómeros. Esto significa que los filamentos se pueden remodelar rápidamente y pueden cambiar la estructura celular en respuesta a un estímulo ambiental. Lo que, junto con el mecanismo bioquímico por el que se produce, se conoce como "dinámica de ensamblaje".
Plegable
La actina puede adquirir espontáneamente gran parte de su estructura terciaria. Sin embargo, la forma en que adquiere su forma totalmente funcional a partir de su forma nativa recién sintetizada es especial y casi única en la química de las proteínas. La razón de esta ruta especial podría ser la necesidad de evitar la presencia de monómeros de actina incorrectamente plegados, que podrían ser tóxicos ya que pueden actuar como terminadores de polimerización ineficientes. No obstante, es clave para establecer la estabilidad del citoesqueleto y, además, es un proceso fundamental para coordinar el ciclo celular.
Se requiere CCT para garantizar que el plegado se realice correctamente. CCT es una chaperonina del grupo II, un gran complejo proteico que ayuda en el plegamiento de otras proteínas. La CCT está formada por un doble anillo de ocho subunidades diferentes (heterooctámeras) y se diferencia de las chaperoninas del grupo I como GroEL, que se encuentra en las Eubacterias y en los orgánulos eucariotas, en que no requiere una co-chaperona que actúe como tapa. sobre la cavidad catalítica central. Los sustratos se unen a CCT a través de dominios específicos. Inicialmente se pensó que sólo se unía a la actina y la tubulina, aunque recientes estudios de inmunoprecipitación han demostrado que interacciona con un gran número de polipéptidos, que posiblemente funcionan como sustratos.
Para completar con éxito su plegamiento, tanto la actina como la tubulina necesitan interactuar con otra proteína llamada prefoldina, que es un complejo heterohexamérico (formado por seis subunidades distintas), en una interacción tan específica que las moléculas han coevolucionado. La actina forma complejos con la prefoldina mientras aún se está formando, cuando tiene aproximadamente 145 aminoácidos de largo, específicamente aquellos en el N-terminal.
Se utilizan diferentes subunidades de reconocimiento para la actina o la tubulina, aunque existe cierta superposición. En la actina, las subunidades que se unen a la prefoldina son probablemente PFD3 y PFD4, que se unen en dos lugares, uno entre los residuos 60 a 79 y el otro entre los residuos 170 a 198. La actina es reconocida, cargada y entregada a la chaperonina citosólica (CCT) en una conformación abierta por el extremo interior de los "tentáculos" de la predobladura (ver la imagen y la nota). El contacto cuando la actina es entregada es tan breve que se forma un complejo terciario. no se forma, liberando inmediatamente el prefoldin.
Luego, el CCT provoca el plegamiento secuencial de la actina al formar enlaces con sus subunidades en lugar de simplemente encerrarlo en su cavidad. Es por esto que posee áreas específicas de reconocimiento en su dominio β apical. La primera etapa del plegamiento consiste en el reconocimiento de los residuos 245–249. A continuación, otros determinantes establecen contacto.Tanto la actina como la tubulina se unen a CCT en conformaciones abiertas en ausencia de ATP. En el caso de la actina, dos subunidades se unen durante cada cambio conformacional, mientras que en el caso de la tubulina, la unión se produce con cuatro subunidades. La actina tiene secuencias de unión específicas, que interactúan con las subunidades δ y β-CCT o con δ-CCT y ε-CCT. Después de que AMP-PNP se une a CCT, los sustratos se mueven dentro de la cavidad de la chaperonina. También parece que en el caso de la actina, la proteína CAP es necesaria como posible cofactor en los estados finales de plegamiento de la actina.
La forma exacta en que se regula este proceso aún no se comprende del todo, pero se sabe que la proteína PhLP3 (una proteína similar a la fosducina) inhibe su actividad mediante la formación de un complejo terciario.
Mecanismo catalítico de la ATPasa
La actina es una ATPasa, lo que significa que es una enzima que hidroliza el ATP. Este grupo de enzimas se caracteriza por sus bajas velocidades de reacción. Se sabe que esta ATPasa es “activa”, es decir, su velocidad aumenta unas 40.000 veces cuando la actina forma parte de un filamento. Un valor de referencia para esta tasa de hidrólisis en condiciones ideales es de alrededor de 0,3 s. Luego, el Pi permanece unido a la actina junto al ADP durante mucho tiempo, hasta que se libera cooperativamente del interior del filamento.
Los detalles moleculares exactos del mecanismo catalítico aún no se conocen por completo. Aunque hay mucho debate sobre este tema, parece seguro que se requiere una conformación "cerrada" para la hidrólisis del ATP, y se piensa que los residuos que intervienen en el proceso se desplazan a la distancia adecuada.El ácido glutámico Glu137 es uno de los residuos clave, que se encuentra en el subdominio 1. Su función es unir la molécula de agua que produce un ataque nucleofílico sobre el enlace γ-fosfato del ATP, mientras que el nucleótido está fuertemente unido a los subdominios 3 y 4. La lentitud del proceso catalítico se debe a la gran distancia y posición sesgada de la molécula de agua en relación con el reactivo. Es muy probable que el cambio conformacional producido por la rotación de los dominios entre las formas G y F de la actina acerque el Glu137 permitiendo su hidrólisis. Este modelo sugiere que la polimerización y la función de la ATPasa se desacoplarían inmediatamente.La transformación "abierta" a "cerrada" entre las formas G y F y sus implicaciones en el movimiento relativo de varios residuos clave y la formación de hilos de agua se han caracterizado en dinámica molecular y simulaciones QM/MM.
Dinámica de montaje
Los filamentos de actina a menudo se ensamblan y desensamblan rápidamente, lo que les permite generar fuerza y apoyar el movimiento celular. El montaje se produce clásicamente en tres pasos. Primero, la "fase de nucleación", en la que dos o tres moléculas de actina G se unen lentamente para formar un pequeño oligómero que nucleará un mayor crecimiento. En segundo lugar, la "fase de elongación", cuando el filamento de actina crece rápidamente mediante la adición de muchas moléculas de actina en ambos extremos. A medida que el filamento crece, las moléculas de actina se agregan al extremo (+) del filamento alrededor de 10 veces más rápido que al extremo (-), por lo que los filamentos tienden a crecer principalmente en el extremo (+). En tercer lugar, la "fase de estado estacionario", en la que se alcanza un equilibrio cuando las moléculas de actina se unen y abandonan el filamento a la misma velocidad, manteniendo la longitud del filamento.Si bien la longitud del filamento permanece constante en la fase de estado estacionario, constantemente se agregan nuevas moléculas al extremo (+) y se caen del extremo (-), un fenómeno llamado "treadmilling", ya que una molécula de actina dada parecería moverse a lo largo. la hebra De forma aislada, si un filamento crecerá o se encogerá, y con qué rapidez, están determinados por la concentración de actina G alrededor del filamento; sin embargo, en las células, la dinámica de los filamentos de actina está fuertemente influenciada por varias proteínas de unión a actina.
Proteínas de unión a actina
El citoesqueleto de actina in vivo no está compuesto exclusivamente por actina, se requieren otras proteínas para su formación, continuidad y función. Estas proteínas se denominan proteínas de unión a actina y están involucradas en la polimerización, despolimerización, estabilidad y organización de la actina. La diversidad de estas proteínas es tal que se piensa que la actina es la proteína que participa en el mayor número de interacciones proteína-proteína.
La nucleación de nuevos filamentos de actina, el paso limitante de la velocidad en la polimerización de actina, es asistida por proteínas que nuclean actina, como las forminas y el complejo Arp2/3. Las forminas ayudan a nuclear los filamentos largos de actina. Se unen a dos moléculas de actina-ATP libres, uniéndolas. Luego, a medida que el filamento comienza a crecer, la forma se mueve a lo largo del extremo (+) del filamento en crecimiento, mientras recluta proteínas de unión a actina que promueven el crecimiento del filamento y excluye las proteínas de protección que bloquearían la extensión del filamento.Las ramificaciones en los filamentos de actina normalmente son nucleadas por el complejo Arp2/3 junto con factores que promueven la nucleación. Los factores que promueven la nucleación se unen a dos moléculas de actina G libres, luego reclutan y activan el complejo Arp2/3. El complejo Arp2/3 activado se une a un filamento de actina existente y utiliza las dos moléculas de actina G unidas para nuclear un nuevo filamento de actina que se ramifica del antiguo en un ángulo de 70°.
A medida que crecen los filamentos, el grupo de moléculas de actina G disponible es administrado por proteínas de unión a actina G, como la profilina y la timosina β-4. Profilin asegura un suministro de actina-ATP disponible al unirse a la actina G unida a ADP y promover el intercambio de ADP por ATP. La unión de profilina a la molécula de actina bloquea físicamente su adición al extremo (-) de un filamento, pero permite que se una al extremo (+). Una vez que la actina-ATP se ha unido al filamento, la profilina lo libera. A medida que las forminas promueven la nucleación y la extensión de nuevos filamentos de actina, reclutan profilina en el área, lo que aumenta la concentración local de actina-ATP para impulsar el crecimiento del filamento. Por el contrario, la timosina β-4 se une y secuestra actina-ATP, evitando que se una a un microfilamento.
Una vez que se establece una fibra de actina, la dinámica de su crecimiento o colapso está influenciada por numerosas proteínas. Las hebras existentes pueden ser interrumpidas por proteínas que escinden filamentos, como la cofilina y la gelsolina. Cofilin se une a lo largo de dos moléculas de actina-ADP en un filamento, forzando un movimiento que desestabiliza el filamento y hace que se rompa. La gelsolina se inserta entre las moléculas de actina en un filamento, interrumpiendo el filamento. Tras la rotura del filamento, la gelsolina queda adherida al nuevo extremo (+), impidiendo que crezca, obligando así a su desmontaje.
Otras proteínas se unen a los extremos de los filamentos de actina, estabilizándolos. Estos se denominan "proteínas de protección" e incluyen CapZ y tropomodulina. CapZ se une al extremo (+) de un filamento, lo que evita la adición o pérdida de actina de ese extremo. La tropomodulina se une al extremo (-) de un filamento, nuevamente evitando la adición o pérdida de moléculas en ese extremo. La tropomodulina se encuentra típicamente en células que requieren filamentos de actina extremadamente estables, como los de los músculos y los glóbulos rojos.
Estas proteínas de unión a actina normalmente están reguladas por varias señales celulares para controlar la dinámica de ensamblaje de actina en diferentes ubicaciones celulares. Las forminas, por ejemplo, normalmente se pliegan en una conformación inactiva hasta que son activadas por la unión de la pequeña GTPasa Rho. La ramificación de actina en la membrana celular es importante para el movimiento celular, por lo que el lípido PIP 2 de la membrana plasmática activa el factor promotor de la nucleación WASp e inhibe CapZ. WASp también es activado por la pequeña GTPasa Cdc42, mientras que otro factor promotor de la nucleación WAVE es activado por la GTPasa Rac1.
Genética
Aunque la mayoría de las levaduras tienen un solo gen de actina, los eucariotas superiores, en general, expresan varias isoformas de actina codificadas por una familia de genes relacionados. Los mamíferos tienen al menos seis isoformas de actina codificadas por genes separados, que se dividen en tres clases: alfa, beta y gamma, según sus puntos isoeléctricos. En general, las actinas alfa se encuentran en el músculo (α-esqueléticas, α-aórticas lisas, α-cardíacas), mientras que las isoformas beta y gamma son prominentes en las células no musculares (β-citoplasmáticas, γ1-citoplasmáticas, γ2-entéricas lisas). Aunque las secuencias de aminoácidos y las propiedades in vitro de las isoformas son muy similares, estas isoformas no pueden sustituirse completamente entre sí in vivo. Las plantas contienen más de 60 genes y pseudogenes de actina.
El gen de actina típico tiene una UTR 5' de aproximadamente 100 nucleótidos, una región traducida de 1200 nucleótidos y una UTR 3' de 200 nucleótidos. La mayoría de los genes de actina están interrumpidos por intrones, con hasta seis intrones en cualquiera de las 19 ubicaciones bien caracterizadas. La alta conservación de la familia hace que la actina sea el modelo favorito para los estudios que comparan los modelos intrones-tempranos e intrones-tardíos de evolución de intrones.
Evolución
La actina y las proteínas estrechamente relacionadas están presentes en todos los organismos, lo que sugiere que el ancestro común de toda la vida en la Tierra tenía actina. La actina es una de las proteínas más conservadas a lo largo de la evolución de los eucariotas. Las secuencias de proteínas de actina de animales y amebas son idénticas en un 80% a pesar de estar separadas por aproximadamente mil millones de años de evolución. Muchos eucariotas unicelulares tienen un solo gen de actina, mientras que los eucariotas multicelulares a menudo tienen varios genes estrechamente relacionados que cumplen funciones especializadas. Los humanos tienen seis; las plantas tienen 10 o más. Además de la actina, los eucariotas tienen una gran familia de proteínas relacionadas con la actina, o "Arps", que comparten un ancestro común con la actina y se denominan Arp1-Arp11, siendo Arp1 la más estrechamente relacionada con la actina y Arp11 la menos.
Las bacterias codifican tres tipos de actina: MreB influye en la forma celular, la división celular FtsA y la separación ParM de plásmidos grandes. Algunas arqueas tienen un gen MreB similar a una bacteria, mientras que otras tienen un gen de actina que se parece más a la actina eucariota.
El citoesqueleto eucariótico de los organismos entre todos los grupos taxonómicos tiene componentes similares a la actina y la tubulina. Por ejemplo, la proteína codificada por el gen ACTG2 en humanos es completamente equivalente a los homólogos presentes en ratas y ratones, aunque a nivel de nucleótidos la similitud se reduce al 92%. Sin embargo, existen grandes diferencias con los equivalentes en procariotas (FtsZ y MreB), donde la similitud entre las secuencias de nucleótidos se encuentra entre 40 y 50 % entre diferentes especies de bacterias y arqueas. Algunos autores sugieren que la proteína ancestral que dio lugar a la actina eucariota modelo se asemeja a las proteínas presentes en los citoesqueletos bacterianos modernos.
Algunos autores señalan que el comportamiento de la actina, la tubulina y la histona, proteína involucrada en la estabilización y regulación del ADN, es similar en su capacidad para unir nucleótidos y en su capacidad para aprovechar el movimiento browniano. También se ha sugerido que todos ellos tienen un ancestro común. Por lo tanto, los procesos evolutivos dieron como resultado la diversificación de las proteínas ancestrales en las variedades actuales, conservando, entre otras, las actinas como moléculas eficientes que eran capaces de abordar procesos biológicos ancestrales esenciales, como la endocitosis.
El complejo Arp2/3 se encuentra ampliamente en todos los organismos eucariotas.
Equivalentes en procariotas
El citoesqueleto bacteriano contiene proteínas que son muy similares a los monómeros y polímeros de actina. La proteína bacteriana MreB se polimeriza en finos filamentos no helicoidales y, ocasionalmente, en estructuras helicoidales similares a la actina F. Además, su estructura cristalina es muy similar a la de la actina G (en cuanto a su conformación tridimensional), incluso existen similitudes entre los protofilamentos MreB y la actina F. El citoesqueleto bacteriano también contiene las proteínas FtsZ, que son similares a la tubulina.
Por tanto, las bacterias poseen un citoesqueleto con elementos homólogos a la actina (por ejemplo, MreB, AlfA, ParM, FtsA y MamK), aunque la secuencia de aminoácidos de estas proteínas difiere de la presente en las células animales. Sin embargo, tales proteínas tienen un alto grado de similitud estructural con la actina eucariota. Los microfilamentos altamente dinámicos formados por la agregación de MreB y ParM son esenciales para la viabilidad celular y están involucrados en la morfogénesis celular, la segregación cromosómica y la polaridad celular. ParM es un homólogo de actina que está codificado en un plásmido y está involucrado en la regulación del ADN del plásmido. Los ParM de diferentes plásmidos bacterianos pueden formar estructuras helicoidales asombrosamente diversas que comprenden dos o cuatro hebras para mantener una herencia fiel del plásmido.
En arqueas, el homólogo Ta0583 es aún más similar a las actinas eucariotas.
Patología molecular
La mayoría de los mamíferos poseen seis genes de actina diferentes. De estos, dos codifican para el citoesqueleto (ACTB y ACTG1) mientras que los otros cuatro están involucrados en el músculo estriado esquelético (ACTA1), el tejido muscular liso (ACTA2), los músculos intestinales (ACTG2) y el músculo cardíaco (ACTC1). La actina del citoesqueleto está involucrada en los mecanismos patogénicos de muchos agentes infecciosos, incluido el VIH. La gran mayoría de las mutaciones que afectan a la actina son mutaciones puntuales que tienen un efecto dominante, con la excepción de seis mutaciones involucradas en la miopatía nemalínica. Esto se debe a que, en muchos casos, el mutante del monómero de actina actúa como una "tapa" al evitar el alargamiento de la actina F.
Patología asociada a ACTA1
ACTA1 es el gen que codifica la isoforma α de la actina predominante en el músculo estriado esquelético humano, aunque también se expresa en el músculo cardíaco y en la glándula tiroides. Su secuencia de ADN consta de siete exones que producen cinco transcripciones conocidas. La mayoría de estos consisten en mutaciones puntuales que provocan la sustitución de aminoácidos. Las mutaciones están en muchos casos asociadas con un fenotipo que determina la gravedad y el curso de la aflicción.
La mutación altera la estructura y función de los músculos esqueléticos produciendo una de tres formas de miopatía: miopatía nemalínica tipo 3, miopatía congénita con un exceso de miofilamentos delgados (CM) y miopatía congénita con desproporción de tipos de fibras (CMFTD). También se han encontrado mutaciones que producen miopatías centrales. Aunque sus fenotipos son similares, además de la miopatía nemalínica típica, algunos especialistas distinguen otro tipo de miopatía denominada miopatía nemalínica actínica. En el primero se forman grumos de actina en lugar de los típicos bastones. Es importante señalar que un paciente puede mostrar más de uno de estos fenotipos en una biopsia.Los síntomas más comunes consisten en una morfología facial típica (facies miopática), debilidad muscular, retraso en el desarrollo motor y dificultad respiratoria. El curso de la enfermedad, su gravedad y la edad en que aparece son variables y también se encuentran formas superpuestas de miopatía. Un síntoma de la miopatía de nemalina es que aparecen "bastones de nemalina" en diferentes lugares de las fibras musculares de tipo 1. Estos bastones son estructuras no patognomónicas que tienen una composición similar a los discos Z que se encuentran en el sarcómero.
La patogenia de esta miopatía es muy variada. Muchas mutaciones ocurren en la región de indentación de actina cerca de sus sitios de unión de nucleótidos, mientras que otras ocurren en el Dominio 2, o en las áreas donde ocurre la interacción con las proteínas asociadas. Esto de alguna manera explica la gran variedad de aglomeraciones que se forman en estos casos, como Nemaline o Intranuclear Bodies o Zebra Bodies. En la miopatía nemalínica se producen cambios en el plegamiento de la actina, así como cambios en su agregación y también hay cambios en la expresión de otras proteínas asociadas. En algunas variantes donde se encuentran cuerpos intranucleares los cambios en el plegamiento enmascaran la señal de exportación de proteína del núcleo por lo que se produce la acumulación de la forma mutada de actina en el núcleo celular. Por otro lado, parece que las mutaciones aLos ACTA1 que dan lugar a una CFTDM tienen un mayor efecto sobre la función sarcomérica que sobre su estructura. Investigaciones recientes han tratado de comprender esta aparente paradoja, que sugiere que no existe una correlación clara entre el número de varillas y la debilidad muscular. Parece que algunas mutaciones son capaces de inducir una mayor tasa de apoptosis en las fibras musculares de tipo II.
En musculo liso
Hay dos isoformas que codifican actinas en el tejido muscular liso:
ACTG2 codifica para la isoforma de actina más grande, que tiene nueve exones, uno de los cuales, el que se encuentra en el extremo 5', no se traduce. Es una γ-actina que se expresa en el músculo liso entérico. No se han encontrado mutaciones en este gen que correspondan a patologías, aunque los microarrays han demostrado que esta proteína se expresa con mayor frecuencia en los casos resistentes a la quimioterapia con cisplatino.
ACTA2 codifica para una α-actina ubicada en el músculo liso y también en el músculo liso vascular. Se ha señalado que la mutación MYH11 podría ser responsable de al menos el 14% de los aneurismas hereditarios de la aorta torácica, particularmente del tipo 6. Esto se debe a que la variante mutada produce un ensamblaje filamentoso incorrecto y una capacidad reducida para la contracción del músculo liso vascular. En estos individuos se ha registrado degradación de la media aórtica, con áreas de desorganización e hiperplasia, así como estenosis de los vasa vasorum de la aorta.El número de afecciones en las que está implicado el gen va en aumento. Se ha relacionado con la enfermedad de Moyamoya y parece probable que ciertas mutaciones en heterocigosis puedan conferir una predisposición a muchas patologías vasculares, como el aneurisma de aorta torácica y la cardiopatía isquémica. La α-actina que se encuentra en los músculos lisos también es un marcador interesante para evaluar el progreso de la cirrosis hepática.
En músculo cardíaco
El gen ACTC1 codifica la isoforma de α-actina presente en el músculo cardíaco. Hamada y sus colaboradores lo secuenciaron por primera vez en 1982, cuando se descubrió que estaba interrumpido por cinco intrones. Fue el primero de los seis genes en los que se encontraron alelos implicados en procesos patológicos.
Se han descrito varios trastornos estructurales asociados con mutaciones puntuales de este gen que provocan el mal funcionamiento del corazón, como la miocardiopatía dilatada tipo 1R y la miocardiopatía hipertrófica tipo 11. Recientemente se han descrito ciertos defectos del tabique interauricular que también podrían estar relacionados con estas mutaciones.
Se han estudiado dos casos de miocardiopatía dilatada que implican una sustitución de aminoácidos altamente conservados pertenecientes a los dominios proteicos que se unen e intercalan con los discos Z. Esto ha llevado a la teoría de que la dilatación se produce por un defecto en la transmisión de la fuerza contráctil en los miocitos.
Las mutaciones en ACTC1 son responsables de al menos el 5% de las miocardiopatías hipertróficas. También se ha encontrado la existencia de una serie de mutaciones puntuales:
- Mutación E101K: cambios de carga neta y formación de un enlace electrostático débil en el sitio de unión de actomiosina.
- P166A: zona de interacción entre monómeros de actina.
- A333P: zona de interacción actina-miosina.
La patogenia parece implicar un mecanismo compensatorio: las proteínas mutadas actúan como toxinas con un efecto dominante, disminuyendo la capacidad de contracción del corazón provocando un comportamiento mecánico anormal, de modo que la hipertrofia, que suele ser tardía, es consecuencia de la respuesta normal del músculo cardíaco al estrés.
Estudios recientes han descubierto mutaciones en ACTC1 que están implicadas en otros dos procesos patológicos: la miocardiopatía restrictiva idiopática infantil y la no compactación del miocardio del ventrículo izquierdo.
En actinas citoplasmáticas
ACTB es un locus altamente complejo. Existen una serie de pseudogenes que se encuentran distribuidos por todo el genoma, y su secuencia contiene seis exones que pueden dar lugar a hasta 21 transcripciones diferentes por splicing alternativo, que se conocen como β-actinas. En consonancia con esta complejidad, sus productos también se encuentran en múltiples localizaciones y forman parte de una amplia variedad de procesos (citoesqueleto, complejo NuA4 histona-aciltransferasa, núcleo celular) y además están asociados a los mecanismos de un gran número de de procesos patológicos (carcinomas, distonías juveniles, mecanismos de infección, malformaciones del sistema nervioso e invasión tumoral, entre otros). Se ha descubierto una nueva forma de actina, la actina kappa, que parece sustituir a la β-actina en procesos relacionados con tumores.
Hasta el momento se han descubierto tres procesos patológicos causados por una alteración directa en la secuencia del gen:
- El hemangiopericitoma con translocaciones t(7;12)(p22;q13) es una afección rara en la que una mutación translocacional provoca la fusión del gen ACTB sobre GLI1 en el cromosoma 12.
- La distonía de inicio juvenil es una rara enfermedad degenerativa que afecta al sistema nervioso central; en particular, afecta áreas de la neocorteza y el tálamo, donde se forman inclusiones eosinofílicas en forma de bastoncillos. Los individuos afectados representan un fenotipo con deformidades en la línea media, hipoacusia sensorial y distonía. Está causada por una mutación puntual en la que el aminoácido triptófano reemplaza a la arginina en la posición 183. Esto altera la interacción de la actina con el sistema ADF/cofilina, que regula la dinámica de la formación del citoesqueleto de las células nerviosas.
- También se ha descubierto una mutación puntual dominante que provoca disfunción de los granulocitos de los neutrófilos e infecciones recurrentes. Parece que la mutación modifica el dominio responsable de la unión entre la profilina y otras proteínas reguladoras. La afinidad de la actina por la profilina está muy reducida en este alelo.
El locus ACTG1 codifica la proteína citosólica γ-actina que es responsable de la formación de microfilamentos del citoesqueleto. Contiene seis exones, dando lugar a 22 ARNm diferentes, que producen cuatro isoformas completas cuya forma de expresión probablemente depende del tipo de tejido en el que se encuentran. También tiene dos promotores de ADN diferentes. Se ha observado que las secuencias traducidas desde este locus y desde el de β-actina son muy similares a las predichas, sugiriendo una secuencia ancestral común que sufrió duplicación y conversión genética.
En cuanto a la patología, se ha asociado a procesos como amiloidosis, retinosis pigmentaria, mecanismos de infección, enfermedades renales y diversos tipos de hipoacusia congénita.
Se ha encontrado que seis mutaciones puntuales autosómicas dominantes en la secuencia causan varios tipos de pérdida auditiva, particularmente pérdida auditiva neurosensorial relacionada con el locus DFNA 20/26. Parece que afectan a los estereocilios de las células ciliadas presentes en el Órgano de Corti del oído interno. La β-actina es la proteína más abundante que se encuentra en el tejido humano, pero no es muy abundante en las células ciliadas, lo que explica la localización de la patología. Por otro lado, parece que la mayoría de estas mutaciones afectan las áreas involucradas en la unión con otras proteínas, particularmente la actomiosina. Algunos experimentos han sugerido que el mecanismo patológico de este tipo de pérdida auditiva se relaciona con que la actina F en las mutaciones es más sensible a la cofilina de lo normal.
Sin embargo, aunque no hay registro de ningún caso, se sabe que la γ-actina también se expresa en los músculos esqueléticos, y aunque está presente en pequeñas cantidades, organismos modelo han demostrado que su ausencia puede dar lugar a miopatías.
Otros mecanismos patológicos
Algunos agentes infecciosos utilizan actina, especialmente actina citoplasmática, en su ciclo de vida. Dos formas básicas están presentes en las bacterias:
- Listeria monocytogenes, algunas especies de Rickettsia, Shigella flexneri y otros gérmenes intracelulares escapan de las vacuolas fagocíticas recubriéndose con una cápsula de filamentos de actina. Tanto L. monocytogenes como S. flexneri generan una cola en forma de "cola de cometa" que les da movilidad. Cada especie exhibe pequeñas diferencias en el mecanismo de polimerización molecular de sus "colas de cometa". Se han observado diferentes velocidades de desplazamiento, por ejemplo, Listeria y Shigella son las más rápidas. Muchos experimentos han demostrado este mecanismo in vitro.. Esto indica que las bacterias no están utilizando un motor proteico similar a la miosina, y parece que su propulsión se adquiere a partir de la presión ejercida por la polimerización que tiene lugar cerca de la pared celular del microorganismo. Las bacterias han sido rodeadas previamente por ABP del huésped y, como mínimo, la cubierta contiene complejo Arp2/3, proteínas Ena/VASP, cofilina, una proteína amortiguadora y promotores de la nucleación, como el complejo vinculina. Mediante estos movimientos forman protuberancias que llegan a las células vecinas, infectándolas también a ellas, por lo que el sistema inmunitario solo puede combatir la infección a través de la inmunidad celular. El movimiento podría ser causado por la modificación de la curva y desramificación de los filamentos. Otras especies, como Mycobacterium marinum yBurkholderia pseudomallei, también son capaces de polimerización localizada de actina celular para ayudar a su movimiento a través de un mecanismo que se centra en el complejo Arp2/3. Además, el virus vacunal Vaccinia también utiliza elementos del citoesqueleto de actina para su diseminación.
- Pseudomonas aeruginosa es capaz de formar una biopelícula protectora para escapar de las defensas del organismo huésped, especialmente los glóbulos blancos y los antibióticos. La biopelícula se construye utilizando ADN y filamentos de actina del organismo huésped.
Además del ejemplo citado anteriormente, la polimerización de actina se estimula en los pasos iniciales de la internalización de algunos virus, especialmente el VIH, por ejemplo, inactivando el complejo de cofilina.
Aún no se ha determinado el papel que juega la actina en el proceso de invasión de las células cancerosas.
Aplicaciones
La actina se utiliza en los laboratorios científicos y tecnológicos como vía para motores moleculares como la miosina (ya sea en el tejido muscular o fuera de él) y como componente necesario para el funcionamiento celular. También se puede utilizar como herramienta de diagnóstico, ya que varias de sus variantes anómalas están relacionadas con la aparición de patologías específicas.
- Nanotecnología. Los sistemas actina-miosina actúan como motores moleculares que permiten el transporte de vesículas y orgánulos por todo el citoplasma. Es posible que la actina se pueda aplicar a la nanotecnología, ya que su capacidad dinámica se ha aprovechado en una serie de experimentos, incluidos los realizados en sistemas acelulares. La idea subyacente es utilizar los microfilamentos como pistas para guiar motores moleculares que puedan transportar una carga determinada. Es decir, la actina podría usarse para definir un circuito a lo largo del cual se puede transportar una carga de una manera más o menos controlada y dirigida. En términos de aplicaciones generales, podría ser utilizado para el transporte dirigido de moléculas para su depósito en lugares determinados, lo que permitiría el ensamblaje controlado de nanoestructuras. Estos atributos podrían aplicarse a procesos de laboratorio como enlab-on-a-chip, en mecánica de nanocomponentes y en nanotransformadores que convierten la energía mecánica en energía eléctrica.
- La actina se usa como control interno en transferencias Western para determinar que se han cargado cantidades iguales de proteína en cada carril del gel. En el ejemplo de transferencia que se muestra en el lado izquierdo, se cargaron 75 µg de proteína total en cada pocillo. La transferencia se hizo reaccionar con un anticuerpo anti-β-actina (para otros detalles de la transferencia, consulte la referencia)
El uso de la actina como control interno se basa en el supuesto de que su expresión es prácticamente constante e independiente de las condiciones experimentales. Comparando la expresión del gen de interés con la de la actina, es posible obtener una cantidad relativa que puede compararse entre diferentes experimentos, siempre que la expresión de esta última sea constante. Vale la pena señalar que la actina no siempre tiene la estabilidad deseada en su expresión génica.
- Salud. Algunos alelos de actina causan enfermedades; por ello se han desarrollado técnicas para su detección. Además, la actina puede utilizarse como marcador indirecto en patología quirúrgica: es posible utilizar variaciones en el patrón de su distribución en los tejidos como marcador de invasión en neoplasias, vasculitis y otras afecciones. Además, debido a la estrecha asociación de la actina con el aparato de contracción muscular, sus niveles en el músculo esquelético disminuyen cuando estos tejidos se atrofian, por lo que puede utilizarse como marcador de este proceso fisiológico.
- Tecnología de los Alimentos. Es posible determinar la calidad de ciertos alimentos procesados, como los embutidos, cuantificando la cantidad de actina presente en la carne constituyente. Tradicionalmente se ha utilizado un método que se basa en la detección de 3-metilhistidina en muestras hidrolizadas de estos productos, ya que este compuesto está presente en la cadena pesada de actina y F-miosina (ambos componentes mayoritarios del músculo). La generación de este compuesto en la carne se deriva de la metilación de residuos de histidina presentes en ambas proteínas.
Historia
La actina fue observada experimentalmente por primera vez en 1887 por WD Halliburton, quien extrajo una proteína del músculo que "coagulaba" preparaciones de miosina que él llamó "fermento de miosina". Sin embargo, Halliburton no pudo refinar más sus hallazgos, y el descubrimiento de la actina se atribuye a Brunó Ferenc Straub, un joven bioquímico que trabaja en el laboratorio de Albert Szent-Györgyi en el Instituto de Química Médica de la Universidad de Szeged, Hungría.
Siguiendo con el descubrimiento de Ilona Banga & Szent-Györgyi en 1941 de que la coagulación solo ocurre en algunas extracciones de miosina y se revierte con la adición de ATP, Straub identificó y purificó la actina de aquellas preparaciones de miosina que coagulaban. Sobre la base del método de extracción original de Banga, desarrolló una técnica novedosa para extraer proteína muscular que le permitió aislar cantidades sustanciales de actina relativamente pura, publicada en 1942. El método de Straub es esencialmente el mismo que se usa en los laboratorios en la actualidad. Dado que la proteína de Straub era necesaria para activar la coagulación de la miosina, se la denominó actina. Al darse cuenta de que las preparaciones de miosina coagulante de Banga también contenían actina, Szent-Györgyi llamó a la mezcla de ambas proteínas actomiosina.
Las hostilidades de la Segunda Guerra Mundial significaron que Szent-Gyorgyi no pudo publicar el trabajo de su laboratorio en revistas científicas occidentales. Por lo tanto, la actina solo se hizo conocida en Occidente en 1945, cuando su artículo se publicó como suplemento de Acta Physiologica Scandinavica. Straub continuó trabajando en la actina y en 1950 informó que la actina contiene ATP unido y que, durante la polimerización de la proteína en microfilamentos, el nucleótido se hidroliza a ADP y fosfato inorgánico (que permanecen unidos al microfilamento). Straub sugirió que la transformación de actina unida a ATP en actina unida a ADP desempeñaba un papel en la contracción muscular. De hecho, esto es cierto solo en el músculo liso y no se comprobó mediante experimentación hasta 2001.
La secuenciación de aminoácidos de la actina fue completada por M. Elzinga y colaboradores en 1973. La estructura cristalina de la actina G fue resuelta en 1990 por Kabsch y colaboradores. En el mismo año, Holmes y sus colegas propusieron un modelo para la actina F después de experimentos que usaban cocristalización con diferentes proteínas. El procedimiento de co-cristalización con diferentes proteínas se utilizó repetidamente durante los años siguientes, hasta que en 2001 se cristalizó la proteína aislada junto con el ADP. Sin embargo, todavía no existe una estructura de rayos X de alta resolución de F-actina. La cristalización de la actina G fue posible gracias al uso de un conjugado de rodamina que impide la polimerización al bloquear el aminoácido cys-374.Christine Oriol-Audit murió el mismo año en que se cristalizó la actina por primera vez, pero fue la investigadora que en 1977 cristalizó por primera vez la actina en ausencia de proteínas de unión a actina (ABP). Sin embargo, los cristales resultantes eran demasiado pequeños para la tecnología disponible en ese momento.
Aunque actualmente no existe un modelo de alta resolución de la forma filamentosa de la actina, en 2008 el equipo de Sawaya pudo producir un modelo más exacto de su estructura basado en múltiples cristales de dímeros de actina que se unen en diferentes lugares. Posteriormente, este modelo ha sido perfeccionado por Sawaya y Lorenz. Otros enfoques, como el uso de microscopía crioelectrónica y radiación de sincrotrón, han permitido recientemente una mayor resolución y una mejor comprensión de la naturaleza de las interacciones y los cambios conformacionales implicados en la formación de filamentos de actina.
Investigar
Inhibidores químicos
Varias toxinas naturales que interfieren con la dinámica de la actina se utilizan ampliamente en la investigación para estudiar el papel de la actina en la biología. La latrunculina, una toxina producida por las esponjas, se une a la actina G y evita que se una a los microfilamentos. La citocalasina D, producida por ciertos hongos, sirve como factor de protección, se une al extremo (+) de un filamento y evita la adición adicional de moléculas de actina. Por el contrario, la toxina esponjosa jasplakinolide promueve la nucleación de nuevos filamentos de actina al unir y estabilizar pares de moléculas de actina. La faloidina, del hongo Amanita phalloides del "casquete de la muerte", se une a las moléculas de actina adyacentes dentro del filamento de actina F, estabilizando el filamento y evitando su despolimerización.
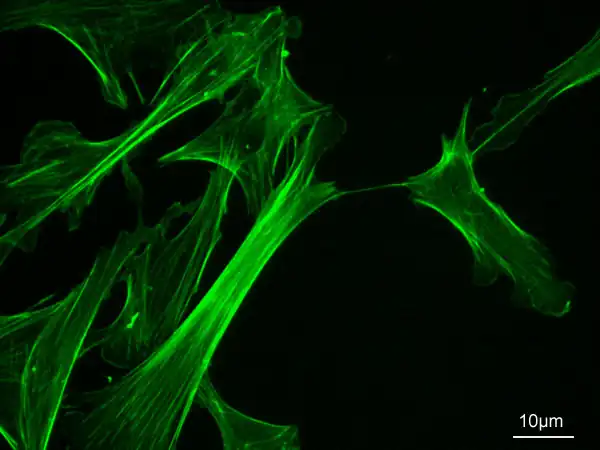
La faloidina a menudo se marca con tintes fluorescentes para visualizar los filamentos de actina mediante microscopía de fluorescencia.
Contenido relacionado
Nucleido
Tacticidad
Electrón de valencia