Ácido cloroacético
ácido cloroacético, conocido industrialmente como ácido monocloroacético (MCA), es el compuesto organoclorado de fórmula ClCH2CO2H. Este ácido carboxílico es un componente útil en la síntesis orgánica. Es un sólido incoloro. Los compuestos relacionados son el ácido dicloroacético y el ácido tricloroacético.
Producción
El ácido cloroacético fue preparado por primera vez (en forma impura) por el químico francés Félix LeBlanc (1813–1886) en 1843 clorando ácido acético en presencia de luz solar, y en 1857 (en forma pura) por el químico alemán Reinhold Hoffmann. (1831-1919) mediante reflujo de ácido acético glacial en presencia de cloro y luz solar, y luego por el químico francés Charles Adolphe Wurtz mediante hidrólisis de cloruro de cloroacetilo (ClCH2COCl), también en 1857.
El ácido cloroacético se prepara industrialmente mediante dos rutas. El método predominante implica la cloración del ácido acético, con anhídrido acético como catalizador:
- H
3C−COH + Cl
2 → ClH
2C−COH + HCl
Esta ruta adolece de la producción de ácido dicloroacético y ácido tricloroacético como impurezas, que son difíciles de separar por destilación:
- H
3C−COH + 2 Cl
2 → Cl
2HC−COH + 2 HCl - H
3C−COH + 3 Cl
2 → Cl
3C−COH + 3 HCl
El segundo método implica la hidrólisis del tricloroetileno:
- ClHC=CCl2 + 2 H
2O → ClH
2C−COH + 2 HCl
La hidrólisis se realiza a 130-140 °C en una solución concentrada (al menos 75%) de ácido sulfúrico. Este método produce un producto de gran pureza, a diferencia de la ruta de halogenación. Sin embargo, las cantidades significativas de HCl liberadas han llevado a una mayor popularidad de la ruta de halogenación. En todo el mundo se producen aproximadamente 420.000 toneladas al año.
Usos y reacciones
La mayoría de las reacciones aprovechan la alta reactividad del enlace C-Cl.
En su aplicación a mayor escala, el ácido cloroacético se utiliza para preparar el agente espesante carboximetilcelulosa y carboximetilalmidón.
El ácido cloroacético también se utiliza en la producción de herbicidas fenoxi mediante eterificación con clorofenoles. De esta forma se producen el ácido 2-metil-4-clorofenoxiacético (MCPA), el ácido 2,4-diclorofenoxiacético y el ácido 2,4,5-triclorofenoxiacético (2,4,5-T). Es el precursor del herbicida glifosato y dimetoato. El ácido cloroacético se convierte en cloruro de cloroacetilo, un precursor de la adrenalina (epinefrina). El desplazamiento del cloruro por el sulfuro da ácido tioglicólico, que se utiliza como estabilizador en el PVC y como componente de algunos cosméticos.
Ilustrativo de su utilidad en química orgánica es la O-alquilación de salicilaldehído con ácido cloroacético, seguida de la descarboxilación del éter resultante, produciendo benzofurano.
Seguridad
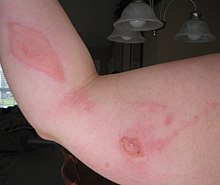
Al igual que otros ácidos cloroacéticos y halocarbonos relacionados, el ácido cloroacético es un agente alquilante peligroso. La DL50 para ratas es 76 mg/kg.
Está clasificada como una sustancia extremadamente peligrosa en los Estados Unidos, según se define en la Sección 302 de la Ley de Planificación de Emergencias y Derecho a la Información de la Comunidad (42 U.S.C. 11002), y está sujeta a estrictos requisitos de informes por parte de las instalaciones que producen, almacenarlo o utilizarlo en cantidades significativas.
Contenido relacionado
Ley de Fick
Masa molar
Miscibilidad