Ácido butírico
Ácido butírico (del griego antiguo: βούτῡρον, que significa "mantequilla"), también conocido bajo el nombre sistemático ácido butanoico es un ácido alquilcarboxílico de cadena lineal con la fórmula química CH3CH2CH2CO2H. Es un líquido aceitoso, incoloro y de olor desagradable. El ácido isobutírico (ácido 2-metilpropanoico) es un isómero. Las sales y ésteres del ácido butírico se conocen como butiratos o butanoatos. El ácido no se encuentra ampliamente en la naturaleza, pero sus ésteres están muy extendidos. Es un químico industrial común y un componente importante en el intestino de los mamíferos.
Historia
El ácido butírico fue observado por primera vez en forma impura en 1814 por el químico francés Michel Eugène Chevreul. Para 1818, lo había purificado lo suficiente como para caracterizarlo. Sin embargo, Chevreul no publicó sus primeras investigaciones sobre el ácido butírico; en cambio, depositó sus hallazgos en forma de manuscrito con el secretario de la Academia de Ciencias en París, Francia. Henri Braconnot, un químico francés, también estaba investigando la composición de la mantequilla y estaba publicando sus hallazgos, y esto generó disputas sobre la prioridad. Ya en 1815, Chevreul afirmó que había encontrado la sustancia responsable del olor a mantequilla. En 1817, publicó algunos de sus hallazgos sobre las propiedades del ácido butírico y lo nombró. Sin embargo, no fue hasta 1823 que presentó en detalle las propiedades del ácido butírico. El nombre ácido butírico proviene del griego antiguo: βούτῡρον, que significa "mantequilla", la sustancia en la que se encontró por primera vez. El nombre latino butyrum (o buturum) es similar.
Ocurrencia
Los triglicéridos del ácido butírico componen el 3-4 % de la mantequilla. Cuando la mantequilla se vuelve rancia, el ácido butírico se libera del glicérido por hidrólisis. Es uno del subgrupo de ácidos grasos llamados ácidos grasos de cadena corta. El ácido butírico es un ácido carboxílico típico que reacciona con las bases y afecta a muchos metales. Se encuentra en grasas animales y aceites vegetales, leche bovina, leche materna, mantequilla, queso parmesano, olor corporal, vómitos y como producto de fermentación anaeróbica (incluso en el colon). Tiene un sabor parecido a la mantequilla y un olor desagradable. Los mamíferos con buenas capacidades de detección de olores, como los perros, pueden detectarlo en 10 partes por mil millones, mientras que los humanos solo pueden detectarlo en concentraciones superiores a 10 partes por millón. En la fabricación de alimentos, se utiliza como agente aromatizante.
En los seres humanos, el ácido butírico es uno de los dos agonistas endógenos principales del receptor de ácido hidroxicarboxílico 2 humano (HCA2), un receptor acoplado a proteína G acoplado a Gi/o.
El ácido butírico está presente como éster octílico en la chirivía (Pastinaca sativa) y en la semilla del árbol ginkgo.
Producción
Industriales
En la industria, el ácido butírico se produce por hidroformilación a partir de propeno y gas de síntesis, formando butiraldehído, que se oxida al producto final.
- H2 + CO + CH3CH=CH2 → CH3CH2CH2CHOoxidación→ácido butírico
Se puede separar de soluciones acuosas por saturación con sales como el cloruro de calcio. La sal de calcio, Ca(C4H7O2)2 · H2O, es menos soluble en agua caliente que en agua fría.
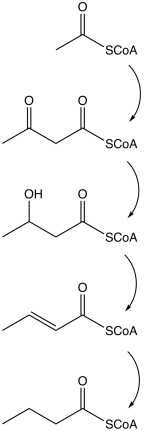
Biosíntesis microbiana
El butirato se produce mediante varios procesos de fermentación realizados por bacterias anaerobias obligadas. Esta vía de fermentación fue descubierta por Louis Pasteur en 1861. Ejemplos de especies de bacterias productoras de butirato:
- Clostridium butyricum
- Clostridium kluyveri
- Clostridium pasteurianum
- Faecalibacterium prausnitzii
- Fusobacterium nucleatum
- Butyrivibrio fibrisolvens
- Eubacterium limosum
La vía comienza con la escisión glucolítica de la glucosa en dos moléculas de piruvato, como sucede en la mayoría de los organismos. El piruvato se oxida a acetil coenzima A catalizada por piruvato: ferredoxina oxidorreductasa. Dos moléculas de dióxido de carbono (CO2) y dos moléculas de hidrógeno (H2) se forman como productos de desecho. Posteriormente, se produce ATP en el último paso de la fermentación. Se producen tres moléculas de ATP por cada molécula de glucosa, un rendimiento relativamente alto. La ecuación balanceada para esta fermentación es
- C6H12O6 → C4H8O2 + 2CO2 + 2H2
Otras vías hacia el butirato incluyen la reducción de succinato y la desproporción de crotonato.
| Medida | Enzima responsable |
|---|---|
| Acetyl coenzyme Un convertido en acetoacetil coenzyme A | acetyl-CoA-acetyl transferase |
| Acetoacetyl coenzyme Un convertido en β-hidroxibutyryl CoA | β-hidroxibutyryl-CoA deshidrogenasa |
| β-hidroxibutyryl CoA convierte en crotonyl CoA | crotonase |
| Crotonyl CoA convierte en butyryl CoA (CH3CH2CH2C=O−CoA) | butyryl CoA dehydrogenase |
| Un grupo de fosfato reemplaza a la AA para formar fosfato butil | fosfobutyrylase |
| El grupo fosfato se une a ADP para formar ATP y butyrate | butyrate kinase |
Varias especies forman acetona y n-butanol en una vía alternativa, que comienza como fermentación de butirato. Algunas de estas especies son:
- Clostridium acetobutylicum, el productor de acetona y butanol más prominente, utilizado también en la industria
- Clostridium beijerinckii
- Clostridium tetanomorfum
- Clostridium aurantibutyricum
Estas bacterias comienzan con la fermentación de butirato, como se describió anteriormente, pero, cuando el pH cae por debajo de 5, pasan a la producción de butanol y acetona para evitar una mayor disminución del pH. Por cada molécula de acetona se forman dos moléculas de butanol.
El cambio en la ruta ocurre después de la formación de acetoacetil CoA. Este intermedio toma entonces dos caminos posibles:
- acetoacetil CoA → acetoacetate → acetone
- acetoacetil CoA → butyryl CoA → butyraldehyde → butanol
Fuentes de fibra fermentable
Los residuos de fibra altamente fermentables, como los del almidón resistente, el salvado de avena, la pectina y el guar, son transformados por las bacterias del colon en ácidos grasos de cadena corta (SCFA), incluido el butirato, que producen más SCFA que las fibras menos fermentables, como las celulosas.. Un estudio encontró que el almidón resistente produce consistentemente más butirato que otros tipos de fibra dietética. La producción de SCFA a partir de fibras en animales rumiantes como el ganado es responsable del contenido de butirato de la leche y la mantequilla.
Los fructanos son otra fuente de fibras dietéticas solubles prebióticas que se pueden digerir para producir butirato. A menudo se encuentran en las fibras solubles de los alimentos con alto contenido de azufre, como el allium y las verduras crucíferas. Las fuentes de fructanos incluyen el trigo (aunque algunas variedades de trigo, como la espelta, contienen cantidades más bajas), centeno, cebada, cebolla, ajo, alcachofa de Jerusalén y globo, espárragos, remolacha, achicoria, hojas de diente de león, puerro, achicoria, la parte blanca de la cebolla tierna., brócoli, coles de Bruselas, col, hinojo y prebióticos, como fructooligosacáridos (FOS), oligofructosa e inulina.
Reacciones
El ácido butírico reacciona como un ácido carboxílico típico: puede formar derivados de amida, éster, anhídrido y cloruro. Este último, el cloruro de butirilo, se usa comúnmente como intermedio para obtener los demás.
Usos
El ácido butírico se utiliza en la preparación de varios ésteres de butirato. Se utiliza para producir butirato de acetato de celulosa (CAB), que se utiliza en una amplia variedad de herramientas, pinturas y revestimientos, y es más resistente a la degradación que el acetato de celulosa. CAB puede degradarse con la exposición al calor y la humedad, liberando ácido butírico.
Los ésteres de ácido butírico de bajo peso molecular, como el butirato de metilo, tienen en su mayoría aromas o sabores agradables. Como consecuencia, se utilizan como aditivos para alimentos y perfumes. Es un aromatizante alimentario aprobado en la base de datos EU FLAVIS (número 08.005).
Debido a su potente olor, también se ha utilizado como aditivo para cebos de pesca. Muchos de los sabores disponibles en el mercado que se utilizan en los cebos para carpa (Cyprinus carpio) utilizan ácido butírico como base de éster. No está claro si los peces son atraídos por el propio ácido butírico o por las sustancias que se le añaden. El ácido butírico fue uno de los pocos ácidos orgánicos que demostró ser apetecible tanto para la tenca como para la amarga. La sustancia ha sido utilizada como bomba fétida por la Sea Shepherd Conservation Society para interrumpir las tripulaciones balleneras japonesas.
Farmacología
| Enzima inhibida | IC50 (nM) | Nota de entrada |
|---|---|---|
| HDAC1 | 16.000 | |
| HDAC2 | 12.000 | |
| HDAC3 | 9.000 | |
| HDAC4 | 2,000,000 | Limitado inferior |
| HDAC5 | 2,000,000 | Limitado inferior |
| HDAC6 | 2,000,000 | Limitado inferior |
| HDAC7 | 2,000,000 | Limitado inferior |
| HDAC8 | 15.000 | |
| HDAC9 | 2,000,000 | Limitado inferior |
| CA1 | 511. | |
| CA2 | 1.032.000 | |
| Objetivo del GPCR | pEC50 | Nota de entrada |
| FFAR2 | 2.9 a 4.6 | Agonista completo |
| FFAR3 | 3.8 a 4.9 | Agonista completo |
| HCA2 | 2.8 | Agonista |
Farmacodinámica
El ácido butírico (pKa 4,82) está totalmente ionizado a pH fisiológico, por lo que su anión es el material de mayor relevancia en los sistemas biológicos. Es uno de los dos agonistas endógenos primarios del receptor de ácido hidroxicarboxílico humano 2 (HCA2, también conocido como GPR109A), un receptor acoplado a proteína G acoplado a Gi/o (GPCR),
Al igual que otros ácidos grasos de cadena corta (AGCC), el butirato es un agonista de los receptores de ácidos grasos libres FFAR2 y FFAR3, que funcionan como sensores de nutrientes que facilitan el control homeostático del equilibrio energético; sin embargo, entre el grupo de SCFA, solo el butirato es un agonista de HCA2. También es un inhibidor de HDAC (en concreto, HDAC1, HDAC2, HDAC3 y HDAC8), fármaco que inhibe la función de las enzimas histona desacetilasa, favoreciendo así un estado acetilado de las histonas en las células. La acetilación de histonas afloja la estructura de la cromatina al reducir la atracción electrostática entre las histonas y el ADN. En general, se cree que los factores de transcripción no podrán acceder a regiones donde las histonas están estrechamente asociadas con el ADN (es decir, no acetiladas, por ejemplo, heterocromatina). Por lo tanto, se cree que el ácido butírico mejora la actividad transcripcional en los promotores, que normalmente están silenciados o regulados a la baja debido a la actividad de la histona desacetilasa.
Farmacocinética
El butirato que se produce en el colon a través de la fermentación microbiana de la fibra dietética es principalmente absorbido y metabolizado por los colonocitos y el hígado para la generación de ATP durante el metabolismo energético; sin embargo, algo de butirato se absorbe en el colon distal, que no está conectado a la vena porta, lo que permite la distribución sistémica de butirato a múltiples órganos y sistemas a través del sistema circulatorio. El butirato que ha alcanzado la circulación sistémica puede cruzar fácilmente la barrera hematoencefálica a través de transportadores de monocarboxilato (es decir, ciertos miembros del grupo de transportadores SLC16A). Otros transportadores que median el paso del butirato a través de las membranas lipídicas incluyen SLC5A8 (SMCT1), SLC27A1 (FATP1) y SLC27A4 (FATP4).
Metabolismo
El ácido butírico es metabolizado por varias XM-ligasas humanas (ACSM1, ACSM2B, ASCM3, ACSM4, ACSM5 y ACSM6), también conocidas como butirato-CoA ligasa. El metabolito producido por esta reacción es butiril-CoA y se produce de la siguiente manera:
- Adenosina triphosphate + ácido butírico + coenzime A → monofosfato adenosina + pirofosfato + butyryl-CoA
Como ácido graso de cadena corta, el butirato es metabolizado por las mitocondrias como fuente de energía (es decir, trifosfato de adenosina o ATP) a través del metabolismo de los ácidos grasos. En particular, es una importante fuente de energía para las células que recubren el colon de los mamíferos (colonocitos). Sin butiratos, las células del colon experimentan autofagia (es decir, autodigestión) y mueren.
En los seres humanos, el precursor del butirato, la tributirina, que está presente de forma natural en la mantequilla, es metabolizado por la triacilglicerol lipasa en dibutirina y butirato a través de la reacción:
- Tributyrin + H2O → dibutyrin + ácido butírico
Bioquímica
El butirato tiene numerosos efectos sobre la homeostasis energética y las enfermedades relacionadas (diabetes y obesidad), la inflamación y la función inmunológica (por ejemplo, tiene efectos antimicrobianos y anticancerígenos pronunciados) en humanos. Estos efectos ocurren a través de su metabolismo por las mitocondrias para generar ATP durante el metabolismo de los ácidos grasos o a través de uno o más de sus objetivos enzimáticos modificadores de histonas (es decir, las histonas desacetilasas de clase I) y Objetivos de receptores acoplados a proteína G (es decir, FFAR2, FFAR3 y HCA2).
En el intestino de los mamíferos
El butirato es esencial para la homeostasis inmunitaria del huésped. Aunque el papel y la importancia del butirato en el intestino no se comprenden por completo, muchos investigadores argumentan que el agotamiento de las bacterias productoras de butirato en pacientes con varias enfermedades vasculíticas es esencial para la patogenia de estos trastornos. Un agotamiento de butirato en el intestino generalmente es causado por la ausencia o el agotamiento de las bacterias productoras de butirato (BPB). Este agotamiento en BPB conduce a la disbiosis microbiana. Esto se caracteriza por una baja biodiversidad general y un agotamiento de los miembros clave productores de butirato. El butirato es un metabolito microbiano esencial con un papel vital como modulador de la función inmunitaria adecuada en el huésped. Se ha demostrado que los niños que carecen de BPB son más susceptibles a enfermedades alérgicas y diabetes tipo 1. El butirato también se reduce en una dieta baja en fibra que puede inducir inflamación y tener otros efectos adversos en la medida en que estos ácidos grasos de cadena corta activen PPAR-γ.
El butirato ejerce un papel clave en el mantenimiento de la homeostasis inmunitaria tanto localmente (en el intestino) como sistémicamente (a través del butirato circulante). Se ha demostrado que promueve la diferenciación de las células T reguladoras. En particular, el butirato circulante estimula la generación de células T reguladoras extratímicas. Los bajos niveles de butirato en sujetos humanos podrían favorecer un control reducido mediado por células T reguladoras, promoviendo así una poderosa respuesta inmunopatológica de células T. Por otro lado, se ha informado que el butirato intestinal inhibe las citocinas proinflamatorias locales. Por lo tanto, la ausencia o el agotamiento de estos BPB en el intestino podría ser un posible ayudante en la respuesta inflamatoria demasiado activa. El butirato en el intestino también protege la integridad de la barrera epitelial intestinal. Por lo tanto, los niveles reducidos de butirato conducen a una barrera epitelial intestinal dañada o disfuncional.
En un estudio de investigación de 2013 realizado por Furusawa et al., se descubrió que el butirato derivado de microbios es esencial para inducir la diferenciación de las células T reguladoras del colon en ratones. Esto es de gran importancia y posiblemente relevante para la patogenia y la vasculitis asociadas con muchas enfermedades inflamatorias porque las células T reguladoras tienen un papel central en la supresión de las respuestas inflamatorias y alérgicas. En varios estudios de investigación se ha demostrado que el butirato inducía la diferenciación de células T reguladoras in vitro e in vivo. La capacidad antiinflamatoria del butirato ha sido ampliamente analizada y respaldada por muchos estudios. Se ha encontrado que el butirato producido por microorganismos acelera la producción de células T reguladoras, aunque no está claro el mecanismo específico por el cual lo hace. Más recientemente, se ha demostrado que el butirato juega un papel esencial y directo en la modulación de la expresión génica de las células T citotóxicas. El butirato también tiene un efecto antiinflamatorio sobre los neutrófilos, reduciendo su migración a las heridas. Este efecto está mediado por el receptor HCA1
En los microbiomas intestinales que se encuentran en la clase Mammalia, los omnívoros y herbívoros tienen comunidades bacterianas productoras de butirato dominadas por la vía butiril-CoA:acetato CoA-transferasa, mientras que los carnívoros tienen comunidades bacterianas productoras de butirato dominadas por la vía butirato quinasa.
Inmunomodulación e inflamación
Los efectos del butirato en el sistema inmunitario están mediados por la inhibición de las histonas desacetilasas de clase I y la activación de sus receptores acoplados a proteínas G: HCA2 (GPR109A), FFAR2 (GPR43) y FFAR3 (GPR41). Entre los ácidos grasos de cadena corta, el butirato es el promotor más potente de las células T reguladoras intestinales in vitro y el único del grupo que es un HCA2 ligando. Se ha demostrado que es un mediador crítico de la respuesta inflamatoria del colon. Posee potencial tanto preventivo como terapéutico para contrarrestar la colitis ulcerosa mediada por inflamación y el cáncer colorrectal.
El butirato ha establecido propiedades antimicrobianas en humanos que están mediadas por el péptido antimicrobiano LL-37, que induce a través de la inhibición de HDAC en la histona H3. In vitro, el butirato aumenta la expresión génica de FOXP3 (el regulador de la transcripción de las Tregs) y promueve las células T reguladoras del colon (Tregs) a través de la inhibición de las histonas desacetilasas de clase I; a través de estas acciones, aumenta la expresión de la interleucina 10, una citocina antiinflamatoria. El butirato también suprime la inflamación del colon al inhibir las vías de señalización de IFN-γ-STAT1, que está mediada parcialmente por la inhibición de la histona desacetilasa. Mientras que la señalización transitoria de IFN-γ generalmente se asocia con una respuesta inmune normal del huésped, la señalización crónica de IFN-γ a menudo se asocia con inflamación crónica. Se ha demostrado que el butirato inhibe la actividad de HDAC1 que se une al promotor del gen Fas en las células T, lo que da como resultado la hiperacetilación del promotor Fas y la regulación positiva del receptor Fas en la superficie de las células T.
Al igual que otros agonistas HCA2 estudiados, el butirato también produce marcados efectos antiinflamatorios en un variedad de tejidos, incluyendo el cerebro, el tracto gastrointestinal, la piel y el tejido vascular. La unión de butirato en FFAR3 induce la liberación del neuropéptido Y y promueve la homeostasis funcional de la mucosa colónica y el sistema inmunitario entérico.
Cáncer
Se ha demostrado que el butirato es un mediador fundamental de la respuesta inflamatoria del colon. Es responsable de alrededor del 70% de la energía de los colonocitos, siendo un SCFA crítico en la homeostasis del colon. El butirato posee un potencial tanto preventivo como terapéutico para contrarrestar la colitis ulcerosa (CU) mediada por inflamación y el cáncer colorrectal. Produce diferentes efectos en células sanas y cancerosas: esto se conoce como la "paradoja del butirato". En particular, el butirato inhibe las células tumorales colónicas y estimula la proliferación de células epiteliales colónicas sanas. La explicación de por qué el butirato es una fuente de energía para los colonocitos normales e induce la apoptosis en las células de cáncer de colon es el efecto Warburg en las células cancerosas, que hace que el butirato no se metabolice adecuadamente. Este fenómeno conduce a la acumulación de butirato en el núcleo, que actúa como inhibidor de la histona desacetilasa (HDAC). Un mecanismo subyacente a la función del butirato en la supresión de la inflamación del colon es la inhibición de las vías de señalización de IFN-γ/STAT1. Se ha demostrado que el butirato inhibe la actividad de HDAC1 que se une al promotor del gen Fas en las células T, lo que da como resultado la hiperacetilación del promotor Fas y la regulación positiva del receptor Fas en la superficie de las células T. Por lo tanto, se sugiere que el butirato aumenta la apoptosis de las células T en el tejido del colon y, por lo tanto, elimina la fuente de inflamación (producción de IFN-γ). El butirato inhibe la angiogénesis al inactivar la actividad del factor de transcripción Sp1 y regular a la baja la expresión del gen del factor de crecimiento endotelial vascular.
En resumen, la producción de ácidos grasos volátiles como el butirato a partir de fibras fermentables puede contribuir al papel de la fibra dietética en el cáncer de colon. Los ácidos grasos de cadena corta, que incluyen el ácido butírico, son producidos por bacterias colónicas beneficiosas (probióticos) que se alimentan o fermentan prebióticos, que son productos vegetales que contienen fibra dietética. Estos ácidos grasos de cadena corta benefician a los colonocitos al aumentar la producción de energía y pueden proteger contra el cáncer de colon al inhibir la proliferación celular.
Por el contrario, algunos investigadores han tratado de eliminar el butirato y lo consideran un factor potencial de cáncer. Los estudios en ratones indican que impulsa la transformación de las células epiteliales del colon deficientes en MSH2.
Tratamientos potenciales de la restauración con butirato
Debido a la importancia del butirato como regulador inflamatorio y colaborador del sistema inmunitario, las depleciones de butirato podrían ser un factor clave que influya en la patogenia de muchas enfermedades vasculíticas. Por lo tanto, es esencial mantener niveles saludables de butirato en el intestino. Los trasplantes de microbiota fecal (para restaurar la BPB y la simbiosis en el intestino) podrían ser efectivos al reponer los niveles de butirato. En este tratamiento, una persona sana dona sus heces para trasplantarlas a una persona con disbiosis. Una opción de tratamiento menos invasiva es la administración de butirato, como suplementos orales o enemas, que ha demostrado ser muy eficaz para eliminar los síntomas de la inflamación con efectos secundarios mínimos o nulos. En un estudio en el que los pacientes con colitis ulcerosa fueron tratados con enemas de butirato, la inflamación disminuyó significativamente y el sangrado cesó por completo después de la administración de butirato.
Adicción
El ácido butírico es un inhibidor de HDAC que es selectivo para las HDAC de clase I en humanos. Las HDAC son enzimas modificadoras de histonas que pueden causar la desacetilación de histonas y la represión de la expresión génica. Los HDAC son reguladores importantes de la formación sináptica, la plasticidad sináptica y la formación de la memoria a largo plazo. Se sabe que las HDAC de clase I intervienen en la mediación del desarrollo de una adicción. El ácido butírico y otros inhibidores de HDAC se han utilizado en investigaciones preclínicas para evaluar los efectos transcripcionales, neurales y conductuales de la inhibición de HDAC en animales adictos a las drogas.
Sales y ésteres de butirato
El ion butirato o butanoato, C3 H7COO−, es la base conjugada del ácido butírico. Es la forma que se encuentra en los sistemas biológicos a pH fisiológico. Un compuesto butírico (o butanoico) es una sal de carboxilato o un éster de ácido butírico.
Ejemplos
Sales
- Butirato de sodio
Ésteres
- Butyl butyrate
- Butyryl-CoA
- Butirato de acetato de celulosa (hipo de aeronaves)
- Estradiol benzoato butyrate
- Ethyl butyrate
- Metil butyrate
- Butyrate Pentyl
- Tributyrin
Contenido relacionado
Michael Swanwick
Clase M
Fourier