Acetiluro
En química organometálica, acetiluro se refiere a compuestos químicos con las fórmulas químicas MC≡CH y MC ≡CM, donde M es un metal. El término se usa de manera vaga y puede referirse a acetiluros sustituidos que tienen la estructura general RC≡CM (donde R es una cadena lateral orgánica). Los acetiluros son reactivos en síntesis orgánica. El acetiluro de calcio, comúnmente llamado carburo de calcio, es un compuesto importante en el comercio.
Estructura y unión
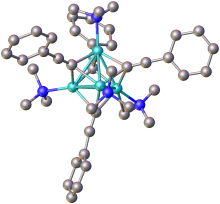
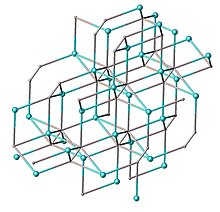
Los acetiluros de metales alcalinos y alcalinotérreos de fórmula general MC≡CM son compuestos de fase Zintl similares a sales que contienen C2−
>2 iones. Se puede ver evidencia de este carácter iónico en la fácil hidrólisis de estos compuestos para formar acetileno y óxidos metálicos; también hay alguna evidencia de la solubilidad del C2−
>2</sub iones en amoníaco líquido. El C2−
2 El ion tiene un estado fundamental de capa cerrada de 1Σ+
g, lo que lo hace isoelectrónico con respecto a una molécula neutra N2, lo que puede proporcionarle cierta estabilidad.
Los acetiluros análogos preparados a partir de otros metales, particularmente metales de transición, muestran carácter covalente y están invariablemente asociados con sus centros metálicos. Esto se puede ver en su estabilidad general al agua (como acetiluro de plata, acetiluro de cobre) y aplicaciones químicas radicalmente diferentes.
Los acetiluros de fórmula general RC≡CM (donde R = H o alquilo) generalmente muestran propiedades similares a sus análogos doblemente sustituidos. En ausencia de ligandos adicionales, los acetiluros metálicos adoptan estructuras poliméricas en las que los grupos acetiluro son ligandos puente.
Preparación
Los alquinos terminales son ácidos débiles:
- RCristán + R.M.
Generar acetiladas de acetileno y alquinos se basa en el uso de superbases organometálicos o inorgánicos en solventes que son menos ácidos que el alquino terminal. En estudios tempranos se empleó amoníaco líquido, pero los solventes etéreos son más comunes.
La amida de litio, LiHMDS o reactivos de organolitio, como el butillitio, se utilizan con frecuencia para formar acetiluros de litio:
- [{ce {THF}}][-78^{circ }{ce {C}}]{Li-!{equiv }!-H}+BuH}}}" xmlns="http://www.w3.org/1998/Math/MathML">H− − C↑ ↑ C− − H+BuLibutyllithium→− − 78∘ ∘ CTHFLi− − ↑ ↑ − − H+BuH{fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {fnMicrosoft {f}\fnMicrosoft {\fnMicrosoft {fnMicrosoft {fnMicrosoft}\fnMicrosoft {\fnMicrosoft\fnMicrosoft\\\\\fnMicrosoft\\\\fnMicrosoft\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\\\\\\\\\\\\\\fnMicrosoft\\\\\\\\\\\\\\\\\\\\\\\ {H-C{equiv {fnMicrosoft} {fnMicrosoft} {fnMicrosoft} {fnMicrosoft} {fnMicrosoft} {fnMicrosoft} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} }
[{ce {THF}}][-78^{circ }{ce {C}}]{Li-!{equiv }!-H}+BuH}}}" aria-hidden="true" class="mwe-math-fallback-image-inline mw-invert" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/7f2a31939e76759509d17aec8c45e1c46780193c" style="vertical-align: -1.974ex; margin-bottom: -0.531ex; width:47.678ex; height:6.343ex;"/>
El acetiluro monopotásico y monosódico se puede preparar a partir de diversos reactivos inorgánicos (como la amida de sodio) o de sus metales elementales, a menudo a temperatura ambiente y presión atmosférica.
El acetiluro de cobre(I) se puede preparar pasando acetileno a través de una solución acuosa de cloruro de cobre(I) debido a un equilibrio de baja solubilidad. De manera similar, a partir del nitrato de plata se pueden obtener acetiluros de plata.
El carburo de calcio se prepara calentando carbono con cal (óxido de calcio) a aproximadamente 2.000 °C. Un proceso similar se utiliza para producir carburo de litio.
Reacciones
Acetildes del tipo RC2M son ampliamente utilizados en las alquiniciones en química orgánica. Son nucleófilos que añaden a una variedad de sustratos electrofilos e insaturados. Una aplicación clásica es la reacción Favorskii.
La secuencia que se muestra a continuación es ilustrativa: el propiolato de etilo se desprotona mediante n-butillitio para dar el acetiluro correspondiente. Este acetiluro se suma al centro carbonilo de la ciclopentanona. El tratamiento hidrolítico libera el alcohol alquinílico.

Reacciones de acoplamiento
Los acetiluros son a veces intermediarios en reacciones de acoplamiento. Los ejemplos incluyen el acoplamiento Sonogashira, el acoplamiento Cadiot-Chodkiewicz, el acoplamiento Glaser y el acoplamiento Eglinton.
Peligros
Algunos acetiluros son notoriamente explosivos. La formación de acetiluros supone un riesgo en la manipulación de acetileno gaseoso en presencia de metales como mercurio, plata o cobre, o aleaciones con su alto contenido (latón, bronce, soldadura de plata).
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar