Acetilcolina
La acetilcolina (ACh) es una sustancia química orgánica que funciona en el cerebro y el cuerpo de muchos tipos de animales (incluidos los humanos) como neurotransmisor. Su nombre se deriva de su estructura química: es un éster de ácido acético y colina. Las partes del cuerpo que usan o se ven afectadas por la acetilcolina se denominan colinérgicas. Las sustancias que aumentan o disminuyen la actividad general del sistema colinérgico se denominan colinérgicos y anticolinérgicos, respectivamente.
La acetilcolina es el neurotransmisor que se usa en la unión neuromuscular; en otras palabras, es la sustancia química que liberan las neuronas motoras del sistema nervioso para activar los músculos. Esta propiedad significa que las drogas que afectan los sistemas colinérgicos pueden tener efectos muy peligrosos que van desde la parálisis hasta las convulsiones. La acetilcolina también es un neurotransmisor en el sistema nervioso autónomo, como transmisor interno del sistema nervioso simpático y como producto final liberado por el sistema nervioso parasimpático. La acetilcolina es el principal neurotransmisor del sistema nervioso parasimpático.
En el cerebro, la acetilcolina funciona como neurotransmisor y como neuromodulador. El cerebro contiene varias áreas colinérgicas, cada una con funciones distintas; tales como desempeñar un papel importante en la excitación, la atención, la memoria y la motivación.
También se ha encontrado acetilcolina en células de origen no neural, así como en microbios. Recientemente, las enzimas relacionadas con su síntesis, degradación y captación celular se remontan a los primeros orígenes de los eucariotas unicelulares. El patógeno protista Acanthamoeba spp. han mostrado evidencia de la presencia de ACh, que proporciona señales de crecimiento y proliferación a través de un homólogo del receptor muscarínico M1 ubicado en la membrana.
En parte debido a su función de activación muscular, pero también a sus funciones en el sistema nervioso autónomo y el cerebro, muchos fármacos importantes ejercen sus efectos alterando la transmisión colinérgica. Numerosos venenos y toxinas producidos por plantas, animales y bacterias, así como agentes nerviosos químicos como el sarín, causan daño al inactivar o hiperactivar los músculos a través de sus influencias en la unión neuromuscular. Los medicamentos que actúan sobre los receptores muscarínicos de acetilcolina, como la atropina, pueden ser venenosos en grandes cantidades, pero en dosis más pequeñas se usan comúnmente para tratar ciertas afecciones cardíacas y problemas oculares. La escopolamina o difenhidramina, que actúa principalmente sobre los receptores muscarínicos del cerebro, puede causar delirio, alucinaciones y amnesia. Las cualidades adictivas de la nicotina se derivan de sus efectos sobre los receptores nicotínicos de acetilcolina en el cerebro.
Química
La acetilcolina es una molécula de colina que ha sido acetilada en el átomo de oxígeno. Debido al grupo amonio cargado, la acetilcolina no penetra en las membranas lipídicas. Por ello, cuando la molécula se introduce externamente, permanece en el espacio extracelular y actualmente se considera que la molécula no atraviesa la barrera hematoencefálica.
Bioquímica
La acetilcolina se sintetiza en ciertas neuronas mediante la enzima colina acetiltransferasa a partir de los compuestos colina y acetil-CoA. Las neuronas colinérgicas son capaces de producir ACh. Un ejemplo de un área colinérgica central es el núcleo basal de Meynert en el prosencéfalo basal. La enzima acetilcolinesterasa convierte la acetilcolina en los metabolitos inactivos colina y acetato. Esta enzima abunda en la hendidura sináptica y su papel en la eliminación rápida de la acetilcolina libre de la sinapsis es esencial para la función muscular adecuada. Ciertas neurotoxinas actúan inhibiendo la acetilcolinesterasa, lo que provoca un exceso de acetilcolina en la unión neuromuscular, lo que provoca la parálisis de los músculos necesarios para respirar y detiene los latidos del corazón.
Funciones
La acetilcolina funciona tanto en el sistema nervioso central (SNC) como en el sistema nervioso periférico (SNP). En el SNC, las proyecciones colinérgicas desde el prosencéfalo basal hasta la corteza cerebral y el hipocampo respaldan las funciones cognitivas de esas áreas objetivo. En el SNP, la acetilcolina activa los músculos y es un neurotransmisor importante en el sistema nervioso autónomo.
Efectos celulares
Al igual que muchas otras sustancias biológicamente activas, la acetilcolina ejerce sus efectos al unirse y activar los receptores ubicados en la superficie de las células. Hay dos clases principales de receptores de acetilcolina, nicotínicos y muscarínicos. Reciben su nombre de sustancias químicas que pueden activar selectivamente cada tipo de receptor sin activar el otro: la muscarina es un compuesto que se encuentra en el hongo Amanita muscaria; la nicotina se encuentra en el tabaco.
Los receptores nicotínicos de acetilcolina son canales iónicos activados por ligandos permeables a los iones de sodio, potasio y calcio. En otras palabras, son canales iónicos incrustados en las membranas celulares, capaces de cambiar de un estado cerrado a uno abierto cuando la acetilcolina se une a ellos; en estado abierto permiten el paso de iones. Los receptores nicotínicos vienen en dos tipos principales, conocidos como de tipo muscular y de tipo neuronal. El tipo muscular puede bloquearse selectivamente con curare, el tipo neuronal con hexametonio. La ubicación principal de los receptores de tipo muscular se encuentra en las células musculares, como se describe con más detalle a continuación. Los receptores de tipo neuronal se encuentran en los ganglios autónomos (tanto simpáticos como parasimpáticos) y en el sistema nervioso central.
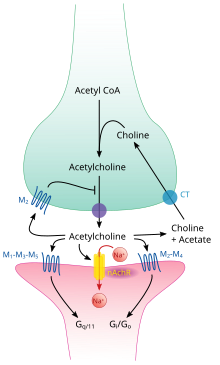
Los receptores de acetilcolina muscarínicos tienen un mecanismo más complejo y afectan a las células diana durante un período de tiempo más prolongado. En los mamíferos, se han identificado cinco subtipos de receptores muscarínicos, etiquetados como M1 a M5. Todos ellos funcionan como receptores acoplados a proteínas G, lo que significa que ejercen sus efectos a través de un sistema de segundos mensajeros. Los subtipos M1, M3 y M5 están acoplados a Gq; aumentan los niveles intracelulares de IP3 y calcio al activar la fosfolipasa C. Su efecto sobre las células diana suele ser excitatorio. Los subtipos M2 y M4 están acoplados a Gi/Go; disminuyen los niveles intracelulares de AMPc al inhibir la adenilato ciclasa. Su efecto sobre las células diana suele ser inhibitorio. Los receptores muscarínicos de acetilcolina se encuentran tanto en el sistema nervioso central como en el sistema nervioso periférico del corazón, los pulmones, el tracto gastrointestinal superior y las glándulas sudoríparas.
Unión neuromuscular
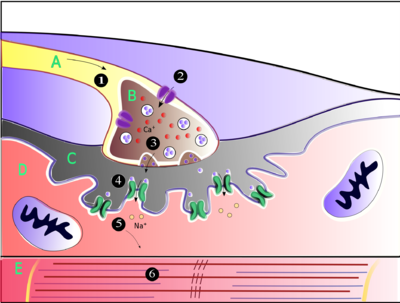
La acetilcolina es la sustancia que utiliza el sistema nervioso para activar los músculos esqueléticos, una especie de músculo estriado. Estos son los músculos que se utilizan para todo tipo de movimiento voluntario, en contraste con el tejido muscular liso, que participa en una serie de actividades involuntarias, como el movimiento de los alimentos a través del tracto gastrointestinal y la constricción de los vasos sanguíneos. Los músculos esqueléticos están controlados directamente por neuronas motoras ubicadas en la médula espinal o, en algunos casos, en el tronco encefálico. Estas neuronas motoras envían sus axones a través de los nervios motores, de los cuales emergen para conectarse a las fibras musculares en un tipo especial de sinapsis llamada unión neuromuscular.
Cuando una neurona motora genera un potencial de acción, viaja rápidamente a lo largo del nervio hasta llegar a la unión neuromuscular, donde inicia un proceso electroquímico que hace que se libere acetilcolina en el espacio entre la terminal presináptica y la fibra muscular. Las moléculas de acetilcolina luego se unen a los receptores de los canales de iones nicotínicos en la membrana de la célula muscular, lo que hace que se abran los canales de iones. Luego, los iones de sodio fluyen hacia la célula muscular, iniciando una secuencia de pasos que finalmente producen la contracción muscular.
Factores que disminuyen la liberación de acetilcolina (y, por lo tanto, afectan los canales de calcio de tipo P):
- Antibióticos (clindamicina, polimicina)
- Magnesio: antagoniza Canales de calcio tipo P
- Hipocalcemia
- Anticonvulsivos
- Diuréticos (furosemida)
- Síndrome Eaton-Lambert: inhibe los canales de calcio tipo P
- Miastenia gravis
- Toxina botulínica: inhibe las proteínas SNARE
Los bloqueadores de los canales de calcio (nifedipina, diltiazem) no afectan los canales P. Estos medicamentos afectan los canales de calcio de tipo L.
Sistema nervioso autónomo
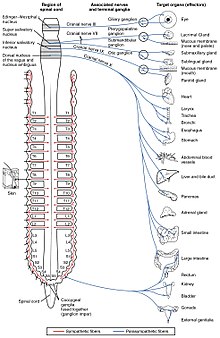
El sistema nervioso autónomo controla una amplia gama de funciones corporales involuntarias e inconscientes. Sus ramas principales son el sistema nervioso simpático y el sistema nervioso parasimpático. En términos generales, la función del sistema nervioso simpático es movilizar el cuerpo para la acción; la frase que se invoca a menudo para describirlo es lucha o huida. La función del sistema nervioso parasimpático es poner al cuerpo en un estado propicio para el descanso, la regeneración, la digestión y la reproducción; la frase que se invoca a menudo para describirlo es "descansar y digerir" o "alimentar y criar". Ambos sistemas mencionados anteriormente usan acetilcolina, pero de diferentes maneras.
A nivel esquemático, los sistemas nerviosos simpático y parasimpático están organizados esencialmente de la misma manera: las neuronas preganglionares del sistema nervioso central envían proyecciones a las neuronas ubicadas en los ganglios autónomos, que envían proyecciones de salida a prácticamente todos los tejidos del cuerpo.. En ambas ramas, las conexiones internas, las proyecciones del sistema nervioso central a los ganglios autónomos, utilizan la acetilcolina como neurotransmisor para inervar (o excitar) las neuronas de los ganglios. En el sistema nervioso parasimpático las conexiones de salida, las proyecciones de las neuronas ganglionares a tejidos que no pertenecen al sistema nervioso, también liberan acetilcolina pero actúan sobre los receptores muscarínicos. En el sistema nervioso simpático, las conexiones de salida liberan principalmente noradrenalina, aunque se libera acetilcolina en algunos puntos, como la inervación sudomotora de las glándulas sudoríparas.
Efectos vasculares directos
La acetilcolina en el suero ejerce un efecto directo sobre el tono vascular al unirse a los receptores muscarínicos presentes en el endotelio vascular. Estas células responden aumentando la producción de óxido nítrico, lo que indica al músculo liso circundante que se relaje, lo que lleva a la vasodilatación.
Sistema nervioso central
En el sistema nervioso central, la ACh tiene una variedad de efectos sobre la plasticidad, la excitación y la recompensa. ACh tiene un papel importante en la mejora del estado de alerta cuando nos despertamos, en el mantenimiento de la atención y en el aprendizaje y la memoria.
Se ha demostrado que el daño al sistema colinérgico (productor de acetilcolina) en el cerebro está asociado con los déficits de memoria asociados con la enfermedad de Alzheimer. También se ha demostrado que la ACh promueve el sueño REM.
En el tronco encefálico, la acetilcolina se origina en el núcleo pedunculopontino y el núcleo tegmentario laterodorsal, conocidos colectivamente como área del tegmento mesopontino o complejo pontomesencefalo-tegmentario. En el prosencéfalo basal, se origina en el núcleo basal de Meynert y el núcleo septal medial:
- El complejo actúa principalmente en los receptores M1 en el tronco cerebral, núcleos cerebellares profundos, núcleos pontinos, locus coeruleus, núcleo raphe, núcleo reticular lateral y aceituna inferior. También proyecta al tálamo, tectum, ganglia basal y forebraina basal.
- El núcleo basal de Meynert actúa principalmente en los receptores M1 en el neocortex.
- El núcleo septal medial actúa principalmente en los receptores M1 en el hipocampo y partes de la corteza cerebral.
Además, la ACh actúa como un importante transmisor interno en el cuerpo estriado, que forma parte de los ganglios basales. Es liberado por interneuronas colinérgicas. En humanos, primates no humanos y roedores, estas interneuronas responden a estímulos ambientales destacados con respuestas que se alinean temporalmente con las respuestas de las neuronas dopaminérgicas de la sustancia negra.
Memoria
La acetilcolina se ha relacionado con el aprendizaje y la memoria de varias maneras. El fármaco anticolinérgico, la escopolamina, impide la adquisición de nueva información en humanos y animales. En los animales, la interrupción del suministro de acetilcolina al neocórtex afecta el aprendizaje de tareas de discriminación simples, comparable a la adquisición de información fáctica, y la interrupción del suministro de acetilcolina al hipocampo y áreas corticales adyacentes produce olvido, comparable a la amnesia anterógrada en humanos..
Enfermedades y trastornos
Miastenia gravis
La enfermedad miastenia gravis, caracterizada por debilidad muscular y fatiga, ocurre cuando el cuerpo produce anticuerpos contra los receptores nicotínicos de acetilcolina de manera inapropiada y, por lo tanto, inhibe la transmisión adecuada de la señal de acetilcolina. Con el tiempo, la placa final del motor se destruye. Los fármacos que inhiben de forma competitiva la acetilcolinesterasa (p. ej., neostigmina, fisostigmina o principalmente piridostigmina) son eficaces para tratar los síntomas de este trastorno. Permiten que la acetilcolina liberada endógenamente tenga más tiempo para interactuar con su receptor respectivo antes de ser inactivada por la acetilcolinesterasa en la hendidura sináptica (el espacio entre el nervio y el músculo).
Farmacología
Bloquear, dificultar o imitar la acción de la acetilcolina tiene muchos usos en medicina. Los fármacos que actúan sobre el sistema de la acetilcolina son agonistas de los receptores, estimulando el sistema, o antagonistas, inhibiéndolo. Los agonistas y antagonistas de los receptores de acetilcolina pueden tener un efecto directamente sobre los receptores o ejercer sus efectos indirectamente, por ejemplo, afectando a la enzima acetilcolinesterasa, que degrada el ligando del receptor. Los agonistas aumentan el nivel de activación del receptor; los antagonistas lo reducen.
La acetilcolina en sí misma no tiene valor terapéutico como fármaco para administración intravenosa debido a su acción multifacética (no selectiva) y su rápida inactivación por la colinesterasa. Sin embargo, se utiliza en forma de colirio para provocar la constricción de la pupila durante la cirugía de cataratas, lo que facilita una rápida recuperación postoperatoria.
Receptores nicotínicos
La nicotina se une a los receptores nicotínicos de acetilcolina y los activa, imitando el efecto de la acetilcolina en estos receptores. ACh abre un Na+ canal al unirse para que Na+ fluya hacia la célula. Esto provoca una despolarización y da como resultado un potencial postsináptico excitatorio. Por tanto, la ACh es excitatoria en el músculo esquelético; la respuesta eléctrica es rápida y de corta duración. Los curares son venenos de flecha, que actúan en los receptores nicotínicos y se han utilizado para desarrollar terapias clínicamente útiles.
Receptores muscarínicos
Los receptores muscarínicos forman complejos de receptor acoplado a proteína G en las membranas celulares de las neuronas y otras células. La atropina es un antagonista competitivo no selectivo de la acetilcolina en los receptores muscarínicos.
Inhibidores de la colinesterasa
Muchos agonistas de los receptores de ACh funcionan indirectamente al inhibir la enzima acetilcolinesterasa. La acumulación resultante de acetilcolina provoca una estimulación continua de los músculos, las glándulas y el sistema nervioso central, lo que puede provocar convulsiones fatales si la dosis es alta.
Son ejemplos de inhibidores enzimáticos, y aumentan la acción de la acetilcolina retrasando su degradación; algunos se han utilizado como agentes nerviosos (gas neurotóxico Sarin y VX) o pesticidas (organofosforados y carbamatos). Muchas toxinas y venenos producidos por plantas y animales también contienen inhibidores de la colinesterasa. En uso clínico, se administran en dosis bajas para revertir la acción de los relajantes musculares, para tratar la miastenia grave y para tratar los síntomas de la enfermedad de Alzheimer (rivastigmina, que aumenta la actividad colinérgica en el cerebro).
Inhibidores de la síntesis
Los compuestos orgánicos de mercurio, como el metilmercurio, tienen una gran afinidad por los grupos sulfhidrilo, lo que provoca una disfunción de la enzima colina acetiltransferasa. Esta inhibición puede conducir a una deficiencia de acetilcolina y puede tener consecuencias en la función motora.
Inhibidores de la liberación
La toxina botulínica (Botox) actúa suprimiendo la liberación de acetilcolina, mientras que el veneno de la araña viuda negra (alfa-latrotoxina) tiene el efecto contrario. La inhibición de ACh causa parálisis. Cuando es mordido por una araña viuda negra, uno experimenta el desperdicio de los suministros de ACh y los músculos comienzan a contraerse. Si y cuando el suministro se agota, se produce la parálisis.
Biología comparada y evolución
La acetilcolina es utilizada por organismos en todos los dominios de la vida para una variedad de propósitos. Se cree que la colina, un precursor de la acetilcolina, fue utilizada por organismos unicelulares hace miles de millones de años para sintetizar fosfolípidos de la membrana celular. Siguiendo la evolución de los transportadores de colina, la abundancia de colina intracelular allanó el camino para que la colina se incorporara a otras vías sintéticas, incluida la producción de acetilcolina. La acetilcolina es utilizada por bacterias, hongos y una variedad de otros animales. Muchos de los usos de la acetilcolina se basan en su acción sobre los canales iónicos a través de los GPCR, como las proteínas de membrana.
Los dos tipos principales de receptores de acetilcolina, los receptores muscarínicos y nicotínicos, han evolucionado de manera convergente para responder a la acetilcolina. Esto significa que en lugar de haber evolucionado a partir de un homólogo común, estos receptores evolucionaron a partir de familias de receptores separadas. Se estima que la familia de receptores nicotínicos se remonta a más de 2.500 millones de años. Asimismo, se cree que los receptores muscarínicos se separaron de otros GPCR hace al menos 500 millones de años. Ambos grupos de receptores han desarrollado numerosos subtipos con afinidades de ligando y mecanismos de señalización únicos. La diversidad de los tipos de receptores permite que la acetilcolina cree respuestas variables según los tipos de receptores que se activen y permite que la acetilcolina regule dinámicamente los procesos fisiológicos. Los receptores ACh están relacionados con los receptores 5-HT3 (serotonina), GABA y glicina, tanto en secuencia como en estructura, lo que sugiere fuertemente que tienen un origen evolutivo común.
Historia
En 1867, Adolf von Baeyer resolvió las estructuras de la colina y la acetilcolina y las sintetizó, refiriéndose a esta última como "acetilneurina" en el estudio. La colina es un precursor de la acetilcolina. Esta es la razón por la que Frederick Walker Mott y William Dobinson Halliburton señalaron en 1899 que las inyecciones de colina reducían la presión arterial de los animales. Se observó por primera vez que la acetilcolina es biológicamente activa en 1906, cuando Reid Hunt (1870–1948) y René de M. Taveau descubrieron que disminuía la presión arterial en dosis excepcionalmente pequeñas.
En 1914, Arthur J. Ewins fue el primero en extraer acetilcolina de la naturaleza. Lo identificó como el contaminante que disminuye la presión arterial de algunos extractos de cornezuelo de centeno Claviceps purpurea, a pedido de Henry Hallett Dale. Más tarde, en 1914, Dale describió los efectos de la acetilcolina en varios tipos de sinapsis periféricas y también notó que reducía la presión arterial de los gatos a través de inyecciones subcutáneas incluso en dosis de un nanogramo.
El concepto de neurotransmisores se desconocía hasta 1921, cuando Otto Loewi observó que el nervio vago secretaba una sustancia que inhibía el músculo cardíaco mientras trabajaba como profesor en la Universidad de Graz. Lo llamó vagusstoff ("sustancia vaga"), señaló que era un análogo estructural de la colina y sospechó que era acetilcolina. En 1926, Loewi y E. Navratil dedujeron que el compuesto probablemente sea acetilcolina, ya que el vagusstoff y la acetilcolina sintética perdieron su actividad de manera similar cuando entraron en contacto con lisados de tejidos que contenían enzimas degradantes de acetilcolina (ahora conocidas como colinesterasas). Esta conclusión fue ampliamente aceptada. Estudios posteriores confirmaron la función de la acetilcolina como neurotransmisor.
En 1936, H. H. Dale y O. Loewi compartieron el Premio Nobel de Fisiología o Medicina por sus estudios sobre la acetilcolina y los impulsos nerviosos.
Referencias específicas
- ^ a b Tiwari P, Dwivedi S, Singh MP, Mishra R, Chandy A (octubre de 2012). "Conceptos básicos y modernos sobre el receptor cholinergic: Una revisión". Asian Pacific Journal of Tropical Disease. 3 (5): 413-420. doi:10.1016/S222222-1808(13)60094-8. PMC4027320.
- ^ Lott EL, Jones EB (junio 2019). "Toxicidad Cholinergica". StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 30969605.
- ^ Kapalka GM (2010). "Substances Involved in Neurotransmission". Terapias Nutricionales y Herbales para Niños y Adolescentes. Elsevier. pp. 71–99. doi:10.1016/b978-0-12-374927-7.00004-2. ISBN 978-0-12-374927-7.
- ^ Baig AM, Rana Z, Tariq S, Lalani S, Ahmad HR (marzo 2018). "Traced on the Timeline: Discovery of Acetylcholine and the Components of the Human Cholinergic System in a Primitive Unicellular Eukaryote Acanthamoeba spp". ACS Chem Neurosci. 9 (3): 494–504. doi:10.1021/acschemneuro.7b00254. PMID 29058403.
- ^ Baig AM, Ahmad HR (junio de 2017). "Evidence of a M1-muscarinic GPCR homolog in unicellular eukaryotes: with Acanthamoeba spp bioinformatics 3D-modelling and experimentations". J. Recept. Transductor de señal. Res. 37 (3): 267–275. doi:10.1080/10799893.2016.1217884. PMID 27601178. S2CID 5234123.
- ^ Smythies J (2009). "Filosofía, percepción y neurociencia". Percepción. 38 (5): 638–51. doi:10.1068/p6025. PMID 19662940. S2CID 45579740.
- ^ Smythies J, d'Oreye de Lantremange M (2016). "La naturaleza y función de los mecanismos de compresión de información digital en el cerebro y en la tecnología de televisión digital". Front Syst Neurosci. 10: 40. doi:10.3389/fnsys.2016.00040. PMC4858531. PMID 27199688.
- ^ Miller RD, Eriksson LI, Fleisher LA, Wiener-Kronish JP, Young WL, eds. (2009-01-01). Miller's Anesthesia (7a edición). Elsevier Health Sciences. pp. 343–47. ISBN 978-0-443-06959-8.
- ^ Kellogg DL, Zhao JL, Coey U, Green JV (Febrero 2005). "La vasodilatación inducida por la acetilcolina está mediada por óxido nitrico y prostaglandinas en la piel humana". J. Appl. Physiol. 98 (2): 629–32. doi:10.1152/japplphysiol.00728.2004. PMID 15649880. S2CID 293055.
- ^ Jones BE (noviembre de 2005). "De despertar a dormir: sustratos neuronales y químicos". Trends Pharmacol. Sci. 26 11): 578–86. doi:10.1016/j.tips.2005.09.009. PMID 16183137.
- ^ Himmelheber AM, Sarter M, Bruno JP (junio 2000). "El aumento de la liberación de acetilcolina cortical durante el desempeño sostenido de la atención en ratas". Resoluciones del cerebro. 9 (3): 313–25. doi:10.1016/S0926-6410(00)00012-4. PMID 10808142.
- ^ a b Ridley RM, Bowes PM, Baker HF, Crow TJ (1984). "Una participación de la acetilcolina en el aprendizaje y la memoria de discriminación por objeto en la marmoset". Neuropsicología. 22 (3): 253–63. doi:10.1016/0028-3932(84)90073-3. PMID 6431311. S2CID 7110504.
- ^ Francis PT, Palmer AM, Snape M, Wilcock GK (febrero de 1999). "La hipótesis cholinergica de la enfermedad de Alzheimer: una revisión del progreso". J. Neurol. Neurosurg. Psiquiatría. 66 (2): 137–47. doi:10.1136/jnp.66.2.137. PMC1736202. PMID 10071091.
- ^ Platt B, Riedel G (agosto 2011). "El sistema cholinergico, el EEG y el sueño". Comportamiento. Respiro cerebral. 221 (2): 499–504. doi:10.1016/j.bbr.2011.01.017. PMID 21238497. S2CID 25323695.
- ^ a b Woolf NJ, Butcher LL (mayo de 1986). "Los sistemas celeréticos en el cerebro de la rata: III. Proyecciones del tegmentum pontomesencefálico al tálamo, tectum, ganglia basal y forebraina basal". Resoluciones cerebrales.. 16 (5): 603–37. doi:10.1016/0361-9230(86)90134-6. PMID 3742247. S2CID 39665815.
- ^ a b Woolf NJ, Butcher LL (diciembre de 1989). "Los sistemas celeréticos en el cerebro de la rata: IV. Proyección descendente del tegmentum pontomesencefálico". Resoluciones cerebrales.. 23 (6): 519–40. doi:10.1016/0361-9230(89)90197-4. PMID 2611694. S2CID 4721282.
- ^ Goldberg JA, Reynolds JN (diciembre de 2011). "Disparos espontáneos y pausas evocadas en los interneurones cholinergicos tonicamente activos del estriato". Neurociencia. 198: 27–43. doi:10.1016/j.neuroscience.2011.08.067. PMID 21925242. S2CID 21908514.
- ^ Morris G, Arkadir D, Nevet A, Vaadia E, Bergman H (julio de 2004). "Los mensajes accidentales pero distintos de la dopamina midbrain y las neuronas tonográficamente activas". Neuron. 43 (1): 133–43. doi:10.1016/j.neuron.2004.06.012. PMID 15233923.
- ^ Crow TJ, Grove-White IG (octubre de 1973). "Un análisis del déficit de aprendizaje tras la administración de la hyoscine al hombre". Br. J. Pharmacol. 49 (2): 322–7. doi:10.1111/j.1476-5381.1973.tb08379.x. PMC1776392. PMID 4793334.
- ^ Ridley RM, Murray TK, Johnson JA, Baker HF (junio de 1986). "Aprender el deterioro tras lesión del núcleo basal de Meynert en la marmoseta: modificación por fármacos cholinergicos". Respiro cerebral. 376 (1): 108–16. doi:10.1016/0006-8993(86)904-2. PMID 3087582. S2CID 29182517.
- ^ Easton A, Ridley RM, Baker HF, Gaffan D (julio de 2002). "Las lesiones unilaterales de la forebraina basal colinergica y la fornix en un hemisferio y la corteza temporal inferior en el hemisferio opuesto producen graves deficiencias de aprendizaje en monos retsus". Cereb. Cortex. 12 (7): 729–36. doi:10.1093/cercor/12.729. PMID 12050084.
- ^ a b Dean B (noviembre de 2009). "Evolución del sistema coreónico del CNS humano: ¿ha resultado la aparición de enfermedades psiquiátricas?". Aust N Z J Psychiatry. 43 (11): 1016–28. doi:10.3109/00048670903270431. PMID 20001397. S2CID 31059344.
- ^ Ortells MO, Lunt GG (marzo de 1995). "Historia evolutiva de la superfamilia de los receptores de iones ligados". Tendencias en neurociencias. 18 (3): 121–127. doi:10.1016/0166-2236(95)93887-4. PMID 7754520. S2CID 18062185.
- ^ Baeyer A (1867). "I. Üeber das neurin". Justus Liebigs Ann Chem (en alemán). 142 (3): 322–326. doi:10.1002/jlac.18671420311.
- ^ a b c d e f Kawashima K, Fujii T, Moriwaki Y, Misawa H, Horiguchi K (2015). "No-neuronal cholinergic system in regulation of inmuno function with a focus on α7 nAChRs". International Immunopharmacology. 29 (1): 127–34. doi:10.1016/j.intimp.2015.04.015. PMID 25907239.
- ^ Mott FW, Halliburton WD (1899). "VII. La acción fisiológica del choline y neurine". Transacciones filosóficas de la Royal Society de Londres. Serie B, Documentos que contienen un carácter biológico. 191 (2001): 211–267. doi:10.1098/rstb.1899.0007. PMC2463419. PMID 20758460.
- ^ Hunt R, Taveau M (1906). "Sobre la acción fisiológica de ciertos derivados de la línea coreana y nuevos métodos para detectar la línea cholina". BMJ. 2: 1788-1791.
- ^ Dorkins HR (abril de 1982). "Suxamethonium-the development of a modern drug from 1906 to the present day". Historia médica. 26 (2): 145–68. doi:10.1017/s0025727300041132. PMC1139149. PMID 7047939.
- ^ Dale HH (1914). "La acción de ciertos ésteres y éteres de la línea, y su relación con la muscarina". J Pharmacol Exp Ther. 6 (2): 147-190.
- ^ Loewi O (1922). "Über humorale übertragbarkeit der herznervenwirkung". Pflug Arch Ges Phys (en alemán). 193 (1): 201–213. doi:10.1007/BF02331588. S2CID 34861770.
- ^ a b Zeisel SH (2012). "Una breve historia de la línea". Annals of Nutrition " Metabolism. 61 (3): 254-8. doi:10.1159/000343120. PMC4422379. PMID 23183298.
- ^ Loewi O, Navratil E (1926). "Über humorale übertragbarkeit der herznervenwirkung". Pflug Arch Ges Phys (en alemán). 214 (1): 678-688. doi:10.1007/BF01741946. S2CID 43748121.
- ^ Zimmer HG (marzo de 2006). "Otto Loewi y la transmisión química de estimulación escénica en el corazón". Cardiología clínica. 29 (3): 135-6. doi:10.1002/clc.4960290313. PMC6654523. PMID 16596840.
Contenido relacionado
EO Wilson
Digital
Cuerpo