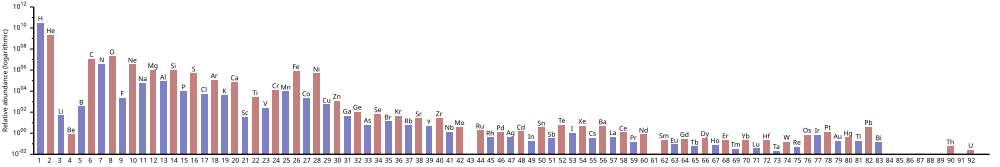
Abundancia de los elementos químicos.
La abundancia de elementos químicos es una medida de la presencia de elementos químicos en relación con todos los demás elementos en un entorno determinado. La abundancia se mide de tres maneras: por fracción de masa (en contextos comerciales a menudo llamada fracción de peso), por fracción molar (fracción de átomos por conteo numérico o, a veces, fracción de moléculas en los gases), o por fracción de volumen. La fracción de volumen es una medida de abundancia común en gases mixtos, como las atmósferas planetarias, y tiene un valor similar a la fracción molar molecular para mezclas de gases a densidades y presiones relativamente bajas, y mezclas de gases ideales. La mayoría de los valores de abundancia en este artículo se dan como fracciones de masa.
Por ejemplo, la abundancia de oxígeno en el agua pura se puede medir de dos maneras: la fracción de masa es aproximadamente el 89%, porque esa es la fracción de la masa del agua que es oxígeno.. Sin embargo, la fracción molar es aproximadamente del 33% porque sólo 1 átomo de 3 en el agua, H2O, es oxígeno. Como otro ejemplo, si observamos la abundancia de fracción de masa de hidrógeno y helio tanto en el Universo en su conjunto como en las atmósferas de planetas gigantes gaseosos como Júpiter, es del 74% para el hidrógeno y del 23%. 25% para helio; mientras que la fracción molar (atómica) del hidrógeno es del 92% y del helio del 8%, en estos entornos. Cambiar el entorno dado a la atmósfera exterior de Júpiter, donde el hidrógeno es diatómico mientras que el helio no lo es, cambia la fracción molar molecular (fracción del total de moléculas de gas), así como la fracción de la atmósfera en volumen, de hidrógeno a aproximadamente el 86% y de helio al 13%.
La abundancia de elementos químicos en el universo está dominada por las grandes cantidades de hidrógeno y helio que se produjeron durante el Big Bang. Los elementos restantes, que representan sólo alrededor del 2% del universo, fueron producidos en gran medida por supernovas y ciertas estrellas gigantes rojas. El litio, el berilio y el boro, a pesar de su bajo número atómico, son raros porque, aunque se producen por fusión nuclear, son destruidos por otras reacciones en las estrellas. Los elementos, desde el carbono hasta el hierro, son relativamente más abundantes en el universo debido a la facilidad de producirlos en la nucleosíntesis de supernovas. Los elementos de mayor número atómico que el hierro (elemento 26) se vuelven cada vez más raros en el universo, porque absorben cada vez más energía estelar en su producción. Además, los elementos con números atómicos pares son generalmente más comunes que sus vecinos en la tabla periódica, debido a la favorable energía de formación.
La abundancia de elementos en el Sol y los planetas exteriores es similar a la del universo. Debido al calentamiento solar, los elementos de la Tierra y los planetas rocosos interiores del Sistema Solar han sufrido un agotamiento adicional de hidrógeno volátil, helio, neón, nitrógeno y carbono (que se volatiliza en forma de metano). La corteza, el manto y el núcleo de la Tierra muestran evidencia de segregación química más cierto secuestro por densidad. En la corteza se encuentran silicatos de aluminio más ligeros, con más silicato de magnesio en el manto, mientras que el hierro metálico y el níquel componen el núcleo. La abundancia de elementos en entornos especializados, como la atmósfera, los océanos o el cuerpo humano, es principalmente producto de interacciones químicas con el medio en el que residen.
Universo
| Z | Elemento | Fracción de masas (ppm) |
|---|---|---|
| 1 | Hidrogen | 739.000 |
| 2 | Helio | 240.000 |
| 8 | Oxygen | 10.400 |
| 6 | Carbon | 4.600 |
| 10 | Neon | 1.340 |
| 26 | Iron | 1.090 |
| 7 | Nitrogen | 960 |
| 14 | Silicon | 650 |
| 12 | Magnesio | 580 |
| 16 | Sulfuro | 440 |
| Total | 999,060 |
Los elementos, es decir, la materia ordinaria (bariónica) formada por protones, neutrones y electrones, son sólo una pequeña parte del contenido del Universo. Las observaciones cosmológicas sugieren que solo el 4,6% de la energía del universo (incluida la masa aportada por la energía, E = mc2 ⇔ m = E / c2) comprende la materia bariónica visible que constituye las estrellas, los planetas y los seres vivos. Se cree que el resto está formado por energía oscura (68%) y materia oscura (27%). Se trata de formas de materia y energía que se cree que existen sobre la base de la teoría científica y el razonamiento inductivo basado en observaciones, pero no han sido observadas directamente y su naturaleza no se comprende bien.
La mayor parte de la materia estándar (bariónica) se encuentra en gases intergalácticos, estrellas y nubes interestelares, en forma de átomos o iones (plasma), aunque se puede encontrar en formas degeneradas en entornos astrofísicos extremos, como las altas densidades. dentro de enanas blancas y estrellas de neutrones.
El hidrógeno es el elemento más abundante en el Universo; el helio es el segundo. Sin embargo, después de esto, el rango de abundancia no sigue correspondiendo al número atómico; el oxígeno tiene un rango de abundancia 3, pero un número atómico 8. Todos los demás son sustancialmente menos comunes.
El modelo cosmológico estándar predice bien la abundancia de los elementos más ligeros, ya que en su mayoría se produjeron poco (es decir, unos pocos cientos de segundos) después del Big Bang, en un proceso conocido como nucleosíntesis del Big Bang. Los elementos más pesados se produjeron en su mayoría mucho más tarde, en el interior de las estrellas.
Se estima que el hidrógeno y el helio constituyen aproximadamente el 74% y el 24% de toda la materia bariónica del universo, respectivamente. A pesar de comprender sólo una fracción muy pequeña del universo, los "elementos pesados" puede influir enormemente en los fenómenos astronómicos. Sólo alrededor del 2% (en masa) del disco de la Vía Láctea está compuesto de elementos pesados.
Estos otros elementos son generados por procesos estelares. En astronomía, un "metal" es cualquier elemento distinto del hidrógeno o el helio. Esta distinción es significativa porque el hidrógeno y el helio son los únicos elementos que se produjeron en cantidades significativas en el Big Bang. Por tanto, la metalicidad de una galaxia u otro objeto es un indicio de actividad estelar después del Big Bang.
En general, los elementos hasta el hierro son producidos por estrellas grandes en proceso de convertirse en supernovas, o por estrellas más pequeñas en proceso de morir. Un tipo de hierro, el hierro-56, es particularmente común, ya que es el nucleido más estable (ya que tiene la mayor energía de enlace nuclear por nucleón) y puede formarse fácilmente a partir de partículas alfa (que son un producto de la desintegración del níquel radiactivo). -56, formado en última instancia a partir de 14 núcleos de helio). Los elementos más pesados que el hierro se producen en procesos de absorción de energía en estrellas grandes, y su abundancia en el universo (y en la Tierra) generalmente disminuye a medida que aumenta el número atómico.
La tabla muestra los diez elementos más comunes en nuestra galaxia (estimados espectroscópicamente), medidos en partes por millón, en masa. Las galaxias cercanas que han evolucionado de manera similar tienen el correspondiente enriquecimiento de elementos más pesados que el hidrógeno y el helio. Las galaxias más distantes se están viendo tal como aparecían en el pasado, por lo que su abundancia de elementos parece más cercana a la mezcla primordial. Sin embargo, dado que las leyes y procesos físicos son uniformes en todo el universo, se espera que estas galaxias también hayan desarrollado abundancias similares de elementos.
Como se muestra en la tabla periódica a continuación, la abundancia de elementos está en consonancia con su origen. El hidrógeno y el helio, que son muy abundantes, son productos del Big Bang. Los siguientes tres elementos de la tabla periódica (litio, berilio y boro) son raros, a pesar de su bajo número atómico. Tuvieron poco tiempo para formarse en el Big Bang. Se producen en pequeñas cantidades por fusión nuclear en estrellas moribundas o por desintegración de elementos más pesados en el polvo interestelar, provocada por los rayos cósmicos. En las estrellas supernova, se producen por fusión nuclear, pero luego se destruyen mediante otras reacciones.
Los elementos más pesados, empezando por el carbono, se han producido en estrellas moribundas o supernovas mediante la acumulación de partículas alfa (núcleos de helio), lo que da como resultado una abundancia alternativamente mayor de elementos con números atómicos pares (éstos también son más estables). El efecto de que los elementos químicos impares sean generalmente más raros en el universo se observó empíricamente en 1914 y se conoce como la regla de Oddo-Harkins.
El siguiente gráfico (observe la escala logarítmica) muestra la abundancia de elementos en el Sistema Solar.
Relación con la energía nuclear vinculante
Se han observado correlaciones vagas entre las abundancias elementales estimadas en el universo y la curva de energía de enlace nuclear. En términos generales, la estabilidad relativa de varios nucleidos atómicos ha ejercido una fuerte influencia en la abundancia relativa de elementos formados en el Big Bang y durante el desarrollo posterior del universo. Consulte el artículo sobre nucleosíntesis para obtener una explicación de cómo ciertos procesos de fusión nuclear en las estrellas (como la quema de carbono, etc.) crean elementos más pesados que el hidrógeno y el helio.
Otra peculiaridad observada es la alternancia irregular entre la abundancia relativa y la escasez de números atómicos adyacentes en la curva de abundancia elemental, y un patrón similar de niveles de energía en la curva de energía de enlace nuclear. Esta alternancia es causada por la mayor energía de enlace relativa (correspondiente a la estabilidad relativa) de los números atómicos pares en comparación con los números atómicos impares y se explica por el principio de exclusión de Pauli. La fórmula de masa semiempírica (SEMF), también llamada fórmula de Weizsäcker o fórmula de masa de Bethe-Weizsäcker, ofrece una explicación teórica de la forma general de la masa. curva de energía de enlace nuclear.
Tierra
La Tierra se formó a partir de la misma nube de materia que formó el Sol, pero los planetas adquirieron diferentes composiciones durante la formación y evolución del Sistema Solar. A su vez, la historia natural de la Tierra hizo que partes de este planeta tuvieran diferentes concentraciones de elementos.
La masa de la Tierra es aproximadamente 5,97×1024 kg. En masa, se compone principalmente de hierro (32,1%), oxígeno (30,1%), silicio (15,1%), magnesio (13,9%), azufre (2,9%), níquel (1,8%), calcio (1,5 %) y aluminio (1,4%); y el 1,2% restante consiste en trazas de otros elementos.
La composición general de la Tierra por masa elemental es más o menos similar a la composición bruta del sistema solar, con la diferencia principal de que a la Tierra le faltan una gran cantidad de elementos volátiles: hidrógeno, helio, neón y nitrógeno. así como el carbono que se ha perdido en forma de hidrocarburos volátiles. La composición elemental restante es más o menos típica de las zonas "rocosas". planetas interiores, que se formaron en la zona térmica donde el calor solar expulsó compuestos volátiles al espacio. La Tierra retiene oxígeno como el segundo componente más grande de su masa (y la fracción atómica más grande), principalmente debido a que este elemento está retenido en minerales de silicato que tienen un punto de fusión muy alto y una baja presión de vapor.
| Número atómico | Nombre | Signatura | Fracción masiva (ppm) | Fracción atómica (ppb) |
|---|---|---|---|---|
| 8 | oxígeno | O | 297.000 | 482,000,000 |
| 12 | magnesio | Mg | 154.000 | 164.000 |
| 14 | silicio | Si | 161. | 150,000,000 |
| 26 | plancha | Fe | 319.000 | 148 millones |
| 13 | aluminio | Al | 15.900 | 15.300,000 |
| 20 | calcio | Ca | 17,100 | 11.100.000 |
| 28 | Nickel | Ni | 18.220 | 8.010,000 |
| 1 | hidrógeno | H | 260 | 6.700.000 |
| 16 | azufre | S | 6.350 | 5.150.000 |
| 24 | cromo | Cr | 4.700 | 2.300.000 |
| 11 | sodio | Na | 1.800 | 2,000,000 |
| 6 | carbono | C | 730 | 1.600.000 |
| 15 | fósforo | P | 1.210 | 1.020.000 |
| 25 | manganeso | Mn | 1.700 | 800.000 |
| 22 | titanio | Ti | 810 | 440.000 |
| 27 | cobalto | Co | 880 | 390.000 |
| 19 | potasio | K | 160 | 110.000 |
| 17 | cloro | Cl | 76 | 56.000 |
| 23 | vanadium | V | 105 | 53,600 |
| 7 | nitrógeno | N | 25 | 46.000 |
| 29 | cobre | Cu | 60 | 25.000 |
| 30 | zinc | Zn | 40 | 16.000 |
| 9 | fluorina | F | 10 | 14.000 |
| 21 | escaso | Sc | 11 | 6.300 |
| 3 | litio | Li | 1.10 | 4,100 |
| 38 | estroncio | Sr | 13 | 3.900 |
| 32 | germanio | Ge | 7.00 | 2.500 |
| 40 | zirconium | Zr | 7.10 | 2.000 |
| 31 | gallium | Ga | 3.00 | 1.000 |
| 34 | selenio | Se | 2.70 | 890 |
| 56 | bario | Ba | 4.50 | 850 |
| 39 | Yttrium | Y | 2.90 | 850 |
| 33 | arsenic | As | 1.70 | 590 |
| 5 | Boron | B | 0.20 | 480 |
| 42 | molibdeno | Mo | 1.70 | 460 |
| 44 | rutenio | Ru | 1.30 | 330 |
| 78 | platino | Pt | 1.90 | 250 |
| 46 | palladium | Pd | 1.00 | 240 |
| 58 | cercio | Ce | 1.13 | 210 |
| 60 | neodimio | Nd | 0.84 | 150 |
| 4 | beryllium | Be | 0,05 | 140 |
| 41 | niobio | Nb | 0.44 | 120 |
| 76 | osmium | Os | 0.90 | 120 |
| 77 | iridium | Ir | 0.90 | 120 |
| 37 | rubidium | Rb | 0.40 | 120 |
| 35 | bromo | Br | 0.30 | 97 |
| 57 | lanthanum | La | 0.44 | 82 |
| 66 | disprosio | Dy | 0.46 | 74 |
| 64 | gadolinio | Gd | 0.37 | 61 |
| 52 | dicurium | Te | 0.30 | 61 |
| 45 | rhodium | Rh | 0,244 | 61 |
| 50 | lata | Sn | 0,25 | 55 |
| 62 | samarium | Sm | 0,277 | 47 |
| 68 | erbium | Er | 0.30 | 47 |
| 70 | ytterbium | Yb | 0.30 | 45 |
| 59 | praseodymium | Pr | 0.17 | 31 |
| 82 | plomo | Pb | 0.23 | 29 |
| 72 | hafnium | Hf | 0.19 | 28 |
| 74 | tungsteno | W | 0.17 | 24 |
| 79 | oro | Au | 0.16 | 21 |
| 48 | cadmio | Cd | 0,08 | 18 |
| 63 | europio | Eu | 0.10 | 17 |
| 67 | Holmium | Ho | 0.10 | 16 |
| 47 | plata | Ag | 0,05 | 12 |
| 65 | terbium | Tb | 0,07 | 11 |
| 51 | antimonio | Sb | 0,05 | 11 |
| 75 | rhenium | Re | 0,08 | 10 |
| 53 | Yodo | I | 0,05 | 10 |
| 69 | thulium | T m | 0,05 | 7 |
| 55 | cesio | Cs | 0,04 | 7 |
| 71 | lutetium | Lu | 0,05 | 7 |
| 90 | thorium | Th | 0,06 | 6 |
| 73 | equivalente | Ta | 0,03 | 4 |
| 80 | mercurio | Hg | 0,02 | 3 |
| 92 | uranio | U | 0,02 | 2 |
| 49 | indio | In | 0,01 | 2 |
| 81 | thallium | Tl | 0,01 | 2 |
| 83 | bismuth | Bi | 0,01 | 1 |
Corteza
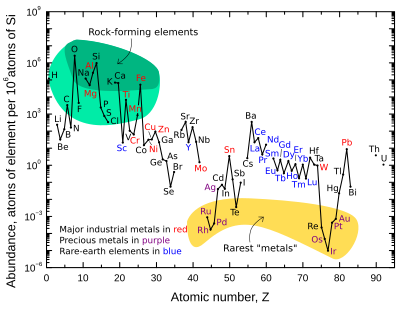
La abundancia masiva de los nueve elementos más abundantes en la corteza terrestre es aproximadamente: oxígeno 46%, silicio 28%, aluminio 8,3%, hierro 5,6%, calcio 4,2%, sodio 2,5%, magnesio 2,4 %, potasio 2,0% y titanio 0,61%. Otros elementos se encuentran en menos del 0,15%. Para obtener una lista completa, consulte abundancia de elementos en la corteza terrestre.
El gráfico de la derecha ilustra la abundancia atómica relativa de los elementos químicos en la corteza continental superior de la Tierra, la parte que es relativamente accesible para mediciones y estimaciones.
Muchos de los elementos que se muestran en el gráfico están clasificados en categorías (parcialmente superpuestas):
- elementos formadores de roca (elementos mayores en campo verde, y elementos menores en campo verde claro);
- elementos raros de la tierra (lantanos (La-Lu), Sc y Y; etiquetados en azul);
- metales industriales importantes (producción global √3×107 kg/year; labeled in red);
- metales preciosos (marcados en púrpura);
- los nueve "metales" más raros – los seis elementos del grupo platino más Au, Re y Te (un metalloide) – en el campo amarillo. Estos son raros en la corteza de ser solubles en hierro y así concentrados en el núcleo de la Tierra. El Tellurium es el único elemento más agotador en la Tierra silicada relativo a la abundancia cósmica, porque además de ser concentrado como densos chalcogenidos en el núcleo fue severamente agotado por clasificación preacrecional en la nebulosa como volátil dicurido de hidrógeno.
Hay dos quiebres donde estarían los elementos inestables (radiactivos) tecnecio (número atómico 43) y prometio (número atómico 61). Estos elementos están rodeados de elementos estables, pero sus isótopos más estables tienen vidas medias relativamente cortas (~4 millones de años y ~18 años respectivamente). Por lo tanto, son extremadamente raros, ya que cualquier fracción inicial primordial de estos en los materiales anteriores al Sistema Solar hace mucho que se descompuso. Estos dos elementos ahora sólo se producen de forma natural mediante la fisión espontánea de elementos radiactivos muy pesados (por ejemplo, uranio, torio o las trazas de plutonio que existen en los minerales de uranio), o mediante la interacción de otros elementos determinados con los rayos cósmicos. Tanto el tecnecio como el prometio se han identificado espectroscópicamente en las atmósferas de las estrellas, donde se producen mediante procesos nucleosintéticos en curso.
También hay cortes en el gráfico de abundancia donde estarían los seis gases nobles, ya que no están unidos químicamente en la corteza terrestre, y sólo se generan en la corteza por cadenas de desintegración de elementos radiactivos, y Por lo tanto, son extremadamente raros allí.
Los ocho elementos naturales muy raros y altamente radiactivos (polonio, astato, francio, radio, actinio, protactinio, neptunio y plutonio) no están incluidos, ya que cualquiera de estos elementos que estaban presentes en la formación de la Tierra tienen Se desintegraron hace eones, y su cantidad hoy es insignificante y sólo se produce a partir de la desintegración radiactiva del uranio y el torio.
El oxígeno y el silicio son, en particular, los elementos más comunes en la corteza. En la Tierra y en los planetas rocosos en general, el silicio y el oxígeno son mucho más comunes que su abundancia cósmica. La razón es que se combinan entre sí para formar minerales de silicato. Otros elementos cósmicamente comunes, como el hidrógeno, el carbono y el nitrógeno, forman compuestos volátiles como el amoníaco y el metano que se evaporan fácilmente en el espacio debido al calor de la formación planetaria y/o la luz del Sol.
Elementos de tierras raras
"Raro" elementos terrestres es un nombre histórico inapropiado. La persistencia del término refleja desconocimiento más que una verdadera rareza. Los elementos de tierras raras más abundantes se concentran de manera similar en la corteza en comparación con los metales industriales comunes como el cromo, el níquel, el cobre, el zinc, el molibdeno, el estaño, el tungsteno o el plomo. Los dos elementos estables de tierras raras menos abundantes (tulio y lutecio) son casi 200 veces más comunes que el oro. Sin embargo, a diferencia de los metales comunes y preciosos, las tierras raras tienen muy poca tendencia a concentrarse en depósitos minerales explotables. En consecuencia, la mayor parte del suministro mundial de tierras raras proviene de sólo un puñado de fuentes. Además, los metales de tierras raras son todos bastante similares químicamente entre sí y, por lo tanto, son bastante difíciles de separar en cantidades de elementos puros.
Las diferencias en la abundancia de elementos individuales de tierras raras en la corteza continental superior de la Tierra representan la superposición de dos efectos, uno nuclear y otro geoquímico. En primer lugar, las tierras raras con números atómicos pares (58Ce, 60Nd,...) tienen mayores abundancias cósmicas y terrestres que las tierras raras adyacentes con números atómicos impares. números (57La, 59Pr,...). En segundo lugar, las tierras raras más ligeras son más incompatibles (porque tienen radios iónicos más grandes) y, por tanto, están más fuertemente concentradas en la corteza continental que las tierras raras más pesadas. En la mayoría de los depósitos de minerales de tierras raras, los primeros cuatro elementos de tierras raras (lantano, cerio, praseodimio y neodimio) constituyen entre el 80 % y el 99 % de la cantidad total de metales de tierras raras que se pueden encontrar en el mineral.
Manto
La abundancia masiva de los siete elementos más abundantes en el manto de la Tierra es aproximadamente: oxígeno 44,3%, magnesio 22,3%, silicio 21,3%, hierro 6,32%, calcio 2,48%, aluminio 2,29%, níquel 0,19 %.
Núcleo
Debido a la segregación masiva, se cree que el núcleo de la Tierra está compuesto principalmente de hierro (88,8%), con cantidades más pequeñas de níquel (5,8%), azufre (4,5%) y menos del 1% de oligoelementos.
Océano
Los elementos más abundantes en el océano por proporción de masa en porcentaje son oxígeno (85,84%), hidrógeno (10,82%), cloro (1,94%), sodio (1,08%), magnesio (0,13%), azufre (0,09 %), calcio (0,04%), potasio (0,04%), bromo (0,007%), carbono (0,003%) y boro (0,0004%).
Ambiente
El orden de los elementos por fracción de volumen (que es aproximadamente una fracción molar molecular) en la atmósfera es nitrógeno (78,1%), oxígeno (20,9%), argón (0,96%), seguido por (en orden incierto) carbono e hidrógeno. porque el vapor de agua y el dióxido de carbono, que representan la mayoría de estos dos elementos en el aire, son componentes variables. El azufre, el fósforo y todos los demás elementos están presentes en proporciones significativamente más bajas.
Según el gráfico de la curva de abundancia, el argón, un componente importante, si no importante, de la atmósfera, no aparece en la corteza en absoluto. Esto se debe a que la atmósfera tiene una masa mucho menor que la corteza, por lo que el argón que permanece en la corteza contribuye poco a la fracción de masa allí, mientras que al mismo tiempo la acumulación de argón en la atmósfera se ha vuelto lo suficientemente grande como para ser significativa.
Suelos urbanos
Para obtener una lista completa de la abundancia de elementos en los suelos urbanos, consulte Abundancias de los elementos (página de datos)#Suelos urbanos.
Cuerpo humano
| Elemento | Proporción (por masa) |
|---|---|
| Oxygen | 65 |
| Carbon | 18 |
| Hidrogen | 10 |
| Nitrogen | 3 |
| Calcio | 1,5 |
| fósforo | 1.2 |
| Potasio | 0.2 |
| Sulfuro | 0.2 |
| Cloro | 0.2 |
| Sodium | 0.1 |
| Magnesio | 0,05 |
| Iron | ▪ 0,05 |
| Cobalto | ▪ 0,05 |
| Copper | ▪ 0,05 |
| Zinc | ▪ 0,05 |
| Yodo | ▪ 0,05 |
| Selenio | ▪ 0,01 |
En masa, las células humanas están compuestas por entre un 65% y un 90% de agua (H2O), y una porción significativa del resto está compuesta por moléculas orgánicas que contienen carbono. Por lo tanto, el oxígeno constituye la mayor parte de la masa del cuerpo humano, seguido del carbono. Casi el 99% de la masa del cuerpo humano está formada por seis elementos: hidrógeno (H), carbono (C), nitrógeno (N), oxígeno (O), calcio (Ca) y fósforo (P). El siguiente 0,75% está formado por los siguientes cinco elementos: potasio (K), azufre (S), cloro (Cl), sodio (Na) y magnesio (Mg). Se sabe con certeza que sólo 17 elementos son necesarios para la vida humana, y se cree que un elemento adicional (el flúor) es útil para fortalecer el esmalte dental. Algunos oligoelementos más pueden desempeñar algún papel en la salud de los mamíferos. El boro y el silicio son especialmente necesarios para las plantas, pero tienen funciones inciertas en los animales. Los elementos aluminio y silicio, aunque muy comunes en la corteza terrestre, son notoriamente raros en el cuerpo humano.
A continuación se muestra una tabla periódica que destaca los elementos nutricionales.
| Elementos nutricionales en la tabla periódica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | Él | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cs | Ba | * | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fr. | Ra | # | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | T m | Yb | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| # | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | F m | Md | No | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Leyenda: Los cuatro elementos orgánicos básicos
Cantidad de elementos
Elementos de traza esenciales
Estimado elemento de traza esencial por Estados Unidos, no por la Unión Europea
Función sugerida de efectos de privación o manejo metabólico activo, pero no función bioquímica claramente identificada en humanos
Limitada evidencia circunstancial para los beneficios o la acción biológica en mamíferos
No hay evidencia de acción biológica en mamíferos, pero esencial en algunos organismos inferiores. (En el caso del lantano, la definición de un nutriente esencial como indispensable e irremplazable no es completamente aplicable debido a la extrema similitud de los lantanoides. Los lantanoides tempranos estables hasta Sm son conocidos para estimular el crecimiento de varios organismos de uso de la lantanoide.) |
Contenido relacionado
Problema de la meseta
Teorema de Gelfand-Naimark
Codificación de video avanzada