Trifosfato de adenosina
Trifosfato de adenosina (ATP) é um composto orgânico que fornece energia para conduzir muitos processos em células vivas, como contração muscular, propagação de impulso nervoso, dissolução de condensado e síntese química. Encontrado em todas as formas de vida conhecidas, o ATP é muitas vezes referido como a "unidade molecular de moeda" de transferência de energia intracelular. Quando consumido em processos metabólicos, converte-se em difosfato de adenosina (ADP) ou em monofosfato de adenosina (AMP). Outros processos regeneram o ATP. O corpo humano recicla seu próprio peso corporal equivalente em ATP a cada dia. É também um precursor do DNA e do RNA e é usado como uma coenzima.
Do ponto de vista da bioquímica, o ATP é classificado como um nucleosídeo trifosfato, o que indica que ele consiste em três componentes: uma base nitrogenada (adenina), o açúcar ribose e o trifosfato.
Estrutura
ATP consiste em uma adenina ligada pelo átomo de nitrogênio 9 ao átomo de carbono 1' de um açúcar (ribose), que por sua vez está ligado no 5' átomo de carbono do açúcar a um grupo trifosfato. Em suas diversas reações relacionadas ao metabolismo, os grupos adenina e açúcar permanecem inalterados, mas o trifosfato é convertido em di e monofosfato, dando respectivamente os derivados ADP e AMP. Os três grupos fosforil são rotulados como alfa (α), beta (β) e, para o fosfato terminal, gama (γ).
Em solução neutra, o ATP ionizado existe principalmente como ATP4−, com uma pequena proporção de ATP3−.
Ligação de cátions metálicos ao ATP
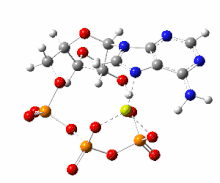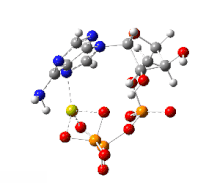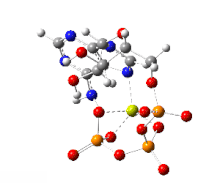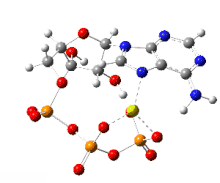
Sendo polianiônico e apresentando um grupo polifosfato potencialmente quelante, o ATP se liga a cátions metálicos com alta afinidade. A constante de ligação para Mg2+ é (9554). A ligação de um cátion bivalente, quase sempre magnésio, afeta fortemente a interação do ATP com várias proteínas. Devido à força da interação ATP-Mg2+, o ATP existe na célula principalmente como um complexo com Mg2+
ligado aos centros de oxigênio de fosfato.
Um segundo íon de magnésio é crítico para a ligação do ATP no domínio quinase. A presença de Mg2+ regula a atividade da quinase.
Propriedades químicas
Os sais de ATP podem ser isolados como sólidos incolores.
ATP é estável em soluções aquosas entre pH 6,8 e 7,4, na ausência de catalisadores. Em pHs mais extremos, ele se hidrolisa rapidamente em ADP e fosfato. As células vivas mantêm a proporção de ATP para ADP em um ponto dez ordens de grandeza a partir do equilíbrio, com concentrações de ATP cinco vezes maiores que a concentração de ADP. No contexto das reações bioquímicas, as ligações P-O-P são freqüentemente chamadas de ligações de alta energia.
Aspectos reativos
A hidrólise de ATP em ADP e fosfato inorgânico libera 20,5 kJ/mol de entalpia. Os valores da energia livre liberada pela clivagem de uma unidade de fosfato (Pi) ou pirofosfato (PPi) do ATP em concentrações de estado padrão de 1 mol/L em pH 7 são:
- ATP + H. H. H.
2O → ADP + PEu... ?G° = −30.5 kJ/mol (−7.3 kcal/mol) - ATP + H. H. H.
2O → AMP + PPEu... ?G°' = −45.6 kJ/mol (−10.9 kcal/mol)
Estas equações abreviadas em um pH próximo a 7 podem ser escritas de forma mais explícita (R = adenosil):
- [RO-P(O)2-O-P(O)2- O-PO3]4... + H. H. H.
2O → [RO-P(O)2- O-PO3]3... - Sim.4]2- + H+ - [RO-P(O)2-O-P(O)2- O-PO3]4... + H. H. H.
2O → [RO-PO3]2- - Sim.3P-O-PO3]3... + H+
Em condições citoplasmáticas, onde a razão ADP/ATP é de 10 ordens de grandeza do equilíbrio, o ΔG é de cerca de −57 kJ/mol.
Produção de AMP e ADP
Produção, condições aeróbicas
Uma concentração intracelular típica de ATP é difícil de definir, no entanto, relatórios mostraram que há 1–10 μmol por grama de tecido em uma variedade de eucariotos. A desfosforilação do ATP e a refosforilação do ADP e AMP ocorrem repetidamente no decorrer do metabolismo aeróbico.
O ATP pode ser produzido por vários processos celulares distintos; as três vias principais em eucariotos são (1) glicólise, (2) ciclo do ácido cítrico/fosforilação oxidativa e (3) beta-oxidação. O processo geral de oxidação da glicose a dióxido de carbono, a combinação das vias 1 e 2, conhecida como respiração celular, produz cerca de 30 equivalentes de ATP de cada molécula de glicose.
A produção de ATP por um eucarioto aeróbico não fotossintético ocorre principalmente nas mitocôndrias, que compreendem cerca de 25% do volume de uma célula típica.
Glicólise
Na glicólise, a glicose e o glicerol são metabolizados em piruvato. A glicólise gera dois equivalentes de ATP através da fosforilação do substrato catalisada por duas enzimas, fosfoglicerato quinase (PGK) e piruvato quinase. Também são produzidos dois equivalentes de nicotinamida adenina dinucleotídeo (NADH), que podem ser oxidados através da cadeia de transporte de elétrons e resultar na geração de ATP adicional pela ATP sintase. O piruvato gerado como produto final da glicólise é um substrato para o Ciclo de Krebs.
A glicólise é vista como consistindo em duas fases com cinco etapas cada. Na fase 1, "fase preparatória", a glicose é convertida em 2 d-gliceraldeído-3-fosfato (g3p). Um ATP é investido na Etapa 1 e outro ATP é investido na Etapa 3. As etapas 1 e 3 da glicólise são chamadas de "etapas de preparação". Na Fase 2, dois equivalentes de g3p são convertidos em dois piruvatos. Na Etapa 7, dois ATP são produzidos. Além disso, na Etapa 10, são produzidos mais dois equivalentes de ATP. Nas etapas 7 e 10, o ATP é gerado a partir do ADP. Uma rede de dois ATPs é formada no ciclo da glicólise. A via da glicólise é posteriormente associada ao Ciclo do Ácido Cítrico, que produz equivalentes adicionais de ATP.
Regulamento
Na glicólise, a hexoquinase é diretamente inibida por seu produto, glicose-6-fosfato, e a piruvato quinase é inibida pelo próprio ATP. O principal ponto de controle da via glicolítica é a fosfofrutoquinase (PFK), que é alostericamente inibida por altas concentrações de ATP e ativada por altas concentrações de AMP. A inibição do PFK pelo ATP é incomum, pois o ATP também é um substrato na reação catalisada pelo PFK; a forma ativa da enzima é um tetrâmero que existe em duas conformações, das quais apenas uma se liga ao segundo substrato frutose-6-fosfato (F6P). A proteína tem dois sítios de ligação para ATP - o sítio ativo é acessível em qualquer conformação de proteína, mas a ligação de ATP ao sítio inibidor estabiliza a conformação que se liga mal a F6P. Várias outras pequenas moléculas podem compensar a mudança induzida por ATP na conformação de equilíbrio e reativar PFK, incluindo AMP cíclico, íons amônio, fosfato inorgânico e frutose-1,6- e -2,6-bifosfato.
Ciclo do ácido cítrico
Na mitocôndria, o piruvato é oxidado pelo complexo piruvato desidrogenase ao grupo acetil, que é totalmente oxidado a dióxido de carbono pelo ciclo do ácido cítrico (também conhecido como ciclo de Krebs). Cada "volta" do ciclo do ácido cítrico produz duas moléculas de dióxido de carbono, um equivalente de ATP trifosfato de guanosina (GTP) através da fosforilação em nível de substrato catalisada pela succinil-CoA sintetase, à medida que o succinil-CoA é convertido em succinato, três equivalentes de NADH e um equivalente de FADH2. NADH e FADH2 são reciclados (para NAD+ e FAD, respectivamente) por fosforilação oxidativa, gerando ATP adicional. A oxidação do NADH resulta na síntese de 2–3 equivalentes de ATP, e a oxidação de um FADH2 produz entre 1–2 equivalentes de ATP. A maior parte do ATP celular é gerada por este processo. Embora o próprio ciclo do ácido cítrico não envolva oxigênio molecular, é um processo obrigatoriamente aeróbico porque O2 é usado para reciclar o NADH e o FADH2. Na ausência de oxigênio, o ciclo do ácido cítrico cessa.
A geração de ATP pela mitocôndria a partir do NADH citosólico depende da lançadeira malato-aspartato (e, em menor grau, da lançadeira glicerol-fosfato) porque a membrana mitocondrial interna é impermeável ao NADH e NAD+. Em vez de transferir o NADH gerado, uma enzima malato desidrogenase converte oxaloacetato em malato, que é translocado para a matriz mitocondrial. Outra reação catalisada pela malato desidrogenase ocorre na direção oposta, produzindo oxaloacetato e NADH a partir do malato recém-transportado e do armazenamento interior da mitocôndria de NAD+. Uma transaminase converte o oxaloacetato em aspartato para transporte de volta através da membrana e para o espaço intermembranar.
Na fosforilação oxidativa, a passagem de elétrons de NADH e FADH2 através da cadeia de transporte de elétrons libera a energia para bombear prótons para fora da matriz mitocondrial e para o espaço intermembrana. Esse bombeamento gera uma força motriz de prótons que é o efeito líquido de um gradiente de pH e um gradiente de potencial elétrico através da membrana mitocondrial interna. O fluxo de prótons nesse gradiente potencial - isto é, do espaço intermembrana para a matriz - produz ATP pela ATP sintase. Três ATP são produzidos por volta.
Embora o consumo de oxigênio pareça fundamental para a manutenção da força motriz do próton, em caso de escassez de oxigênio (hipóxia), a acidose intracelular (mediada por taxas glicolíticas aumentadas e hidrólise de ATP), contribui para o potencial de membrana mitocondrial e impulsiona diretamente a síntese de ATP.
A maior parte do ATP sintetizado na mitocôndria será utilizada para processos celulares no citosol; assim, deve ser exportado de seu local de síntese na matriz mitocondrial. O movimento para fora do ATP é favorecido pelo potencial eletroquímico da membrana porque o citosol tem uma carga relativamente positiva em comparação com a matriz relativamente negativa. Para cada ATP transportado, custa 1 H+. Produzir um ATP custa cerca de 3 H+. Portanto, produzir e exportar um ATP requer 4H+. A membrana interna contém um antiportador, o ADP/ATP translocase, que é uma proteína de membrana integral usada para trocar ATP recém-sintetizado na matriz por ADP no espaço intermembranar. Essa translocase é impulsionada pelo potencial de membrana, pois resulta no movimento de cerca de 4 cargas negativas através da membrana mitocondrial em troca de 3 cargas negativas movidas para dentro. No entanto, também é necessário transportar o fosfato para dentro da mitocôndria; o transportador de fosfato move um próton com cada fosfato, dissipando parcialmente o gradiente de prótons. Após completar a glicólise, o ciclo do ácido cítrico, a cadeia de transporte de elétrons e a fosforilação oxidativa, aproximadamente 30 a 38 moléculas de ATP são produzidas por glicose.
Regulamento
O ciclo do ácido cítrico é regulado principalmente pela disponibilidade de substratos chave, particularmente a proporção de NAD+ para NADH e as concentrações de cálcio, fosfato inorgânico, ATP, ADP e AMP. O citrato – o íon que dá nome ao ciclo – é um inibidor de feedback da citrato sintase e também inibe o PFK, fornecendo uma ligação direta entre a regulação do ciclo do ácido cítrico e a glicólise.
Oxidação beta
Na presença de ar e vários cofatores e enzimas, os ácidos graxos são convertidos em acetil-CoA. A via é chamada beta-oxidação. Cada ciclo de beta-oxidação encurta a cadeia de ácidos graxos em dois átomos de carbono e produz um equivalente de acetil-CoA, NADH e FADH2. O acetil-CoA é metabolizado pelo ciclo do ácido cítrico para gerar ATP, enquanto o NADH e o FADH2 são utilizados pela fosforilação oxidativa para gerar ATP. Dezenas de equivalentes de ATP são gerados pela beta-oxidação de uma única cadeia longa de acilo.
Regulamento
Na fosforilação oxidativa, o ponto de controle chave é a reação catalisada pela citocromo c oxidase, que é regulada pela disponibilidade de seu substrato – a forma reduzida do citocromo c. A quantidade de citocromo c reduzido disponível está diretamente relacionada com as quantidades de outros substratos:
- 12NADH+Ciclocox+ADP+PEu...? ? 12Não.++Ciclocvermelho+ATP(1}{2}} {NADH}}+{ce {cyt}} O quê? {c_{ox}+{ce (ADP)+ {P_{i}}}rightleftharpoons - Sim. {NAD^+}+********************************************** O quê? {c_{red}}}+{ce (ATP)}
que implica diretamente nesta equação:
- Não.cSim.)cReD]Não.cSim.)cox]= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =(Não.NADH. H. H.]Não.NAD]+)12(Não.ADP]Não.PEu...]Não.ATP])KKeq{displaystyle {frac {[mathrm {cyt~c_{red}}}{[mathrm {cyt~c_{ox}}}}=left({frac {[mathrm {NADH} ]}{[mathrm {NAD}}^{+}}}right)^{frac {1}{2}}left({frac {[mathrm {ADP} ][mathrm {P_{i}}}{[mathrm {ATP}}}right)K_{mathrm {eq} }}
Assim, uma alta proporção de [NADH] para [NAD+] ou uma alta proporção de [ADP][Pi] para [ATP] implica uma alta quantidade de citocromo c reduzido e um alto nível de atividade da citocromo c oxidase. Um nível adicional de regulação é introduzido pelas taxas de transporte de ATP e NADH entre a matriz mitocondrial e o citoplasma.
Cetose
Os corpos cetônicos podem ser usados como combustíveis, produzindo 22 moléculas de ATP e 2 moléculas de GTP por molécula de acetoacetato quando oxidadas nas mitocôndrias. Os corpos cetônicos são transportados do fígado para outros tecidos, onde o acetoacetato e o beta-hidroxibutirato podem ser reconvertidos em acetil-CoA para produzir equivalentes redutores (NADH e FADH 2), por meio do ciclo do ácido cítrico. Os corpos cetônicos não podem ser usados como combustível pelo fígado, porque o fígado não possui a enzima β-cetoacil-CoA transferase, também chamada de tiolase. O acetoacetato em baixas concentrações é captado pelo fígado e sofre desintoxicação pela via do metilglioxal que termina em lactato. O acetoacetato em altas concentrações é absorvido por outras células além das do fígado e entra em uma via diferente via 1,2-propanodiol. Embora a via siga uma série diferente de etapas que requerem ATP, o 1,2-propanodiol pode ser transformado em piruvato.
Produção, condições anaeróbicas
A fermentação é o metabolismo de compostos orgânicos na ausência de ar. Envolve fosforilação em nível de substrato na ausência de uma cadeia respiratória de transporte de elétrons. A equação para a reação da glicose para formar o ácido lático é:
- C
6H. H. H.
12O
6 + 2 ADP + 2 PEu... → 2CH
3CH(OH)COOH + 2 ATP + 2H. H. H.
2O
A respiração anaeróbica é a respiração na ausência de O2. Os procariotos podem utilizar uma variedade de aceptores de elétrons. Estes incluem nitrato, sulfato e dióxido de carbono.
Reabastecimento de ATP por quinases de difosfato de nucleosídeo
ATP também pode ser sintetizado por meio de vários chamados "reabastecimento" reações catalisadas pelas famílias enzimáticas de nucleosídeos difosfato quinases (NDKs), que utilizam outros nucleosídeos trifosfatos como doadores de fosfato de alta energia, e a família ATP:guanido-fosfotransferase.
Produção de ATP durante a fotossíntese
Nas plantas, o ATP é sintetizado na membrana tilacoide do cloroplasto. O processo é chamado de fotofosforilação. A "máquina" é semelhante ao da mitocôndria, exceto que a energia da luz é usada para bombear prótons através de uma membrana para produzir uma força protônica motriz. A ATP sintase ocorre exatamente como na fosforilação oxidativa. Parte do ATP produzido nos cloroplastos é consumido no ciclo de Calvin, que produz açúcares triose.
Reciclagem de ATP
A quantidade total de ATP no corpo humano é de cerca de 0,1 mol/L. A maior parte do ATP é reciclada do ADP pelos processos acima mencionados. Assim, a qualquer momento, a quantidade total de ATP + ADP permanece razoavelmente constante.
A energia usada pelas células humanas em um adulto requer a hidrólise de 100 a 150 mol/L de ATP diariamente, o que significa que um ser humano normalmente usará seu peso corporal em ATP ao longo do dia. Cada equivalente de ATP é reciclado 1000–1500 vezes durante um único dia (150 / 0,1 = 1500), a aproximadamente 9×1020 moléculas/s.
Funções bioquímicas
Sinalização intracelular
O ATP está envolvido na transdução de sinal, servindo como substrato para quinases, enzimas que transferem grupos fosfato. As quinases são as proteínas de ligação de ATP mais comuns. Eles compartilham um pequeno número de dobras comuns. A fosforilação de uma proteína por uma quinase pode ativar uma cascata, como a cascata de proteína quinase ativada por mitógeno.
O ATP também é um substrato da adenilato ciclase, mais comumente nas vias de transdução de sinal do receptor acoplado à proteína G e é transformado em segundo mensageiro, AMP cíclico, que está envolvido no desencadeamento de sinais de cálcio pela liberação de cálcio dos estoques intracelulares. Esta forma de transdução de sinal é particularmente importante na função cerebral, embora esteja envolvida na regulação de uma infinidade de outros processos celulares.
Síntese de DNA e RNA
ATP é um dos quatro monômeros necessários na síntese de RNA. O processo é promovido por polimerases de RNA. Um processo semelhante ocorre na formação do DNA, exceto que o ATP é primeiro convertido no desoxirribonucleotídeo dATP. Como muitas reações de condensação na natureza, a replicação e a transcrição do DNA também consomem ATP.
Ativação de aminoácidos na síntese de proteínas
As enzimas aminoacil-tRNA sintetase consomem ATP na ligação do tRNA aos aminoácidos, formando complexos aminoacil-tRNA. A aminoacil transferase liga o AMP-aminoácido ao tRNA. A reação de acoplamento ocorre em duas etapas:
- aa + ATP ≡ aa-AMP + PPi
- aa-AMP + tRNA ⭐ aa-tRNA + AMP
O aminoácido é acoplado ao penúltimo nucleotídeo na extremidade 3' do tRNA (o A na sequência CCA) por meio de uma ligação éster (roll over na ilustração).
Transportador de cassete de ligação de ATP
O transporte de produtos químicos para fora de uma célula contra um gradiente é frequentemente associado à hidrólise de ATP. O transporte é mediado por transportadores de cassete de ligação ao ATP. O genoma humano codifica 48 transportadores ABC, que são usados para exportar drogas, lipídios e outros compostos.
Sinalização extracelular e neurotransmissão
As células secretam ATP para se comunicar com outras células em um processo chamado sinalização purinérgica. O ATP serve como um neurotransmissor em muitas partes do sistema nervoso, modula o batimento ciliar, afeta o suprimento de oxigênio vascular, etc. As células detectam ATP usando as proteínas receptoras purinérgicas P2X e P2Y.
Solubilidade de proteína
O ATP foi recentemente proposto para atuar como um hidrótropo biológico e demonstrou afetar a solubilidade em todo o proteoma.
Análogos de ATP
Laboratórios de bioquímica costumam usar estudos in vitro para explorar processos moleculares dependentes de ATP. Os análogos de ATP também são usados em cristalografia de raios-X para determinar uma estrutura de proteína em complexo com ATP, muitas vezes junto com outros substratos.
Os inibidores enzimáticos de enzimas dependentes de ATP, como as quinases, são necessários para examinar os locais de ligação e os estados de transição envolvidos nas reações dependentes de ATP.
Os análogos de ATP mais úteis não podem ser hidrolisados como o ATP seria; em vez disso, eles aprisionam a enzima em uma estrutura intimamente relacionada ao estado ligado ao ATP. A adenosina 5'-(γ-tiotrifosfato) é um análogo de ATP extremamente comum no qual um dos oxigênios do gama-fosfato é substituído por um átomo de enxofre; esse ânion é hidrolisado a uma taxa dramaticamente mais lenta do que o próprio ATP e funciona como um inibidor de processos dependentes de ATP. Em estudos cristalográficos, os estados de transição da hidrólise são modelados pelo íon vanadato ligado.
É necessário ter cuidado ao interpretar os resultados de experimentos usando análogos de ATP, uma vez que algumas enzimas podem hidrolizá-los em taxas apreciáveis em alta concentração.
Uso medicinal
O ATP é usado por via intravenosa para algumas condições relacionadas ao coração.
História
O ATP foi descoberto em 1929 por Karl Lohmann e Jendrassik e, independentemente, por Cyrus Fiske e Yellapragada Subba Rao da Harvard Medical School, ambas as equipes competindo entre si para encontrar um ensaio para o fósforo.
Foi proposto ser o intermediário entre as reações que produzem e requerem energia nas células por Fritz Albert Lipmann em 1941.
Foi sintetizado pela primeira vez em laboratório por Alexander Todd em 1948, e ele recebeu o Prêmio Nobel de Química em 1957 em parte por este trabalho.
O Prêmio Nobel de Química de 1978 foi concedido ao Dr. Peter Dennis Mitchell pela descoberta do mecanismo quimiosmótico da síntese de ATP.
O Prêmio Nobel de Química de 1997 foi dividido, metade para Paul D. Boyer e John E. Walker "por sua elucidação do mecanismo enzimático subjacente à síntese de trifosfato de adenosina (ATP)" e a outra metade para Jens C. Skou "pela primeira descoberta de uma enzima transportadora de íons, Na+, K+ -ATPase."



![{displaystyle {frac {[mathrm {cyt~c_{red}} ]}{[mathrm {cyt~c_{ox}} ]}}=left({frac {[mathrm {NADH} ]}{[mathrm {NAD} ]^{+}}}right)^{frac {1}{2}}left({frac {[mathrm {ADP} ][mathrm {P_{i}} ]}{[mathrm {ATP} ]}}right)K_{mathrm {eq} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/baed008d658c507750599ae155a9a1c11da873e7)