Sinapse química

Sinapses químicas são junções biológicas através das quais os neurônios & #39; os sinais podem ser enviados entre si e para células não neuronais, como as dos músculos ou glândulas. As sinapses químicas permitem que os neurônios formem circuitos dentro do sistema nervoso central. Eles são cruciais para os cálculos biológicos que fundamentam a percepção e o pensamento. Eles permitem que o sistema nervoso se conecte e controle outros sistemas do corpo.
Em uma sinapse química, um neurônio libera moléculas de neurotransmissores em um pequeno espaço (a fenda sináptica) adjacente a outro neurônio. Os neurotransmissores estão contidos em pequenos sacos chamados vesículas sinápticas e são liberados na fenda sináptica por exocitose. Essas moléculas então se ligam aos receptores de neurotransmissores na célula pós-sináptica. Finalmente, os neurotransmissores são eliminados da sinapse através de um dos vários mecanismos potenciais, incluindo a degradação enzimática ou a recaptação por transportadores específicos, quer na célula pré-sináptica, quer em alguma outra neuróglia, para terminar a acção do neurotransmissor.
Estima-se que o cérebro humano adulto contenha de 1014 a 5 × 1014 (100–500 trilhões) de sinapses. Cada milímetro cúbico de córtex cerebral contém cerca de um bilhão (escala curta, ou seja, 109) deles. O número de sinapses no córtex cerebral humano foi estimado separadamente em 0,15 quatrilhões (150 trilhões)
A palavra "sinapse" foi introduzido por Sir Charles Scott Sherrington em 1897. As sinapses químicas não são o único tipo de sinapse biológica: também existem sinapses elétricas e imunológicas. Sem um qualificador, entretanto, "sinapse" comumente se refere a sinapses químicas.
Estrutura
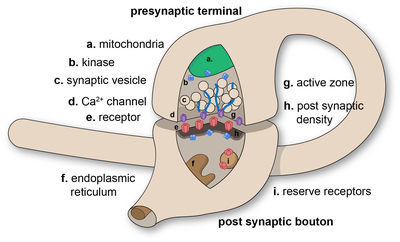
Sinapses são conexões funcionais entre neurônios ou entre neurônios e outros tipos de células. Um neurônio típico dá origem a vários milhares de sinapses, embora existam alguns tipos que produzem muito menos. A maioria das sinapses conecta axônios a dendritos, mas também existem outros tipos de conexões, incluindo axônio com corpo celular, axônio com axônio e dendrito com dendrito. As sinapses são geralmente muito pequenas para serem reconhecíveis usando um microscópio óptico, exceto como pontos onde as membranas de duas células parecem se tocar, mas seus elementos celulares podem ser visualizados claramente usando um microscópio eletrônico.
As sinapses químicas passam informações direcionalmente de uma célula pré-sináptica para uma célula pós-sináptica e são, portanto, assimétricas em estrutura e função. O terminal do axônio pré-sináptico, ou botão sináptico , é uma área especializada dentro do axônio da célula pré-sináptica que contém neurotransmissores encerrados em pequenas esferas ligadas à membrana chamadas vesículas sinápticas. (bem como uma série de outras estruturas e organelas de suporte, como mitocôndrias e retículo endoplasmático). As vesículas sinápticas estão ancoradas na membrana plasmática pré-sináptica em regiões chamadas zonas ativas.
Imediatamente oposta está uma região da célula pós-sináptica contendo receptores de neurotransmissores; para sinapses entre dois neurônios, a região pós-sináptica pode ser encontrada nos dendritos ou no corpo celular. Imediatamente atrás da membrana pós-sináptica está um elaborado complexo de proteínas interligadas chamado densidade pós-sináptica (PSD).
As proteínas do PSD estão envolvidas na ancoragem e no tráfego de receptores de neurotransmissores e na modulação da atividade desses receptores. Os receptores e PSDs são frequentemente encontrados em saliências especializadas da haste dendrítica principal, chamadas espinhas dendríticas.
As sinapses podem ser descritas como simétricas ou assimétricas. Quando examinadas ao microscópio eletrônico, as sinapses assimétricas são caracterizadas por vesículas arredondadas na célula pré-sináptica e uma densidade pós-sináptica proeminente. As sinapses assimétricas são tipicamente excitatórias. As sinapses simétricas, em contraste, têm vesículas achatadas ou alongadas e não contêm uma densidade pós-sináptica proeminente. As sinapses simétricas são tipicamente inibitórias.
A fenda sináptica, também chamada de lacuna sináptica, é uma lacuna entre as células pré e pós-sinápticas com cerca de 20 nm (0,02 μ) de largura. O pequeno volume da fenda permite que a concentração do neurotransmissor seja aumentada e diminuída rapidamente.
Uma autapse é uma sinapse química (ou elétrica) formada quando o axônio de um neurônio faz sinapse com seus próprios dendritos.
Sinalização em sinapses químicas
Visão geral
Aqui está um resumo da sequência de eventos que ocorrem na transmissão sináptica de um neurônio pré-sináptico para uma célula pós-sináptica. Cada etapa é explicada com mais detalhes abaixo. Observe que, com exceção da etapa final, todo o processo pode durar apenas algumas centenas de microssegundos, nas sinapses mais rápidas.
- O processo começa com uma onda de excitação eletroquímica chamada potencial de ação viajando ao longo da membrana da célula pré-sináptica, até atingir a sinapse.
- A despolarização elétrica da membrana na sinapse faz com que os canais abram que são permeáveis aos íons de cálcio.
- Os íons de cálcio fluem através da membrana pré-sináptica, aumentando rapidamente a concentração de cálcio no interior.
- A alta concentração de cálcio ativa um conjunto de proteínas sensíveis ao cálcio ligadas a vesículas que contêm um neurotransmissor químico.
- Estas proteínas mudam de forma, fazendo com que as membranas de alguns vesículas "docked" fusam com a membrana da célula pré-sináptica, abrindo assim os vesículas e despejando seu conteúdo do neurotransmissor na fenda sináptica, o espaço estreito entre as membranas das células pré- e pós-sinápticas.
- O neurotransmissor se espalha dentro da fenda. Alguns escapam, mas alguns se ligam a moléculas de receptores químicos localizadas na membrana da célula pós-sináptica.
- A ligação do neurotransmissor faz com que a molécula do receptor seja ativado ativado de alguma forma. Vários tipos de ativação são possíveis, conforme descrito em mais detalhes abaixo. Em qualquer caso, este é o passo chave pelo qual o processo sináptico afeta o comportamento da célula pós-sináptica.
- Devido à vibração térmica, o movimento dos átomos, vibrando sobre suas posições de equilíbrio em um sólido cristalino, moléculas de neurotransmissor eventualmente se soltam dos receptores e se afastam.
- O neurotransmissor é ou reabsorvido pela célula pré-sináptica, e depois reembalado para liberação futura, ou então é quebrado metabólico.
Liberação de neurotransmissores

A liberação de um neurotransmissor é desencadeada pela chegada de um impulso nervoso (ou potencial de ação) e ocorre através de um processo invulgarmente rápido de secreção celular (exocitose). Dentro do terminal nervoso pré-sináptico, vesículas contendo neurotransmissores estão localizadas perto da membrana sináptica. O potencial de ação que chega produz um influxo de íons de cálcio através de canais de íons seletivos de cálcio, dependentes de voltagem, no curso descendente do potencial de ação (corrente de cauda). Os íons cálcio então se ligam às proteínas sinaptotagmina encontradas nas membranas das vesículas sinápticas, permitindo que as vesículas se fundam com a membrana pré-sináptica. A fusão de uma vesícula é um processo estocástico, levando à falha frequente da transmissão sináptica nas sinapses muito pequenas, típicas do sistema nervoso central. Grandes sinapses químicas (por exemplo, a junção neuromuscular), por outro lado, têm uma probabilidade de liberação sináptica, com efeito, de 1. A fusão das vesículas é impulsionada pela ação de um conjunto de proteínas no terminal pré-sináptico conhecido como SNAREs. Como um todo, o complexo ou estrutura proteica que medeia o acoplamento e a fusão das vesículas pré-sinápticas é denominado zona ativa. A membrana adicionada pelo processo de fusão é posteriormente recuperada por endocitose e reciclada para a formação de novas vesículas cheias de neurotransmissores.
Uma exceção à tendência geral de liberação de neurotransmissores por fusão vesicular é encontrada nas células receptoras tipo II das papilas gustativas de mamíferos. Aqui, o neurotransmissor ATP é liberado diretamente do citoplasma na fenda sináptica por meio de canais dependentes de voltagem.
Ligação do receptor
Receptores no lado oposto da lacuna sináptica ligam moléculas de neurotransmissores. Os receptores podem responder de duas maneiras gerais. Primeiro, os receptores podem abrir diretamente canais iônicos controlados por ligantes na membrana celular pós-sináptica, fazendo com que os íons entrem ou saiam da célula e alterando o potencial transmembranar local. A mudança resultante na voltagem é chamada de potencial pós-sináptico. Em geral, o resultado é excitatório no caso de correntes despolarizantes, e inibitório no caso de correntes hiperpolarizantes. Se uma sinapse é excitatória ou inibitória depende de que tipo(s) de canal iônico conduz a(s) corrente(s) pós-sináptica(s), que por sua vez é uma função do tipo de receptores e neurotransmissores empregados na sinapse. A segunda maneira pela qual um receptor pode afetar o potencial de membrana é modulando a produção de mensageiros químicos dentro do neurônio pós-sináptico. Esses segundos mensageiros podem então amplificar a resposta inibitória ou excitatória aos neurotransmissores.
Rescisão
Depois que uma molécula neurotransmissora se liga a uma molécula receptora, ela deve ser removida para permitir que a membrana pós-sináptica continue a retransmitir EPSPs e/ou IPSPs subsequentes. Essa remoção pode acontecer através de um ou mais processos:
- O neurotransmissor pode difundir-se devido a oscilações térmicamente induzidas de ambos e do receptor, tornando-o disponível para ser quebrado metabolicamente fora do neurônio ou para ser reabsorvido.
- Enzimas dentro da membrana subsináptica podem inativar/metabolizar o neurotransmissor.
- As bombas de recaptação podem bombear ativamente o neurotransmissor de volta para o terminal de axônio pré-sináptico para reprocessamento e relançamento após um potencial de ação posterior.
Força sináptica
A força de uma sinapse foi definida por Bernard Katz como o produto da probabilidade de liberação (pré-sináptica) pr, tamanho quântico q (a resposta pós-sináptica à liberação de uma única vesícula neurotransmissora, um 'quântico') e n, o número de locais de liberação. "Conexão unitária" geralmente se refere a um número desconhecido de sinapses individuais conectando um neurônio pré-sináptico a um neurônio pós-sináptico. A amplitude dos potenciais pós-sinápticos (PSPs) pode ser tão baixa quanto 0,4 mV até 20 mV. A amplitude de um PSP pode ser modulada por neuromoduladores ou pode mudar como resultado de atividade anterior. As mudanças na força sináptica podem ser de curto prazo, durando de segundos a minutos, ou de longo prazo (potenciação de longo prazo ou LTP), durando horas. Acredita-se que a aprendizagem e a memória resultem de mudanças de longo prazo na força sináptica, através de um mecanismo conhecido como plasticidade sináptica.
Dessensibilização do receptor
A dessensibilização dos receptores pós-sinápticos é uma diminuição na resposta ao mesmo estímulo neurotransmissor. Isto significa que a força de uma sinapse pode, de facto, diminuir à medida que um conjunto de potenciais de acção chega em rápida sucessão – um fenómeno que dá origem à chamada dependência de frequência das sinapses. O sistema nervoso explora esta propriedade para fins computacionais e pode sintonizar as suas sinapses através de meios como a fosforilação das proteínas envolvidas.
Plasticidade sináptica
A transmissão sináptica pode ser alterada por atividades anteriores. Essas alterações são chamadas de plasticidade sináptica e podem resultar em uma diminuição na eficácia da sinapse, chamada depressão, ou em um aumento na eficácia, chamado potenciação. Essas mudanças podem ser de longo ou curto prazo. As formas de plasticidade de curto prazo incluem fadiga ou depressão sináptica e aumento sináptico. As formas de plasticidade a longo prazo incluem depressão a longo prazo e potenciação a longo prazo. A plasticidade sináptica pode ser homossináptica (ocorrendo em uma única sinapse) ou heterossináptica (ocorrendo em múltiplas sinapses).
Plasticidade homossináptica
A plasticidade homossináptica (ou também a modulação homotrópica) é uma mudança na força sináptica que resulta do histórico de atividade em uma sinapse específica. Isso pode resultar de alterações no cálcio pré-sináptico, bem como de feedback sobre os receptores pré-sinápticos, ou seja, uma forma de sinalização autócrina. A plasticidade homossináptica pode afetar o número e a taxa de reposição das vesículas ou pode afetar a relação entre o cálcio e a liberação das vesículas. A plasticidade homossináptica também pode ser de natureza pós-sináptica. Isso pode resultar em um aumento ou diminuição na força sináptica.
Um exemplo são os neurônios do sistema nervoso simpático (SNS), que liberam noradrenalina, que, além de afetar os receptores pós-sinápticos, também afeta os receptores α2-adrenérgicos pré-sinápticos, inibindo a liberação adicional de noradrenalina. Este efeito é utilizado com clonidina para realizar efeitos inibitórios no SNS.
Plasticidade heterossináptica
A plasticidade heterossináptica (ou também a modulação heterotrópica) é uma mudança na força sináptica que resulta da atividade de outros neurônios. Novamente, a plasticidade pode alterar o número de vesículas ou a sua taxa de reposição ou a relação entre o cálcio e a libertação das vesículas. Além disso, pode afetar diretamente o influxo de cálcio. A plasticidade heterossináptica também pode ser de natureza pós-sináptica, afetando a sensibilidade do receptor.
Um exemplo são novamente os neurônios do sistema nervoso simpático, que liberam noradrenalina, que, além disso, gera um efeito inibitório nos terminais pré-sinápticos dos neurônios do sistema nervoso parassimpático.
Integração de entradas sinápticas
Em geral, se uma sinapse excitatória for suficientemente forte, um potencial de ação no neurônio pré-sináptico desencadeará um potencial de ação na célula pós-sináptica. Em muitos casos, o potencial excitatório pós-sináptico (EPSP) não atingirá o limiar para eliciar um potencial de ação. Quando potenciais de ação de múltiplos neurônios pré-sinápticos disparam simultaneamente, ou se um único neurônio pré-sináptico dispara em uma frequência suficientemente alta, os EPSPs podem se sobrepor e somar. Se um número suficiente de EPSPs se sobrepuserem, o EPSP somado pode atingir o limiar para iniciar um potencial de ação. Este processo é conhecido como soma e pode servir como um filtro passa-alta para neurônios.
Por outro lado, um neurônio pré-sináptico liberando um neurotransmissor inibitório, como o GABA, pode causar um potencial pós-sináptico inibitório (IPSP) no neurônio pós-sináptico, afastando o potencial de membrana do limiar, diminuindo sua excitabilidade e tornando-o mais difícil para o neurônio iniciar um potencial de ação. Se um IPSP se sobrepõe a um EPSP, o IPSP pode, em muitos casos, impedir que o neurônio dispare um potencial de ação. Desta forma, a saída de um neurônio pode depender da entrada de muitos neurônios diferentes, cada um dos quais pode ter um grau diferente de influência, dependendo da força e do tipo de sinapse com aquele neurônio. John Carew Eccles realizou alguns dos primeiros experimentos importantes sobre integração sináptica, pelos quais recebeu o Prêmio Nobel de Fisiologia ou Medicina em 1963.
Transmissão de volume
Quando um neurotransmissor é liberado em uma sinapse, ele atinge sua concentração mais alta dentro do espaço estreito da fenda sináptica, mas é certo que parte dele se difundirá antes de ser reabsorvido ou decomposto. Se se difundir, terá o potencial de ativar receptores localizados em outras sinapses ou na membrana distante de qualquer sinapse. A atividade extra-sináptica de um neurotransmissor é conhecida como transmissão de volume. Está bem estabelecido que tais efeitos ocorrem até certo ponto, mas a sua importância funcional tem sido motivo de controvérsia.
Trabalhos recentes indicam que a transmissão de volume pode ser o modo predominante de interação para alguns tipos especiais de neurônios. No córtex cerebral dos mamíferos, uma classe de neurônios chamados células neurogliaformes pode inibir outros neurônios corticais próximos, liberando o neurotransmissor GABA no espaço extracelular. Na mesma linha, o GABA liberado das células neurogliaformais para o espaço extracelular também atua nos astrócitos circundantes, atribuindo um papel à transmissão de volume no controle da homeostase iônica e de neurotransmissores. Aproximadamente 78% dos botões das células neurogliaformes não formam sinapses clássicas. Este pode ser o primeiro exemplo definitivo de neurônios que se comunicam quimicamente onde as sinapses clássicas não estão presentes.
Relação com sinapses elétricas
Uma sinapse elétrica é uma ligação eletricamente condutora entre dois neurônios adjacentes que é formada em uma lacuna estreita entre as células pré e pós-sinápticas, conhecida como junção comunicante. Nas junções comunicantes, as células se aproximam a cerca de 3,5 nm uma da outra, em vez da distância de 20 a 40 nm que separa as células nas sinapses químicas. Ao contrário das sinapses químicas, o potencial pós-sináptico nas sinapses elétricas não é causado pela abertura de canais iônicos por transmissores químicos, mas sim pelo acoplamento elétrico direto entre ambos os neurônios. As sinapses elétricas são mais rápidas que as sinapses químicas. Sinapses elétricas são encontradas em todo o sistema nervoso, inclusive na retina, no núcleo reticular do tálamo, no neocórtex e no hipocampo. Embora as sinapses químicas sejam encontradas entre neurônios excitatórios e inibitórios, as sinapses elétricas são mais comumente encontradas entre neurônios inibitórios locais menores. As sinapses elétricas podem existir entre dois axônios, dois dendritos ou entre um axônio e um dendrito. Em alguns peixes e anfíbios, as sinapses elétricas podem ser encontradas no mesmo terminal de uma sinapse química, como nas células de Mauthner.
Efeitos das drogas
Uma das características mais importantes das sinapses químicas é que elas são o local de ação da maioria das drogas psicoativas. As sinapses são afetadas por drogas, como curare, estricnina, cocaína, morfina, álcool, LSD e inúmeras outras. Essas drogas têm efeitos diferentes na função sináptica e muitas vezes estão restritas a sinapses que utilizam um neurotransmissor específico. Por exemplo, o curare é um veneno que impede a acetilcolina de despolarizar a membrana pós-sináptica, causando paralisia. A estricnina bloqueia os efeitos inibitórios do neurotransmissor glicina, que faz com que o corpo capte e reaja a estímulos mais fracos e anteriormente ignorados, resultando em espasmos musculares incontroláveis. A morfina atua nas sinapses que utilizam neurotransmissores endorfina, e o álcool aumenta os efeitos inibitórios do neurotransmissor GABA. O LSD interfere nas sinapses que utilizam o neurotransmissor serotonina. A cocaína bloqueia a recaptação da dopamina e, portanto, aumenta os seus efeitos.
História e etimologia
Durante a década de 1950, Bernard Katz e Paul Fatt observaram correntes sinápticas espontâneas em miniatura na junção neuromuscular do sapo. Com base nessas observações, eles desenvolveram a 'hipótese quântica' essa é a base para nossa compreensão atual da liberação de neurotransmissores como exocitose e pela qual Katz recebeu o Prêmio Nobel de Fisiologia ou Medicina em 1970. No final da década de 1960, Ricardo Miledi e Katz apresentaram a hipótese de que o influxo de íons de cálcio induzido pela despolarização desencadeia a exocitose..
Sir Charles Scott Sherringtonin cunhou a palavra 'sinapse' e a história da palavra foi contada por Sherrington em uma carta que escreveu a John Fulton:
' Senti a necessidade de um nome para chamar a junção entre a célula nervosa e a célula nervosa... Sugeri usar "syndesm"... Ele [ Sir Michael Foster ] consultou seu amigo da Trindade Verrall, o estudioso euripideano, sobre ele, e Verrall sugeriu "synapse" (do grego "clasp"). Charles Scott Sherrington
Contenido relacionado
Konrad Emil Bloch
Fabales
Bexiga (desambiguação)