Quimioterapia
Quimioterapia (muitas vezes abreviada para chemo e às vezes CTX ou CTx) é um tipo de tratamento contra o câncer que usa um ou mais medicamentos anticancerígenos (agentes quimioterápicos ou agentes alquilantes) como parte de um regime de quimioterapia padronizado. A quimioterapia pode ser administrada com intenção curativa (que quase sempre envolve combinações de medicamentos) ou pode ter como objetivo prolongar a vida ou reduzir os sintomas (quimioterapia paliativa). A quimioterapia é uma das principais categorias da disciplina médica especificamente dedicada à farmacoterapia para o câncer, que é chamada de oncologia médica.
O termo quimioterapia passou a conotar o uso não específico de venenos intracelulares para inibir a mitose (divisão celular) ou induzir danos ao DNA, e é por isso que a inibição do reparo do DNA pode aumentar a quimioterapia. A conotação da palavra quimioterapia exclui agentes mais seletivos que bloqueiam sinais extracelulares (transdução de sinal). O desenvolvimento de terapias com alvos moleculares ou genéticos específicos, que inibem sinais promotores de crescimento de hormônios endócrinos clássicos (principalmente estrogênios para câncer de mama e andrógenos para câncer de próstata) são agora chamados de terapias hormonais. Em contraste, outras inibições de sinais de crescimento, como aquelas associadas com receptores de tirosina quinase, são chamadas de terapia direcionada.
É importante ressaltar que o uso de medicamentos (seja quimioterapia, terapia hormonal ou terapia direcionada) constitui uma terapia sistêmica para o câncer, pois são introduzidos na corrente sanguínea e, portanto, em princípio, são capazes de tratar o câncer em qualquer localização anatômica do corpo. A terapia sistêmica é frequentemente usada em conjunto com outras modalidades que constituem terapia local (ou seja, tratamentos cuja eficácia é confinada à área anatômica onde são aplicados) para o câncer, como radioterapia, cirurgia ou terapia de hipertermia.
Agentes quimioterápicos tradicionais são citotóxicos por meio da interferência na divisão celular (mitose), mas as células cancerígenas variam amplamente em sua suscetibilidade a esses agentes. Em grande medida, a quimioterapia pode ser considerada uma forma de danificar ou estressar as células, o que pode levar à morte celular se a apoptose for iniciada. Muitos dos efeitos colaterais da quimioterapia podem ser atribuídos a danos às células normais que se dividem rapidamente e, portanto, são sensíveis a drogas antimitóticas: células da medula óssea, trato digestivo e folículos pilosos. Isso resulta nos efeitos colaterais mais comuns da quimioterapia: mielossupressão (diminuição da produção de células sanguíneas, portanto também imunossupressão), mucosite (inflamação do revestimento do trato digestivo) e alopecia (perda de cabelo). Devido ao efeito sobre as células imunológicas (especialmente linfócitos), os medicamentos quimioterápicos geralmente são úteis em uma série de doenças que resultam da hiperatividade prejudicial do sistema imunológico contra si mesmo (a chamada autoimunidade). Estes incluem artrite reumatóide, lúpus eritematoso sistêmico, esclerose múltipla, vasculite e muitos outros.
Estratégias de tratamento
| Tipo de câncer | Drogas | Acrônimo |
|---|---|---|
| Câncer de mama | Cyclophosphamide, methotrexate, 5-fluorouracil, vinorelbine | CMF |
| Doxorubicina, ciclofosfamida | ACÇÃO | |
| Linfoma de Hodgkin | Docetaxel, doxorubicina, ciclofosfamida | TAC |
| Doxorubicin, bleomycin, vinblastine, dacarbazine | ABVD | |
| Mustine, vincristine, procarbazine, prednisolone | MOPP | |
| Linfoma não Hodgkin | Cyclophosphamide, doxorubicin, vincristine, prednisolone | CHOP, R-CVP |
| tumor da célula de germe | Bleomycin, etoposide, cisplatin | BEP |
| Câncer de estômago | Epirubicina, cisplatina, 5-fluorouracil | ECF |
| Epirubicina, cisplatina, capecitabina | ECX | |
| Câncer de bexiga | Methotrexate, vincristine, doxorubicin, cisplatin | MVAC |
| Câncer de pulmão | Cyclophosphamide, doxorubicin, vincristine, vinorelbine | CAV |
| Câncer colorretal | 5-fluorouracil, ácido folínico, oxaliplatina | FOLFOX |
| Câncer pancreático | Gemcitabina, 5-fluorouracil | FOLFOX |
| Câncer de ossos | Doxorubicina, cisplatina, metotrexato, seosfamida, etoposide | MAP/MAPIE |
Há uma série de estratégias na administração de drogas quimioterápicas usadas hoje. A quimioterapia pode ser administrada com intenção curativa ou pode ter como objetivo prolongar a vida ou aliviar os sintomas.
- A quimioterapia por indução é o primeiro tratamento de linha de câncer com um medicamento quimioterápico. Este tipo de quimioterapia é usado para a intenção curativa.
- A quimioterapia de moda combinada é o uso de drogas com outros tratamentos de câncer, como cirurgia, radioterapia ou hipertermia.
- A quimioterapia de consolidação é dada após a remissão, a fim de prolongar o tempo livre de doença geral e melhorar a sobrevivência geral. A droga que é administrada é a mesma que a droga que alcançou a remissão.
- A quimioterapia de intensificação é idêntica à quimioterapia de consolidação, mas uma droga diferente da quimioterapia de indução é usada.
- A quimioterapia de combinação envolve tratar uma pessoa com um número de diferentes drogas simultaneamente. As drogas diferem em seu mecanismo e efeitos colaterais. A maior vantagem é minimizar as chances de resistência se desenvolver para qualquer um agente. Além disso, os medicamentos muitas vezes podem ser usados em doses mais baixas, reduzindo a toxicidade.
- A quimioterapia neoadjuvante é dada antes de um tratamento local, como a cirurgia, e é projetada para encolher o tumor primário. Também é dado para cânceres com alto risco de doença micrometastática.
- A quimioterapia adjuvante é dada após um tratamento local (radioterapia ou cirurgia). Pode ser usado quando há pouca evidência de câncer presente, mas há risco de recorrência. Também é útil matar todas as células cancerosas que se espalharam para outras partes do corpo. Estes micrometastases podem ser tratados com quimioterapia adjuvante e podem reduzir as taxas de recaída causadas por essas células disseminadas.
- A quimioterapia de manutenção é um tratamento de baixa dose repetido para prolongar a remissão.
- Quimioterapia salvamento ou quimioterapia paliativa é dada sem intenção curativa, mas simplesmente para diminuir a carga tumoral e aumentar a expectativa de vida. Para estes regimes, em geral, espera-se um melhor perfil de toxicidade.
Todos os regimes de quimioterapia exigem que o receptor seja capaz de se submeter ao tratamento. O status de desempenho é freqüentemente usado como uma medida para determinar se uma pessoa pode receber quimioterapia ou se a redução da dose é necessária. Como apenas uma fração das células em um tumor morre com cada tratamento (morte fracionada), doses repetidas devem ser administradas para continuar a reduzir o tamanho do tumor. Os regimes quimioterápicos atuais aplicam o tratamento medicamentoso em ciclos, com a frequência e a duração dos tratamentos limitadas pela toxicidade.
Eficiência
A eficiência da quimioterapia depende do tipo de câncer e do estágio. A eficácia geral varia de curativa para alguns tipos de câncer, como algumas leucemias, a ineficácia, como em alguns tumores cerebrais, e desnecessária em outros, como a maioria dos cânceres de pele não melanoma.
Dosagem
A dosagem da quimioterapia pode ser difícil: Se a dose for muito baixa, ela será ineficaz contra o tumor, enquanto que, em doses excessivas, a toxicidade (efeitos colaterais) será intolerável para a pessoa que a recebe. O método padrão de determinação da dosagem de quimioterapia é baseado na área de superfície corporal calculada (BSA). A BSA geralmente é calculada com uma fórmula matemática ou um nomograma, usando o peso e a altura do destinatário, em vez da medição direta da área corporal. Esta fórmula foi originalmente derivada de um estudo de 1916 e tentou traduzir doses medicinais estabelecidas com animais de laboratório em doses equivalentes para humanos. O estudo incluiu apenas nove seres humanos. Quando a quimioterapia foi introduzida na década de 1950, a fórmula BSA foi adotada como padrão oficial para dosagem de quimioterapia por falta de uma opção melhor.
A validade desse método no cálculo de doses uniformes tem sido questionada porque a fórmula leva em consideração apenas o peso e a altura do indivíduo. A absorção e a depuração da droga são influenciadas por múltiplos fatores, incluindo idade, sexo, metabolismo, estado da doença, função do órgão, interações entre drogas, genética e obesidade, que têm grandes impactos na concentração real da droga na pessoa. 39;s corrente sanguínea. Como resultado, há uma alta variabilidade na concentração de drogas quimioterápicas sistêmicas em pessoas medicadas com BSA, e essa variabilidade demonstrou ser mais de dez vezes maior para muitas drogas. Em outras palavras, se duas pessoas recebem a mesma dose de um determinado medicamento à base de BSA, a concentração desse medicamento na corrente sanguínea de uma pessoa pode ser 10 vezes maior ou menor em relação à outra pessoa. Essa variabilidade é típica de muitas drogas quimioterápicas dosadas por BSA e, conforme mostrado abaixo, foi demonstrada em um estudo de 14 drogas quimioterápicas comuns.
O resultado dessa variabilidade farmacocinética entre as pessoas é que muitas pessoas não recebem a dose certa para alcançar a eficácia ideal do tratamento com efeitos colaterais tóxicos minimizados. Algumas pessoas sofrem overdose, enquanto outras sofrem subdosagem. Por exemplo, em um ensaio clínico randomizado, os investigadores descobriram que 85% dos pacientes com câncer colorretal metastático tratados com 5-fluorouracil (5-FU) não receberam a dose terapêutica ideal quando administrados pelo padrão BSA - 68% receberam subdosagem e 17% foram overdose.
Houve controvérsia sobre o uso de BSA para calcular as doses de quimioterapia para pessoas obesas. Por causa de sua BSA mais alta, os médicos muitas vezes reduzem arbitrariamente a dose prescrita pela fórmula de BSA por medo de overdose. Em muitos casos, isso pode resultar em tratamento abaixo do ideal.
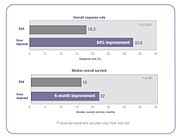
Vários estudos clínicos demonstraram que, quando a dosagem de quimioterapia é individualizada para atingir a exposição sistêmica ideal ao medicamento, os resultados do tratamento são melhorados e os efeitos colaterais tóxicos são reduzidos. No estudo clínico de 5-FU citado acima, as pessoas cuja dose foi ajustada para atingir uma exposição-alvo pré-determinada obtiveram uma melhora de 84% na taxa de resposta ao tratamento e uma melhora de seis meses na sobrevida geral (OS) em comparação com aquelas dosadas por BSA.
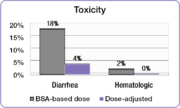
No mesmo estudo, os investigadores compararam a incidência de toxicidades comuns de grau 3/4 associadas ao 5-FU entre pessoas com dose ajustada e pessoas com doses por BSA. A incidência de graus debilitantes de diarréia foi reduzida de 18% no grupo de dosagem de BSA para 4% no grupo de dose ajustada e os efeitos colaterais hematológicos graves foram eliminados. Devido à toxicidade reduzida, os pacientes com dose ajustada puderam ser tratados por períodos de tempo mais longos. As pessoas com doses de BSA foram tratadas por um total de 680 meses, enquanto as pessoas no grupo de dose ajustada foram tratadas por um total de 791 meses. Concluir o curso do tratamento é um fator importante para alcançar melhores resultados de tratamento.
Resultados semelhantes foram encontrados em um estudo envolvendo pessoas com câncer colorretal que foram tratadas com o popular regime FOLFOX. A incidência de diarreia grave foi reduzida de 12% no grupo de pacientes com dose de BSA para 1,7% no grupo de dose ajustada, e a incidência de mucosite grave foi reduzida de 15% para 0,8%.
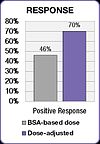
O estudo FOLFOX também demonstrou uma melhora nos resultados do tratamento. A resposta positiva aumentou de 46% no grupo de dose de BSA para 70% no grupo de dose ajustada. A sobrevida livre de progressão mediana (PFS) e a sobrevida global (OS) melhoraram em seis meses no grupo de dose ajustada.
Uma abordagem que pode ajudar os médicos a individualizar a dosagem de quimioterapia é medir os níveis da droga no plasma sanguíneo ao longo do tempo e ajustar a dose de acordo com uma fórmula ou algoritmo para atingir a exposição ideal. Com uma exposição-alvo estabelecida para eficácia otimizada do tratamento com toxicidades minimizadas, a dosagem pode ser personalizada para atingir a exposição-alvo e resultados ideais para cada pessoa. Esse algoritmo foi usado nos ensaios clínicos citados acima e resultou em resultados de tratamento significativamente melhorados.
Os oncologistas já estão individualizando a dosagem de alguns medicamentos contra o câncer com base na exposição. A dosagem de carboplatina e busulfan depende dos resultados de exames de sangue para calcular a dose ideal para cada pessoa. Exames de sangue simples também estão disponíveis para otimização da dose de metotrexato, 5-FU, paclitaxel e docetaxel.
O nível de albumina sérica imediatamente antes da administração da quimioterapia é um preditor prognóstico independente de sobrevivência em vários tipos de câncer.
Tipos
Agentes alquilantes
Os agentes alquilantes são o grupo mais antigo de quimioterápicos em uso atualmente. Originalmente derivado do gás mostarda usado na Primeira Guerra Mundial, agora existem muitos tipos de agentes alquilantes em uso. Eles são assim chamados por causa de sua capacidade de alquilar muitas moléculas, incluindo proteínas, RNA e DNA. Essa capacidade de se ligar covalentemente ao DNA por meio de seu grupo alquil é a principal causa de seus efeitos anticancerígenos. O DNA é feito de duas fitas e as moléculas podem se ligar duas vezes a uma fita de DNA (reticulação intrastrand) ou podem se ligar uma vez a ambas as fitas (crosslink interstrand). Se a célula tentar replicar o DNA reticulado durante a divisão celular, ou tentar repará-lo, os filamentos de DNA podem quebrar. Isso leva a uma forma de morte celular programada chamada apoptose. Os agentes alquilantes funcionarão em qualquer ponto do ciclo celular e, portanto, são conhecidos como drogas independentes do ciclo celular. Por esta razão, o efeito na célula é dependente da dose; a fração de células que morrem é diretamente proporcional à dose da droga.
Os subtipos de agentes alquilantes são as mostardas nitrogenadas, nitrosouréias, tetrazinas, aziridinas, cisplatinas e derivados, e agentes alquilantes não clássicos. As mostardas nitrogenadas incluem mecloretamina, ciclofosfamida, melfalano, clorambucil, ifosfamida e busulfan. As nitrosouréias incluem N-Nitroso-N-metilureia (MNU), carmustina (BCNU), lomustina (CCNU) e semustina (MeCCNU), fotemustina e estreptozotocina. Tetrazinas incluem dacarbazina, mitozolomida e temozolomida. Aziridinas incluem tiotepa, mitomicina e diaziquona (AZQ). Cisplatina e derivados incluem cisplatina, carboplatina e oxaliplatina. Eles prejudicam a função celular formando ligações covalentes com os grupos amino, carboxila, sulfidrila e fosfato em moléculas biologicamente importantes. Agentes alquilantes não clássicos incluem procarbazina e hexametilmelamina.
Antimetabólitos
Os anti-metabólitos são um grupo de moléculas que impedem a síntese de DNA e RNA. Muitos deles têm uma estrutura semelhante aos blocos de construção do DNA e do RNA. Os blocos de construção são nucleotídeos; uma molécula compreendendo uma nucleobase, um açúcar e um grupo fosfato. As nucleobases são divididas em purinas (guanina e adenina) e pirimidinas (citosina, timina e uracila). Os antimetabólitos se assemelham a nucleobases ou nucleosídeos (um nucleotídeo sem o grupo fosfato), mas possuem grupos químicos alterados. Essas drogas exercem seu efeito bloqueando as enzimas necessárias para a síntese de DNA ou incorporando-se ao DNA ou RNA. Ao inibir as enzimas envolvidas na síntese do DNA, eles impedem a mitose porque o DNA não pode se duplicar. Além disso, após a incorporação incorreta das moléculas no DNA, pode ocorrer dano ao DNA e a morte celular programada (apoptose) é induzida. Ao contrário dos agentes alquilantes, os antimetabólitos são dependentes do ciclo celular. Isso significa que eles só funcionam durante uma parte específica do ciclo celular, neste caso a fase S (a fase de síntese do DNA). Por esta razão, em uma determinada dose, o efeito se estabiliza e proporcionalmente não ocorre mais morte celular com doses aumentadas. Subtipos de antimetabólitos são os antifolatos, fluoropirimidinas, análogos desoxinucleosídeos e tiopurinas.
Os antifolatos incluem metotrexato e pemetrexed. O metotrexato inibe a diidrofolato redutase (DHFR), uma enzima que regenera o tetraidrofolato a partir do diidrofolato. Quando a enzima é inibida pelo metotrexato, os níveis celulares das coenzimas folato diminuem. Estes são necessários para a produção de timidilato e purina, que são essenciais para a síntese de DNA e divisão celular. O pemetrexede é outro antimetabólito que afeta a produção de purina e pirimidina e, portanto, também inibe a síntese de DNA. Inibe principalmente a enzima timidilato sintase, mas também tem efeitos sobre DHFR, aminoimidazol carboxamida ribonucleotídeo formiltransferase e glicinamida ribonucleotídeo formiltransferase. As fluoropirimidinas incluem fluorouracil e capecitabina. Fluorouracil é um análogo de nucleobase que é metabolizado nas células para formar pelo menos dois produtos ativos; monofosfato de 5-fluourouridina (FUMP) e 5-fluoro-2'-desoxiuridina 5'-fosfato (fdUMP). O FUMP torna-se incorporado ao RNA e o fdUMP inibe a enzima timidilato sintase; ambos os quais levam à morte celular. A capecitabina é um pró-fármaco do 5-fluorouracil que é decomposto nas células para produzir o fármaco ativo. Os análogos desoxinucleosídeos incluem citarabina, gemcitabina, decitabina, azacitidina, fludarabina, nelarabina, cladribina, clofarabina e pentostatina. As tiopurinas incluem tioguanina e mercaptopurina.
Agentes antimicrotúbulos
Agentes antimicrotúbulos são produtos químicos derivados de plantas que bloqueiam a divisão celular impedindo a função dos microtúbulos. Os microtúbulos são uma importante estrutura celular composta por duas proteínas, α-tubulina e β-tubulina. Eles são estruturas ocas em forma de haste que são necessárias para a divisão celular, entre outras funções celulares. Os microtúbulos são estruturas dinâmicas, o que significa que estão permanentemente em estado de montagem e desmontagem. Os alcalóides da vinca e os taxanos são os dois principais grupos de agentes antimicrotúbulos e, embora ambos os grupos de drogas causem disfunção dos microtúbulos, seus mecanismos de ação são completamente opostos: os alcaloides da vinca impedem a montagem dos microtúbulos, enquanto os taxanos impedem a sua desmontagem. Ao fazer isso, eles podem induzir uma catástrofe mitótica nas células cancerígenas. Em seguida, ocorre a parada do ciclo celular, que induz a morte celular programada (apoptose). Essas drogas também podem afetar o crescimento dos vasos sanguíneos, um processo essencial que os tumores utilizam para crescer e metástase.
Os alcaloidesVinca são derivados da pervinca de Madagascar, Catharanthus roseus, anteriormente conhecida como Vinca rosea. Eles se ligam a locais específicos na tubulina, inibindo a montagem da tubulina em microtúbulos. Os alcaloides originais da vinca são produtos naturais que incluem vincristina e vinblastina. Após o sucesso dessas drogas, foram produzidos alcaloides semissintéticos da vinca: vinorelbina (usada no tratamento de câncer de pulmão de células não pequenas), vindesina e vinflunina. Essas drogas são específicas do ciclo celular. Eles se ligam às moléculas de tubulina na fase S e impedem a formação adequada de microtúbulos necessária para a fase M.
Taxanos são drogas naturais e semissintéticas. A primeira droga de sua classe, o paclitaxel, foi originalmente extraída de Taxus brevifolia, o teixo do Pacífico. Agora, essa droga e outra dessa classe, o docetaxel, são produzidas semi-sinteticamente a partir de uma substância química encontrada na casca de outro teixo, Taxus baccata.
A podofilotoxina é uma lignana antineoplásica obtida principalmente da maçã americana (Podophyllum peltatum) e da maçã do Himalaia (Sinopodophyllum hexandrum). Possui atividade antimicrotúbulos e seu mecanismo é semelhante ao dos alcalóides da vinca, pois se ligam à tubulina, inibindo a formação de microtúbulos. A podofilotoxina é usada para produzir duas outras drogas com diferentes mecanismos de ação: etoposídeo e teniposídeo.
Inibidores da topoisomerase
Os inibidores da topoisomerase são drogas que afetam a atividade de duas enzimas: topoisomerase I e topoisomerase II. Quando a hélice de fita dupla do DNA é desenrolada, durante a replicação ou transcrição do DNA, por exemplo, o DNA não aberto adjacente enrola-se mais apertado (superenrolamentos), como a abertura no meio de uma corda torcida. O estresse causado por esse efeito é em parte auxiliado pelas enzimas topoisomerase. Eles produzem quebras de fita simples ou dupla no DNA, reduzindo a tensão na fita de DNA. Isso permite que o desenrolamento normal do DNA ocorra durante a replicação ou transcrição. A inibição da topoisomerase I ou II interfere com ambos os processos.
Dois inibidores da topoisomerase I, irinotecano e topotecano, são derivados semi-sinteticamente da camptotecina, que é obtida da árvore ornamental chinesa Camptotheca acuminata. As drogas que têm como alvo a topoisomerase II podem ser divididas em dois grupos. Os venenos da topoisomerase II causam níveis aumentados de enzimas ligadas ao DNA. Isso impede a replicação e a transcrição do DNA, causa quebras na fita de DNA e leva à morte celular programada (apoptose). Esses agentes incluem etoposido, doxorrubicina, mitoxantrona e teniposido. O segundo grupo, inibidores catalíticos, são drogas que bloqueiam a atividade da topoisomerase II e, portanto, impedem a síntese e a tradução do DNA porque o DNA não pode se desenrolar adequadamente. Este grupo inclui a novobiocina, merbarona e aclarrubicina, que também possuem outros mecanismos de ação significativos.
Antibióticos citotóxicos
Os antibióticos citotóxicos são um grupo variado de fármacos que apresentam vários mecanismos de ação. O tema comum que eles compartilham em sua indicação de quimioterapia é que eles interrompem a divisão celular. O subgrupo mais importante é o das antraciclinas e das bleomicinas; outros exemplos proeminentes incluem mitomicina C e actinomicina.
Entre as antraciclinas, a doxorrubicina e a daunorrubicina foram as primeiras, obtidas da bactéria Streptomyces peucetius. Derivados desses compostos incluem epirrubicina e idarrubicina. Outras drogas usadas clinicamente no grupo das antraciclinas são a pirarubicina, aclarrubicina e mitoxantrona. Os mecanismos das antraciclinas incluem intercalação de DNA (moléculas inseridas entre as duas fitas de DNA), geração de radicais livres altamente reativos que danificam moléculas intercelulares e inibição da topoisomerase.
A actinomicina é uma molécula complexa que intercala o DNA e impede a síntese de RNA.
A bleomicina, um glicopeptídeo isolado do Streptomyces verticillus, também intercala o DNA, mas produz radicais livres que danificam o DNA. Isso ocorre quando a bleomicina se liga a um íon metálico, torna-se quimicamente reduzida e reage com o oxigênio.
A mitomicina é um antibiótico citotóxico com a capacidade de alquilar o DNA.
Entrega

A maior parte da quimioterapia é administrada por via intravenosa, embora vários agentes possam ser administrados por via oral (por exemplo, melfalano, bussulfano, capecitabina). De acordo com uma revisão sistemática recente (2016), as terapias orais apresentam desafios adicionais para pacientes e equipes de cuidados para manter e apoiar a adesão aos planos de tratamento.
Existem muitos métodos intravenosos de administração de medicamentos, conhecidos como dispositivos de acesso vascular. Estes incluem o dispositivo de infusão alado, cateter venoso periférico, cateter de linha média, cateter central de inserção periférica (PICC), cateter venoso central e porta implantável. Os dispositivos têm diferentes aplicações quanto à duração do tratamento quimioterápico, método de administração e tipos de agentes quimioterápicos.
Dependendo da pessoa, do câncer, do estágio do câncer, do tipo de quimioterapia e da dosagem, a quimioterapia intravenosa pode ser administrada em regime de internação ou ambulatorial. Para administração de quimioterapia intravenosa contínua, frequente ou prolongada, vários sistemas podem ser inseridos cirurgicamente na vasculatura para manter o acesso. Os sistemas comumente usados são a linha Hickman, o Port-a-Cath e a linha PICC. Estes têm um menor risco de infecção, são muito menos propensos a flebite ou extravasamento e eliminam a necessidade de inserção repetida de cânulas periféricas.
A perfusão isolada do membro (frequentemente usada no melanoma) ou a infusão isolada de quimioterapia no fígado ou no pulmão têm sido usadas para tratar alguns tumores. O principal objetivo dessas abordagens é administrar uma dose muito alta de quimioterapia nos locais do tumor sem causar dano sistêmico avassalador. Essas abordagens podem ajudar a controlar metástases solitárias ou limitadas, mas por definição não são sistêmicas e, portanto, não tratam metástases distribuídas ou micrometástases.
Quimioterapias tópicas, como 5-fluorouracil, são usadas para tratar alguns casos de câncer de pele não melanoma.
Se o câncer tiver envolvimento do sistema nervoso central ou com doença meníngea, pode ser administrada quimioterapia intratecal.
Efeitos adversos
As técnicas quimioterápicas têm uma série de efeitos colaterais que dependem do tipo de medicamento utilizado. Os medicamentos mais comuns afetam principalmente as células de divisão rápida do corpo, como as células sanguíneas e as células que revestem a boca, o estômago e os intestinos. As toxicidades relacionadas à quimioterapia podem ocorrer de forma aguda após a administração, em horas ou dias, ou cronicamente, de semanas a anos.
Imunossupressão e mielossupressão
Praticamente todos os esquemas quimioterápicos podem causar depressão do sistema imunológico, muitas vezes paralisando a medula óssea e levando a uma diminuição de glóbulos brancos, glóbulos vermelhos e plaquetas. Anemia e trombocitopenia podem requerer transfusão de sangue. A neutropenia (uma diminuição da contagem de granulócitos neutrófilos abaixo de 0,5 x 109/litro) pode ser melhorada com G-CSF sintético (fator estimulador de colônias de granulócitos, por exemplo, filgrastim, lenograstim).
Na mielossupressão muito grave, que ocorre em alguns regimes, quase todas as células-tronco da medula óssea (células que produzem glóbulos brancos e vermelhos) são destruídas, ou seja, alogênicas ou autólogas são necessários transplantes de células da medula óssea. (Nos BMTs autólogos, as células são removidas da pessoa antes do tratamento, multiplicadas e depois reinjetadas; nos BMTs alogênicos, a fonte é um doador.) No entanto, algumas pessoas ainda desenvolvem doenças por causa de esta interferência com a medula óssea.
Embora as pessoas que recebem quimioterapia sejam incentivadas a lavar as mãos, evitar pessoas doentes e tomar outras medidas para reduzir infecções, cerca de 85% das infecções são devidas a microrganismos que ocorrem naturalmente no próprio trato gastrointestinal da pessoa (incluindo oral cavidade) e pele. Isso pode se manifestar como infecções sistêmicas, como sepse, ou como surtos localizados, como Herpes simplex, herpes zoster ou outros membros do Herpesviridea. O risco de doença e morte pode ser reduzido tomando antibióticos comuns, como quinolonas ou trimetoprima/sulfametoxazol, antes que qualquer febre ou sinal de infecção apareça. Quinolonas mostram profilaxia eficaz principalmente com câncer hematológico. No entanto, em geral, para cada cinco pessoas imunossuprimidas após a quimioterapia que tomam um antibiótico, uma febre pode ser evitada; para cada 34 que tomam um antibiótico, uma morte pode ser evitada. Às vezes, os tratamentos de quimioterapia são adiados porque o sistema imunológico é suprimido a um nível criticamente baixo.
No Japão, o governo aprovou o uso de alguns cogumelos medicinais como Trametes versicolor, para neutralizar a depressão do sistema imunológico em pessoas submetidas à quimioterapia.
O trilaciclibe é um inibidor da quinase dependente de ciclina 4/6 aprovado para a prevenção da mielossupressão causada pela quimioterapia. O medicamento é administrado antes da quimioterapia para proteger a função da medula óssea.
Enterocolite neutropênica
Devido à supressão do sistema imunológico, a enterocolite neutropênica (tiflite) é uma "complicação gastrointestinal da quimioterapia com risco de vida." A tiflite é uma infecção intestinal que pode se manifestar através de sintomas como náuseas, vômitos, diarreia, abdômen distendido, febre, calafrios ou dor e sensibilidade abdominal.
A tiflite é uma emergência médica. Tem um prognóstico muito ruim e muitas vezes é fatal, a menos que seja prontamente reconhecida e tratada de forma agressiva. O sucesso do tratamento depende do diagnóstico precoce fornecido por um alto índice de suspeita e do uso de tomografia computadorizada, tratamento conservador para casos não complicados e, às vezes, hemicolectomia direita eletiva para prevenir a recorrência.
Desconforto gastrointestinal
Náuseas, vômitos, anorexia, diarréia, cólicas abdominais e constipação são efeitos colaterais comuns dos medicamentos quimioterápicos que matam as células de divisão rápida. Desnutrição e desidratação podem ocorrer quando o receptor não come ou bebe o suficiente, ou quando a pessoa vomita com frequência devido a danos gastrointestinais. Isso pode resultar em rápida perda de peso ou, ocasionalmente, em ganho de peso, se a pessoa comer demais em um esforço para aliviar a náusea ou azia. O ganho de peso também pode ser causado por alguns medicamentos esteróides. Esses efeitos colaterais podem frequentemente ser reduzidos ou eliminados com drogas antieméticas. Evidências de baixa qualidade também sugerem que os probióticos podem ter um efeito preventivo e de tratamento da diarreia relacionada apenas à quimioterapia e à radioterapia. No entanto, um alto índice de suspeita é apropriado, uma vez que diarreia e inchaço também são sintomas de tiflite, uma emergência médica muito séria e potencialmente fatal que requer tratamento imediato.
Anemia
A anemia pode ser um resultado combinado causado pela quimioterapia mielossupressora e possíveis causas relacionadas ao câncer, como sangramento, destruição de células sanguíneas (hemólise), doença hereditária, disfunção renal, deficiências nutricionais ou anemia de doença crônica. Os tratamentos para mitigar a anemia incluem hormônios para aumentar a produção de sangue (eritropoetina), suplementos de ferro e transfusões de sangue. A terapia mielossupressora pode causar uma tendência a sangrar facilmente, levando à anemia. Medicamentos que matam células que se dividem rapidamente ou células sanguíneas podem reduzir o número de plaquetas no sangue, o que pode resultar em hematomas e sangramento. Contagens de plaquetas extremamente baixas podem ser temporariamente aumentadas por meio de transfusões de plaquetas e novos medicamentos para aumentar as contagens de plaquetas durante a quimioterapia estão sendo desenvolvidos. Às vezes, os tratamentos de quimioterapia são adiados para permitir a recuperação da contagem de plaquetas.
A fadiga pode ser uma consequência do câncer ou de seu tratamento e pode durar meses ou anos após o tratamento. Uma causa fisiológica da fadiga é a anemia, que pode ser causada por quimioterapia, cirurgia, radioterapia, doença primária e metastática ou depleção nutricional. Verificou-se que o exercício aeróbico é benéfico na redução da fadiga em pessoas com tumores sólidos.
Náuseas e vômitos
Náuseas e vômitos são dois dos efeitos colaterais mais temidos relacionados ao tratamento do câncer para pessoas com câncer e suas famílias. Em 1983, Coates e cols. descobriram que as pessoas que receberam quimioterapia classificaram náuseas e vômitos como o primeiro e o segundo efeitos colaterais mais graves, respectivamente. Até 20% das pessoas que receberam agentes altamente emetogênicos nesta época adiaram ou até recusaram tratamentos potencialmente curativos. Náuseas e vômitos induzidos por quimioterapia (NVIQ) são comuns em muitos tratamentos e em algumas formas de câncer. Desde a década de 1990, várias novas classes de antieméticos foram desenvolvidas e comercializadas, tornando-se um padrão quase universal nos regimes de quimioterapia e ajudando a controlar com sucesso esses sintomas em muitas pessoas. A mediação eficaz desses sintomas desagradáveis e às vezes debilitantes resulta em maior qualidade de vida para o receptor e ciclos de tratamento mais eficientes, devido à menor interrupção do tratamento devido a melhor tolerância e melhor saúde geral.
Queda de cabelo
A perda de cabelo (alopecia) pode ser causada pela quimioterapia, que mata as células que se dividem rapidamente; outros medicamentos podem causar queda de cabelo. Na maioria das vezes, são efeitos temporários: o cabelo geralmente começa a crescer algumas semanas após o último tratamento, mas às vezes com uma mudança na cor, textura, espessura ou estilo. Às vezes, o cabelo tem tendência a enrolar após o crescimento, resultando em "cachos quimioterápicos". A perda de cabelo grave ocorre mais frequentemente com medicamentos como doxorrubicina, daunorrubicina, paclitaxel, docetaxel, ciclofosfamida, ifosfamida e etoposido. Afinamento permanente ou perda de cabelo pode resultar de alguns regimes de quimioterapia padrão.
A queda de cabelo induzida por quimioterapia ocorre por um mecanismo não androgênico e pode se manifestar como alopecia total, eflúvio telógeno ou, menos frequentemente, alopecia areata. Geralmente está associada ao tratamento sistêmico devido à alta taxa mitótica dos folículos pilosos, sendo mais reversível que a calvície androgênica, embora casos permanentes possam ocorrer. A quimioterapia induz a queda de cabelo em mulheres com mais frequência do que em homens.
O resfriamento do couro cabeludo oferece um meio de prevenir a perda de cabelo permanente e temporária; no entanto, preocupações sobre esse método foram levantadas.
Neoplasia secundária
Pode ocorrer o desenvolvimento de neoplasia secundária após tratamento bem-sucedido de quimioterapia ou radioterapia. A neoplasia secundária mais comum é a leucemia mielóide aguda secundária, que se desenvolve principalmente após o tratamento com agentes alquilantes ou inibidores da topoisomerase. Os sobreviventes de câncer infantil têm 13 vezes mais chances de desenvolver uma neoplasia secundária durante os 30 anos após o tratamento do que a população em geral. Nem todo esse aumento pode ser atribuído à quimioterapia.
Infertilidade
Alguns tipos de quimioterapia são gonadotóxicos e podem causar infertilidade. Quimioterapias com alto risco incluem procarbazina e outras drogas alquilantes, como ciclofosfamida, ifosfamida, busulfan, melfalano, clorambucil e clormetina. Drogas com risco médio incluem doxorrubicina e análogos de platina, como cisplatina e carboplatina. Por outro lado, terapias com baixo risco de gonadotoxicidade incluem derivados de plantas como vincristina e vinblastina, antibióticos como bleomicina e dactinomicina e antimetabólitos como metotrexato, mercaptopurina e 5-fluorouracil.
A infertilidade feminina por quimioterapia parece ser secundária à falência ovariana prematura por perda de folículos primordiais. Esta perda não é necessariamente um efeito direto dos agentes quimioterápicos, mas pode ser devido a um aumento da taxa de iniciação do crescimento para substituir os folículos em desenvolvimento danificados.
As pessoas podem escolher entre vários métodos de preservação da fertilidade antes da quimioterapia, incluindo criopreservação de sêmen, tecido ovariano, oócitos ou embriões. Como mais da metade dos pacientes com câncer são idosos, esse efeito adverso é relevante apenas para uma minoria de pacientes. Um estudo na França entre 1999 e 2011 chegou ao resultado de que o congelamento de embriões antes da administração de agentes gonadotóxicos em mulheres causou um atraso no tratamento em 34% dos casos e um nascido vivo em 27% dos casos sobreviventes que queriam engravidar, com o tempo de seguimento variando entre 1 e 13 anos.
Potenciais agentes protetores ou atenuantes incluem análogos de GnRH, onde vários estudos mostraram um efeito protetor in vivo em humanos, mas alguns estudos não mostram tal efeito. A esfingosina-1-fosfato (S1P) tem demonstrado efeito semelhante, mas seu mecanismo de inibição da via apoptótica da esfingomielina também pode interferir na ação apoptótica de drogas quimioterápicas.
Na quimioterapia como um regime de condicionamento no transplante de células-tronco hematopoiéticas, um estudo de pessoas condicionadas apenas com ciclofosfamida para anemia aplástica grave chegou ao resultado de que a recuperação ovariana ocorreu em todas as mulheres com menos de 26 anos no momento do transplante, mas apenas em cinco das 16 mulheres com mais de 26 anos.
Teratogenicidade
A quimioterapia é teratogênica durante a gravidez, especialmente durante o primeiro trimestre, na medida em que o aborto geralmente é recomendado se a gravidez neste período for encontrada durante a quimioterapia. A exposição no segundo e terceiro trimestre geralmente não aumenta o risco teratogênico e os efeitos adversos no desenvolvimento cognitivo, mas pode aumentar o risco de várias complicações da gravidez e mielossupressão fetal.
Em homens submetidos anteriormente a quimioterapia ou radioterapia, parece não haver aumento de defeitos genéticos ou malformações congênitas em seus filhos concebidos após a terapia. O uso de tecnologias de reprodução assistida e técnicas de micromanipulação pode aumentar esse risco. Em mulheres submetidas previamente à quimioterapia, aborto espontâneo e malformações congênitas não são aumentados em concepções subsequentes. No entanto, quando a fertilização in vitro e a criopreservação de embriões são praticadas entre ou logo após o tratamento, existem possíveis riscos genéticos para os oócitos em crescimento e, portanto, recomenda-se que os bebês sejam rastreados.
Neuropatia periférica
Entre 30 e 40 por cento das pessoas submetidas à quimioterapia apresentam neuropatia periférica induzida por quimioterapia (PIPN), uma condição progressiva, duradoura e muitas vezes irreversível, causando dor, formigamento, dormência e sensibilidade ao frio, começando nas mãos e pés e às vezes progredindo para os braços e pernas. Os medicamentos quimioterápicos associados à NPIQ incluem talidomida, epotilonas, alcalóides da vinca, taxanos, inibidores de proteassoma e medicamentos à base de platina. O surgimento de NPIQ e em que grau é determinado pela escolha da droga, duração do uso, quantidade total consumida e se a pessoa já tem neuropatia periférica. Embora os sintomas sejam principalmente sensoriais, em alguns casos os nervos motores e o sistema nervoso autônomo são afetados. A NPIQ geralmente segue a primeira dose de quimioterapia e aumenta em gravidade à medida que o tratamento continua, mas essa progressão geralmente se estabiliza ao término do tratamento. As drogas à base de platina são a exceção; com esses medicamentos, a sensação pode continuar a piorar por vários meses após o término do tratamento. Alguns CIPN parecem ser irreversíveis. Muitas vezes, a dor pode ser controlada com medicamentos ou outros tratamentos, mas a dormência geralmente é resistente ao tratamento.
Deficiência cognitiva
Algumas pessoas que recebem quimioterapia relatam fadiga ou problemas neurocognitivos inespecíficos, como incapacidade de concentração; isso às vezes é chamado de comprometimento cognitivo pós-quimioterapia, conhecido como "quimioterapia cerebral" nas mídias populares e sociais.
Síndrome de lise tumoral
Em tumores particularmente grandes e cânceres com altas contagens de glóbulos brancos, como linfomas, teratomas e algumas leucemias, algumas pessoas desenvolvem a síndrome de lise tumoral. A rápida decomposição das células cancerígenas causa a liberação de substâncias químicas do interior das células. Em seguida, altos níveis de ácido úrico, potássio e fosfato são encontrados no sangue. Altos níveis de fosfato induzem hipoparatireoidismo secundário, resultando em baixos níveis de cálcio no sangue. Isso causa danos nos rins e os altos níveis de potássio podem causar arritmia cardíaca. Embora a profilaxia esteja disponível e seja frequentemente iniciada em pessoas com tumores grandes, esse é um efeito colateral perigoso que pode levar à morte se não for tratado.
Dano de órgãos
A cardiotoxicidade (dano ao coração) é especialmente proeminente com o uso de drogas antraciclinas (doxorrubicina, epirrubicina, idarrubicina e doxorrubicina lipossomal). A causa disso é provavelmente devido à produção de radicais livres na célula e subsequente dano ao DNA. Outros quimioterápicos que causam cardiotoxicidade, porém em menor incidência, são a ciclofosfamida, o docetaxel e a clofarabina.
A hepatotoxicidade (danos hepáticos) pode ser causada por muitos medicamentos citotóxicos. A suscetibilidade de um indivíduo a lesões hepáticas pode ser alterada por outros fatores, como o próprio câncer, hepatites virais, imunossupressão e deficiência nutricional. O dano hepático pode consistir em danos às células hepáticas, síndrome sinusoidal hepática (obstrução das veias do fígado), colestase (onde a bile não flui do fígado para o intestino) e fibrose hepática.
A nefrotoxicidade (dano renal) pode ser causada pela síndrome de lise tumoral e também devido aos efeitos diretos da depuração da droga pelos rins. Diferentes medicamentos afetarão diferentes partes do rim e a toxicidade pode ser assintomática (observada apenas em exames de sangue ou urina) ou pode causar lesão renal aguda.
A ototoxicidade (dano ao ouvido interno) é um efeito colateral comum de medicamentos à base de platina que pode produzir sintomas como tontura e vertigem. Crianças tratadas com análogos de platina correm risco de desenvolver perda auditiva.
Outros efeitos colaterais
Efeitos colaterais menos comuns incluem pele vermelha (eritema), pele seca, unhas danificadas, boca seca (xerostomia), retenção de água e impotência sexual. Alguns medicamentos podem desencadear reações alérgicas ou pseudoalérgicas.
Agentes quimioterápicos específicos estão associados a toxicidades específicas de órgãos, incluindo doença cardiovascular (por exemplo, doxorrubicina), doença pulmonar intersticial (por exemplo, bleomicina) e, ocasionalmente, neoplasia secundária (por exemplo, terapia MOPP para doença de Hodgkin).
A síndrome mão-pé é outro efeito colateral da quimioterapia citotóxica.
Problemas nutricionais também são frequentemente observados em pacientes com câncer no momento do diagnóstico e durante o tratamento quimioterápico. A pesquisa sugere que, em crianças e jovens em tratamento contra o câncer, a nutrição parenteral pode ajudar com isso, levando ao ganho de peso e ao aumento da ingestão de calorias e proteínas, quando comparada à nutrição enteral.
Limitações
A quimioterapia nem sempre funciona e, mesmo quando é útil, pode não destruir completamente o câncer. As pessoas freqüentemente não conseguem entender suas limitações. Em um estudo com pessoas recém-diagnosticadas com câncer incurável em estágio 4, mais de dois terços das pessoas com câncer de pulmão e mais de quatro quintos das pessoas com câncer colorretal ainda acreditavam que a quimioterapia provavelmente curaria o câncer.
A barreira hematoencefálica representa um obstáculo para a administração de quimioterapia ao cérebro. Isso ocorre porque o cérebro possui um extenso sistema para protegê-lo de produtos químicos nocivos. Os transportadores de drogas podem bombear drogas do cérebro e das células dos vasos sanguíneos do cérebro para o líquido cefalorraquidiano e a circulação sanguínea. Esses transportadores bombeiam a maioria das drogas quimioterápicas, o que reduz sua eficácia no tratamento de tumores cerebrais. Apenas pequenos agentes alquilantes lipofílicos, como lomustina ou temozolomida, são capazes de atravessar essa barreira hematoencefálica.
Os vasos sanguíneos nos tumores são muito diferentes daqueles observados nos tecidos normais. À medida que um tumor cresce, as células tumorais mais distantes dos vasos sanguíneos ficam com baixo teor de oxigênio (hipóxia). Para neutralizar isso, eles sinalizam para o crescimento de novos vasos sanguíneos. A vasculatura tumoral recém-formada é mal formada e não fornece um suprimento sanguíneo adequado para todas as áreas do tumor. Isso leva a problemas com a entrega de medicamentos porque muitos medicamentos serão entregues ao tumor pelo sistema circulatório.
Resistência
A resistência é uma das principais causas de falha no tratamento de drogas quimioterápicas. Existem algumas causas possíveis de resistência no câncer, uma das quais é a presença de pequenas bombas na superfície das células cancerígenas que movem ativamente a quimioterapia de dentro para fora da célula. As células cancerígenas produzem grandes quantidades dessas bombas, conhecidas como p-glicoproteína, para se protegerem dos quimioterápicos. A pesquisa sobre p-glicoproteína e outras bombas de efluxo de quimioterapia está atualmente em andamento. Medicamentos para inibir a função da p-glicoproteína estão sendo investigados, mas devido a toxicidades e interações com drogas anticancerígenas, seu desenvolvimento tem sido difícil. Outro mecanismo de resistência é a amplificação de genes, um processo no qual múltiplas cópias de um gene são produzidas por células cancerígenas. Isso supera o efeito de drogas que reduzem a expressão de genes envolvidos na replicação. Com mais cópias do gene, a droga não pode impedir toda a expressão do gene e, portanto, a célula pode restaurar sua capacidade proliferativa. As células cancerígenas também podem causar defeitos nas vias celulares da apoptose (morte celular programada). Como a maioria dos medicamentos quimioterápicos mata as células cancerígenas dessa maneira, a apoptose defeituosa permite a sobrevivência dessas células, tornando-as resistentes. Muitas drogas quimioterápicas também causam danos ao DNA, que podem ser reparados por enzimas na célula que realizam o reparo do DNA. A regulação positiva desses genes pode superar o dano ao DNA e prevenir a indução da apoptose. Podem ocorrer mutações em genes que produzem proteínas-alvo de drogas, como a tubulina, que impedem que as drogas se liguem à proteína, levando à resistência a esses tipos de drogas. Drogas usadas na quimioterapia podem induzir estresse celular, que pode matar uma célula cancerígena; entretanto, sob certas condições, o estresse celular pode induzir alterações na expressão gênica que possibilitam resistência a diversos tipos de drogas. No câncer de pulmão, acredita-se que o fator de transcrição NFκB desempenhe um papel na resistência à quimioterapia, por meio de vias inflamatórias.
Citotóxicos e terapias direcionadas
As terapias direcionadas são uma classe relativamente nova de medicamentos contra o câncer que podem superar muitos dos problemas observados com o uso de citotóxicos. Eles são divididos em dois grupos: pequenas moléculas e anticorpos. A toxicidade maciça observada com o uso de citotóxicos deve-se à falta de especificidade celular das drogas. Eles vão matar qualquer célula de divisão rápida, tumoral ou normal. As terapias direcionadas são projetadas para afetar proteínas celulares ou processos que são utilizados pelas células cancerígenas. Isso permite uma dose alta nos tecidos cancerosos com uma dose relativamente baixa em outros tecidos. Embora os efeitos colaterais sejam frequentemente menos graves do que os observados com quimioterápicos citotóxicos, podem ocorrer efeitos que ameaçam a vida. Inicialmente, a terapêutica direcionada deveria ser apenas seletiva para uma proteína. Agora está claro que muitas vezes há uma gama de alvos de proteínas que a droga pode ligar. Um exemplo de alvo para terapia direcionada é a proteína BCR-ABL1 produzida a partir do cromossomo Filadélfia, uma lesão genética comumente encontrada na leucemia mielóide crônica e em alguns pacientes com leucemia linfoblástica aguda. Essa proteína de fusão tem atividade enzimática que pode ser inibida pelo imatinibe, um medicamento de molécula pequena.
Mecanismo de ação
O câncer é o crescimento descontrolado de células associado a um comportamento maligno: invasão e metástase (entre outras características). É causada pela interação entre suscetibilidade genética e fatores ambientais. Esses fatores levam ao acúmulo de mutações genéticas em oncogenes (genes que controlam a taxa de crescimento das células) e genes supressores de tumor (genes que ajudam a prevenir o câncer), o que confere às células cancerígenas suas características malignas, como o crescimento descontrolado.
Em um sentido amplo, a maioria dos medicamentos quimioterápicos atua prejudicando a mitose (divisão celular), visando efetivamente as células de divisão rápida. Como essas drogas causam danos às células, elas são denominadas citotóxicas. Eles impedem a mitose por vários mecanismos, incluindo danos ao DNA e inibição da maquinaria celular envolvida na divisão celular. Uma teoria de por que essas drogas matam as células cancerígenas é que elas induzem uma forma programada de morte celular conhecida como apoptose.
Como a quimioterapia afeta a divisão celular, os tumores com altas taxas de crescimento (como a leucemia mielóide aguda e os linfomas agressivos, incluindo a doença de Hodgkin) são mais sensíveis à quimioterapia, pois uma proporção maior das células-alvo está sofrendo divisão a qualquer momento. Malignidades com taxas de crescimento mais lentas, como linfomas indolentes, tendem a responder à quimioterapia de forma muito mais modesta. Tumores heterogêneos também podem exibir sensibilidade variável a agentes quimioterápicos, dependendo das populações subclonais dentro do tumor.
Células do sistema imunológico também fazem contribuições cruciais para os efeitos antitumorais da quimioterapia. Por exemplo, as drogas quimioterápicas oxaliplatina e ciclofosfamida podem causar a morte de células tumorais de uma forma que é detectável pelo sistema imunológico (denominado morte celular imunogênica), que mobiliza células imunes com funções antitumorais. Drogas quimioterápicas que causam a morte de células tumorais imunogênicas do câncer podem tornar os tumores não responsivos à terapia de ponto de controle imunológico.
Outros usos
Alguns medicamentos quimioterápicos são usados em outras doenças além do câncer, como em distúrbios autoimunes e discrasia de células plasmáticas não cancerosas. Em alguns casos, eles são frequentemente usados em doses mais baixas, o que significa que os efeitos colaterais são minimizados, enquanto em outros casos são usadas doses semelhantes às usadas para tratar o câncer. O metotrexato é utilizado no tratamento da artrite reumatóide (AR), psoríase, espondilite anquilosante e esclerose múltipla. Acredita-se que a resposta antiinflamatória observada na AR se deva ao aumento da adenosina, que causa imunossupressão; efeitos nas vias imunorreguladoras da enzima ciclooxigenase-2; redução de citocinas pró-inflamatórias; e propriedades antiproliferativas. Embora o metotrexato seja usado para tratar tanto a esclerose múltipla quanto a espondilite anquilosante, sua eficácia nessas doenças ainda é incerta. Às vezes, a ciclofosfamida é usada para tratar a nefrite lúpica, um sintoma comum do lúpus eritematoso sistêmico. A dexametasona juntamente com bortezomibe ou melfalano é comumente usada como tratamento para amiloidose AL. Recentemente, bortezomida em combinação com ciclofosfamida e dexametasona também se mostrou promissora como tratamento para amiloidose AL. Outros medicamentos usados para tratar o mieloma, como a lenalidomida, mostraram-se promissores no tratamento da amiloidose AL.
As drogas quimioterápicas também são usadas em regimes de condicionamento antes do transplante de medula óssea (transplante de células-tronco hematopoiéticas). Os regimes de condicionamento são usados para suprimir o sistema imunológico do receptor, a fim de permitir que um transplante seja implantado. A ciclofosfamida é uma droga citotóxica comum usada dessa maneira e é frequentemente usada em conjunto com a irradiação total do corpo. Drogas quimioterápicas podem ser usadas em altas doses para remover permanentemente as células da medula óssea do receptor (condicionamento mieloablativo) ou em doses mais baixas que evitarão a perda permanente da medula óssea (condicionamento não mieloablativo e de intensidade reduzida). Quando usado em ambiente não oncológico, o tratamento ainda é chamado de "quimioterapia" e geralmente é feito nos mesmos centros de tratamento usados para pessoas com câncer.
Exposição ocupacional e manuseio seguro
Na década de 1970, drogas antineoplásicas (quimioterapia) foram identificadas como perigosas, e a Sociedade Americana de Farmacêuticos do Sistema de Saúde (ASHP) desde então introduziu o conceito de drogas perigosas depois de publicar uma recomendação em 1983 sobre o manuseio de drogas perigosas. A adaptação dos regulamentos federais ocorreu quando a Administração de Saúde e Segurança Ocupacional dos EUA (OSHA) divulgou suas diretrizes pela primeira vez em 1986 e as atualizou em 1996, 1999 e, mais recentemente, em 2006.
O Instituto Nacional de Segurança e Saúde Ocupacional (NIOSH) vem realizando uma avaliação no local de trabalho desde então em relação a essas drogas. A exposição ocupacional a drogas antineoplásicas tem sido associada a múltiplos efeitos na saúde, incluindo infertilidade e possíveis efeitos carcinogênicos. Alguns casos foram relatados pelo relatório de alerta do NIOSH, como aquele em que uma farmacêutica foi diagnosticada com carcinoma papilífero de células transicionais. Doze anos antes de a farmacêutica ser diagnosticada com a doença, ela havia trabalhado por 20 meses em um hospital onde era responsável pelo preparo de múltiplos medicamentos antineoplásicos. A farmacêutica não tinha nenhum outro fator de risco para câncer e, portanto, seu câncer foi atribuído à exposição aos medicamentos antineoplásicos, embora uma relação de causa e efeito não tenha sido estabelecida na literatura. Outro caso ocorreu quando se acredita que um mau funcionamento no armário de biossegurança expôs o pessoal de enfermagem a drogas antineoplásicas. As investigações revelaram evidências de biomarcadores genotóxicos dois e nove meses após essa exposição.
Rotas de exposição
Os medicamentos antineoplásicos são geralmente administrados por via intravenosa, intramuscular, intratecal ou subcutânea. Na maioria dos casos, antes de o medicamento ser administrado ao paciente, ele precisa ser preparado e manuseado por vários trabalhadores. Qualquer trabalhador envolvido no manuseio, preparo ou administração de medicamentos, ou na limpeza de objetos que tenham entrado em contato com medicamentos antineoplásicos, está potencialmente exposto a medicamentos perigosos. Os profissionais de saúde estão expostos a medicamentos em diferentes circunstâncias, como quando farmacêuticos e técnicos de farmácia preparam e manuseiam medicamentos antineoplásicos e quando enfermeiros e médicos administram os medicamentos aos pacientes. Além disso, os responsáveis pelo descarte de medicamentos antineoplásicos em unidades de saúde também correm risco de exposição.
A exposição cutânea é considerada a principal via de exposição devido ao fato de que quantidades significativas de agentes antineoplásicos foram encontradas nas luvas usadas pelos profissionais de saúde que preparam, manuseiam e administram os agentes. Outra rota de exposição digna de nota é a inalação das drogas. vapores. Vários estudos investigaram a inalação como uma rota de exposição e, embora a amostragem de ar não tenha mostrado níveis perigosos, ainda é uma rota potencial de exposição. A ingestão de mão a boca é uma via de exposição menos provável em comparação com outras devido ao padrão de higiene exigido nas instituições de saúde. No entanto, ainda é um percurso potencial, principalmente no ambiente de trabalho, fora de uma instituição de saúde. A pessoa também pode ser exposta a essas drogas perigosas por meio de injeção por picadas de agulha. A pesquisa realizada nesta área estabeleceu que a exposição ocupacional ocorre por meio do exame de evidências em múltiplas amostras de urina de profissionais de saúde.
Perigos
Drogas perigosas expõem os profissionais de saúde a sérios riscos à saúde. Muitos estudos mostram que as drogas antineoplásicas podem ter muitos efeitos colaterais no sistema reprodutivo, como perda fetal, malformação congênita e infertilidade. Os profissionais de saúde expostos a drogas antineoplásicas em muitas ocasiões apresentam resultados reprodutivos adversos, como abortos espontâneos, natimortos e malformações congênitas. Além disso, estudos demonstraram que a exposição a essas drogas leva a irregularidades no ciclo menstrual. Drogas antineoplásicas também podem aumentar o risco de dificuldades de aprendizagem entre filhos de profissionais de saúde expostos a essas substâncias perigosas.
Além disso, essas drogas têm efeitos cancerígenos. Nas últimas cinco décadas, vários estudos mostraram os efeitos carcinogênicos da exposição a drogas antineoplásicas. Da mesma forma, houve estudos de pesquisa que ligaram agentes alquilantes com humanos desenvolvendo leucemias. Estudos relataram risco elevado de câncer de mama, câncer de pele não melanoma e câncer de reto entre enfermeiras expostas a esses medicamentos. Outras investigações revelaram que há um potencial efeito genotóxico de drogas antineoplásicas para trabalhadores em serviços de saúde.
Manuseio seguro em ambientes de assistência médica
A partir de 2018, não havia limites de exposição ocupacional estabelecidos para drogas antineoplásicas, ou seja, a OSHA ou a Conferência Americana de Higienistas Industriais Governamentais (ACGIH) não definiram diretrizes de segurança no local de trabalho.
Preparação
O NIOSH recomenda o uso de um gabinete ventilado projetado para diminuir a exposição do trabalhador. Além disso, recomenda o treinamento de toda a equipe, o uso de armários, a implementação de uma avaliação inicial da técnica do programa de segurança e o uso de luvas e aventais de proteção na abertura de embalagens de medicamentos, manipulação de frascos ou rotulagem. Ao usar equipamento de proteção individual, deve-se inspecionar as luvas quanto a defeitos físicos antes do uso e sempre usar luvas duplas e aventais de proteção. Os profissionais de saúde também são obrigados a lavar as mãos com água e sabão antes e depois de trabalhar com drogas antineoplásicas, trocar as luvas a cada 30 minutos ou sempre que forem perfuradas e descartá-las imediatamente em um recipiente para resíduos quimioterápicos.
As batas utilizadas devem ser batas descartáveis feitas de polipropileno revestido a polietileno. Ao usar batas, os indivíduos devem certificar-se de que as batas estão fechadas e têm mangas compridas. Terminada a preparação, o produto final deve estar completamente lacrado em um saco plástico.
O profissional de saúde também deve limpar todos os recipientes de lixo dentro do gabinete ventilado antes de removê-los do gabinete. Por fim, os trabalhadores devem remover todas as roupas de proteção e colocá-las em um saco para descarte dentro do gabinete ventilado.
Administração
Os medicamentos só devem ser administrados usando dispositivos médicos de proteção, como listas de agulhas e sistemas fechados e técnicas como preparação de tubos IV pelo pessoal da farmácia dentro de um gabinete ventilado. Os trabalhadores devem sempre usar equipamentos de proteção individual como luvas duplas, óculos e aventais de proteção ao abrir a bolsa externa e montar o sistema de entrega para entregar o medicamento ao paciente e ao descartar todo o material utilizado na administração dos medicamentos.
Os funcionários do hospital nunca devem remover o tubo de uma bolsa intravenosa que contenha um medicamento antineoplásico e, ao desconectar o tubo do sistema, devem certificar-se de que o tubo foi bem lavado. Após retirar a bolsa IV, os trabalhadores devem colocá-la juntamente com outros itens descartáveis diretamente no recipiente amarelo para resíduos de quimioterapia com a tampa fechada. O equipamento de proteção deve ser removido e colocado em um recipiente descartável para resíduos de quimioterapia. Depois disso, deve-se ensacar duas vezes os resíduos de quimioterapia antes ou depois de remover as luvas internas. Além disso, deve-se sempre lavar as mãos com água e sabão antes de sair do local de administração do medicamento.
Treinamento de funcionários
Todos os funcionários cujos empregos em unidades de saúde os expõem a drogas perigosas devem receber treinamento. O treinamento deve incluir pessoal de embarque e recebimento, camareiras, farmacêuticos, auxiliares e todos os indivíduos envolvidos no transporte e armazenamento de drogas antineoplásicas. Esses indivíduos devem receber informações e treinamento para informá-los sobre os perigos das drogas presentes em suas áreas de trabalho. Eles devem ser informados e treinados sobre operações e procedimentos em suas áreas de trabalho onde podem encontrar perigos, diferentes métodos usados para detectar a presença de drogas perigosas e como os perigos são liberados, e os perigos físicos e de saúde das drogas, incluindo sua reprodução e potencial de risco carcinogênico. Além disso, eles devem ser informados e treinados sobre as medidas que devem tomar para evitar e se proteger desses perigos. Essas informações devem ser fornecidas quando os profissionais de saúde entram em contato com as drogas, ou seja, realizam a tarefa inicial em uma área de trabalho com drogas perigosas. Além disso, o treinamento também deve ser fornecido quando surgem novos perigos, bem como quando novos medicamentos, procedimentos ou equipamentos são introduzidos.
Arrumação e eliminação de resíduos
Ao realizar a limpeza e descontaminação da área de trabalho onde drogas antineoplásicas são usadas, deve-se garantir que haja ventilação suficiente para evitar o acúmulo de concentrações de drogas no ar. Na limpeza da superfície de trabalho, os trabalhadores hospitalares devem utilizar agentes de desativação e limpeza antes e após cada atividade, bem como ao final de seus turnos. A limpeza deve ser sempre feita com luvas duplas de proteção e batas descartáveis. Após o término da limpeza, os funcionários devem descartar os itens utilizados na atividade em um recipiente amarelo para resíduos quimioterápicos, ainda com luvas de proteção. Depois de retirar as luvas, devem lavar bem as mãos com água e sabão. Qualquer coisa que entre em contato ou tenha vestígios de medicamentos antineoplásicos, como agulhas, frascos vazios, seringas, aventais e luvas, deve ser colocado no recipiente de resíduos de quimioterapia.
Controle de derramamento
Uma política escrita precisa estar em vigor em caso de derramamento de produtos antineoplásicos. A política deve abordar a possibilidade de vários tamanhos de derramamento, bem como o procedimento e os equipamentos de proteção individual necessários para cada tamanho. Um trabalhador treinado deve lidar com um grande derramamento e sempre descartar todos os materiais de limpeza no recipiente de resíduos químicos de acordo com os regulamentos da EPA, não em um recipiente amarelo de resíduos de quimioterapia.
Monitoramento ocupacional
Um programa de vigilância médica deve ser estabelecido. Em caso de exposição, os profissionais de saúde ocupacional precisam solicitar um histórico detalhado e fazer um exame físico completo. Eles devem testar a urina do trabalhador potencialmente exposto por meio de vareta medidora de urina ou exame microscópico, principalmente procurando sangue, pois vários medicamentos antineoplásicos são conhecidos por causar danos à bexiga.
A mutagenicidade urinária é um marcador de exposição a drogas antineoplásicas que foi usado pela primeira vez por Falck e colegas em 1979 e usa ensaios de mutagenicidade bacteriana. Além de ser inespecífico, o teste pode ser influenciado por fatores externos, como ingestão alimentar e tabagismo, sendo, portanto, usado com moderação. No entanto, o teste desempenhou um papel significativo na mudança do uso de cabines de fluxo horizontal para cabines de segurança biológica de fluxo vertical durante a preparação de drogas antineoplásicas, porque as primeiras expuseram os profissionais de saúde a altos níveis de drogas. Isso mudou o manuseio de drogas e efetivamente reduziu a carga de trabalho dos trabalhadores. exposição a drogas antineoplásicas.
Os biomarcadores de exposição a drogas antineoplásicas geralmente incluem platina urinária, metotrexato, ciclofosfamida e ifosfamida urinárias e metabólito urinário de 5-fluorouracil. Além disso, existem outras drogas usadas para medir as drogas diretamente na urina, embora raramente sejam usadas. Uma medição dessas drogas diretamente na urina é um sinal de altos níveis de exposição e que uma absorção das drogas está ocorrendo por inalação ou por via cutânea.
Agentes disponíveis
Existe uma extensa lista de agentes antineoplásicos. Vários esquemas de classificação têm sido usados para subdividir os medicamentos usados para o câncer em vários tipos diferentes.
História
O primeiro uso de drogas de moléculas pequenas para tratar o câncer foi no início do século 20, embora os produtos químicos específicos usados pela primeira vez não fossem originalmente destinados a esse fim. O gás mostarda foi usado como agente de guerra química durante a Primeira Guerra Mundial e descobriu-se que era um potente supressor da hematopoiese (produção de sangue). Uma família semelhante de compostos conhecidos como mostardas nitrogenadas foi estudada durante a Segunda Guerra Mundial na Escola de Medicina de Yale. Foi argumentado que um agente que danificava os glóbulos brancos em rápido crescimento poderia ter um efeito semelhante no câncer. Portanto, em dezembro de 1942, várias pessoas com linfomas avançados (cânceres do sistema linfático e dos gânglios linfáticos) receberam a droga por via intravenosa, em vez de inalar o gás irritante. Sua melhora, embora temporária, foi notável. Ao mesmo tempo, durante uma operação militar na Segunda Guerra Mundial, após um ataque aéreo alemão no porto italiano de Bari, várias centenas de pessoas foram acidentalmente expostas ao gás mostarda, que havia sido transportado para lá pelas forças aliadas para se preparar para uma possível retaliação no caso do uso alemão de guerra química. Mais tarde, descobriu-se que os sobreviventes tinham contagens de glóbulos brancos muito baixas. Depois que a Segunda Guerra Mundial acabou e os relatórios foram desclassificados, as experiências convergiram e levaram os pesquisadores a procurar outras substâncias que pudessem ter efeitos semelhantes contra o câncer. O primeiro quimioterápico desenvolvido a partir dessa linha de pesquisa foi o mustine. Desde então, muitas outras drogas foram desenvolvidas para tratar o câncer, e o desenvolvimento de drogas explodiu em uma indústria multibilionária, embora os princípios e limitações da quimioterapia descobertos pelos primeiros pesquisadores ainda se apliquem.
O termo quimioterapia
A palavra quimioterapia sem um modificador geralmente se refere ao tratamento do câncer, mas seu significado histórico era mais amplo. O termo foi cunhado no início de 1900 por Paul Ehrlich como significando qualquer uso de produtos químicos para tratar qualquer doença (quimioterapia + terapia), como o uso de antibióticos (quimioterapia antibacteriana). Ehrlich não estava otimista quanto à descoberta de medicamentos quimioterápicos eficazes para o tratamento do câncer. O primeiro agente quimioterápico moderno foi a arsfenamina, um composto arsênico descoberto em 1907 e usado para tratar a sífilis. Isso foi posteriormente seguido por sulfonamidas (medicamentos sulfa) e penicilina. No uso atual, o sentido "qualquer tratamento de doença com drogas" é muitas vezes expressa com a palavra farmacoterapia.
Vendas
Os 10 medicamentos contra o câncer mais vendidos (em termos de receita) de 2013:
| Não. | 2013 Global Sales | INN | Nomes de comércio | Titular de autorização de comercialização | Indicações |
|---|---|---|---|---|---|
| 1 | $7.78 bilhões | Rituximab | Rituxan, MabThera | Roche, padrão Pharm | linfoma não Hodgkin, CLL |
| 2 | $6,75 bilhões | O que fazer? | Avastin | Rochedo | Câncer colorretal, pulmonar, ovariano e cerebral |
| 3 | US$ 6,6 bilhões | Trastículos | Herceptin | Rochedo | Peito, esôfago e câncer de estômago |
| 4 | $4.69 bilhões | Imatinib | Gleevec | Nova Iorque | Leucemia, câncer de GI |
| 5 | $1.09 bilhões | Lenaliida | Revlimid | Celgene, padrão Pharm | Mieloma múltiplo, linfoma da pilha do manto |
| 6 | $2,7 bilhões | Pemetrexed | Alimta. | Eli Lilly. | Câncer de pulmão |
| 7 | $2,6 bilhões | Não sei. | Vela | Johnson & Johnson, Takeda, Pharmstandard | Múltiplo mieloma |
| 8 | $1.87 bilhões | Cetuximab | Erbitux | Merck KGaA, Bristol-Myers Squibb | Câncer de coluna e cabeça e pescoço |
| 9 | $1.73 bilhões | Produtos agrícolas | Lupron, Eligard | AbbVie e Takeda; Sanofi e Astellas Pharma | Câncer de próstata e ovário |
| 10. | 1,7 bilhões de dólares | Abiraterone | Zytiga | Johnson & Johnson | Câncer de próstata |
Pesquisa
Terapias direcionadas
Veículos de entrega especialmente direcionados visam aumentar os níveis efetivos de quimioterapia para células tumorais enquanto reduzem os níveis efetivos para outras células. Isso deve resultar em uma morte tumoral aumentada ou toxicidade reduzida ou ambos.
Conjugados anticorpo-droga
Os conjugados anticorpo-droga (ADCs) compreendem um anticorpo, uma droga e um ligante entre eles. O anticorpo será direcionado a uma proteína preferencialmente expressa nas células tumorais (conhecida como antígeno tumoral) ou em células que o tumor pode utilizar, como células endoteliais de vasos sanguíneos. Eles se ligam ao antígeno tumoral e são internalizados, onde o ligante libera a droga na célula. Esses veículos de entrega especialmente direcionados variam em sua estabilidade, seletividade e escolha do alvo, mas, em essência, todos visam aumentar a dose efetiva máxima que pode ser entregue às células tumorais. A toxicidade sistêmica reduzida significa que eles também podem ser usados em pessoas mais doentes e que podem transportar novos agentes quimioterápicos que seriam tóxicos demais para serem administrados por meio de abordagens sistêmicas tradicionais.
O primeiro medicamento aprovado desse tipo foi o gemtuzumab ozogamicina (Mylotarg), lançado pela Wyeth (agora Pfizer). A droga foi aprovada para tratar a leucemia mielóide aguda. Dois outros medicamentos, trastuzumab entansine e brentuximab vedotin, estão ambos em ensaios clínicos tardios, e o último recebeu aprovação acelerada para o tratamento de linfoma de Hodgkin refratário e linfoma anaplásico sistêmico de grandes células.
Nanopartículas
As nanopartículas são partículas de tamanho de 1 a 1.000 nanômetros (nm) que podem promover a seletividade do tumor e ajudar na administração de medicamentos de baixa solubilidade. As nanopartículas podem ser direcionadas de forma passiva ou ativa. O direcionamento passivo explora a diferença entre os vasos sanguíneos do tumor e os vasos sanguíneos normais. Os vasos sanguíneos nos tumores são "vazados" porque eles têm lacunas de 200 a 2000 nm, que permitem que as nanopartículas escapem para o tumor. O direcionamento ativo usa moléculas biológicas (anticorpos, proteínas, DNA e ligantes do receptor) para direcionar preferencialmente as nanopartículas para as células tumorais. Existem muitos tipos de sistemas de entrega de nanopartículas, como sílica, polímeros, lipossomas e partículas magnéticas. As nanopartículas feitas de material magnético também podem ser usadas para concentrar agentes em locais de tumor usando um campo magnético aplicado externamente. Surgiram como um veículo útil na distribuição magnética de fármacos para agentes pouco solúveis, como o paclitaxel.
Eletroquimioterapia
A eletroquimioterapia é o tratamento combinado no qual a injeção de uma droga quimioterápica é seguida pela aplicação de pulsos elétricos de alta voltagem localmente no tumor. O tratamento permite que os quimioterápicos, que de outra forma não conseguem ou dificilmente atravessam a membrana das células (como a bleomicina e a cisplatina), entrem nas células cancerígenas. Assim, consegue-se uma maior eficácia do tratamento antitumoral.
A eletroquimioterapia clínica tem sido utilizada com sucesso no tratamento de tumores cutâneos e subcutâneos, independentemente de sua origem histológica. O método tem sido relatado como seguro, simples e altamente eficaz em todos os relatos de uso clínico da eletroquimioterapia. De acordo com o projeto ESOPE (European Standard Operating Procedures of Electrochemotherapy), foram elaborados os Standard Operating Procedures (SOP) para eletroquimioterapia, com base na experiência dos principais centros oncológicos europeus em eletroquimioterapia. Recentemente, novas modalidades de eletroquimioterapia foram desenvolvidas para o tratamento de tumores internos usando procedimentos cirúrgicos, vias endoscópicas ou abordagens percutâneas para obter acesso à área de tratamento.
Terapia de hipertermia
A terapia de hipertermia é um tratamento térmico para câncer que pode ser uma ferramenta poderosa quando usada em combinação com quimioterapia (termoquimioterapia) ou radiação para o controle de uma variedade de cânceres. O calor pode ser aplicado localmente no local do tumor, o que dilatará os vasos sanguíneos do tumor, permitindo que mais medicamentos quimioterápicos entrem no tumor. Além disso, a membrana da célula tumoral se tornará mais porosa, permitindo ainda que mais medicamento quimioterápico entre na célula tumoral.
Também foi demonstrado que a hipertermia ajuda a prevenir ou reverter a "quimiorresistência" A resistência à quimioterapia às vezes se desenvolve com o tempo, à medida que os tumores se adaptam e podem superar a toxicidade da medicação quimioterápica. “A superação da quimiorresistência foi extensivamente estudada no passado, especialmente usando células resistentes a CDDP. Em relação ao benefício potencial de que células resistentes a drogas podem ser recrutadas para terapia eficaz combinando quimioterapia com hipertermia, foi importante mostrar que a quimiorresistência contra várias drogas anticancerígenas (por exemplo, mitomicina C, antraciclinas, BCNU, melfalano), incluindo CDDP, poderia ser revertida pelo menos parcialmente pela adição de calor.
Outros animais
A quimioterapia é usada na medicina veterinária de maneira semelhante à usada na medicina humana.
Contenido relacionado
Doenças do neurônio motor
Anestésico geral
Isolamento de substância corporal