Quimiotaxia
Quimiotaxia (de quimio- + táxis) é o movimento de um organismo ou entidade em resposta a um estímulo químico. Células somáticas, bactérias e outros organismos unicelulares ou multicelulares direcionam seus movimentos de acordo com certas substâncias químicas em seu ambiente. Isso é importante para as bactérias encontrarem comida (por exemplo, glicose) nadando em direção à maior concentração de moléculas de alimentos ou para fugir de venenos (por exemplo, fenol). Em organismos multicelulares, a quimiotaxia é crítica para o desenvolvimento inicial (por exemplo, movimento do esperma em direção ao óvulo durante a fertilização) e desenvolvimento (por exemplo, migração de neurônios ou linfócitos), bem como para a função e saúde normais (por exemplo, migração de leucócitos durante lesão ou infecção). Além disso, foi reconhecido que os mecanismos que permitem a quimiotaxia em animais podem ser subvertidos durante a metástase do câncer. A quimiotaxia aberrante de leucócitos e linfócitos também contribui para doenças inflamatórias, como aterosclerose, asma e artrite. Componentes subcelulares, como o patch de polaridade gerado pela levedura de acasalamento, também podem exibir comportamento quimiotático.
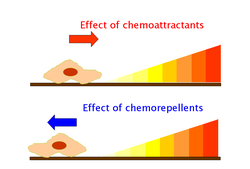
A quimiotaxiapositiva ocorre se o movimento for em direção a uma maior concentração do produto químico em questão; quimiotaxia negativa se o movimento for na direção oposta. A cinesia estimulada quimicamente (direcionada aleatoriamente ou não direcional) pode ser chamada de quimiocinese.
História da pesquisa de quimiotaxia
Embora a migração de células tenha sido detectada desde os primeiros dias do desenvolvimento da microscopia por Leeuwenhoek, uma palestra da Caltech sobre quimiotaxia propõe que "a descrição erudita da quimiotaxia foi feita apenas pela primeira vez por T. W. Engelmann (1881) e W. F. Pfeffer (1884) em bactérias e H. S. Jennings (1906) em ciliados'. O Prêmio Nobel I. Metchnikoff também contribuiu para o estudo do campo durante 1882 a 1886, com investigações do processo como uma etapa inicial da fagocitose. A importância da quimiotaxia na biologia e na patologia clínica foi amplamente aceita na década de 1930, e as definições mais fundamentais subjacentes ao fenômeno foram elaboradas nessa época. Os aspectos mais importantes no controle de qualidade dos ensaios de quimiotaxia foram descritos por H. Harris na década de 1950. Nas décadas de 1960 e 1970, a revolução da moderna biologia celular e bioquímica forneceu uma série de novas técnicas que se tornaram disponíveis para investigar as células respondedoras migratórias e as frações subcelulares responsáveis pela atividade quimiotática. A disponibilidade dessa tecnologia levou à descoberta do C5a, um importante fator quimiotático envolvido na inflamação aguda. Os trabalhos pioneiros de J. Adler modernizaram o ensaio capilar de Pfeffer e representaram um ponto de virada significativo na compreensão de todo o processo de transdução de sinal intracelular de bactérias.
Quimiotaxia bacteriana—características gerais
Algumas bactérias, como E. coli, têm vários flagelos por célula (normalmente 4–10). Estes podem girar de duas maneiras:
- A rotação anti-horário alinha a flagela em um único feixe rotativo, fazendo com que a bactéria nadasse em uma linha reta; e
- Rotação no sentido horário quebra o feixe de flagela para além de que cada flagellum aponta em uma direção diferente, fazendo com que a bactéria tropeça no lugar.
As direções de rotação são dadas para um observador fora da célula olhando pelos flagelos em direção à célula.
Comportamento
O movimento geral de uma bactéria é o resultado de fases alternadas de tombo e nado, chamadas de movimento de corrida e tombo. Como resultado, a trajetória de uma bactéria nadando em um ambiente uniforme formará uma caminhada aleatória com nados relativamente retos interrompidos por tombos aleatórios que reorientam a bactéria. Bactérias como E. coli são incapazes de escolher a direção em que nadam e são incapazes de nadar em linha reta por mais de alguns segundos devido à difusão rotacional; em outras palavras, as bactérias "esquecem" a direção em que estão indo. Ao avaliar repetidamente seu curso e ajustar se estão se movendo na direção errada, as bactérias podem direcionar seu movimento aleatório para locais favoráveis.
Na presença de um gradiente químico, as bactérias irão quimiotaxar ou direcionar seu movimento geral com base no gradiente. Se a bactéria sentir que está se movendo na direção correta (em direção ao atrativo/para longe do repelente), ela continuará nadando em linha reta por mais tempo antes de cair; no entanto, se estiver se movendo na direção errada, cairá mais cedo. Bactérias como E. coli usa a detecção temporal para decidir se sua situação está melhorando ou não e, dessa forma, encontra o local com a maior concentração de atrativo, detectando até mesmo pequenas diferenças de concentração.
Este passeio aleatório tendencioso é o resultado de simplesmente escolher entre dois métodos de movimento aleatório; ou seja, cair e nadar em linha reta. A natureza helicoidal do filamento flagelar individual é crítica para que esse movimento ocorra. A estrutura da proteína que compõe o filamento flagelar, a flagelina, é conservada entre todas as bactérias flageladas. Os vertebrados parecem ter aproveitado esse fato por possuírem um receptor imunológico (TLR5) projetado para reconhecer essa proteína conservada.
Como em muitos casos da biologia, existem bactérias que não seguem essa regra. Muitas bactérias, como Vibrio, são monoflageladas e possuem um único flagelo em um pólo da célula. Seu método de quimiotaxia é diferente. Outros possuem um único flagelo que é mantido dentro da parede celular. Essas bactérias se movem girando toda a célula, que tem a forma de um saca-rolhas.
Transdução de sinal
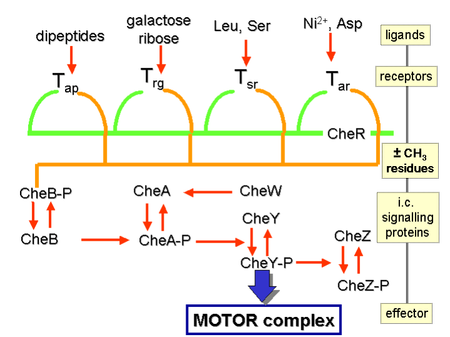
Os gradientes químicos são detectados por meio de múltiplos receptores transmembranares, chamados de proteínas de quimiotaxia de aceitação de metila (MCPs), que variam nas moléculas que detectam. Milhares de receptores MCP são conhecidos por serem codificados em todo o reino bacteriano. Esses receptores podem se ligar a atrativos ou repelentes direta ou indiretamente por meio da interação com proteínas do espaço periplasmático. Os sinais desses receptores são transmitidos através da membrana plasmática para o citosol, onde as proteínas Che são ativadas. As proteínas Che alteram a frequência de queda e alteram os receptores.
Regulação do flagelo
As proteínas CheW e CheA se ligam ao receptor. A ausência de ativação do receptor resulta em autofosforilação na histidina quinase, CheA, em um único resíduo de histidina altamente conservado. CheA, por sua vez, transfere grupos fosforil para resíduos de aspartato conservados nos reguladores de resposta CheB e CheY; CheA é uma histidina quinase e não transfere ativamente o grupo fosforil, em vez disso, o regulador de resposta CheB pega o grupo fosforil de CheA. Esse mecanismo de transdução de sinal é chamado de sistema de dois componentes e é uma forma comum de transdução de sinal em bactérias. CheY induz a rotação interagindo com a proteína interruptora flagelar FliM, induzindo uma mudança da rotação anti-horária para a horária do flagelo. A mudança no estado de rotação de um único flagelo pode interromper todo o feixe de flagelos e causar uma queda.
Regulação do receptor
CheB, quando ativado por CheA, atua como uma metilesterase, removendo grupos metil de resíduos de glutamato no lado citosólico do receptor; funciona de forma antagônica com a CheR, uma metiltransferase, que adiciona resíduos de metila aos mesmos resíduos de glutamato. Se o nível de um atrativo permanecer alto, o nível de fosforilação de CheA (e, portanto, CheY e CheB) permanecerá baixo, a célula nadará suavemente e o nível de metilação dos MCPs aumentará (porque CheB-P é não presente para desmetilar). Os MCPs não respondem mais ao atrativo quando estão totalmente metilados; portanto, mesmo que o nível de atrativo permaneça alto, o nível de CheA-P (e CheB-P) aumenta e a célula começa a cair. Os MCPs podem ser desmetilados pelo CheB-P e, quando isso acontece, os receptores podem responder novamente aos atrativos. A situação é oposta em relação aos repelentes: os MCPs totalmente metilados respondem melhor aos repelentes, enquanto os MCPs menos metilados respondem pior aos repelentes. Este regulamento permite que a bactéria 'lembre' concentrações químicas do passado recente, alguns segundos, e compará-las com as que está experimentando atualmente, assim 'saber' se está viajando para cima ou para baixo em um gradiente. que as bactérias têm gradientes químicos, outros mecanismos estão envolvidos no aumento do valor absoluto da sensibilidade em um determinado fundo. Exemplos bem estabelecidos são a resposta ultrassensível do motor ao sinal CheY-P e o agrupamento de quimiorreceptores.
Quimioatraentes e quimiorrepelentes
Quimioatraentes e quimiorepelentes são substâncias inorgânicas ou orgânicas que possuem efeito indutor de quimiotaxia em células móveis. Esses ligantes quimiotáticos criam gradientes de concentração química dos quais os organismos procarióticos e eucarióticos se aproximam ou se afastam, respectivamente.
Os efeitos dos quimioatraentes são induzidos por meio de quimiorreceptores, como as proteínas de quimiotaxia aceitadoras de metil (MCP). MCPs em E.coli incluem Tar, Tsr, Trg e Tap. Os quimioatrativos para Trg incluem ribose e galactose com fenol como quimiorepelente. Tap e Tsr reconhecem dipeptídeos e serina como quimioatraentes, respectivamente.
Os quimioatraentes ou quimiorepelentes se ligam às MCPs em seu domínio extracelular; um domínio de sinalização intracelular retransmite as mudanças na concentração desses ligantes quimiotáticos para proteínas a jusante como a de CheA, que então retransmite esse sinal para motores flagelares via CheY fosforilado (CheY-P). CheY-P pode então controlar a rotação flagelar influenciando a direção da motilidade celular.
Para E.coli, S. meliloti, e R. esferoides, a ligação de quimioatraentes a MCPs inibe a atividade de CheA e, portanto, de CheY-P, resultando em corridas suaves, mas para B. substilis, a atividade CheA aumenta. Os eventos de metilação em E.coli fazem com que os MCPs tenham menor afinidade com quimioatraentes, o que causa aumento da atividade de CheA e CheY-P, resultando em quedas. Desta forma, as células são capazes de se adaptar à concentração imediata de quimioatraente e detectar outras alterações para modular a motilidade celular.
Os quimioatraentes em eucariotos são bem caracterizados para células imunes. Peptídeos formil, como fMLF, atraem leucócitos, como neutrófilos e macrófagos, causando movimento em direção aos locais de infecção. Peptídeos de metioninil não acilados não atuam como quimioatraentes para neutrófilos e macrófagos. Os leucócitos também se movem em direção aos quimioatraentes C5a, um componente do complemento e ligantes específicos do patógeno nas bactérias.
Mecanismos relacionados aos quimiorrepelentes são menos conhecidos que os quimioatraentes. Embora os quimiorrepelentes trabalhem para conferir uma resposta de evitação nos organismos, Tetrahymena thermophila se adapta a um quimiorrepelente, o peptídeo Netrin-1, dentro de 10 minutos após a exposição; no entanto, a exposição a quimiorrepelentes como GTP, PACAP-38 e nociceptina não apresenta tais adaptações. GTP e ATP são quimiorrepelentes em concentrações micromolares tanto para Tetrahymena quanto para Paramecium. Esses organismos evitam essas moléculas produzindo reações de evitação para se reorientarem para longe do gradiente.
Quimiotaxia eucariótica
O mecanismo de quimiotaxia que as células eucarióticas empregam é bastante diferente daquele nas bactérias E. coli; no entanto, a detecção de gradientes químicos ainda é uma etapa crucial no processo. Devido ao seu pequeno tamanho e outras restrições biofísicas, E. coli não pode detectar diretamente um gradiente de concentração. Em vez disso, eles empregam detecção de gradiente temporal, onde se movem por distâncias maiores várias vezes a sua própria largura e medem a taxa na qual a concentração química percebida muda.
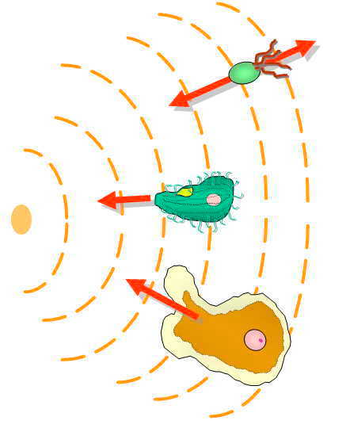
As células eucarióticas são muito maiores que as procariontes e possuem receptores incorporados uniformemente em toda a membrana celular. A quimiotaxia eucariótica envolve a detecção espacial de um gradiente de concentração, comparando a ativação assimétrica desses receptores nas diferentes extremidades da célula. A ativação desses receptores resulta na migração em direção aos quimioatraentes, ou longe dos quimiorepelentes. Em leveduras de acasalamento, que não são móveis, manchas de proteínas de polaridade no córtex celular podem se realocar de forma quimiotática em gradientes de feromônio.
Também foi demonstrado que as células procarióticas e eucarióticas são capazes de memória quimiotática. Em procariotos, esse mecanismo envolve a metilação de receptores chamados proteínas de quimiotaxia de aceitação de metil (MCPs). Isso resulta em sua dessensibilização e permite que os procariotos "lembrem" e se adaptar a um gradiente químico. Em contraste, a memória quimiotática em eucariotos pode ser explicada pelo modelo de inibição global de excitação local (LEGI). O LEGI envolve o equilíbrio entre uma excitação rápida e uma inibição atrasada que controla a sinalização a jusante, como a ativação de Ras e a produção de PIP3.
Os níveis de receptores, as vias de sinalização intracelular e os mecanismos efetores representam diversos componentes do tipo eucariótico. Em células unicelulares eucarióticas, o movimento amebóide e o cílio ou o flagelo eucariótico são os principais efetores (por exemplo, Amoeba ou Tetrahymena). Algumas células eucarióticas de origem vertebrada superior, como as células imunes, também se movem para onde precisam estar. Além das células imunocompetentes (granulócitos, monócitos, linfócitos), um grande grupo de células – consideradas previamente fixadas nos tecidos – também são móveis em condições fisiológicas especiais (por exemplo, mastócitos, fibroblastos, células endoteliais) ou patológicas (por exemplo, metástases).. A quimiotaxia tem grande importância nas fases iniciais da embriogênese, pois o desenvolvimento das camadas germinativas é guiado por gradientes de moléculas sinalizadoras.
Motilidade
Ao contrário da motilidade na quimiotaxia bacteriana, o mecanismo pelo qual as células eucarióticas se movem fisicamente não é claro. Parece haver mecanismos pelos quais um gradiente quimiotático externo é detectado e transformado em um gradiente de PIP3 intracelular, o que resulta em um gradiente e na ativação de uma via de sinalização, culminando na polimerização dos filamentos de actina. A extremidade distal crescente dos filamentos de actina desenvolve conexões com a superfície interna da membrana plasmática por meio de diferentes conjuntos de peptídeos e resulta na formação de pseudópodes anteriores e urópodes posteriores. Os cílios das células eucarióticas também podem produzir quimiotaxia; neste caso, é principalmente uma indução dependente de Ca2+ do sistema microtubular do corpo basal e o batimento dos microtúbulos 9 + 2 dentro dos cílios. O batimento orquestrado de centenas de cílios é sincronizado por um sistema submembranoso construído entre os corpos basais. Os detalhes das vias de sinalização ainda não estão totalmente claros.
Respostas migratórias relacionadas à quimiotaxia
Quimiotaxia refere-se à migração direcional de células em resposta a gradientes químicos; existem várias variações de migração induzida por produtos químicos, conforme listado abaixo.
- Chemokinesis refere-se a um aumento da motilidade celular em resposta a produtos químicos no ambiente circundante. Ao contrário da quimiotaxia, a migração estimulada pela quimiocinese carece de direcionalidade e, em vez disso, aumenta os comportamentos de digitalização ambiental.
- Em hematotáxis o gradiente do quimiotrante é expresso ou ligado em uma superfície, em contraste com o modelo clássico de quimiotaxia, em que o gradiente se desenvolve em um fluido solúvel. A superfície biologicamente ativa mais comum é a matriz extracelular (ECM); a presença de ligantes ligados é responsável pela indução da migração transendotelial e da angiogênese.
- Necrotaxis encarna um tipo especial de quimiotáxis quando as moléculas quimioattractantes são liberadas de células necróticas ou apoptóticas. Dependendo do caráter químico de substâncias liberadas, a necrotaxia pode acumular ou repelir células, o que sublinha o significado patofisiológico deste fenômeno.
Receptores
Em geral, as células eucarióticas detectam a presença de estímulos quimiotáticos através do uso de receptores acoplados à proteína G heterotrimérica 7-transmembrana (ou serpentina), uma classe que representa uma porção significativa do genoma. Alguns membros desta superfamília de genes são usados na visão (rodopsinas), bem como no olfato (cheiro). As principais classes de receptores de quimiotaxia são desencadeadas por:
- Peptídeos Formílicos - receptores de peptídeos formais (FPR),
- Chemokines - receptores de chemokine (CCR ou CXCR), e
- Leukotrienes - receptores de leucotrieno (BLT).
No entanto, a indução de um amplo conjunto de receptores de membrana (por exemplo, nucleotídeos cíclicos, aminoácidos, insulina, peptídeos vasoativos) também provoca a migração da célula.
Seleção quimiotática
Enquanto alguns receptores de quimiotaxia são expressos na superfície da membrana com características de longo prazo, pois são determinados geneticamente, outros têm dinâmica de curto prazo, pois são montados ad hoc na presença do ligando. As diversas características dos receptores e ligantes da quimiotaxia permitem a seleção de células quimiotáticas com um simples ensaio de quimiotaxia. Pela seleção quimiotática, podemos determinar se uma molécula ainda não caracterizada age pela via do receptor de longo ou curto prazo. O termo seleção quimiotática também é usado para designar uma técnica que separa células eucarióticas ou procarióticas de acordo com sua responsividade quimiotática a ligantes seletores.
Ligantes quimiotáticos
O número de moléculas capazes de provocar respostas quimiotáticas é relativamente alto, e podemos distinguir moléculas quimiotáticas primárias e secundárias. Os principais grupos de ligantes primários são os seguintes:
- Peptídeos de forma são di-, tri-, tetrapeptídeos de origem bacteriana, formylated no N-terminus do peptídeo. Eles são liberados de bactérias in vivo ou após a decomposição da célula[ um membro típico deste grupo é o N-formylmethionyl-leucyl-phenylalanine (fMLF abreviado ou fMLP). FMLF bacteriano é um componente chave da inflamação tem efeitos quimioattractantes característicos em granulócitos de neutrófilos e monócitos. Os ligantes e receptores do fator quimiotático relacionados aos peptídeos do formilo são resumidos no artigo relacionado, receptores do peptídeo Formyl.
- Complemento 3a (C3a) e complemento 5a (C5a) são produtos intermediários da cascata de complemento. Sua síntese é unida às três vias alternativas (clássica, dependente de lectina e alternativa) de ativação complementar por uma enzima de convertase. As principais células-alvo destes derivados também são granulócitos e monócitos de neutrófilos.
- Chemokins pertencem a uma classe especial de citocinas; não só os seus grupos (C, CC, CXC, CX3Chemokines C) representam moléculas estruturalmente relacionadas com um arranjo especial de pontes desulfeto, mas também sua especificidade de células-alvo é diversificada. Os quimioquímicos CC atuam em monócitos (por exemplo, RANTES) e quimiocinas CXC são específicos de granulócitos de neutrófilos (por exemplo, IL-8). Investigações das estruturas tridimensionais de quimiocinas forneceram evidências de que uma composição característica de folhas beta e uma hélice alfa fornece expressão de sequências necessárias para interação com os receptores de quimioquina. A formação de dimers e sua atividade biológica aumentada foi demonstrada por cristalografia de várias quimiocinas, por exemplo, IL-8.
- Metabolitos de ácidos graxos poliinsaturados
- Leukotrienes são mediadores lipídicos eicosanóides feitos pelo metabolismo do ácido aracidonico por ALOX5 (também denominado 5-lipoxigenase). Seu membro mais proeminente com a atividade do fator quimiotático é leucotrieno B4, que estimula a adesão, quimiotáxis e agregação de leucócitos. A ação quimioattractante do LTB4 é induzida através de dois receptores de proteína G-coupled, BLT1 e BLT2, que são altamente expressos em células envolvidas na inflamação e alergia.
- A família de eicosanóides de ácido hidroxiicosatetraenoico são metabolitos de ácido aracidonico também formados por ALOX5. Três membros da família formam naturalmente e têm atividade quimiotática proeminente. Estes, listados em ordem de diminuição da potência, são: 5 anos de idade Ácido, 5-oxo-15-hidroxi-eicosatetraenóico Ácidoe 5-Hydroxyeicosatetraenoic ácido. Esta família de agonistas estimula respostas quimiotáticas em eosinófilos humanos, neutrófilos e monócitos por ligação ao receptor Oxoeicosanóide 1, que, como os receptores para leucotrieno B4, é um receptor de proteína G. Além da pele, os neutrófilos são a primeira linha de defesa do corpo contra infecções bacterianas. Depois de deixar os vasos sanguíneos próximos, essas células reconhecem produtos químicos produzidos por bactérias em um corte ou arranhão e migram "para o cheiro".
- ácido 5-hidroxieicosatrienal e ácido 5-oxoeicosatrienoic são metabolitos do ácido de Mead (5Z.,8Z.,11Z.-eicosatrirenóide ácido); eles estimulam quimiotaxia leucócito através do receptor de oxoeicosanóide 1 com 5-oxoeicosatrienoic ácido sendo tão potente como o seu ácido araquidônico-derivado do ácido, 5-oxo-eicosatetraenoico ácido, em estimular o eosinófilo do sangue humano e quimiotáxis neutrophil.
- 12-Hydroxyeicosatetraenoic ácido é um metabolito eicosanóide do ácido aracidonic feito por ALOX12 que estimula a quimiotaxia do leucócito através do receptor B4 do leucotrieno, BLT2.
- Prostaglandina D2 é um metabolito eicosanóide do ácido arachidonônico feito pela ciclooxigenase 1 ou ciclooxigenase 2 que estimula a quimiotaxia através do receptor de Prostaglandina DP2. Ele estimula respostas quimiotáticas em eosinófilos, basófilos e células auxiliares T do subtipo Th2.
- 12-Hydroxyheptadecatrienoic ácido é um metabolito não-eicosanóide do ácido aracidonic feito pela ciclooxigenase 1 ou ciclooxigenase 2 que estimula a chemataxis do leucócito embora o receptor B4 do leucotrieno, BLT2.
- 15 anos de idade Ácido é um metabolito eicosanóide do ácido aracidonic feito meu ALOX15; tem atividade quimiotática fraca para monócitos humanos (sees 15-Hydroxyeicosatetraenoic acid#15-oxo-ETE). O receptor ou outro mecanismo pelo qual este metabolito estimula a quimiotaxia não foi elucidado.
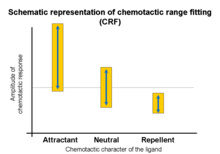
Ajuste de alcance quimiotático
As respostas quimiotáticas induzidas por interações ligante-receptor variam com a concentração do ligante. Investigações de famílias de ligantes (por exemplo, aminoácidos ou oligopeptídeos) demonstram que a atividade quimioatraente ocorre em uma ampla faixa, enquanto as atividades quimiorrepelentes têm faixas estreitas.
Significado clínico
Um potencial migratório alterado das células tem importância relativamente alta no desenvolvimento de vários sintomas clínicos e síndromes. A própria atividade quimiotática alterada de patógenos extracelulares (por exemplo, Escherichia coli) ou intracelulares (por exemplo, Listeria monocytogenes) representa um alvo clínico significativo. A modificação da capacidade quimiotática endógena desses microorganismos por agentes farmacêuticos pode diminuir ou inibir a proporção de infecções ou disseminação de doenças infecciosas. Além das infecções, existem algumas outras doenças em que a quimiotaxia prejudicada é o principal fator etiológico, como na síndrome de Chédiak-Higashi, em que vesículas intracelulares gigantes inibem a migração normal das células.
| Tipo de doença | Aumento da quimiotaxia | A quimiotaxia diminuiu |
|---|---|---|
| InfecçÃμes | Inflamações | SIDA, Brucelose |
| Chemotaxis resulta na doença | — | Síndrome de Chédiak–Higashi, Síndrome de Kartagener |
| Chemotaxis é afetado | Aterosclerose, artrite, periodontite, psoríase, lesão de reperfusão, tumores metastáticos | Esclerose múltipla, doença de Hodgkin, infertilidade masculina |
| Intoxicações | Amianto, benzpyrene | Sals de Hg e Cr, ozônio |
Modelos matemáticos
Vários modelos matemáticos de quimiotaxia foram desenvolvidos dependendo do tipo de
- Migração (por exemplo, diferenças básicas de natação bacteriana, movimento de eucariotes unicelulares com cilia/flagellum e migração amebóide)
- Características físico-químicas dos produtos químicos (por exemplo, difusão) trabalhando como ligantes
- Características biológicas dos ligantes (atraente, neutro e moléculas repelentes)
- Sistemas de ensaio aplicados para avaliar quimiotáxis (ver tempos de incubação, desenvolvimento e estabilidade de gradientes de concentração)
- Outros efeitos ambientais que possuem influência direta ou indireta na migração (luz, temperatura, campos magnéticos, etc.)
Embora as interações dos fatores listados acima tornem o comportamento das soluções de modelos matemáticos de quimiotáxis bastante complexos, é possível descrever o fenômeno básico de movimento orientado por quimiotáxis de uma forma direta. De facto, vamos denotar com φ φ - Sim. a concentração espacialmente não uniforme do químico-atraente e ? ? φ φ {displaystyle nabla varphi } como seu gradiente. Então o fluxo celular quimiotático (também chamado de corrente) JJ{displaystyle {bf {J}}} que é gerado pelo quimiotáxis está ligado ao gradiente acima pela lei:
JJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Cχ χ (φ φ )? ? φ φ {displaystyle {bf {J}}=Cchi (varphi)nabla varphi }
Onde? CNão. C. é a densidade espacial das células e χ χ - Sim. é o chamado coeficiente ’Chemotactic’ - Não. χ χ - Sim. muitas vezes não é constante, mas uma função decrescente do quimio-atraente. Para alguma quantidade ? ? - Sim. que está sujeito ao fluxo total JJ{displaystyle {bf {J}}} e prazo de geração/destruição SNão. S., é possível formular uma equação de continuidade:
- ∂ ∂ ? ? ∂ ∂ )+? ? )) JJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =S{displaystyle {partial rho over {partial t}}+nabla cdot {bf Não.
Onde? ? ? )) (){displaystyle nabla cdot ()} é a divergência. Esta equação geral aplica-se tanto à densidade celular como ao quimio-atraente. Portanto, incorporando um fluxo de difusão no termo do fluxo total, as interações entre essas quantidades são regidas por um conjunto de equações diferenciais parciais derivadas da reação que descrevem a mudança na CNão. C. e φ φ - Sim.:
∂ ∂ C∂ ∂ )= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =f(C)+? ? )) Não.DC? ? C- Sim. - Sim. Cχ χ (φ φ )? ? φ φ ]∂ ∂ φ φ ∂ ∂ )= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =g(φ φ ,C)+? ? )) (Dφ φ ? ? φ φ )- Não. C over {partial t}}&=f(C)+nabla cdot left[D_{C}nabla C-Cchi (varphi)nabla varphi right]{partial varphi over {partial t}}&=g(varphiC)+nabla cdot (D_{varphi }nabla varphi)varphi
Onde? f(C)(C)} descreve o crescimento da densidade celular, g(φ φ ,C){displaystyle g(varphiC)} é o termo cinético/fonte para o quimio-atraente, e os coeficientes de difusão para a densidade celular e o quimio-atraente são respectivamente DCNão. D_{C}} e Dφ φ - Sim.).
A ecologia espacial dos microorganismos do solo é uma função de suas sensibilidades quimiotáticas em relação ao substrato e outros organismos. Foi comprovado que o comportamento quimiotático das bactérias leva a padrões populacionais não triviais, mesmo na ausência de heterogeneidades ambientais. A presença de heterogeneidades estruturais da escala de poros tem um impacto extra nos padrões bacterianos emergentes.
Medição da quimiotaxia
Uma ampla gama de técnicas está disponível para avaliar a atividade quimiotática das células ou o caráter quimioatrativo e quimiorepelente dos ligantes. Os requisitos básicos da medição são os seguintes:
- Os gradientes de concentração podem desenvolver-se relativamente rapidamente e persistir por muito tempo no sistema
- As atividades quimiotáticas e quimiocinéticas são distinguidas
- Migração de células é livre para e fora no eixo do gradiente de concentração
- Respostas detectadas são os resultados da migração ativa das células
Apesar de ainda não existir um ensaio de quimiotaxia ideal, existem vários protocolos e equipamentos que oferecem boa correspondência com as condições descritas acima. Os mais comumente usados estão resumidos na tabela abaixo:
| Tipo de ensaio | Ensaios de placas de agar | Ensaios de duas câmaras | Outros |
|---|---|---|---|
| Exemplos |
|
|
|
Sistemas quimiotáticos artificiais
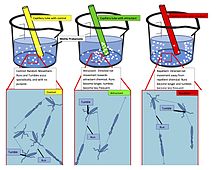
Robôs químicos que usam quimiotaxia artificial para navegar de forma autônoma foram projetados. As aplicações incluem a entrega direcionada de drogas no corpo. Mais recentemente, moléculas enzimáticas também mostraram comportamento quimiotático positivo no gradiente de seus substratos. A ligação termodinamicamente favorável das enzimas aos seus substratos específicos é reconhecida como a origem da quimiotaxia enzimática. Além disso, as enzimas em cascata também mostraram agregação quimiotática dirigida por substrato.
Além das enzimas ativas, as moléculas não reativas também apresentam comportamento quimiotático. Isso foi demonstrado usando moléculas de corante que se movem direcionalmente em gradientes de solução de polímero por meio de interações hidrofóbicas favoráveis.
Contenido relacionado
Universidade de Tecnologia de Eindhoven
Número do abade
Arthur Aikin
















![{displaystyle {begin{aligned}{partial C over {partial t}}&=f(C)+nabla cdot left[D_{C}nabla C-Cchi (varphi)nabla varphi right]\{partial varphi over {partial t}}&=g(varphiC)+nabla cdot (D_{varphi }nabla varphi)end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/924b3d46d7dc2a27228a7d98cf43d035a4622c41)



