Química
Química é o estudo científico das propriedades e comportamento da matéria. É uma ciência física no âmbito das ciências naturais que abrange os elementos que compõem a matéria para os compostos feitos de átomos, moléculas e íons: sua composição, estrutura, propriedades, comportamento e as mudanças que sofrem durante uma reação com outras substâncias. A química também aborda a natureza das ligações químicas em compostos químicos.
No âmbito da sua disciplina, a química ocupa uma posição intermédia entre a física e a biologia. Às vezes é chamada de ciência central porque fornece uma base para a compreensão das disciplinas científicas básicas e aplicadas em um nível fundamental. Por exemplo, a química explica aspectos do crescimento das plantas (botânica), a formação de rochas ígneas (geologia), como o ozônio atmosférico é formado e como os poluentes ambientais são degradados (ecologia), as propriedades do solo na lua (cosmoquímica), como medicamentos funcionam (farmacologia) e como coletar evidências de DNA na cena do crime (forense).
Etimologia
A palavra química vem de uma modificação durante o Renascimento da palavra alquimia, que se referia a um conjunto anterior de práticas que englobavam elementos de química, metalurgia, filosofia, astrologia, astronomia, misticismo e medicina. A alquimia é frequentemente associada à busca de transformar chumbo ou outros metais básicos em ouro, embora os alquimistas também estivessem interessados em muitas das questões da química moderna.
A palavra moderna alquimia, por sua vez, é derivada da palavra árabe al-kīmīā (الكیمیاء). Isso pode ter origens egípcias, pois al-kīmīā é derivado do grego antigo χημία, que por sua vez é derivado da palavra Kemet, que é o antigo nome do Egito na língua egípcia. Como alternativa, al-kīmīā pode derivar da língua χημεία 'lançar juntos'.
Princípios modernos
O modelo atual da estrutura atômica é o modelo da mecânica quântica. A química tradicional começa com o estudo de partículas elementares, átomos, moléculas, substâncias, metais, cristais e outros agregados da matéria. A matéria pode ser estudada nos estados sólido, líquido, gasoso e plasmático, isoladamente ou em combinação. As interações, reações e transformações que são estudadas em química são geralmente o resultado de interações entre átomos, levando a rearranjos das ligações químicas que mantêm os átomos unidos. Tais comportamentos são estudados em um laboratório de química.
O laboratório de química usa estereotipadamente várias formas de vidraria de laboratório. No entanto, a vidraria não é central para a química, e grande parte da química experimental (bem como aplicada/industrial) é feita sem ela.
Uma reação química é a transformação de algumas substâncias em uma ou mais substâncias diferentes. A base de tal transformação química é o rearranjo de elétrons nas ligações químicas entre os átomos. Pode ser representado simbolicamente por meio de uma equação química, que geralmente envolve átomos como sujeitos. O número de átomos à esquerda e à direita na equação para uma transformação química é igual. (Quando o número de átomos em ambos os lados é desigual, a transformação é chamada de reação nuclear ou decaimento radioativo.) O tipo de reações químicas que uma substância pode sofrer e as mudanças de energia que podem acompanhá-la são limitados por certas regras básicas, conhecidas como leis químicas.
As considerações de energia e entropia são invariavelmente importantes em quase todos os estudos químicos. As substâncias químicas são classificadas em termos de sua estrutura, fase, bem como suas composições químicas. Eles podem ser analisados usando as ferramentas de análise química, por ex. espectroscopia e cromatografia. Os cientistas envolvidos na pesquisa química são conhecidos como químicos. A maioria dos químicos se especializa em uma ou mais subdisciplinas. Vários conceitos são essenciais para o estudo da química; alguns deles são:
Matéria
Na química, a matéria é definida como qualquer coisa que tenha massa e volume em repouso (ocupa espaço) e é composta de partículas. As partículas que compõem a matéria também têm massa de repouso – nem todas as partículas têm massa de repouso, como o fóton. A matéria pode ser uma substância química pura ou uma mistura de substâncias.
Átomo
O átomo é a unidade básica da química. Consiste em um núcleo denso chamado núcleo atômico cercado por um espaço ocupado por uma nuvem de elétrons. O núcleo é composto de prótons carregados positivamente e nêutrons não carregados (juntos chamados de núcleons), enquanto a nuvem de elétrons consiste em elétrons carregados negativamente que orbitam o núcleo. Em um átomo neutro, os elétrons carregados negativamente equilibram a carga positiva dos prótons. O núcleo é denso; a massa de um núcleon é aproximadamente 1.836 vezes a de um elétron, mas o raio de um átomo é cerca de 10.000 vezes o de seu núcleo.
O átomo também é a menor entidade que pode ser considerada para reter as propriedades químicas do elemento, como eletronegatividade, potencial de ionização, estado(s) de oxidação preferido(s), número de coordenação e tipos preferidos de ligações a serem formadas (por exemplo, metálico, iônico, covalente).
Elemento
Um elemento químico é uma substância pura que é composta por um único tipo de átomo, caracterizado por seu número particular de prótons nos núcleos de seus átomos, conhecido como número atômico e representado pelo símbolo Z. O número de massa é a soma do número de prótons e nêutrons em um núcleo. Embora todos os núcleos de todos os átomos pertencentes a um elemento tenham o mesmo número atômico, eles podem não ter necessariamente o mesmo número de massa; átomos de um elemento que têm diferentes números de massa são conhecidos como isótopos. Por exemplo, todos os átomos com 6 prótons em seus núcleos são átomos do elemento químico carbono, mas os átomos de carbono podem ter números de massa de 12 ou 13.
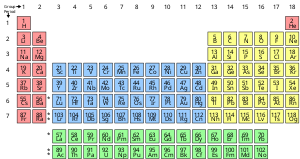
A apresentação padrão dos elementos químicos está na tabela periódica, que ordena os elementos por número atômico. A tabela periódica é organizada em grupos, ou colunas, e períodos, ou linhas. A tabela periódica é útil para identificar tendências periódicas.
Composto
Um composto é uma substância química pura composta por mais de um elemento. As propriedades de um composto têm pouca semelhança com as de seus elementos. A nomenclatura padrão de compostos é definida pela União Internacional de Química Pura e Aplicada (IUPAC). Os compostos orgânicos são nomeados de acordo com o sistema de nomenclatura orgânica. Os nomes dos compostos inorgânicos são criados de acordo com o sistema de nomenclatura inorgânica. Quando um composto tem mais de um componente, eles são divididos em duas classes, os componentes eletropositivos e os eletronegativos. Além disso, o Chemical Abstracts Service desenvolveu um método para indexar substâncias químicas. Neste esquema, cada substância química é identificável por um número conhecido como seu número de registro CAS.
Molécula
Uma molécula é a menor porção indivisível de uma substância química pura que possui seu conjunto único de propriedades químicas, ou seja, seu potencial para sofrer um determinado conjunto de reações químicas com outras substâncias. No entanto, essa definição só funciona bem para substâncias compostas de moléculas, o que não é verdade para muitas substâncias (veja abaixo). As moléculas são tipicamente um conjunto de átomos unidos por ligações covalentes, de modo que a estrutura é eletricamente neutra e todos os elétrons de valência são emparelhados com outros elétrons em ligações ou em pares solitários.
Assim, as moléculas existem como unidades eletricamente neutras, ao contrário dos íons. Quando esta regra é quebrada, dando a "molécula" uma carga, o resultado às vezes é chamado de íon molecular ou íon poliatômico. No entanto, a natureza discreta e separada do conceito molecular geralmente requer que os íons moleculares estejam presentes apenas em formas bem separadas, como um feixe direcionado no vácuo em um espectrômetro de massa. Coleções poliatômicas carregadas que residem em sólidos (por exemplo, íons sulfato ou nitrato comuns) geralmente não são consideradas "moléculas" em química. Algumas moléculas contêm um ou mais elétrons desemparelhados, criando radicais. A maioria dos radicais são relativamente reativos, mas alguns, como o óxido nítrico (NO), podem ser estáveis.
O "inerte" ou elementos de gás nobre (hélio, néon, argônio, criptônio, xenônio e radônio) são compostos de átomos solitários como sua menor unidade discreta, mas os outros elementos químicos isolados consistem em moléculas ou redes de átomos ligados uns aos outros de alguma forma. Moléculas identificáveis compõem substâncias familiares como água, ar e muitos compostos orgânicos como álcool, açúcar, gasolina e vários produtos farmacêuticos.
No entanto, nem todas as substâncias ou compostos químicos consistem em moléculas discretas e, de fato, a maioria das substâncias sólidas que compõem a crosta sólida, o manto e o núcleo da Terra são compostos químicos sem moléculas. Esses outros tipos de substâncias, como compostos iônicos e sólidos em rede, são organizados de forma a não existirem moléculas identificáveis per se. Em vez disso, essas substâncias são discutidas em termos de unidades de fórmula ou células unitárias como a menor estrutura repetida dentro da substância. Exemplos de tais substâncias são sais minerais (como sal de mesa), sólidos como carbono e diamante, metais e sílica familiar e minerais de silicato, como quartzo e granito.
Uma das principais características de uma molécula é sua geometria, muitas vezes chamada de estrutura. Enquanto a estrutura de moléculas diatômicas, triatômicas ou tetraatômicas pode ser trivial, (linear, angular piramidal etc.).
Substância e mistura
Uma substância química é um tipo de matéria com uma composição definida e um conjunto de propriedades. Uma coleção de substâncias é chamada de mistura. Exemplos de misturas são ar e ligas.
Molar e quantidade de substância
O mol é uma unidade de medida que denota uma quantidade de substância (também chamada de quantidade química). Uma toupeira é definida para conter exatamente 6.02214076×1023 partículas (átomos, moléculas, íons ou elétrons), onde o número de partículas por mol é conhecido como constante de Avogadro. A concentração molar é a quantidade de uma determinada substância por volume de solução e é comumente relatada em mol/dm3.
Fase
Além das propriedades químicas específicas que distinguem diferentes classificações químicas, os produtos químicos podem existir em várias fases. Na maioria das vezes, as classificações químicas são independentes dessas classificações de fase em massa; no entanto, algumas fases mais exóticas são incompatíveis com certas propriedades químicas. Uma fase é um conjunto de estados de um sistema químico que possui propriedades estruturais semelhantes em uma variedade de condições, como pressão ou temperatura.
Propriedades físicas, como densidade e índice de refração tendem a cair dentro dos valores característicos da fase. A fase da matéria é definida pela transição de fase, que é quando a energia colocada ou retirada do sistema vai para o rearranjo da estrutura do sistema, em vez de alterar as condições gerais.
Às vezes, a distinção entre as fases pode ser contínua em vez de ter um limite discreto' neste caso, a matéria é considerada em estado supercrítico. Quando três estados se encontram com base nas condições, é conhecido como ponto triplo e, como é invariante, é uma maneira conveniente de definir um conjunto de condições.
Os exemplos mais familiares de fases são sólidos, líquidos e gases. Muitas substâncias exibem múltiplas fases sólidas. Por exemplo, existem três fases de ferro sólido (alfa, gama e delta) que variam com base na temperatura e pressão. Uma diferença principal entre as fases sólidas é a estrutura cristalina, ou arranjo, dos átomos. Outra fase comumente encontrada no estudo da química é a fase aquosa, que é o estado das substâncias dissolvidas em solução aquosa (isto é, em água).
Fases menos familiares incluem plasmas, condensados de Bose-Einstein e condensados fermiônicos e as fases paramagnética e ferromagnética de materiais magnéticos. Embora a maioria das fases familiares lide com sistemas tridimensionais, também é possível definir análogos em sistemas bidimensionais, o que tem recebido atenção por sua relevância para sistemas em biologia.
Vínculo
Diz-se que os átomos que se unem em moléculas ou cristais estão ligados uns aos outros. Uma ligação química pode ser visualizada como o equilíbrio multipolar entre as cargas positivas nos núcleos e as cargas negativas oscilando sobre eles. Mais do que simples atração e repulsão, as energias e distribuições caracterizam a disponibilidade de um elétron para se ligar a outro átomo.
A ligação química pode ser uma ligação covalente, uma ligação iônica, uma ligação de hidrogênio ou apenas por causa da força de Van der Waals. Cada um desses tipos de ligações é atribuído a algum potencial. Esses potenciais criam as interações que mantêm os átomos juntos em moléculas ou cristais. Em muitos compostos simples, a teoria da ligação de valência, o modelo Valence Shell Electron Pair Repulsion (VSEPR) e o conceito de número de oxidação podem ser usados para explicar a estrutura e composição molecular.
Uma ligação iônica é formada quando um metal perde um ou mais de seus elétrons, tornando-se um cátion carregado positivamente, e os elétrons são então ganhos pelo átomo não metálico, tornando-se um ânion carregado negativamente. Os dois íons de cargas opostas se atraem, e a ligação iônica é a força eletrostática de atração entre eles. Por exemplo, o sódio (Na), um metal, perde um elétron para se tornar um cátion Na+ enquanto o cloro (Cl), um não-metal, ganha esse elétron para se tornar Cl−. Os íons são mantidos juntos devido à atração eletrostática, e esse composto cloreto de sódio (NaCl), ou sal de cozinha comum, é formado.

Em uma ligação covalente, um ou mais pares de elétrons de valência são compartilhados por dois átomos: o grupo eletricamente neutro resultante de átomos ligados é chamado de molécula. Os átomos compartilharão elétrons de valência de forma a criar uma configuração eletrônica de gás nobre (oito elétrons em sua camada mais externa) para cada átomo. Diz-se que os átomos que tendem a se combinar de tal maneira que cada um tem oito elétrons em sua camada de valência seguem a regra do octeto. No entanto, alguns elementos como o hidrogênio e o lítio precisam de apenas dois elétrons em sua camada mais externa para atingir essa configuração estável; diz-se que esses átomos seguem a regra do dueto e, dessa forma, atingem a configuração eletrônica do gás nobre hélio, que tem dois elétrons em sua camada externa.
Da mesma forma, as teorias da física clássica podem ser usadas para prever muitas estruturas iônicas. Com compostos mais complicados, como complexos metálicos, a teoria da ligação de valência é menos aplicável e abordagens alternativas, como a teoria do orbital molecular, são geralmente usadas. Veja o diagrama em orbitais eletrônicos.
Energia
No contexto da química, energia é um atributo de uma substância como consequência de sua estrutura atômica, molecular ou agregada. Uma vez que uma transformação química é acompanhada por uma mudança em um ou mais desses tipos de estruturas, ela é invariavelmente acompanhada por um aumento ou diminuição da energia das substâncias envolvidas. Alguma energia é transferida entre o ambiente e os reagentes da reação na forma de calor ou luz; assim, os produtos de uma reação podem ter mais ou menos energia que os reagentes.
Uma reação é dita exergônica se o estado final for menor na escala de energia do que o estado inicial; no caso das reações endergônicas a situação é inversa. Uma reação é considerada exotérmica se a reação liberar calor para o ambiente; no caso de reações endotérmicas, a reação absorve calor do ambiente.
As reações químicas não são invariavelmente possíveis a menos que os reatores superem uma barreira energética conhecida como energia de ativação. O velocidade de velocidade de uma reação química (a dada temperatura T) está relacionada à energia de ativação E, pelo fator populacional de Boltzmann e- Sim. - Sim. E/kT{displaystyle e^{-E/kT}} – essa é a probabilidade de uma molécula ter energia maior ou igual a E na temperatura dada T. Esta dependência exponencial de uma taxa de reação na temperatura é conhecida como a equação de Arrênio. A energia de ativação necessária para uma reação química ocorrer pode ser na forma de calor, luz, eletricidade ou força mecânica na forma de ultra-som.
Uma energia livre de conceito relacionada, que também incorpora considerações de entropia, é um meio muito útil para prever a viabilidade de uma reação e determinar o estado de equilíbrio de uma reação química, em termodinâmica química. Uma reação é viável apenas se a mudança total na energia livre de Gibbs for negativa, ? ? G≤ ≤ 0Não. Delta Gleq 0,}; se for igual a zero a reação química é dito estar em equilíbrio.
Existem apenas estados possíveis limitados de energia para elétrons, átomos e moléculas. Estes são determinados pelas regras da mecânica quântica, que requerem a quantização da energia de um sistema vinculado. Os átomos/moléculas em um estado de maior energia são ditos excitados. As moléculas/átomos da substância em um estado de energia excitado são frequentemente muito mais reativos; isto é, mais passível de reações químicas.
A fase de uma substância é invariavelmente determinada por sua energia e pela energia de seus arredores. Quando as forças intermoleculares de uma substância são tais que a energia do meio não é suficiente para superá-las, ela ocorre em uma fase mais ordenada como líquida ou sólida como é o caso da água (H2O); um líquido à temperatura ambiente porque suas moléculas estão ligadas por pontes de hidrogênio. Já o sulfeto de hidrogênio (H2S) é um gás à temperatura ambiente e à pressão padrão, pois suas moléculas são ligadas por interações dipolo-dipolo mais fracas.
A transferência de energia de uma substância química para outra depende do tamanho dos quanta de energia emitidos por uma substância. No entanto, a energia térmica é freqüentemente transferida mais facilmente de quase qualquer substância para outra porque os fônons responsáveis pelos níveis de energia vibracional e rotacional em uma substância têm muito menos energia do que os fótons invocados para a transferência eletrônica de energia. Assim, como os níveis de energia vibracional e rotacional são mais espaçados do que os níveis de energia eletrônica, o calor é mais facilmente transferido entre as substâncias em relação à luz ou outras formas de energia eletrônica. Por exemplo, a radiação eletromagnética ultravioleta não é transferida com tanta eficácia de uma substância para outra quanto a energia térmica ou elétrica.
A existência de níveis de energia característicos para diferentes substâncias químicas é útil para sua identificação pela análise de linhas espectrais. Diferentes tipos de espectros são freqüentemente usados em espectroscopia química, por ex. IR, microondas, NMR, ESR, etc. A espectroscopia também é usada para identificar a composição de objetos remotos – como estrelas e galáxias distantes – analisando seus espectros de radiação.
O termo energia química é freqüentemente usado para indicar o potencial de uma substância química para sofrer uma transformação por meio de uma reação química ou para transformar outras substâncias químicas.
Reação
Quando uma substância química é transformada como resultado de sua interação com outra substância ou com energia, diz-se que ocorreu uma reação química. Uma reação química é, portanto, um conceito relacionado à "reação" de uma substância quando entra em contato próximo com outra, seja como mistura ou solução; exposição a alguma forma de energia, ou ambos. Isso resulta em alguma troca de energia entre os constituintes da reação, bem como com o ambiente do sistema, que pode ser recipientes projetados - geralmente vidraria de laboratório.
As reações químicas podem resultar na formação ou dissociação de moléculas, isto é, na quebra de moléculas para formar duas ou mais moléculas ou no rearranjo de átomos dentro ou através das moléculas. As reações químicas geralmente envolvem a formação ou quebra de ligações químicas. Oxidação, redução, dissociação, neutralização ácido-base e rearranjo molecular são alguns exemplos de reações químicas comuns.
Uma reação química pode ser representada simbolicamente por meio de uma equação química. Enquanto em uma reação química não nuclear o número e o tipo de átomos em ambos os lados da equação são iguais, para uma reação nuclear isso é válido apenas para as partículas nucleares viz. prótons e nêutrons.
A sequência de etapas em que a reorganização das ligações químicas pode estar ocorrendo no curso de uma reação química é chamada de mecanismo. Uma reação química pode ocorrer em várias etapas, cada uma das quais pode ter uma velocidade diferente. Muitos intermediários de reação com estabilidade variável podem, portanto, ser considerados durante o curso de uma reação. Mecanismos de reação são propostos para explicar a cinética e a mistura relativa de produtos de uma reação. Muitos físicos químicos se especializam em explorar e propor os mecanismos de várias reações químicas. Várias regras empíricas, como as regras de Woodward-Hoffmann, costumam ser úteis ao propor um mecanismo para uma reação química.
De acordo com o livro de ouro da IUPAC, uma reação química é "um processo que resulta na interconversão de espécies químicas." Consequentemente, uma reação química pode ser uma reação elementar ou uma reação em etapas. Uma ressalva adicional é feita, pois esta definição inclui casos em que a interconversão de conformeres é experimentalmente observável. Tais reações químicas detectáveis normalmente envolvem conjuntos de entidades moleculares conforme indicado por esta definição, mas muitas vezes é conceitualmente conveniente usar o termo também para mudanças envolvendo entidades moleculares únicas (isto é, "eventos químicos microscópicos").
Íons e sais
Um íon é uma espécie carregada, um átomo ou uma molécula, que perdeu ou ganhou um ou mais elétrons. Quando um átomo perde um elétron e, portanto, tem mais prótons do que elétrons, o átomo é um íon ou cátion carregado positivamente. Quando um átomo ganha um elétron e, portanto, tem mais elétrons do que prótons, o átomo é um íon ou ânion carregado negativamente. Cátions e ânions podem formar uma rede cristalina de sais neutros, como os íons Na+ e Cl− formando cloreto de sódio, ou NaCl. Exemplos de íons poliatômicos que não se dividem durante as reações ácido-base são hidróxido (OH−) e fosfato (PO43−).
O plasma é composto de matéria gasosa que foi completamente ionizada, geralmente em altas temperaturas.
Acidez e basicidade
Uma substância pode frequentemente ser classificada como um ácido ou uma base. Existem várias teorias diferentes que explicam o comportamento ácido-base. A mais simples é a teoria de Arrhenius, que afirma que ácido é uma substância que produz íons hidrônio quando é dissolvida em água, e uma base é aquela que produz íons hidróxido quando dissolvida em água. De acordo com a teoria ácido-base de Brønsted-Lowry, ácidos são substâncias que doam um íon de hidrogênio positivo para outra substância em uma reação química; por extensão, uma base é a substância que recebe esse íon de hidrogênio.
Uma terceira teoria comum é a teoria ácido-base de Lewis, baseada na formação de novas ligações químicas. A teoria de Lewis explica que um ácido é uma substância que é capaz de aceitar um par de elétrons de outra substância durante o processo de formação da ligação, enquanto uma base é uma substância que pode fornecer um par de elétrons para formar uma nova ligação. Existem várias outras maneiras pelas quais uma substância pode ser classificada como ácido ou base, como fica evidente na história desse conceito.
A força ácida é comumente medida por dois métodos. Uma medida, baseada na definição de acidez de Arrhenius, é o pH, que é uma medida da concentração do íon hidrônio em uma solução, expressa em uma escala logarítmica negativa. Assim, as soluções que têm um pH baixo têm uma alta concentração de íons hidrônio e podem ser consideradas mais ácidas. A outra medida, baseada na definição de Brønsted-Lowry, é a constante de dissociação ácida (Ka), que mede a capacidade relativa de uma substância de agir como um ácido sob a definição de Brønsted-Lowry de um ácido. Ou seja, substâncias com um Ka mais alto são mais propensas a doar íons de hidrogênio em reações químicas do que aquelas com valores de Ka mais baixos.
Redox
As reaçõesRedox (reduction-ox) incluem todas as reações químicas nas quais os átomos têm seu estado de oxidação alterado por ganho de elétrons (redução) ou perda de elétrons (oxidação). Substâncias que têm a capacidade de oxidar outras substâncias são ditas oxidativas e são conhecidas como agentes oxidantes, oxidantes ou oxidantes. Um oxidante remove elétrons de outra substância. Da mesma forma, substâncias que têm a capacidade de reduzir outras substâncias são ditas redutoras e são conhecidas como agentes redutores, redutores ou redutores.
Um redutor transfere elétrons para outra substância e, portanto, é ele próprio oxidado. E porque "doa" elétrons, também é chamado de doador de elétrons. Oxidação e redução referem-se adequadamente a uma mudança no número de oxidação - a transferência real de elétrons pode nunca ocorrer. Assim, a oxidação é melhor definida como um aumento no número de oxidação e a redução como uma diminuição no número de oxidação.
Equilíbrio
Embora o conceito de equilíbrio seja amplamente utilizado nas ciências, no contexto da química, ele surge sempre que vários estados diferentes da composição química são possíveis, como por exemplo, em uma mistura de vários compostos químicos que podem reagir com entre si, ou quando uma substância pode estar presente em mais de um tipo de fase.
Um sistema de substâncias químicas em equilíbrio, embora tenha uma composição imutável, na maioria das vezes não é estático; as moléculas das substâncias continuam a reagir umas com as outras, dando origem a um equilíbrio dinâmico. Assim, o conceito descreve o estado em que os parâmetros, como a composição química, permanecem inalterados ao longo do tempo.
Leis químicas
As reações químicas são regidas por certas leis, que se tornaram conceitos fundamentais da química. Alguns deles são:
- Lei de Avogadro
- Beer–Lei geral
- Lei de Boyle (1662, relativa à pressão e volume)
- Lei de Carlos (1787, referente ao volume e à temperatura)
- Leis de difusão de Fick
- Lei de Gay-Lussac (1809, relativa à pressão e temperatura)
- Princípio de Le Chatelier
- A lei do Henry
- A lei de Hess
- A lei de conservação da energia leva aos conceitos importantes de equilíbrio, termodinâmica e cinética.
- A lei da conservação da massa continua a ser conservada em sistemas isolados, mesmo na física moderna. No entanto, a relatividade especial mostra que, devido à equivalência de massa-energia, sempre que a "energia" não material (cura, luz, energia cinética) é removida de um sistema não isolado, alguma massa será perdida com ele. As altas perdas de energia resultam na perda de quantidades pesadas de massa, um tópico importante na química nuclear.
- Lei de composição definida, embora em muitos sistemas (nomeadamente biomacromoléculas e minerais) as razões tendem a exigir grandes números, e são frequentemente representadas como uma fração.
- Lei de múltiplas proporções
- A lei de Raoult
História
A história da química abrange um período desde tempos muito antigos até o presente. Desde vários milênios aC, as civilizações usavam tecnologias que eventualmente formariam a base dos vários ramos da química. Exemplos incluem extração de metais de minérios, fabricação de cerâmica e esmaltes, fermentação de cerveja e vinho, extração de produtos químicos de plantas para remédios e perfumes, transformação de gordura em sabão, fabricação de vidro e ligas como o bronze.
A química foi precedida por sua protociência, a alquimia, que operava uma abordagem não científica para entender os constituintes da matéria e suas interações. Apesar de não conseguirem explicar a natureza da matéria e suas transformações, os alquimistas prepararam o terreno para a química moderna realizando experimentos e registrando os resultados. Robert Boyle, embora cético em relação aos elementos e convencido da alquimia, desempenhou um papel fundamental na elevação da "arte sacra" como uma disciplina independente, fundamental e filosófica em sua obra The Skeptical Chymist (1661).
Embora tanto a alquimia quanto a química se preocupem com a matéria e suas transformações, a diferença crucial foi dada pelo método científico que os químicos empregavam em seu trabalho. A química, como um corpo de conhecimento distinto da alquimia, tornou-se uma ciência estabelecida com o trabalho de Antoine Lavoisier, que desenvolveu uma lei de conservação de massa que exigia medições cuidadosas e observações quantitativas de fenômenos químicos. A história da química depois se confunde com a história da termodinâmica, especialmente através do trabalho de Willard Gibbs.
Definição
A definição de química mudou ao longo do tempo, à medida que novas descobertas e teorias foram adicionadas à funcionalidade da ciência. O termo "química", na visão do notável cientista Robert Boyle em 1661, significava o assunto dos princípios materiais de corpos mistos. Em 1663, o químico Christopher Glaser descreveu a "química" como uma arte científica, pela qual se aprende a dissolver corpos, e extrair deles as diferentes substâncias em sua composição, e como uni-los novamente, e exaltá-los a uma perfeição superior.
A definição de 1730 da palavra "química", conforme usada por Georg Ernst Stahl, significava a arte de resolver corpos mistos, compostos ou agregados em seus princípios; e de compor tais corpos a partir desses princípios. Em 1837, Jean-Baptiste Dumas considerou a palavra "química" para se referir à ciência preocupada com as leis e efeitos das forças moleculares. Essa definição evoluiu até que, em 1947, passou a significar a ciência das substâncias: sua estrutura, suas propriedades e as reações que as transformam em outras substâncias – caracterização aceita por Linus Pauling. Mais recentemente, em 1998, o professor Raymond Chang ampliou a definição de "química" para significar o estudo da matéria e as mudanças que ela sofre.
Fundo
As primeiras civilizações, como os egípcios, babilônios e indianos, acumularam conhecimento prático sobre as artes da metalurgia, cerâmica e tinturas, mas não desenvolveram uma teoria sistemática.
Uma hipótese química básica surgiu pela primeira vez na Grécia Clássica com a teoria dos quatro elementos proposta definitivamente por Aristóteles afirmando que fogo, ar, terra e água eram os elementos fundamentais a partir dos quais tudo é formado como uma combinação. O atomismo grego remonta a 440 aC, surgindo em obras de filósofos como Demócrito e Epicuro. Em 50 aC, o filósofo romano Lucrécio expandiu a teoria em seu livro De rerum natura (Sobre a natureza das coisas). Ao contrário dos conceitos modernos de ciência, o atomismo grego era puramente filosófico por natureza, com pouca preocupação com observações empíricas e nenhuma preocupação com experimentos químicos.
Uma forma inicial da ideia de conservação de massa é a noção de que "Nada vem do nada" na filosofia grega antiga, que pode ser encontrada em Empédocles (aproximadamente século 4 aC): "Pois é impossível que qualquer coisa venha a ser do que não é, e não pode ser produzido ou ouvido sobre o que é deve ser totalmente destruído." e Epicuro (século III aC), que, descrevendo a natureza do Universo, escreveu que "a totalidade das coisas sempre foi como é agora e sempre será".
No mundo helenístico a arte da alquimia proliferou pela primeira vez, misturando magia e ocultismo no estudo de substâncias naturais com o objetivo final de transmutar elementos em ouro e descobrir o elixir da vida eterna. O trabalho, particularmente o desenvolvimento da destilação, continuou no início do período bizantino, com o praticante mais famoso sendo o greco-egípcio Zósimo de Panópolis, do século IV. A alquimia continuou a ser desenvolvida e praticada em todo o mundo árabe após as conquistas muçulmanas e, a partir daí, e dos remanescentes bizantinos, difundida na Europa medieval e renascentista por meio de traduções latinas.
Os trabalhos árabes atribuídos a Jabir ibn Hayyan introduziram uma classificação sistemática de substâncias químicas e forneceram instruções para derivar um composto inorgânico (sal amoníaco ou cloreto de amônio) de substâncias orgânicas (como plantas, sangue e cabelo) por meios químicos. Algumas obras jabirianas árabes (por exemplo, o "Livro da Misericórdia" e o "Livro dos Setenta") foram posteriormente traduzidas para o latim sob o nome latinizado de "Geber", e na Europa do século 13, um escritor anônimo, geralmente referido como pseudo-Geber, começou a produzir escritos alquímicos e metalúrgicos sob esse nome. Filósofos muçulmanos influentes posteriores, como Abū al-Rayhān al-Bīrūnī e Avicena, contestaram as teorias da alquimia, particularmente a teoria da transmutação dos metais.
Sob a influência dos novos métodos empíricos propostos por Sir Francis Bacon e outros, um grupo de químicos em Oxford, Robert Boyle, Robert Hooke e John Mayow começaram a remodelar as antigas tradições alquímicas em uma disciplina científica. Boyle, em particular, questionou algumas teorias químicas comumente aceitas e argumentou que os profissionais químicos deveriam ser mais "filosóficos" e menos focado comercialmente em The Skeptical Chemyst. Ele formulou a lei de Boyle, rejeitou os clássicos "quatro elementos" e propôs uma alternativa mecanicista de átomos e reações químicas que poderiam ser submetidas a experimentos rigorosos.
Nas décadas seguintes, muitas descobertas importantes foram feitas, como a natureza do 'ar' que foi descoberto ser composto de muitos gases diferentes. O químico escocês Joseph Black e o flamengo Jan Baptist van Helmont descobriram o dióxido de carbono, ou o que Black chamou de 'ar fixo' em 1754; Henry Cavendish descobriu o hidrogênio e elucidou suas propriedades e Joseph Priestley e, independentemente, Carl Wilhelm Scheele isolaram o oxigênio puro. A teoria do flogisto (substância na raiz de toda combustão) foi proposta pelo alemão Georg Ernst Stahl no início do século XVIII e só foi derrubada no final do século pelo químico francês Antoine Lavoisier, análogo químico de Newton em física. Lavoisier fez mais do que qualquer outro para estabelecer a nova ciência em bases teóricas adequadas, elucidando o princípio da conservação da massa e desenvolvendo um novo sistema de nomenclatura química usado até hoje.
O cientista inglês John Dalton propôs a teoria moderna dos átomos; que todas as substâncias são compostas de 'átomos' da matéria e que átomos diferentes têm pesos atômicos variados.
O desenvolvimento da teoria eletroquímica das combinações químicas ocorreu no início do século XIX como resultado do trabalho de dois cientistas em particular, Jöns Jacob Berzelius e Humphry Davy, possibilitado pela invenção anterior da pilha voltaica por Alessandro Volta. Davy descobriu nove novos elementos, incluindo os metais alcalinos, extraindo-os de seus óxidos com corrente elétrica.
O britânico William Prout propôs pela primeira vez ordenar todos os elementos por seu peso atômico, pois todos os átomos tinham um peso que era um múltiplo exato do peso atômico do hidrogênio. J.A.R. Newlands criou uma tabela inicial de elementos, que foi então desenvolvida na tabela periódica moderna de elementos na década de 1860 por Dmitri Mendeleev e independentemente por vários outros cientistas, incluindo Julius Lothar Meyer. Os gases inertes, mais tarde chamados de gases nobres, foram descobertos por William Ramsay em colaboração com Lord Rayleigh no final do século, preenchendo assim a estrutura básica da tabela.
Na virada do século XX, os fundamentos teóricos da química foram finalmente compreendidos devido a uma série de descobertas notáveis que conseguiram sondar e descobrir a própria natureza da estrutura interna dos átomos. Em 1897, J.J. Thomson, da Universidade de Cambridge, descobriu o elétron e logo depois o cientista francês Becquerel e o casal Pierre e Marie Curie investigaram o fenômeno da radioatividade. Em uma série de experimentos pioneiros de espalhamento, Ernest Rutherford, da Universidade de Manchester, descobriu a estrutura interna do átomo e a existência do próton, classificou e explicou os diferentes tipos de radioatividade e transmutou com sucesso o primeiro elemento bombardeando o nitrogênio com partículas alfa.
Seu trabalho sobre estrutura atômica foi aprimorado por seus alunos, o físico dinamarquês Niels Bohr, o inglês Henry Moseley e o alemão Otto Hahn, que foram os pais da emergente química nuclear e descobriram a fissão nuclear. A teoria eletrônica de ligações químicas e orbitais moleculares foi desenvolvida pelos cientistas americanos Linus Pauling e Gilbert N. Lewis.
O ano de 2011 foi declarado pelas Nações Unidas como o Ano Internacional da Química. Foi uma iniciativa da União Internacional de Química Pura e Aplicada e da Organização das Nações Unidas para a Educação, Ciência e Cultura e envolve sociedades químicas, acadêmicos e instituições em todo o mundo e contou com iniciativas individuais para organizar atividades locais e regionais.
A química orgânica foi desenvolvida por Justus von Liebig e outros, seguindo a síntese de ureia de Friedrich Wöhler. Outros avanços cruciais do século XIX foram; uma compreensão da ligação de valência (Edward Frankland em 1852) e a aplicação da termodinâmica à química (J. W. Gibbs e Svante Arrhenius na década de 1870).
Prática
Subdisciplinas
A química é normalmente dividida em várias subdisciplinas principais. Existem também vários campos interdisciplinares principais e mais especializados da química.
- A química analítica é a análise de amostras de material para obter uma compreensão de sua composição química e estrutura. A química analítica incorpora métodos experimentais padronizados em química. Esses métodos podem ser usados em todas as subdisciplinas da química, excluindo a química puramente teórica.
- A bioquímica é o estudo dos produtos químicos, reações químicas e interações que ocorrem em organismos vivos. A bioquímica e a química orgânica estão estreitamente relacionadas, como na química medicinal ou na neuroquímica. A bioquímica também está associada à biologia molecular e genética.
- A química inorgânica é o estudo das propriedades e reações de compostos inorgânicos. A distinção entre disciplinas orgânicas e inorgânicas não é absoluta e há muita sobreposição, mais importante na subdisciplina da química organometálica.
- A química dos materiais é a preparação, caracterização e compreensão de substâncias com uma função útil. O campo é uma nova amplitude de estudo em programas de pós-graduação, e integra elementos de todas as áreas clássicas de química com foco em questões fundamentais que são únicas aos materiais. Os sistemas primários de estudo incluem a química de fases condensadas (sólidos, líquidos, polímeros) e interfaces entre diferentes fases.
- A neuroquímica é o estudo dos neuroquímicos, incluindo transmissores, peptídeos, proteínas, lipídios, açúcares e ácidos nucleicos; suas interações e os papéis que desempenham na formação, manutenção e modificação do sistema nervoso.
- A química nuclear é o estudo de como as partículas subatômicas se reúnem e fazem núcleos. A Transmutação Moderna é um grande componente da química nuclear, e a tabela de nuclides é um importante resultado e ferramenta para este campo.
- A química orgânica é o estudo da estrutura, propriedades, composição, mecanismos e reações de compostos orgânicos. Um composto orgânico é definido como qualquer composto baseado em um esqueleto de carbono.
- A química física é o estudo da base física e fundamental dos sistemas e processos químicos. Em particular, as energias e dinâmicas de tais sistemas e processos são de interesse para químicos físicos. As áreas importantes do estudo incluem termodinâmica química, cinética química, eletroquímica, mecânica estatística, espectroscopia e, mais recentemente, astroquímica. A química física tem grande sobreposição com a física molecular. A química física envolve o uso de cálculo infinitesimal em equações derivadas. É geralmente associado com química quântica e química teórica. A química física é uma disciplina distinta da física química, mas novamente, há sobreposição muito forte.
- A química teórica é o estudo da química através do raciocínio teórico fundamental (geralmente dentro da matemática ou física). Em particular, a aplicação da mecânica quântica à química é chamada de química quântica. Desde o final da Segunda Guerra Mundial, o desenvolvimento de computadores permitiu um desenvolvimento sistemático da química computacional, que é a arte de desenvolver e aplicar programas de computador para resolver problemas químicos. A química teórica tem grande sobreposição com física de matéria condensada (teórica e experimental) e física molecular.
Outras subdivisões incluem eletroquímica, femtoquímica, química de sabor, química de fluxo, imunohistoquímica, química de hidrogenação, química matemática, mecânica molecular, química de produtos naturais, química organometálica, petroquímica, fotoquímica, química orgânica física, química de polímeros, radioquímica, sonoquímica, supramolecular química, química sintética e muitas outras.
Interdisciplinar
Campos interdisciplinares incluem agroquímica, astroquímica (e cosmoquímica), química atmosférica, engenharia química, biologia química, quimioinformática, química ambiental, geoquímica, química verde, imunoquímica, química marinha, ciência dos materiais, mecanoquímica, química medicinal, biologia molecular, nanotecnologia, enologia, farmacologia, fitoquímica, química do estado sólido, ciência de superfície, termoquímica e muitas outras.
Indústria
A indústria química representa uma importante atividade econômica mundial. Os 50 maiores produtores químicos globais em 2013 tiveram vendas de US$ 980,5 bilhões com uma margem de lucro de 10,3%.
Sociedades profissionais
- American Chemical Society
- Sociedade Americana de Neuroquímica
- Instituto de Química do Canadá
- Sociedade Química do Peru
- União Internacional de Química Pura e Aplicada
- Real Australian Chemical Institute
- Royal Netherlands Chemical Society
- Sociedade Real de Química
- Sociedade da Indústria Química
- Associação Mundial de Chemistas Teóricos e Computacionais
- Lista de sociedades químicas
Contenido relacionado
Berilo
Aspartame
Alcalóide