Nitroglicerina
Nitroglicerina (NG), (grafia alternativa de nitroglicerina) também conhecida como trinitroglicerina (TNG), nitro, trinitrato de glicerilo (GTN), ou 1,2,3-trinitroxipropano, é um denso, incolor, líquido oleoso e explosivo mais comumente produzido pela nitração de glicerol com ácido nítrico fumegante branco sob condições apropriadas para a formação do éster de ácido nítrico. Quimicamente, a substância é um composto de nitrato orgânico em vez de um composto nitro, mas o nome tradicional é mantido. Inventada em 1847 por Ascanio Sobrero, a nitroglicerina tem sido desde então utilizada como ingrediente ativo no fabrico de explosivos, nomeadamente a dinamite, e como tal é utilizada nas indústrias da construção, demolição e mineração. Desde a década de 1880, tem sido usado pelos militares como ingrediente ativo e gelatinizante para nitrocelulose em alguns propelentes sólidos, como cordita e balistita. É um componente importante em propulsores sem fumaça de base dupla usados por recarregadores. Combinadas com nitrocelulose, centenas de combinações de pólvora são usadas por rifles, pistolas e recarregadores de espingarda.
A nitroglicerina é usada há mais de 130 anos na medicina como um potente vasodilatador (dilatação do sistema vascular) para tratar problemas cardíacos, como angina pectoris e insuficiência cardíaca crônica. Embora se soubesse anteriormente que esses efeitos benéficos se deviam à conversão da nitroglicerina em óxido nítrico, um potente venodilatador, a enzima para essa conversão só foi descoberta em 2002 como aldeído desidrogenase mitocondrial (ALDH2). A nitroglicerina está disponível em comprimidos sublinguais, sprays, pomadas e adesivos.
História
A nitroglicerina foi o primeiro explosivo prático produzido que era mais forte que a pólvora negra. Foi sintetizado pela primeira vez pelo químico italiano Ascanio Sobrero em 1847, trabalhando com Théophile-Jules Pelouze na Universidade de Torino. Sobrero inicialmente chamou sua descoberta de piroglicerina e advertiu vigorosamente contra seu uso como explosivo.
A nitroglicerina foi posteriormente adotada como um explosivo comercialmente útil por Alfred Nobel, que experimentou maneiras mais seguras de lidar com o composto perigoso depois que seu irmão mais novo, Emil Oskar Nobel, e vários trabalhadores da fábrica foram mortos em uma explosão no Nobels'. fábrica de armamentos em 1864 em Heleneborg, Suécia.
Um ano depois, Nobel fundou a Alfred Nobel and Company na Alemanha e construiu uma fábrica isolada nas colinas Krümmel de Geesthacht, perto de Hamburgo. Este negócio exportava uma combinação líquida de nitroglicerina e pólvora chamada "Blasting Oil", mas isso era extremamente instável e difícil de manusear, como evidenciado em inúmeras catástrofes. Os edifícios da fábrica Krümmel foram destruídos duas vezes.
Em abril de 1866, várias caixas de nitroglicerina foram enviadas para a Califórnia, três das quais foram destinadas à Central Pacific Railroad, que planejava experimentá-la como um explosivo para acelerar a construção de 1.659 pés de comprimento (506 m) Túnel Summit através das montanhas de Sierra Nevada. Uma das caixas restantes explodiu, destruindo um escritório da empresa Wells Fargo em San Francisco e matando 15 pessoas. Isso levou à proibição total do transporte de nitroglicerina líquida na Califórnia. A fabricação local de nitroglicerina foi, portanto, necessária para a perfuração e detonação de rochas duras restantes necessárias para a conclusão da primeira ferrovia transcontinental na América do Norte.
No dia de Natal de 1867, uma tentativa de se livrar de nove latas de Blasting Oil que haviam sido armazenadas ilegalmente no White Swan Inn, no centro de Newcastle upon Tyne, resultou em uma explosão em Town Moor que matou oito pessoas. Em junho de 1869, dois vagões de uma tonelada carregados com nitroglicerina, então conhecido localmente como Powder-Oil, explodiram na estrada na vila de Cwm-y-glo, no norte do País de Gales. A explosão causou a perda de seis vidas, muitos feridos e muitos danos à aldeia. Poucos vestígios foram encontrados dos dois cavalos. O governo do Reino Unido ficou tão alarmado com os danos causados e com o que poderia ter acontecido em um local da cidade (essas duas toneladas faziam parte de uma carga maior vinda da Alemanha via Liverpool) que logo aprovou o Nitro-Glycerine Act de 1869. A nitroglicerina líquida foi amplamente banido em outros lugares também, e essas restrições legais levaram Alfred Nobel e sua empresa a desenvolver dinamite em 1867. Isso foi feito misturando nitroglicerina com terra de diatomáceas ("Kieselguhr& #34; em alemão) encontrado nas colinas de Krümmel. Misturas semelhantes, como "dualinas" (1867), "lithofracteur" (1869) e "gelignite" (1875), foram formados pela mistura de nitroglicerina com outros absorventes inertes, e muitas combinações foram tentadas por outras empresas na tentativa de contornar as patentes de dinamite mantidas pela Nobel.
As misturas de dinamite contendo nitrocelulose, que aumenta a viscosidade da mistura, são comumente conhecidas como "gelatinas".
Após a descoberta de que o nitrito de amila ajudava a aliviar a dor no peito, o médico William Murrell experimentou o uso de nitroglicerina para aliviar a angina pectoris e reduzir a pressão arterial. Ele começou a tratar seus pacientes com pequenas doses diluídas de nitroglicerina em 1878, e esse tratamento logo foi amplamente adotado depois que Murrell publicou seus resultados na revista The Lancet em 1879. Alguns meses antes de sua morte em Em 1896, Alfred Nobel receitou nitroglicerina para este problema cardíaco, escrevendo a um amigo: "Não é a ironia do destino que me prescreveram nitroglicerina, para ser tomada internamente!" Eles chamam de Trinitrin, para não assustar o químico e o público." O estabelecimento médico também usou o nome "trinitrato de glicerila" pela mesma razão.
Taxas de produção em tempo de guerra
Grandes quantidades de nitroglicerina foram fabricadas durante a Primeira Guerra Mundial e a Segunda Guerra Mundial para uso como propulsores militares e em trabalhos de engenharia militar. Durante a Primeira Guerra Mundial, a HM Factory, Gretna, a maior fábrica de propulsores do Reino Unido, produziu cerca de 800 toneladas de cordite RDB por semana. Essa quantidade exigia pelo menos 336 toneladas de nitroglicerina por semana (supondo que não houvesse perdas na produção). A Royal Navy tinha sua própria fábrica na Royal Navy Cordite Factory, Holton Heath, em Dorset, Inglaterra. Uma grande fábrica de cordita também foi construída no Canadá durante a Primeira Guerra Mundial. A fábrica de cordita da Canadian Explosives Limited em Nobel, Ontário, foi projetada para produzir 1.500.000 lb (680 t) de cordita por mês, exigindo cerca de 286 toneladas de nitroglicerina por mês.
Instabilidade e dessensibilização
Em sua forma não diluída, a nitroglicerina é um explosivo de contato, com choque físico causando sua explosão. Se não for adequadamente purificado durante a fabricação, pode se degradar com o tempo para formas ainda mais instáveis. Isso torna a nitroglicerina altamente perigosa para transportar ou usar. Em sua forma não diluída, é um dos explosivos mais poderosos do mundo, comparável ao RDX e PETN desenvolvidos mais recentemente.
No início de sua história, descobriu-se que a nitroglicerina líquida era "dessensibilizada" congelando-o a uma temperatura abaixo de 45 a 55 °F (7 a 13 °C), dependendo de sua pureza. A sua sensibilidade ao choque quando congelado é algo imprevisível: "É mais insensível ao choque de um boné fulminado ou de uma bala de espingarda quando está nesta condição, mas por outro lado parece estar mais sujeito a explodir ao quebrar, esmagar, compactação, etc." A nitroglicerina congelada é muito menos energética que a líquida e, portanto, deve ser descongelada antes do uso. Descongelá-lo pode ser extremamente sensibilizante, especialmente se houver impurezas ou se o aquecimento for muito rápido. Dinitrato de etileno glicol ou outro polinitrato pode ser adicionado para diminuir o ponto de fusão e, assim, evitar a necessidade de descongelar o explosivo congelado.
Quimicamente "dessensibilizante" a nitroglicerina é possível a um ponto em que pode ser considerada "segura" como altos explosivos modernos, como pela adição de etanol, acetona ou dinitrotolueno. A nitroglicerina pode ter que ser extraída do dessensibilizante químico para restaurar sua eficácia antes do uso, por exemplo, adicionando água para retirar o etanol usado como dessensibilizante.
Detonação
A velocidade de detonação da nitroglicerina é de 7820 metros por segundo, que é cerca de 113% da velocidade do TNT. Consequentemente, a nitroglicerina é considerada um explosivo de alta brisa, ou seja, possui excelente capacidade de estilhaçamento. O calor liberado durante a detonação eleva a temperatura dos subprodutos gasosos para cerca de 5.000 °C (9.000 °F). Com uma entalpia padrão de decomposição explosiva de −1414 kJ/mol e um peso molecular de 227,0865 g/mol, a nitroglicerina tem uma densidade de energia explosiva específica de 1,488 quilocalorias por grama, ou 6,23 kJ/g, tornando a nitroglicerina 49% mais energética em um base de massa do que o valor de definição padrão atribuído ao TNT (precisamente 1 kcal/g).
Fabricação
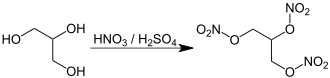
A nitroglicerina pode ser produzida por nitração catalisada por ácido do glicerol (glicerina).
O processo de fabricação industrial frequentemente reage o glicerol com uma mistura de quase 1:1 de ácido sulfúrico concentrado e ácido nítrico concentrado. Isso pode ser produzido pela mistura de ácido nítrico fumegante branco - um ácido nítrico puro bastante caro no qual os óxidos de nitrogênio foram removidos, em oposição ao ácido nítrico fumegante vermelho, que contém óxidos de nitrogênio - e ácido sulfúrico concentrado. Mais frequentemente, essa mistura é obtida pelo método mais barato de misturar ácido sulfúrico fumegante, também conhecido como oleum - ácido sulfúrico contendo excesso de trióxido de enxofre - e ácido nítrico azeotrópico (consistindo de cerca de 70% de ácido nítrico, sendo o restante água).
O ácido sulfúrico produz espécies de ácido nítrico protonadas, que são atacadas pelos átomos nucleofílicos de oxigênio do glicerol. O grupo nitro é então adicionado como um éster C−O−NO2 e a água é produzida. Isso é diferente de uma reação de substituição aromática eletrofílica na qual os íons nitrônio são o eletrófilo.
A adição de glicerol resulta em uma reação exotérmica (ou seja, calor é produzido), como de costume para nitrações de ácidos mistos. Se a mistura ficar muito quente, resulta em uma reação descontrolada, um estado de nitração acelerada acompanhado pela oxidação destrutiva de materiais orgânicos pelo ácido nítrico quente e a liberação de gás venenoso de dióxido de nitrogênio com alto risco de explosão. Assim, a mistura de glicerina é adicionada lentamente ao recipiente de reação contendo o ácido misturado (não ácido para glicerina). O nitrador é resfriado com água fria ou alguma outra mistura de refrigerante e mantido durante a adição de glicerina a cerca de 22 °C (72 °F), quente o suficiente para que a esterificação ocorra em uma taxa rápida, mas frio o suficiente para evitar uma reação descontrolada. O vaso nitrador, muitas vezes construído de ferro ou chumbo e geralmente agitado com ar comprimido, tem um alçapão de emergência em sua base, que paira sobre uma grande poça de água muito fria e na qual toda a mistura de reação (chamada de carga) pode ser despejado para evitar uma explosão, um processo conhecido como afogamento. Se a temperatura da carga exceder cerca de 30 °C (86 °F) (o valor real varia de acordo com o país) ou fumaça marrom for observada na ventilação do nitrador, ela será imediatamente afogada.
Uso como explosivo e propulsor
O principal uso da nitroglicerina, por tonelagem, é em explosivos como dinamite e em propelentes.
A nitroglicerina é um líquido oleoso que pode explodir quando submetido a calor, choque ou chama.
Alfred Nobel desenvolveu o uso de nitroglicerina como um explosivo de detonação misturando nitroglicerina com absorventes inertes, particularmente "Kieselgur", ou terra de diatomáceas. Ele nomeou essa dinamite explosiva e a patenteou em 1867. Ela era fornecida pronta para uso na forma de bastões, embalados individualmente em papel impermeável untado. Dinamite e explosivos semelhantes foram amplamente adotados para tarefas de engenharia civil, como na perfuração de túneis rodoviários e ferroviários, para mineração, para limpar terras agrícolas de tocos, em pedreiras e em trabalhos de demolição. Da mesma forma, engenheiros militares usaram dinamite para trabalhos de construção e demolição.
A nitroglicerina também foi usada como ingrediente em propelentes militares para uso em armas de fogo.
A nitroglicerina tem sido usada em conjunto com fraturamento hidráulico, um processo usado para recuperar petróleo e gás de formações de xisto. A técnica envolve o deslocamento e detonação de nitroglicerina em sistemas de fraturas naturais ou induzidas hidraulicamente, ou o deslocamento e detonação de nitroglicerina em fraturas induzidas hidraulicamente seguidas de tiros de furo de poço usando TNT peletizado.
A nitroglicerina tem uma vantagem sobre alguns outros explosivos de alta potência que, na detonação, praticamente não produz fumaça visível. Portanto, é útil como ingrediente na formulação de vários tipos de pó sem fumaça.
Sua sensibilidade limitou a utilidade da nitroglicerina como explosivo militar, e explosivos menos sensíveis, como TNT, RDX e HMX, a substituíram amplamente em munições. Continua sendo importante na engenharia militar, e os engenheiros de combate ainda usam dinamite.
Alfred Nobel então desenvolveu a balistita, combinando nitroglicerina e guncotton. Ele a patenteou em 1887. A balistita foi adotada por vários governos europeus como propulsor militar. A Itália foi a primeira a adotá-lo. Em vez disso, o governo britânico e os governos da Commonwealth adotaram cordite, que havia sido desenvolvido por Sir Frederick Abel e Sir James Dewar, do Reino Unido, em 1889. O Cordite Mk I original consistia em 58% de nitroglicerina, 37% de guncotton e 5,0% de vaselina. A balistita e a cordita eram ambas fabricadas na forma de "cordões".
Os pós sem fumaça foram originalmente desenvolvidos usando nitrocelulose como único ingrediente explosivo. Portanto, eles eram conhecidos como propelentes de base única. Uma variedade de pós sem fumaça que contém nitrocelulose e nitroglicerina, conhecidos como propelentes de base dupla, também foi desenvolvida. Os pós sem fumaça foram originalmente fornecidos apenas para uso militar, mas logo foram desenvolvidos para uso civil e foram rapidamente adotados para esportes. Alguns são conhecidos como pós esportivos. Os propulsores de base tripla contêm nitrocelulose, nitroglicerina e nitroguanidina, mas são reservados principalmente para cartuchos de munição de calibre extremamente alto, como os usados em canhões de tanques e artilharia naval. A gelatina de jateamento, também conhecida como gelignite, foi inventada por Nobel em 1875, usando nitroglicerina, polpa de madeira e nitrato de sódio ou potássio. Este foi um explosivo inicial, de baixo custo e flexível.
Uso medicinal
A nitroglicerina pertence a um grupo de medicamentos denominados nitratos, que inclui muitos outros nitratos como o dinitrato de isossorbida (Isordil) e o mononitrato de isossorbida (Imdur, Ismo, Monoket). Todos esses agentes exercem seu efeito ao serem convertidos em óxido nítrico no corpo pela aldeído desidrogenase mitocondrial (ALDH2), e o óxido nítrico é um potente vasodilatador natural.
Na medicina, a nitroglicerina é provavelmente mais comumente prescrita para angina pectoris, um sintoma doloroso de doença cardíaca isquêmica causada pelo fluxo inadequado de sangue e oxigênio para o coração e como um potente agente anti-hipertensivo. A nitroglicerina corrige o desequilíbrio entre o fluxo de oxigênio e sangue para o coração e a demanda de energia do coração. Existem muitas formulações no mercado em diferentes dosagens. Em doses baixas, a nitroglicerina dilata mais as veias do que as artérias, reduzindo assim a pré-carga (volume de sangue no coração após o enchimento); acredita-se que este seja seu principal mecanismo de ação. Ao diminuir a pré-carga, o coração tem menos sangue para bombear, o que diminui a necessidade de oxigênio, já que o coração não precisa trabalhar tanto. Além disso, ter uma pré-carga menor reduz a pressão transmural ventricular (pressão exercida nas paredes do coração), o que diminui a compressão das artérias do coração para permitir que mais sangue flua pelo coração. Em doses mais altas, também dilata as artérias, reduzindo assim a pós-carga (diminuindo a pressão contra a qual o coração deve bombear). Uma proporção melhorada de demanda de oxigênio miocárdico para oferta leva aos seguintes efeitos terapêuticos durante os episódios de angina pectoris: diminuição da dor torácica, diminuição da pressão arterial, aumento da frequência cardíaca e hipotensão ortostática. Os pacientes que sofrem de angina ao realizar certas atividades físicas geralmente podem prevenir os sintomas tomando nitroglicerina 5 a 10 minutos antes da atividade. Overdoses podem gerar metemoglobinemia.
A nitroglicerina está disponível em comprimidos, pomada, solução para uso intravenoso, adesivos transdérmicos ou sprays administrados por via sublingual. Algumas formas de nitroglicerina duram muito mais tempo no corpo do que outras. A nitroglicerina, assim como o início e a duração da ação de cada forma, é diferente. O spray sublingual ou comprimido de nitroglicerina tem início de ação de dois minutos e duração de ação de vinte e cinco minutos. A formulação oral de nitroglicerina tem um início de ação de trinta e cinco minutos e uma duração de ação de 4-8 horas. O adesivo transdérmico tem um início de ação de trinta minutos e uma duração de ação de dez a doze horas. Foi demonstrado que a exposição contínua a nitratos faz com que o corpo pare de responder normalmente a este medicamento. Os especialistas recomendam que os adesivos sejam removidos à noite, permitindo ao corpo algumas horas para restaurar sua capacidade de resposta aos nitratos. Preparações de nitroglicerina de ação mais curta podem ser usadas várias vezes ao dia com menos risco de desenvolver tolerância. A nitroglicerina foi usada pela primeira vez por William Murrell para tratar ataques de angina em 1878, com a descoberta publicada no mesmo ano.
Exposição industrial
A exposição pouco frequente a altas doses de nitroglicerina pode causar fortes dores de cabeça conhecidas como "cabeça NG" ou "cabeça de estrondo". Essas dores de cabeça podem ser graves o suficiente para incapacitar algumas pessoas; no entanto, os humanos desenvolvem tolerância e dependência da nitroglicerina após exposição prolongada. Embora rara, a abstinência pode ser fatal. Os sintomas de abstinência incluem dor no peito e outros problemas cardíacos. Esses sintomas podem ser aliviados com a reexposição à nitroglicerina ou outros nitratos orgânicos adequados.
Para trabalhadores em fábricas de nitroglicerina (NTG), os efeitos da abstinência às vezes incluem "ataques cardíacos aos domingos" naqueles que sofrem exposição regular à nitroglicerina no local de trabalho, levando ao desenvolvimento de tolerância aos efeitos venodilatadores. No fim de semana, os trabalhadores perdem a tolerância e, quando são reexpostos na segunda-feira, a vasodilatação drástica produz batimentos cardíacos acelerados, tontura e dor de cabeça. Isso é conhecido como "doença de segunda-feira"
As pessoas podem ser expostas à nitroglicerina no local de trabalho por inalação, absorção pela pele, ingestão ou contato com os olhos. A Occupational Safety and Health Administration definiu o limite legal (limite de exposição permitido) para exposição à nitroglicerina no local de trabalho como 0,2 ppm (2 mg/m3) de exposição da pele durante um dia de trabalho de 8 horas. O Instituto Nacional de Segurança e Saúde Ocupacional estabeleceu um limite de exposição recomendado de 0,1 mg/m3 exposição da pele durante um dia de trabalho de 8 horas. Em níveis de 75 mg/m3, a nitroglicerina é imediatamente perigosa para a vida e a saúde.
Contenido relacionado
Célula eletroquímica
Cristal
Processo endotérmico
Isomeria cis-trans
Hélio