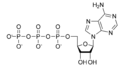
Monofosfato de adenosina cíclico
Monofosfato de adenosina cíclico (cAMP, AMP cíclico ou 3',5'-monofosfato de adenosina cíclico ) é um segundo mensageiro, ou sinal celular que ocorre dentro das células, que é importante em muitos processos biológicos. O cAMP é um derivado do trifosfato de adenosina (ATP) e usado para transdução de sinal intracelular em muitos organismos diferentes, conduzindo a via dependente de cAMP.
História
Earl Sutherland, da Vanderbilt University, ganhou o Prêmio Nobel de Fisiologia ou Medicina em 1971 "por suas descobertas sobre os mecanismos de ação dos hormônios", especialmente a epinefrina, por meio de segundos mensageiros (como o monofosfato de adenosina cíclico, AMP cíclico).
Síntese
O AMP cíclico é sintetizado a partir do ATP pela adenilato ciclase localizada no lado interno da membrana plasmática e ancorada em vários locais no interior da célula. A adenilato ciclase é ativada por uma série de moléculas de sinalização por meio da ativação de receptores acoplados à proteína G (Gs) estimuladores da adenilato ciclase. A adenilato ciclase é inibida por agonistas dos receptores acoplados à proteína G inibitória da adenilato ciclase (Gi). A adenilato ciclase hepática responde mais fortemente ao glucagon, e a adenilato ciclase muscular responde mais fortemente à adrenalina.
A decomposição do cAMP em AMP é catalisada pela enzima fosfodiesterase.Funções
cAMP é um segundo mensageiro, usado para transdução de sinal intracelular, como transferir para as células os efeitos de hormônios como glucagon e adrenalina, que não podem passar pela membrana plasmática. Também está envolvido na ativação de proteínas quinases. Além disso, o cAMP se liga e regula a função de canais iônicos, como os canais HCN e algumas outras proteínas de ligação a nucleotídeos cíclicos, como Epac1 e RAPGEF2.
Papel em células eucarióticas
O cAMPestá associado à função das quinases em vários processos bioquímicos, incluindo a regulação do glicogênio, açúcar e metabolismo lipídico.
Nos eucariotos, o AMP cíclico funciona ativando a proteína quinase A (PKA, ou proteína quinase dependente de cAMP). A PKA é normalmente inativa como uma holoenzima tetramérica, consistindo em duas unidades catalíticas e duas reguladoras (C 2 r 2 ), com as unidades regulatórias bloqueando os centros catalíticos das unidades catalíticas.
AMP cíclica se liga a locais específicos nas unidades regulatórias da proteína quinase e causa dissociação entre as subunidades regulatórias e catalíticas, permitindo assim as unidades catalíticas das proteínas do substrato fosforilato.
As subunidades ativas catalisam a transferência de fosfato de ATP para resíduos específicos de serina ou treonina de substratos proteicos. As proteínas fosforiladas podem atuar diretamente nos canais de íons da célula ou inibidos ou inibidos. A proteína quinase A também pode fosforilar proteínas específicas que se ligam às regiões promotoras de DNA, causando aumentos na transcrição. Nem todas as proteínas quinases respondem ao acampamento. Várias classes de proteínas quinases, incluindo a proteína quinase C, não são dependentes do cAMP.
Além disso, os efeitos dependem principalmente da proteína quinase dependente de cAMP, que variam com base no tipo de célula.
Ainda, existem algumas pequenas funções independentes de PKA de cAMP, por exemplo, ativação dos canais de cálcio, fornecendo uma via menor pela qual o hormônio liberador de hormônios do crescimento causa uma liberação do hormônio do crescimento.
No entanto, a visão de que a maioria dos efeitos do acampamento é controlada pela PKA é desatualizada. Em 1998, foi descoberta uma família de proteínas sensíveis ao cAMP com atividade do fator de troca de nucleotídeos de guanina (GEF). Essas são denominadas proteínas de troca ativadas pelo CAMP (EPAC) e a família compreende EPAC1 e EPAC2. O mecanismo de ativação é semelhante ao do PKA: o domínio GEF é geralmente mascarado pela região N-terminal que contém o domínio de ligação do cAMP. Quando o CAMP se liga, o domínio se dissocia e expõe o domínio GEF agora ativo, permitindo que o EPAC ativasse pequenas proteínas GTPase do tipo Ras, como o RAP1.
Papel adicional do acampamento secretado em amebas sociais
Nas espécies dictyostelium discoideum , o acampamento atua fora da célula como um sinal secretado. A agregação quimiotática de células é organizada por ondas periódicas de cAMP que se propagam entre as células em distâncias tão grandes quanto vários centímetros. As ondas são o resultado de uma produção e secreção regulamentadas de campo extracelular e um oscilador biológico espontâneo que inicia as ondas em centros de territórios.
Papel em bactérias
Nas bactérias, o nível de acampamento varia dependendo do meio usado para o crescimento. Em particular, o acampamento é baixo quando a glicose é a fonte de carbono. Isso ocorre através da inibição da enzima produtora de cAMP, adenilato ciclase, como efeito colateral do transporte de glicose para a célula. A proteína do receptor de cAMP do fator de transcrição (PCR) também chamada CAP (proteína ativadora do gene de catabolito) forma um complexo com cAMP e, assim, é ativado para se ligar ao DNA. O CRP-CAMP aumenta a expressão de um grande número de genes, incluindo algumas enzimas que codificam que podem fornecer energia independente da glicose.
O acampamento, por exemplo, está envolvido na regulamentação positiva do lac operon. Em um ambiente com baixa concentração de glicose, o acampamento se acumula e se liga ao local alostérico na PCR (proteína do receptor de cAMP), uma proteína ativadora da transcrição. A proteína assume sua forma ativa e se liga a um local específico a montante do promotor LAC, facilitando que a RNA polimerase se ligasse ao promotor adjacente para iniciar a transcrição do operon lac, aumentando a taxa de transcrição lac operon. Com uma alta concentração de glicose, a concentração de cAMP diminui e a PCR se desengage do operon lac.
Patologia
Como o AMP cíclico é um segundo mensageiro e desempenha um papel vital na sinalização celular, ele foi implicado em vários distúrbios, mas não restrito aos papéis abaixo:
Papel no carcinoma humano
Algumas pesquisas sugeriram que uma desregulamentação das vias de acampamento e uma ativação aberrante de genes controlados pelo cAMP estão ligados ao crescimento de alguns tipos de câncer.
Papel nos distúrbios do córtex pré -frontal
Pesquisas recentes sugerem que o CAMP afeta a função do pensamento de ordem superior no córtex pré-frontal através de sua regulação de canais de íons chamados canais de nucleotídeos cíclicos ativados por hiperpolarização (HCN). Quando o acampamento estimula o HCN, os canais se abrem, fechando a célula cerebral para comunicar e, assim, interferir na função do córtex pré -frontal. Esta pesquisa, especialmente os déficits cognitivos em doenças relacionadas à idade e no TDAH, é de interesse dos pesquisadores que estudam o cérebro.
O acampamento está envolvido na ativação do sistema trigeminocervical, levando a inflamação neurogênica e causando enxaqueca.
Papel em agentes de doenças infecciosas ' Patogênese
O funcionamento interrompido do CAMP foi observado como um dos mecanismos de várias exotoxinas bacterianas.
Eles podem ser subgrupos em duas categorias distintas:
- Toxinas que interferem nas enzimas ADP-ribosyl-transferases, e
- ciclases invasivas de adenilato.
toxinas relacionadas a ADP-ribosil-transferases
- Toxina de cólera é uma toxina AB que tem cinco subunidades B e uma subunidade A. A toxina atua pelo seguinte mecanismo: Primeiro, o anel de subunidade B da toxina cólera liga-se a gangliosídeos GM1 na superfície das células-alvo. Se uma célula não tem GM1 a toxina provavelmente se liga a outros tipos de glicanos, como Lewis Y e Lewis X, anexado a proteínas em vez de lipídios.
Usos
Forskolin é comumente usado como uma ferramenta em bioquímica para aumentar os níveis de cAMP no estudo e pesquisa da fisiologia celular.
Imagens adicionais
Contenido relacionado
DNA ligase
Kary Mullis
Adenilil ciclase
Eletroforese em gel
Enzima