Microscópio eletrônico
Um microscópio eletrônico é um microscópio que usa um feixe de elétrons acelerados como fonte de iluminação. Como o comprimento de onda de um elétron pode ser até 100.000 vezes menor que o dos fótons de luz visível, os microscópios eletrônicos têm um poder de resolução maior do que os microscópios de luz e podem revelar a estrutura de objetos menores. Um microscópio eletrônico de transmissão de varredura alcançou resolução melhor que 50 pm no modo de imagem de campo escuro anular e ampliações de até cerca de 10.000.000 ×, enquanto a maioria dos microscópios de luz é limitada por difração a cerca de 200 nm de resolução e ampliações úteis abaixo de 2.000 ×.
Os microscópios eletrônicos usam campos magnéticos moldados para formar sistemas de lentes ópticas eletrônicas que são análogos às lentes de vidro de um microscópio óptico de luz.
Os microscópios eletrônicos são usados para investigar a ultraestrutura de uma ampla gama de espécimes biológicos e inorgânicos, incluindo microorganismos, células, moléculas grandes, amostras de biópsia, metais e cristais. Industrialmente, os microscópios eletrônicos são freqüentemente usados para controle de qualidade e análise de falhas. Microscópios eletrônicos modernos produzem micrografias eletrônicas usando câmeras digitais especializadas e captadores de quadros para capturar as imagens.
História
Fundamentos teóricos
Em 1924, o físico Louis de Broglie (Prêmio Nobel, 1929) afirmou que elétrons moderadamente acelerados devem apresentar uma onda associada, e calculou seu comprimento de onda, que seria da ordem dos raios X no espectro eletromagnético. Isso foi posteriormente confirmado pelo experimento de Davisson-Germer em 1927, fornecendo os princípios teóricos que tornam possível o microscópio eletrônico.
Embora os raios X não possam ser desviados por meios ópticos, os elétrons em movimento podem ser, usando campos eletromagnéticos como uma espécie de lentes, que podem ser dispostos como em um microscópio óptico padrão. Um dispositivo eletrônico construído adequadamente poderia, então, ser capaz de focar o feixe de elétrons em uma amostra para estudá-la.
Desenvolvimentos práticos
Em 1926, Hans Busch desenvolveu a lente eletromagnética.
Segundo Dennis Gabor, o físico Leó Szilárd tentou em 1928 convencê-lo a construir um microscópio eletrônico, para o qual ele havia registrado uma patente. O primeiro protótipo de microscópio eletrônico, capaz de ampliação de quatrocentas potências, foi desenvolvido em 1931 pelo físico Ernst Ruska e pelo engenheiro elétrico Max Knoll na Berlin Technische Hochschule ou Universidade Técnica de Berlim. O aparelho foi a primeira demonstração prática dos princípios da microscopia eletrônica. Em maio do mesmo ano, Reinhold Rudenberg, diretor científico da Siemens-Schuckertwerke, obteve a patente de um microscópio eletrônico. Em 1932, Ernst Lubcke da Siemens & Halske construiu e obteve imagens de um protótipo de microscópio eletrônico, aplicando os conceitos descritos na patente de Rudenberg.
No ano seguinte, 1933, Ruska construiu o primeiro microscópio eletrônico que excedia a resolução atingível com um microscópio óptico (de luz). Quatro anos depois, em 1937, a Siemens financiou o trabalho de Ernst Ruska e Bodo von Borries e contratou Helmut Ruska, irmão de Ernst, para desenvolver aplicações para o microscópio, especialmente com espécimes biológicos. Também em 1937, Manfred von Ardenne foi pioneiro no microscópio eletrônico de varredura. A Siemens produziu o primeiro microscópio eletrônico comercial em 1938. Os primeiros microscópios eletrônicos norte-americanos foram construídos em 1930, na Washington State University por Anderson e Fitzsimmons e na University of Toronto, por Eli Franklin Burton e os alunos Cecil Hall, James Hillier e Albert Prebus. A Siemens produziu um microscópio eletrônico de transmissão (TEM) em 1939. Embora os microscópios eletrônicos de transmissão atuais sejam capazes de ampliação de dois milhões de potência, como instrumentos científicos, eles permanecem baseados no protótipo de Ruska.
Princípio físico
Em uma arma eletrônica típica, elétrons individuais, que têm uma carga elementar eNão. (sobre - Sim. - Sim. 1.6× × 10.- Sim. - Sim. 19{displaystyle -1.6times 10^{-19}} coulombs) e uma massa mNão. (sobre 9.1× × 10.- Sim. - Sim. 31{displaystyle 9.1times 10^{-31}}kg), sob uma diferença potencial de VNão. volts, uma quantidade de energia de e)) V- Sim. joules é transferido para cada um deles, que absorvem inteiramente como energia cinética, EKK= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1⁄2mv2Não. E_{text{K}}={text{1⁄2}}mv^{2}} (assumindo mecânica não-relativista) e começar a se mover em uma velocidade vNão.. Assim, sendo
- eV= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =EKKEV=E_{text{K}}},
então v= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =2eV/m{displaystyle v={sqrt {2eV/m}}}.
Para uma tensão de V= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =100.V{displaystyle V=100{text{V}}}, isto dá uma velocidade de aproximadamente v= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =6× × 10.6{displaystyle v=6times 10^{6}}M/s.
De acordo com De Broglie, o comprimento de onda associado (não-relativista) λ λ - Sim. para um impulso p= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =mv- Sim. o
- λ λ = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =hp= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =hmv{displaystyle lambda ={frac Não. Não.,
estar sendo hNão. a constante Planck (sobre 6.626× × 10.- Sim. - Sim. 34{displaystyle 6.626times 10^{-34}}Assim,
- λ λ = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =h2meV{displaystyle lambda ={frac {h}{sqrt {2meV}}}}}},
assim para a tensão dita dá um comprimento de onda de aproximadamente λ λ = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1.228× × 10.- Sim. - Sim. 10.{displaystyle lambda =1.228times 10^{-10}} metros, ou 0,1228 nm, bem abaixo do comprimento de onda violeta visível (380 nm), no domínio de raios X suaves.
Observe que tensões mais altas aceleram elétrons até efeitos relativísticos perceptíveis. Então, a seguinte expressão deve ser usada em seu lugar:
- λ λ = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =hceV(2mc2+eV){displaystyle lambda ={frac {hc}{sqrt {eV(2mc^{2}+eV)}}}},
Onde? cNão. é a velocidade da luz no vácuo (sobre c= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =3× × 10.8{displaystyle c=3times 10^{8}}m/s). Veja a teoria da difração eletrônica (relativista) para uma explicação completa.
Tipos
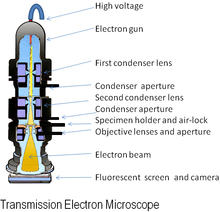
Microscópio eletrônico de transmissão (TEM)
A forma original do microscópio eletrônico, o microscópio eletrônico de transmissão (TEM), usa um feixe de elétrons de alta voltagem para iluminar a amostra e criar uma imagem. O feixe de elétrons é produzido por um canhão de elétrons, comumente equipado com um cátodo de filamento de tungstênio como fonte de elétrons. O feixe de elétrons é acelerado por um ânodo tipicamente em +100 keV (40 a 400 keV) em relação ao cátodo, focalizado por lentes eletrostáticas e eletromagnéticas e transmitido através da amostra que é em parte transparente para os elétrons e em parte os espalha. do feixe. Quando emerge do espécime, o feixe de elétrons carrega informações sobre a estrutura do espécime que são ampliadas pelo sistema de lentes objetivas do microscópio. A variação espacial nesta informação (a "imagem") pode ser visualizada projetando a imagem ampliada do elétron em uma tela de visualização fluorescente revestida com um material de fósforo ou cintilador, como sulfeto de zinco. Alternativamente, a imagem pode ser registrada fotograficamente expondo um filme ou placa fotográfica diretamente ao feixe de elétrons, ou um fósforo de alta resolução pode ser acoplado por meio de um sistema óptico de lente ou um guia de luz de fibra óptica ao sensor de um digital Câmera. A imagem detectada pela câmera digital pode ser exibida em um monitor ou computador.
A resolução dos TEMs é limitada principalmente pela aberração esférica, mas uma nova geração de corretores de hardware pode reduzir a aberração esférica para aumentar a resolução em microscopia eletrônica de transmissão de alta resolução (HRTEM) para menos de 0,5 angstrom (50 picômetros), permitindo ampliações acima de 50 milhões de vezes. A capacidade do HRTEM de determinar as posições dos átomos dentro dos materiais é útil para pesquisa e desenvolvimento de nanotecnologias.
Microscópios eletrônicos de transmissão são frequentemente usados no modo de difração de elétrons. As vantagens da difração de elétrons sobre a cristalografia de raios-X são que o espécime não precisa ser um único cristal ou mesmo um pó policristalino, e também que a reconstrução da transformada de Fourier da estrutura ampliada do objeto ocorre fisicamente e, portanto, evita a necessidade de resolvendo o problema de fase enfrentado pelos cristalógrafos de raios-X após a obtenção de seus padrões de difração de raios-X.
Uma grande desvantagem do microscópio eletrônico de transmissão é a necessidade de seções extremamente finas das amostras, normalmente cerca de 100 nanômetros. A criação dessas seções finas para espécimes biológicos e de materiais é tecnicamente muito desafiadora. Seções finas de semicondutores podem ser feitas usando um feixe de íons focado. Espécimes de tecido biológico são fixados quimicamente, desidratados e embutidos em uma resina de polímero para estabilizá-los o suficiente para permitir o corte ultrafino. Seções de espécimes biológicos, polímeros orgânicos e materiais semelhantes podem exigir coloração com marcadores de átomos pesados para obter o contraste de imagem necessário.
Microscópio eletrônico de seção serial (ssEM)
Uma aplicação do TEM é a microscopia eletrônica de seção serial (ssEM), por exemplo, na análise da conectividade em amostras volumétricas de tecido cerebral por imagens de muitas seções finas em sequência. Isso pode ser obtido pela introdução de um método de fresagem no pipeline de imagem, pelo qual fatias sucessivas de um volume 3D são expostas ao feixe e geradas. Esses métodos incluem SEM de face de bloco serial (SB-SEM) e SEM de feixe de íons focalizado (FIB-SEM). O pré-processamento de volumes para criar muitas fatias cujas imagens são geradas de maneira automatizada alcançou recentemente imagens de alto rendimento de volumes de até 1 mm3. Usando este método, microcircuitos neuronais locais inteiros podem ser resolvidos, embora os requisitos de equipamento e tempo para isso ainda sejam significativos: a imagem de um bloco de tecido cerebral de 1 mm3 exigiu 6 meses de imagem quase contínua por seis TEM rodando em paralelo.
Microscópio eletrônico de transmissão de varredura (STEM)
O STEM rastreia uma sonda incidente focada em uma amostra que (como no TEM) foi diluída para facilitar a detecção de elétrons espalhados através da amostra. A alta resolução do TEM é, portanto, possível no STEM. A ação de focalização (e aberrações) ocorre antes que os elétrons atinjam a amostra no STEM, mas depois no TEM. O uso do STEM de rasterização de feixe semelhante ao SEM simplifica a geração de imagens de campo escuro anular e outras técnicas analíticas, mas também significa que os dados da imagem são adquiridos em série e não em paralelo. Freqüentemente, o TEM pode ser equipado com a opção de digitalização e, em seguida, pode funcionar como TEM e STEM.
Microscópio eletrônico de varredura (SEM)
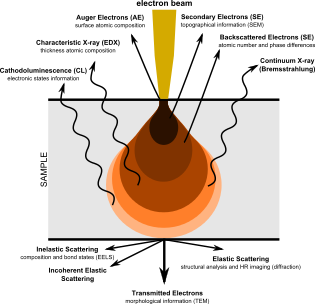
O SEM produz imagens sondando o espécime com um feixe de elétrons focalizado que é escaneado em uma área retangular do espécime (varredura raster). Quando o feixe de elétrons interage com o espécime, ele perde energia por uma variedade de mecanismos. A energia perdida é convertida em formas alternativas, como calor, emissão de elétrons secundários de baixa energia e elétrons retroespalhados de alta energia, emissão de luz (catodoluminescência) ou emissão de raios-X, todos os quais fornecem sinais que transportam informações sobre as propriedades do espécime superfície, como sua topografia e composição. A imagem exibida por um SEM mapeia a intensidade variável de qualquer um desses sinais na imagem em uma posição correspondente à posição do feixe na amostra quando o sinal foi gerado. Na imagem SEM de uma formiga mostrada abaixo e à direita, a imagem foi construída a partir de sinais produzidos por um detector de elétrons secundário, o modo de imagem normal ou convencional na maioria dos SEMs.
Geralmente, a resolução da imagem de um SEM é inferior à de um TEM. No entanto, como o SEM faz imagens da superfície de uma amostra em vez de seu interior, os elétrons não precisam percorrer a amostra. Isso reduz a necessidade de extensa preparação da amostra para diluir o espécime para a transparência eletrônica. O SEM é capaz de obter imagens de amostras em massa que podem caber em seu palco e ainda serem manobradas, incluindo uma altura menor que a distância de trabalho que está sendo usada, geralmente 4 milímetros para imagens de alta resolução. O SEM também possui uma grande profundidade de campo e, portanto, pode produzir imagens que são boas representações da forma tridimensional da superfície da amostra. Outra vantagem dos SEMs vem com microscópios eletrônicos de varredura ambiental (ESEM) que podem produzir imagens de boa qualidade e resolução com amostras hidratadas ou em baixo, em vez de alto, vácuo ou gases sob a câmara. Isso facilita a geração de imagens de amostras biológicas não fixadas que são instáveis no alto vácuo dos microscópios eletrônicos convencionais.
Microscópio eletrônico de reflexão (REM)
No microscópio eletrônico de reflexão (REM) como no TEM, um feixe de elétrons é incidente em uma superfície, mas em vez de usar a transmissão (TEM) ou elétrons secundários (SEM), o feixe refletido de elétrons espalhados elasticamente é detectado. Essa técnica é normalmente associada à difração de elétrons de alta energia de reflexão (RHEED) e à espectroscopia de perda de alta energia de reflexão (RHELS). Outra variação é a microscopia eletrônica de baixa energia polarizada por spin (SPLEEM), que é usada para observar a microestrutura de domínios magnéticos.
Cor
Em suas configurações mais comuns, os microscópios eletrônicos produzem imagens com um único valor de brilho por pixel, com os resultados geralmente renderizados em escala de cinza. No entanto, muitas vezes essas imagens são coloridas por meio do uso de software de detecção de recursos ou simplesmente editadas à mão usando um editor gráfico. Isso pode ser feito para esclarecer a estrutura ou para efeito estético e geralmente não adiciona novas informações sobre o espécime.
Em algumas configurações, informações sobre várias propriedades de espécimes são coletadas por pixel, geralmente pelo uso de vários detectores. Em SEM, os atributos de topografia e contraste do material podem ser obtidos por um par de detectores de elétrons retroespalhados e tais atributos podem ser sobrepostos em uma única imagem colorida, atribuindo-se uma cor primária diferente a cada atributo. Da mesma forma, uma combinação de sinais de elétrons secundários e retroespalhados pode ser atribuída a cores diferentes e sobreposta em uma única micrografia colorida exibindo simultaneamente as propriedades do espécime.
Alguns tipos de detectores usados em SEM têm recursos analíticos e podem fornecer vários itens de dados em cada pixel. Exemplos são os detectores de espectroscopia de raios-X (EDS) de energia dispersiva usados em análise elementar e sistemas de microscópio de catodoluminescência (CL) que analisam a intensidade e o espectro de luminescência induzida por elétrons em (por exemplo) espécimes geológicos. Em sistemas SEM que usam esses detectores, é comum codificar os sinais por cores e sobrepô-los em uma única imagem colorida, de modo que as diferenças na distribuição dos vários componentes da amostra possam ser vistas claramente e comparadas. Opcionalmente, a imagem eletrônica secundária padrão pode ser mesclada com um ou mais canais de composição, de modo que a estrutura e a composição do espécime possam ser comparadas. Essas imagens podem ser feitas mantendo a integridade total do sinal original, que não é modificado de forma alguma.
Preparação da amostra
Materiais a serem vistos em um microscópio eletrônico podem exigir processamento para produzir uma amostra adequada. A técnica necessária varia dependendo da amostra e da análise necessária:
- Fixação química – para espécimes biológicos visa estabilizar a estrutura macromolecular móvel do espécime através da ligação química de proteínas com aldeídos, como formaldeído e glutaraldeído, e lipídios com tetroxido de ósmio.
- Corante negativo – suspensões contendo nanopartículas ou material biológico fino (como vírus e bactérias) são brevemente misturadas com uma solução diluída de uma solução elétron-opaca, como molibdato de amônio, acetato de uranyl (ou formato), ou ácido fosfotungstico. Esta mistura é aplicada a uma grade EM adequadamente revestido, manchado, então permitido secar. A visualização desta preparação no TEM deve ser realizada sem demora para melhores resultados. O método é importante em microbiologia para identificação morfológica rápida, mas bruta, mas também pode ser usado como base para reconstrução 3D de alta resolução usando metodologia de tomografia EM quando os filmes de carbono são usados para suporte. A coloração negativa também é usada para a observação de nanopartículas.
- Criofixação – congelar um espécime tão rapidamente, em etano líquido que a água forma gelo vitreous (não-cristalino). Isso preserva o espécime em um instantâneo de seu estado de solução. Um campo inteiro chamado microscopia crio-eletrônica ramificou-se desta técnica. Com o desenvolvimento da microscopia crio-eletrônica de seções vitreous (CEMOVIS), agora é possível observar amostras de praticamente qualquer espécime biológico próximo ao seu estado nativo.
- Desidratação – ou substituição de água com solventes orgânicos, como etanol ou acetona, seguida de secagem de ponto crítico ou infiltração com resinas de incorporação. Também congelar a secagem.
- Incorporação, espécimes biológicos – após a desidratação, o tecido para observação no microscópio de elétrons de transmissão é incorporado para que possa ser seccionado pronto para visualização. Para fazer isso, o tecido passa-se por um "solvente de transição", como óxido de propileno (epoxypropane) ou acetona e, em seguida, infiltrado com uma resina epóxi, como Araldite, Epon ou Durcupan; os tecidos também podem ser incorporados diretamente na resina acrílica impermeável. Após a resina ter sido polimerizada (hardenada) a amostra é fina seccionada (seções de ultrafina) e manchada – então está pronta para visualização.
- Incorporação, materiais – após a incorporação em resina, o espécime é geralmente moído e polido para um acabamento semelhante ao espelho usando abrasivos ultra finos. O processo de polimento deve ser realizado cuidadosamente para minimizar arranhões e outros artefatos de polimento que reduzem a qualidade da imagem.
- Sombra de metal – O metal (por exemplo, platina) é evaporado de um eletrodo suspenso e aplicado à superfície de uma amostra biológica em um ângulo. A topografia superficial resulta em variações na espessura do metal que são vistos como variações no brilho e contraste na imagem do microscópio eletrônico.
- Replicação – Uma superfície sombreada com metal (por exemplo, platina, ou uma mistura de carbono e platina) em um ângulo é revestido com carbono puro evaporado de eletrodos de carbono em ângulos retos para a superfície. Isto é seguido pela remoção do material do espécime (por exemplo, em um banho ácido, usando enzimas ou por separação mecânica) para produzir uma réplica de superfície que registra a ultraestrutura superficial e pode ser examinada usando microscopia eletrônica de transmissão.
- Secção – produz fatias finas do espécime, semitransparente a elétrons. Estes podem ser cortados em um ultramicrotome com uma faca de vidro ou diamante para produzir seções ultrafinas de cerca de 60-90 nm de espessura. As facas de vidro descartáveis também são usadas porque podem ser feitas no laboratório e são muito mais baratas.
- Manuscrito – usa metais pesados, como chumbo, urânio ou tungstênio para dispersar elétrons de imagem e, portanto, dar contraste entre diferentes estruturas, uma vez que muitos materiais (especialmente biológicos) são quase "transparentes" para elétrons (objetos de fase fraca). Na biologia, os espécimes podem ser manchados "en bloc" antes da incorporação e também depois do seccionamento. Seções tipicamente finas são manchadas por vários minutos com uma solução aquosa ou alcoólica de acetato de uranyl seguido por citrato de chumbo aquoso.
- Freeze-fracture ou freeze-etch – um método de preparação particularmente útil para examinar membranas lipídicas e suas proteínas incorporadas na visão "face on". A suspensão do tecido fresco ou da célula é congelada rapidamente (cryofixação), depois fraturada pela ruptura (ou pelo uso de um microtomo) enquanto mantida à temperatura do nitrogênio líquido. A superfície fracturada a frio (às vezes "esquecida" aumentando a temperatura para cerca de -100 °C por vários minutos para deixar algum gelo sublime) é então sombreada com platina evaporada ou ouro em um ângulo médio de 45° em um evaporador de vácuo elevado. O segundo revestimento de carbono, perpendicular evaporado ao plano de superfície média é frequentemente realizado para melhorar a estabilidade do revestimento da réplica. O espécime é retornado à temperatura ambiente e pressão, então a réplica de metal "pre-sombrada" extremamente frágil da superfície da fratura é liberada do material biológico subjacente por digestão química cuidadosa com ácidos, solução de hipoclorito ou detergente SDS. A réplica ainda flutuante é completamente lavada livre de produtos químicos residuais, cuidadosamente pescados em grades finas, secas então vistas no TEM.
- Freeze-fracture replica immunogold labeling (FRIL) – o método de fratura congelada foi modificado para permitir a identificação dos componentes da face da fratura por rotulagem imunológica. Em vez de remover todo o tecido subjacente da réplica descongelada como o passo final antes de ver no microscópio a espessura do tecido é minimizada durante ou após o processo de fratura. A camada fina de tecido permanece ligada à réplica de metal para que possa ser imunogold rotulado com anticorpos para as estruturas de escolha. A camada fina do espécime original na réplica com ouro anexado permite a identificação de estruturas no plano de fratura. Há também métodos relacionados que rotulam a superfície de células gravadas e outras variações de rotulagem de réplicas.
- Moagem de feixe de iões – reduz amostras até que sejam transparentes para elétrons disparando íons (tipicamente argônio) na superfície de um ângulo e material de pulverização da superfície. Uma subclasse desta é a fresagem de feixe de íons concentrados, onde os íons de cálio são usados para produzir uma membrana transparente de elétrons em uma região específica da amostra, por exemplo, através de um dispositivo dentro de um microprocessador. O fresamento de feixe de iões também pode ser usado para polimento de seção transversal antes da análise SEM de materiais que são difíceis de preparar usando polimento mecânico.
- Revestimento condutivo – um revestimento ultrafino de material condutor eletricamente, depositado por evaporação a vácuo alta ou por baixo revestimento de pulverização a vácuo da amostra. Isso é feito para evitar a acumulação de campos elétricos estáticos no espécime devido à irradiação de elétrons necessária durante a imagem. Os materiais de revestimento incluem ouro, ouro/paládio, platina, tungstênio, grafite, etc.
- Terra – para evitar o acúmulo de carga elétrica em uma amostra condutivamente revestida, geralmente é conectado eletricamente ao suporte de amostra de metal. Muitas vezes, um adesivo condutor elétrico é usado para esta finalidade.
Desvantagens
Os microscópios eletrônicos são caros para construir e manter, mas o capital e os custos operacionais dos sistemas de microscópio de luz confocal agora se sobrepõem aos dos microscópios eletrônicos básicos. Os microscópios projetados para alcançar altas resoluções devem ser alojados em edifícios estáveis (às vezes subterrâneos) com serviços especiais, como sistemas de cancelamento de campo magnético.
As amostras devem ser vistas em grande parte no vácuo, pois as moléculas que compõem o ar espalhariam os elétrons. Uma exceção é a microscopia eletrônica de fase líquida usando uma célula líquida fechada ou uma câmara ambiental, por exemplo, no microscópio eletrônico de varredura ambiental, que permite que amostras hidratadas sejam visualizadas em baixa pressão (até 20 Torr ou 2,7 kPa) ambiente úmido. Várias técnicas para microscopia eletrônica in situ de amostras gasosas também foram desenvolvidas.
Microscópios eletrônicos de varredura operando no modo convencional de alto vácuo geralmente produzem imagens de espécimes condutivos; portanto, materiais não condutores requerem revestimento condutivo (ouro/liga de paládio, carbono, ósmio, etc.). O modo de baixa voltagem dos microscópios modernos torna possível a observação de amostras não condutoras sem revestimento. Materiais não condutores podem ser visualizados também por um microscópio eletrônico de varredura de pressão variável (ou ambiental).
Espécimes pequenos e estáveis, como nanotubos de carbono, frústulas de diatomáceas e pequenos cristais minerais (fibras de amianto, por exemplo) não requerem tratamento especial antes de serem examinados no microscópio eletrônico. Amostras de materiais hidratados, incluindo quase todos os espécimes biológicos, devem ser preparadas de várias maneiras para estabilizá-los, reduzir sua espessura (secção ultrafina) e aumentar seu contraste óptico de elétrons (coloração). Esses processos podem resultar em artefatos, mas eles geralmente podem ser identificados comparando os resultados obtidos usando métodos de preparação de espécimes radicalmente diferentes. Desde a década de 1980, a análise de espécimes criofixados e vitrificados também se tornou cada vez mais usada pelos cientistas, confirmando ainda mais a validade dessa técnica.
Aplicativos
Biologia e ciências da vida
|
|
Contenido relacionado
KOMPILER
Química Analítica
Dendrito