Metal
Um metal (do grego μέταλλον métallon, "mina, pedreira, metal") é um material que, quando recém preparado, polido ou fraturado, mostra uma aparência lustrosa e conduz eletricidade e calor relativamente bem. Os metais são tipicamente dúcteis (podem ser transformados em fios) e maleáveis (podem ser martelados em folhas finas). Essas propriedades são o resultado da ligação metálica entre os átomos ou moléculas do metal.
Um metal pode ser um elemento químico como o ferro; uma liga tal como aço inoxidável; ou um composto molecular tal como nitreto de enxofre polimérico.
Na física, um metal é geralmente considerado como qualquer substância capaz de conduzir eletricidade a uma temperatura de zero absoluto. Muitos elementos e compostos que normalmente não são classificados como metais tornam-se metálicos sob altas pressões. Por exemplo, o iodo não metálico torna-se gradualmente um metal a uma pressão entre 40 e 170 mil vezes a pressão atmosférica. Da mesma forma, alguns materiais considerados metais podem se tornar não-metais. O sódio, por exemplo, torna-se um não-metal sob pressão de pouco menos de dois milhões de vezes a pressão atmosférica.
Na química, dois elementos que de outra forma se qualificariam (na física) como metais frágeis - arsênico e antimônio - são comumente reconhecidos como metaloides devido à sua química (predominantemente não metálica para o arsênico e equilibrada entre metalicidade e não metalicidade para o antimônio). Cerca de 95 dos 118 elementos da tabela periódica são metais (ou provavelmente serão). O número é inexato, pois os limites entre metais, não-metais e metalóides flutuam ligeiramente devido à falta de definições universalmente aceitas das categorias envolvidas.
Na astrofísica, o termo "metal" é expresso de forma mais ampla para se referir a todos os elementos químicos em uma estrela que são mais pesados que o hélio, e não apenas os metais tradicionais. Nesse sentido, os quatro primeiros "metais" coletando em núcleos estelares por meio de nucleossíntese são carbono, nitrogênio, oxigênio e néon, todos os quais são estritamente não-metais em química. Uma estrela funde átomos mais leves, principalmente hidrogênio e hélio, em átomos mais pesados ao longo de sua vida. Usada nesse sentido, a metalicidade de um objeto astronômico é a proporção de sua matéria composta pelos elementos químicos mais pesados.
Os metais, como elementos químicos, compreendem 25% da crosta terrestre e estão presentes em muitos aspectos da vida moderna. A resistência e a resiliência de alguns metais levaram ao seu uso frequente, por exemplo, em edifícios altos e na construção de pontes, bem como na maioria dos veículos, muitos eletrodomésticos, ferramentas, tubulações e trilhos de trem. Metais preciosos foram historicamente usados como cunhagem, mas na era moderna, os metais de cunhagem se estenderam a pelo menos 23 dos elementos químicos.
Pensa-se que a história dos metais refinados começou com o uso do cobre há cerca de 11.000 anos. Ouro, prata, ferro (como ferro meteórico), chumbo e latão também eram usados antes da primeira aparição conhecida do bronze no quinto milênio AEC. Desenvolvimentos subseqüentes incluem a produção de formas iniciais de aço; a descoberta do sódio — o primeiro metal leve — em 1809; a ascensão de ligas de aço modernas; e, desde o final da Segunda Guerra Mundial, o desenvolvimento de ligas mais sofisticadas.
Propriedades
Forma e estrutura
Os metais são brilhantes e lustrosos, pelo menos quando recém-preparados, polidos ou fraturados. Folhas de metal mais espessas do que alguns micrômetros parecem opacas, mas a folha de ouro transmite luz verde.
O estado sólido ou líquido dos metais se origina em grande parte na capacidade dos átomos metálicos envolvidos em perder facilmente seus elétrons da camada externa. Em termos gerais, as forças que mantêm os elétrons da camada externa de um átomo individual no lugar são mais fracas do que as forças atrativas nos mesmos elétrons decorrentes das interações entre os átomos no metal sólido ou líquido. Os elétrons envolvidos tornam-se deslocalizados e a estrutura atômica de um metal pode efetivamente ser visualizada como uma coleção de átomos embutidos em uma nuvem de elétrons relativamente móveis. Esse tipo de interação é chamado de ligação metálica. A força das ligações metálicas para diferentes metais elementares atinge um máximo em torno do centro da série de metais de transição, pois esses elementos possuem um grande número de elétrons deslocalizados.
Embora a maioria dos metais elementares tenha densidades mais altas do que a maioria dos não-metais, há uma grande variação em suas densidades, sendo o lítio o menos denso (0,534 g/cm3) e o ósmio (22,59 g/cm3) o mais denso. (Espera-se que alguns dos metais de transição 6d sejam mais densos que o ósmio, mas as previsões sobre suas densidades variam amplamente na literatura e, em qualquer caso, seus isótopos conhecidos são muito instáveis para que a produção em massa seja possível.) Magnésio, alumínio e titânio são metais leves de importância comercial significativa. Suas respectivas densidades de 1,7, 2,7 e 4,5 g/cm3 podem ser comparadas às dos metais estruturais mais antigos, como ferro em 7,9 e cobre em 8,9 g/cm3. Uma bola de ferro pesaria tanto quanto três bolas de alumínio de igual volume.
Os metais são tipicamente maleáveis e dúcteis, deformando-se sob tensão sem quebrar. Acredita-se que a natureza não direcional da ligação metálica contribua significativamente para a ductilidade da maioria dos sólidos metálicos. Em contraste, em um composto iônico como o sal de mesa, quando os planos de uma ligação iônica deslizam um sobre o outro, a mudança resultante na localização desloca os íons de mesma carga para mais perto, resultando na clivagem do cristal. Tal deslocamento não é observado em um cristal ligado covalentemente, como um diamante, onde ocorre fratura e fragmentação do cristal. A deformação elástica reversível em metais pode ser descrita pela Lei de Hooke para forças restauradoras, onde a tensão é linearmente proporcional à deformação.
Calor ou forças maiores que o limite elástico de um metal podem causar uma deformação permanente (irreversível), conhecida como deformação plástica ou plasticidade. Uma força aplicada pode ser uma força de tração (puxar), uma força compressiva (empurrar) ou uma força de cisalhamento, flexão ou torção (torção). Uma mudança de temperatura pode afetar o movimento ou deslocamento de defeitos estruturais no metal, como contornos de grãos, lacunas de pontos, deslocamentos de linha e parafuso, falhas de empilhamento e gêmeos em metais cristalinos e não cristalinos. Deslizamento interno, fluência e fadiga do metal podem ocorrer.
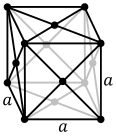
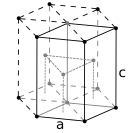
Os átomos de substâncias metálicas são normalmente arranjados em uma das três estruturas cristalinas comuns, ou seja, cúbico de corpo centrado (bcc), cúbico de face centrada (fcc) e hexagonal compactado (hcp). Em bcc, cada átomo é posicionado no centro de um cubo de oito outros. Em fcc e hcp, cada átomo é cercado por outros doze, mas o empilhamento das camadas é diferente. Alguns metais adotam estruturas diferentes dependendo da temperatura.
A célula unitária para cada estrutura cristalina é o menor grupo de átomos que tem a simetria geral do cristal e a partir do qual toda a rede cristalina pode ser construída por repetição em três dimensões. No caso da estrutura cristalina cúbica de corpo centrado mostrada acima, a célula unitária é composta pelo átomo central mais um oito de cada um dos oito átomos dos cantos.
Elétrico e térmico

A estrutura eletrônica dos metais significa que eles são relativamente bons condutores de eletricidade. Os elétrons na matéria só podem ter níveis de energia fixos e não variáveis, e em um metal os níveis de energia dos elétrons em sua nuvem de elétrons, pelo menos até certo ponto, correspondem aos níveis de energia nos quais a condução elétrica pode ocorrer. Em um semicondutor como o silício ou um não-metal como o enxofre, há uma lacuna de energia entre os elétrons da substância e o nível de energia no qual a condução elétrica pode ocorrer. Consequentemente, semicondutores e não-metais são condutores relativamente ruins.
Os metais elementares têm valores de condutividade elétrica de 6,9 × 103 S/cm para manganês a 6,3 × 105 S/cm para prata. Em contraste, um metalóide semicondutor como o boro tem uma condutividade elétrica de 1,5 × 10−6 S/cm. Com uma exceção, os elementos metálicos reduzem sua condutividade elétrica quando aquecidos. O plutônio aumenta sua condutividade elétrica quando aquecido na faixa de temperatura de cerca de -175 a +125 °C.
Os metais são relativamente bons condutores de calor. Os elétrons na nuvem de elétrons de um metal são altamente móveis e facilmente capazes de transmitir energia vibracional induzida pelo calor.
A contribuição dos elétrons de um metal para sua capacidade de calor e condutividade térmica, e a condutividade elétrica do próprio metal podem ser calculadas a partir do modelo de elétron livre. No entanto, isso não leva em conta a estrutura detalhada da rede iônica do metal. Levar em consideração o potencial positivo causado pelo arranjo dos núcleos iônicos permite considerar a estrutura da banda eletrônica e a energia de ligação de um metal. Vários modelos matemáticos são aplicáveis, sendo o mais simples o modelo de elétron quase livre.
Químico
Os metais são geralmente inclinados a formar cátions através da perda de elétrons. A maioria reagirá com o oxigênio do ar para formar óxidos em várias escalas de tempo (o potássio queima em segundos, enquanto o ferro enferruja ao longo de anos). Alguns outros, como paládio, platina e ouro, não reagem com a atmosfera. Os óxidos dos metais são geralmente básicos, ao contrário dos não-metais, que são ácidos ou neutros. As exceções são em grande parte óxidos com estados de oxidação muito altos, como CrO3, Mn2O7 e OsO4, que têm reações estritamente ácidas.
Pintar, anodizar ou chapear metais são boas maneiras de prevenir sua corrosão. No entanto, um metal mais reativo na série eletroquímica deve ser escolhido para o revestimento, especialmente quando o revestimento é esperado. A água e os dois metais formam uma célula eletroquímica e, se o revestimento for menos reativo que o metal subjacente, o revestimento realmente promove a corrosão.
Distribuição de tabelas periódicas
Os elementos que formam estruturas metálicas em condições normais são mostrados em amarelo na tabela periódica abaixo. Os elementos restantes formam estruturas covalentes gigantes (azul claro), estruturas moleculares covalentes (azul escuro) ou permanecem como átomos únicos (violeta). Astato (At), frâncio (Fr) e os elementos de férmio (Fm) em diante são mostrados em cinza porque são extremamente radioativos e nunca foram produzidos em massa. Evidências teóricas e experimentais sugerem que quase todos esses elementos não investigados deveriam ser metais, embora haja alguma dúvida sobre oganesson (Og).
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10. | 11 | 12 | 13 | 14 | 15 | 16. | 17. | 18. | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Grupo → | ||||||||||||||||||||||||||||||||
| ↓ Período | ||||||||||||||||||||||||||||||||
| 1 | H. H. H. | Ele. | ||||||||||||||||||||||||||||||
| 2 | Li | Ser | B | C | N | O | F | Não. | ||||||||||||||||||||||||
| 3 | Nao | Mg | Al. | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | KK | Ca. | Sc | Ti | V | C. | Mn. | Fe | Co | Ni | Cu | Zn | Ga | Ge | Como | Se | B. | Kr | ||||||||||||||
| 5 | Rb | Sr. | Y | Zr | Nb | Mo | TC | Ru | Rh | Pd | Agrupamento | Cd | Em | Sn | Sb | Te | Eu... | Xe | ||||||||||||||
| 6 | C | Bando | La | Ce | Pr | Nd | Pm | Sm | Eu sei. | Gd | TB | Dy! | Ho. | Er. | T m | Yb | Lu | Hf | Ta. | W | Repito | Os | Ir. | Pt | Au! | Hg | ? | PB | B. | Po | Em | RN |
| 7 | Pe. | Ra | Acções | O quê? | Pai. | U | Np | Puxa. | Am | Cm | Bk. | Cf | E | F m | Md. | Não. | Lr. | Rf | Db | Sg | B. | H. | Mt | D | RG | Cn | Não. | Fl | Mc | LV | T | Og |
Metal mecânicaRede covalenteCovalente molecularátomos únicosDesconhecidoCor de fundo mostra a ligação de substâncias simples na tabela periódica. Se houver vários, o alotrope mais estável é considerado.
A situação pode mudar com a pressão: em pressões extremamente altas, espera-se que todos os elementos (e na verdade todas as substâncias) se metalizem. O arsênico (As) tem um alótropo metálico estável e um alótropo semicondutor metaestável em condições padrão.
Elementos próximos à fronteira entre metais e não-metais geralmente têm comportamento químico intermediário. Como tal, uma categoria de metaloides é freqüentemente usada para esses elementos intermediários, mas não há consenso na literatura sobre quais elementos devem se qualificar.
Ligas
Uma liga é uma substância com propriedades metálicas e que é composta de dois ou mais elementos, pelo menos um dos quais é um metal. Uma liga pode ter uma composição variável ou fixa. Por exemplo, ouro e prata formam uma liga na qual as proporções de ouro ou prata podem ser ajustadas livremente; titânio e silício formam uma liga Ti2Si na qual a proporção dos dois componentes é fixa (também conhecido como composto intermetálico).
A maioria dos metais puros são muito moles, quebradiços ou quimicamente reativos para uso prático. A combinação de diferentes proporções de metais como ligas modifica as propriedades dos metais puros para produzir características desejáveis. O objetivo de fazer ligas é geralmente torná-las menos quebradiças, mais duras, resistentes à corrosão ou com uma cor e brilho mais desejáveis. De todas as ligas metálicas em uso hoje, as ligas de ferro (aço, aço inoxidável, ferro fundido, aço ferramenta, aço liga) constituem a maior proporção tanto em quantidade quanto em valor comercial. O ferro ligado com várias proporções de carbono produz aços de baixo, médio e alto teor de carbono, com níveis crescentes de carbono reduzindo a ductilidade e a tenacidade. A adição de silício produzirá ferros fundidos, enquanto a adição de cromo, níquel e molibdênio aos aços carbono (mais de 10%) resulta em aços inoxidáveis.
Outras ligas metálicas significativas são as de alumínio, titânio, cobre e magnésio. As ligas de cobre são conhecidas desde a pré-história - o bronze deu nome à Idade do Bronze - e têm muitas aplicações hoje, principalmente na fiação elétrica. As ligas dos outros três metais foram desenvolvidas há relativamente pouco tempo; devido à sua reatividade química, necessitam de processos de extração eletrolítica. As ligas de alumínio, titânio e magnésio são valorizadas por suas altas relações resistência/peso; o magnésio também pode fornecer blindagem eletromagnética. Esses materiais são ideais para situações em que a alta relação resistência/peso é mais importante do que o custo do material, como na indústria aeroespacial e em algumas aplicações automotivas.
As ligas especialmente projetadas para aplicações altamente exigentes, como motores a jato, podem conter mais de dez elementos.
Categorias
Os metais podem ser classificados de acordo com suas propriedades físicas ou químicas. As categorias descritas nas subseções abaixo incluem metais ferrosos e não ferrosos; metais quebradiços e metais refratários; metais brancos; metais pesados e leves; e metais comuns, nobres e preciosos. A tabela Elementos metálicos nesta seção categoriza os metais elementares com base em suas propriedades químicas em metais alcalinos e alcalino-terrosos; metais de transição e pós-transição; e lantanídeos e actinídeos. Outras categorias são possíveis, dependendo dos critérios de inclusão. Por exemplo, os metais ferromagnéticos - aqueles metais que são magnéticos à temperatura ambiente - são ferro, cobalto e níquel.
Metais ferrosos e não ferrosos
O termo "ferroso" é derivado da palavra latina que significa "contendo ferro". Isso pode incluir ferro puro, como ferro forjado, ou uma liga, como aço. Os metais ferrosos são muitas vezes magnéticos, mas não exclusivamente. Os metais não ferrosos e as ligas carecem de quantidades apreciáveis de ferro.
Metal frágil
Embora quase todos os metais sejam maleáveis ou dúcteis, alguns — berílio, cromo, manganês, gálio e bismuto — são quebradiços. Arsênico e antimônio, se admitidos como metais, são frágeis. Baixos valores da relação entre o módulo de elasticidade aparente e o módulo de cisalhamento (critério de Pugh) são indicativos de fragilidade intrínseca.
Metal refratário
Na ciência de materiais, metalurgia e engenharia, um metal refratário é um metal extraordinariamente resistente ao calor e ao desgaste. Quais metais pertencem a esta categoria varia; a definição mais comum inclui nióbio, molibdênio, tântalo, tungstênio e rênio. Todos eles têm pontos de fusão acima de 2.000 °C e alta dureza à temperatura ambiente.
Metal branco
Um metal branco é qualquer um dos metais de cor branca (ou suas ligas) com pontos de fusão relativamente baixos. Esses metais incluem zinco, cádmio, estanho, antimônio (aqui considerado um metal), chumbo e bismuto, alguns dos quais são bastante tóxicos. Na Grã-Bretanha, o comércio de belas artes usa o termo "metal branco" em catálogos de leilões para descrever itens de prata estrangeiros que não carregam as marcas do British Assay Office, mas que, no entanto, são entendidos como prata e são precificados de acordo.
Metais pesados e leves
Um metal pesado é qualquer metal ou metalóide relativamente denso. Definições mais específicas foram propostas, mas nenhuma obteve ampla aceitação. Alguns metais pesados têm usos de nicho ou são notavelmente tóxicos; alguns são essenciais em quantidades vestigiais. Todos os outros metais são metais leves.
Metais básicos, nobres e preciosos
Em química, o termo metal base é usado informalmente para se referir a um metal que é facilmente oxidado ou corroído, como reagir facilmente com ácido clorídrico diluído (HCl) para formar um cloreto de metal e hidrogênio. Exemplos incluem ferro, níquel, chumbo e zinco. O cobre é considerado um metal básico, pois é oxidado com relativa facilidade, embora não reaja com o HCl.
O termo metal nobre é comumente usado em oposição ao metal básico. Os metais nobres são resistentes à corrosão ou à oxidação, ao contrário da maioria dos metais básicos. Eles tendem a ser metais preciosos, muitas vezes devido à raridade percebida. Exemplos incluem ouro, platina, prata, ródio, irídio e paládio.
Na alquimia e na numismática, o termo metal comum é contrastado com o metal precioso, ou seja, aqueles de alto valor econômico. Um objetivo de longa data dos alquimistas era a transmutação de metais básicos em metais preciosos, incluindo metais de cunhagem como prata e ouro. A maioria das moedas hoje é feita de metais comuns com baixo valor intrínseco; no passado, as moedas freqüentemente derivavam seu valor principalmente de seu conteúdo de metais preciosos.
Quimicamente, os metais preciosos (como os metais nobres) são menos reativos que a maioria dos elementos, possuem alto brilho e alta condutividade elétrica. Historicamente, os metais preciosos eram importantes como moeda, mas agora são considerados principalmente como investimento e commodities industriais. Ouro, prata, platina e paládio têm, cada um, um código de moeda ISO 4217. Os metais preciosos mais conhecidos são o ouro e a prata. Embora ambos tenham usos industriais, eles são mais conhecidos por seus usos em arte, joias e moedas. Outros metais preciosos incluem os metais do grupo da platina: rutênio, ródio, paládio, ósmio, irídio e platina, dos quais a platina é o mais amplamente comercializado.
A demanda por metais preciosos é impulsionada não apenas por seu uso prático, mas também por seu papel como investimento e reserva de valor. O paládio e a platina, no outono de 2018, foram avaliados em cerca de três quartos do preço do ouro. A prata é substancialmente mais barata do que esses metais, mas muitas vezes é tradicionalmente considerada um metal precioso devido ao seu papel na cunhagem e joalheria.
Metais da válvula
Em eletroquímica, um metal de válvula é um metal que passa a corrente em apenas uma direção.
Ciclo de vida
Formação
| abundância e principal ocorrência ou fonte, em peso | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10. | 11 | 12 | 13 | 14 | 15 | 16. | 17. | 18. | ||
| 1 | H. H. H. | Ele. | |||||||||||||||||
| 2 | Li | Ser | B | C | N | O | F | Não. | |||||||||||
| 3 | Nao | Mg | Al. | Si | P | S | Cl | Ar | |||||||||||
| 4 | KK | Ca. | Sc | Ti | V | C. | Mn. | Fe | Co | Ni | Cu | Zn | Ga | Ge | Como | Se | B. | Kr | |
| 5 | Rb | Sr. | Y | Zr | Nb | Mo | Ru | Rh | Pd | Agrupamento | Cd | Em | Sn | Sb | Te | Eu... | Xe | ||
| 6 | C | Bando | Lu | Hf | Ta. | W | Repito | Os | Ir. | Pt | Au! | Hg | ? | PB | B. | ||||
| 7 | |||||||||||||||||||
| La | Ce | Pr | Nd | Sm | Eu sei. | Gd | TB | Dy! | Ho. | Er. | T m | Yb | |||||||
| O quê? | U | ||||||||||||||||||
Mais abundante (até 82) ppm) | |||||||||||||||||||
Abundant (100.–999 ppm) | |||||||||||||||||||
Invulgar (1–99 ppm) | |||||||||||||||||||
Rare (em inglês)0,01–0,99 ppm) | |||||||||||||||||||
Muito raro (0,01–0.0099 ppm) | |||||||||||||||||||
| Os metais deixados da linha divisória ocorrem (ou são fonte) principalmente como litófilos; aqueles à direita, como chalcophiles exceto ouro (um siderophile) e estanho (um lithophile). | |||||||||||||||||||
- Esta subseção lida com a formação de metais elementares de tabela periódica, uma vez que estes formam a base de materiais metálicos, como definido neste artigo.
Metais até a vizinhança do ferro (na tabela periódica) são em grande parte produzidos por nucleossíntese estelar. Nesse processo, elementos mais leves, do hidrogênio ao silício, sofrem sucessivas reações de fusão no interior das estrelas, liberando luz e calor e formando elementos mais pesados e com maior número atômico.
Metais mais pesados geralmente não são formados dessa maneira, pois as reações de fusão envolvendo tais núcleos consumiriam energia em vez de liberar. Em vez disso, eles são amplamente sintetizados (a partir de elementos com um número atômico menor) por captura de nêutrons, com os dois modos principais dessa captura repetitiva sendo o processo s e o processo r. No processo s ("s" significa "lento"), capturas singulares são separadas por anos ou décadas, permitindo que os núcleos menos estáveis sofram decaimento beta, enquanto no processo r ("rápido"), as capturas acontecem mais rapidamente do que os núcleos podem decair. Portanto, o processo s segue um caminho mais ou menos claro: por exemplo, núcleos estáveis de cádmio-110 são sucessivamente bombardeados por nêutrons livres dentro de uma estrela até formar núcleos de cádmio-115 que são instáveis e decaem para formar o índio-115 (que é quase estável, com meia-vida 30000 vezes a idade do universo). Esses núcleos capturam nêutrons e formam o índio-116, que é instável, e decai para formar o estanho-116, e assim por diante. Em contraste, não existe tal caminho no processo r. O processo s para no bismuto devido às meias-vidas curtas dos próximos dois elementos, polônio e astato, que decaem para bismuto ou chumbo. O processo r é tão rápido que pode pular essa zona de instabilidade e criar elementos mais pesados, como tório e urânio.
Os metais condensam-se nos planetas como resultado da evolução estelar e dos processos de destruição. As estrelas perdem muito de sua massa quando são ejetadas no final de suas vidas e, às vezes, como resultado de uma fusão de estrelas de nêutrons, aumentando assim a abundância de elementos mais pesados que o hélio no meio interestelar. Quando a atração gravitacional faz com que essa matéria se aglutine e colapse, novas estrelas e planetas são formados.
Abundância e ocorrência
A crosta terrestre é composta por aproximadamente 25% de metais em peso, dos quais 80% são metais leves, como sódio, magnésio e alumínio. Não-metais (~ 75%) compõem o restante da crosta. Apesar da escassez geral de alguns metais mais pesados, como o cobre, eles podem se concentrar em quantidades economicamente extraíveis como resultado da formação de montanhas, erosão ou outros processos geológicos.
Os metais são encontrados principalmente como litófilos (amantes de rochas) ou calcófilos (amantes de minérios). Os metais litófilos são principalmente os elementos do bloco s, os mais reativos dos elementos do bloco d e os elementos do bloco f. Eles têm uma forte afinidade com o oxigênio e existem principalmente como minerais de silicato de densidade relativamente baixa. Os metais calcófilos são principalmente os elementos menos reativos do bloco d e os metais do bloco p do período 4-6. Eles são geralmente encontrados em minerais de sulfeto (insolúvel). Sendo mais densos que os litófilos, afundando-se mais na crosta no momento de sua solidificação, os calcófilos tendem a ser menos abundantes que os litófilos.
Por outro lado, o ouro é um siderófilo, ou elemento amante do ferro. Não forma facilmente compostos com oxigênio ou enxofre. Na época da formação da Terra, e como o mais nobre (inerte) dos metais, o ouro afundou no núcleo devido à sua tendência de formar ligas metálicas de alta densidade. Consequentemente, é um metal relativamente raro. Alguns outros metais (menos) nobres - molibdênio, rênio, os metais do grupo da platina (rutênio, ródio, paládio, ósmio, irídio e platina), germânio e estanho - podem ser contados como siderófilos, mas apenas em termos de sua ocorrência primária em a Terra (núcleo, manto e crosta), em vez da crosta. Esses metais, de outra forma, ocorrem na crosta, em pequenas quantidades, principalmente como calcófilos (menos em sua forma nativa).
O núcleo externo do fluido rotativo do interior da Terra, que é composto principalmente de ferro, é considerado a fonte do campo magnético protetor da Terra. O núcleo fica acima do núcleo interno sólido da Terra e abaixo de seu manto. Se pudesse ser reorganizado em uma coluna com uma pegada de 5 m2 (54 sq ft), teria uma altura de quase 700 anos-luz. O campo magnético protege a Terra das partículas carregadas do vento solar e dos raios cósmicos que, de outra forma, despojariam a atmosfera superior (incluindo a camada de ozônio que limita a transmissão da radiação ultravioleta).
Extração
Os metais são frequentemente extraídos da Terra por meio da mineração de minérios que são fontes ricas dos elementos necessários, como a bauxita. O minério é localizado por meio de técnicas de prospecção, seguidas da exploração e exame das jazidas. As fontes minerais são geralmente divididas em minas de superfície, que são extraídas por escavação usando equipamentos pesados, e minas subterrâneas. Em alguns casos, o preço de venda do(s) metal(es) envolvido(s) torna economicamente viável a mineração de fontes de menor concentração.
Uma vez que o minério é extraído, os metais devem ser extraídos, geralmente por redução química ou eletrolítica. A pirometalurgia usa altas temperaturas para converter minério em metais brutos, enquanto a hidrometalurgia emprega química aquosa para o mesmo propósito. Os métodos usados dependem do metal e de seus contaminantes.
Quando um minério de metal é um composto iônico desse metal e um não-metal, o minério geralmente deve ser fundido—aquecido com um agente redutor—para extrair o metal puro. Muitos metais comuns, como o ferro, são fundidos usando carbono como agente redutor. Alguns metais, como alumínio e sódio, não possuem agente redutor comercialmente prático e são extraídos por eletrólise.
Os minérios de sulfeto não são reduzidos diretamente ao metal, mas são torrados ao ar para convertê-los em óxidos.
Usos
Os metais estão presentes em quase todos os aspectos da vida moderna. O ferro, um metal pesado, pode ser o mais comum, pois representa 90% de todos os metais refinados; o alumínio, um metal leve, é o segundo metal mais comumente refinado. O ferro puro pode ser o elemento metálico mais barato de todos, com um custo de cerca de US$ 0,07 por grama. Seus minérios são generalizados; é fácil de refinar; e a tecnologia envolvida foi desenvolvida ao longo de centenas de anos. O ferro fundido é ainda mais barato, a uma fração de US$ 0,01 o grama, porque não há necessidade de purificação posterior. A platina, a um custo de cerca de US$ 27 por grama, pode ser a mais onipresente devido ao seu alto ponto de fusão, resistência à corrosão, condutividade elétrica e durabilidade. Diz-se que é encontrado ou usado para produzir 20% de todos os bens de consumo. O polônio provavelmente é o metal mais caro comercializado, a um custo nominal de cerca de US$ 100.000.000 por grama, devido à sua escassez e produção em microescala.
Alguns metais e ligas metálicas possuem alta resistência estrutural por unidade de massa, tornando-os materiais úteis para transportar grandes cargas ou resistir a danos por impacto. As ligas metálicas podem ser projetadas para ter alta resistência ao cisalhamento, torque e deformação. No entanto, o mesmo metal também pode ser vulnerável a danos por fadiga por uso repetido ou por falha repentina por tensão quando uma capacidade de carga é excedida. A força e a resiliência dos metais levaram ao seu uso frequente em arranha-céus e construção de pontes, bem como na maioria dos veículos, muitos aparelhos, ferramentas, tubulações e trilhos de trem.
Os metais são bons condutores, tornando-os valiosos em aparelhos elétricos e para transportar uma corrente elétrica por uma distância com pouca perda de energia. As redes de energia elétrica dependem de cabos metálicos para distribuir eletricidade. Os sistemas elétricos domésticos, em sua maioria, são conectados com fio de cobre por suas boas propriedades de condução.
A condutividade térmica dos metais é útil para recipientes para aquecer materiais sobre uma chama. Os metais também são usados para dissipadores de calor para proteger equipamentos sensíveis contra superaquecimento.
A alta refletividade de alguns metais possibilita seu uso em espelhos, inclusive em instrumentos astronômicos de precisão, e contribui para a estética das joias metálicas.
Alguns metais têm usos especializados; o mercúrio é um líquido à temperatura ambiente e é usado em interruptores para completar um circuito quando flui sobre os contatos do interruptor. Metais radioativos como urânio e plutônio são combustíveis para usinas nucleares, que produzem energia por meio da fissão nuclear. As ligas com memória de forma são usadas para aplicações como tubos, fixadores e stents vasculares.
Os metais podem ser dopados com moléculas estranhas - orgânicas, inorgânicas, biológicas e polímeros. Esta dopagem envolve o metal com novas propriedades que são induzidas pelas moléculas convidadas. Aplicações em catálise, medicina, células eletroquímicas, corrosão e muito mais foram desenvolvidas.
Reciclagem
A demanda por metais está intimamente ligada ao crescimento econômico devido ao seu uso em infraestrutura, construção, manufatura e bens de consumo. Durante o século 20, a variedade de metais usados na sociedade cresceu rapidamente. Hoje, o desenvolvimento de grandes nações, como China e Índia, e os avanços tecnológicos estão alimentando cada vez mais a demanda. O resultado é que as atividades de mineração estão se expandindo e cada vez mais estoques de metais do mundo estão sendo usados acima do solo, em vez de sob o solo como reservas não utilizadas. Um exemplo é o estoque de cobre em uso. Entre 1932 e 1999, o cobre em uso nos EUA aumentou de 73 g para 238 g por pessoa.
Os metais são inerentemente recicláveis, portanto, em princípio, podem ser usados repetidamente, minimizando esses impactos ambientais negativos e economizando energia. Por exemplo, 95% da energia usada para fazer alumínio a partir do minério de bauxita é economizada com o uso de material reciclado.
Globalmente, a reciclagem de metais é geralmente baixa. Em 2010, o International Resource Panel, sediado pelo Programa das Nações Unidas para o Meio Ambiente, publicou relatórios sobre os estoques de metais existentes na sociedade e suas taxas de reciclagem. Os autores do relatório observaram que os estoques de metal na sociedade podem servir como enormes minas acima do solo. Eles alertaram que as taxas de reciclagem de alguns metais raros usados em aplicações como telefones celulares, baterias para carros híbridos e células de combustível são tão baixas que, a menos que as futuras taxas de reciclagem no final da vida sejam dramaticamente aumentadas, esses metais críticos ficarão indisponíveis para uso na tecnologia moderna.
Interações biológicas
O papel dos elementos metálicos na evolução da bioquímica celular foi revisado, incluindo uma seção detalhada sobre o papel do cálcio nas enzimas redox.
Um ou mais dos elementos ferro, cobalto, níquel, cobre e zinco são essenciais para todas as formas de vida superiores. O molibdênio é um componente essencial da vitamina B12. Compostos de todos os outros elementos de transição e pós-transição são tóxicos em maior ou menor grau, com poucas exceções, como certos compostos de antimônio e estanho. Fontes potenciais de envenenamento por metais incluem mineração, rejeitos, resíduos industriais, escoamento agrícola, exposição ocupacional, tintas e madeira tratada.
História
Pré-história
O cobre, que ocorre na forma nativa, pode ter sido o primeiro metal descoberto devido à sua aparência distinta, peso e maleabilidade em comparação com outras pedras ou seixos. Ouro, prata e ferro (como ferro meteórico) e chumbo também foram descobertos na pré-história. Formas de latão, uma liga de cobre e zinco feita pela fusão simultânea dos minérios desses metais, são originárias desse período (embora o zinco puro não tenha sido isolado até o século XIII). A maleabilidade dos metais sólidos levou às primeiras tentativas de criar ornamentos, ferramentas e armas de metal. O ferro meteórico contendo níquel foi descoberto de tempos em tempos e, em alguns aspectos, era superior a qualquer aço industrial fabricado até a década de 1880, quando os aços-liga se tornaram proeminentes.
Antiguidade
A descoberta do bronze (uma liga de cobre com arsênico ou estanho) permitiu que as pessoas criassem objetos de metal mais duros e duráveis do que antes. Ferramentas, armas, armaduras e materiais de construção de bronze, como ladrilhos decorativos, eram mais duros e duráveis do que seus predecessores de pedra e cobre ("Calcolítico"). Inicialmente, o bronze era feito de cobre e arsênico (formando o bronze arsênico) por meio da fundição natural ou artificial de minérios de cobre e arsênico. Os artefatos mais antigos até agora conhecidos vêm do planalto iraniano no quinto milênio aC. Foi só mais tarde que o estanho foi usado, tornando-se o principal ingrediente não cobre do bronze no final do terceiro milênio aC. O próprio estanho puro foi isolado pela primeira vez em 1800 aC por metalúrgicos chineses e japoneses.
Mercúrio era conhecido pelos antigos chineses e indianos antes de 2.000 a.C. e encontrado em tumbas egípcias datadas de 1.500 a.C.
A mais antiga produção conhecida de aço, uma liga de ferro-carbono, é vista em peças de ferragens escavadas em um sítio arqueológico na Anatólia (Kaman-Kalehöyük) e têm quase 4.000 anos, datando de 1800 aC.
Por volta de 500 aC, os fabricantes de espadas de Toledo, na Espanha, fabricavam formas iniciais de liga de aço adicionando um mineral chamado volframita, que continha tungstênio e manganês, ao minério de ferro (e carbono). O aço Toledo resultante chamou a atenção de Roma quando usado por Aníbal nas Guerras Púnicas. Logo se tornou a base para o armamento das legiões romanas; dizia-se que suas espadas eram "tão afiadas que não há elmo que não possa ser cortado por elas".
Na América pré-colombiana, objetos feitos de tumbaga, uma liga de cobre e ouro, começaram a ser produzidos no Panamá e na Costa Rica entre 300 e 500 EC. Pequenas esculturas de metal eram comuns e uma extensa gama de ornamentos tumbaga (e ouro) compunham os trajes usuais de pessoas de alto status.
Na mesma época, indígenas equatorianos combinavam ouro com uma liga de platina natural contendo pequenas quantidades de paládio, ródio e irídio, para produzir miniaturas e máscaras compostas de uma liga de ouro branco e platina. Os metalúrgicos envolveram ouro aquecido com grãos da liga de platina até que o ouro derretesse, ponto em que os metais do grupo da platina ficaram ligados ao ouro. Após o resfriamento, o conglomerado resultante foi martelado e reaquecido repetidamente até ficar tão homogêneo como se todos os metais envolvidos tivessem sido fundidos juntos (atingir os pontos de fusão dos metais do grupo da platina em questão estava além da tecnologia da época).
Idade Média
O ouro é para a amante - prata para a empregada -
Cobre para o artesão astúcia em seu comércio.
"Bom!" disse o Barão, sentado em seu corredor,
"Mas Ferro – Ferro velho – é mestre de todos eles."
de Ferro Frio por Rudyard Kipling
Os alquimistas árabes e medievais acreditavam que todos os metais e matéria eram compostos do princípio do enxofre, o pai de todos os metais e portador da propriedade combustível, e o princípio do mercúrio, a mãe de todos os metais e portador da liquidez, fusibilidade e propriedades de volatilidade. Esses princípios não eram necessariamente as substâncias comuns enxofre e mercúrio encontradas na maioria dos laboratórios. Essa teoria reforçou a crença de que todos os metais estavam destinados a se tornar ouro nas entranhas da terra por meio de combinações adequadas de calor, digestão, tempo e eliminação de contaminantes, os quais poderiam ser desenvolvidos e acelerados por meio do conhecimento e métodos da alquimia..
Arsênico, zinco, antimônio e bismuto tornaram-se conhecidos, embora inicialmente fossem chamados de semimetais ou metais bastardos por causa de sua imaleabilidade. Todos os quatro podem ter sido usados incidentalmente em épocas anteriores sem reconhecer sua natureza. Acredita-se que Albertus Magnus tenha sido o primeiro a isolar o arsênico de um composto em 1250, aquecendo sabão junto com trissulfeto de arsênico. O zinco metálico, que é quebradiço se impuro, foi isolado na Índia por volta de 1300 DC. A primeira descrição de um procedimento para isolar o antimônio está no livro de 1540 De la pirotechnia de Vannoccio Biringuccio. O bismuto foi descrito por Agricola em De Natura Fossilium (c. 1546); havia sido confundido nos primeiros tempos com estanho e chumbo por causa de sua semelhança com esses elementos.
O Renascimento
O primeiro texto sistemático sobre as artes da mineração e metalurgia foi De la Pirotechnia (1540) de Vannoccio Biringuccio, que trata do exame, fusão e trabalho de metais.
Dezesseis anos depois, Georgius Agricola publicou De Re Metallica em 1556, um relato claro e completo da profissão de mineração, metalurgia e artes e ciências acessórias, além de qualificá-lo como o maior tratado sobre a indústria química até o século XVI.
Ele deu a seguinte descrição de um metal em seu De Natura Fossilium (1546):
O metal é um corpo mineral, por natureza líquido ou um tanto duro. Este último pode ser derretido pelo calor do fogo, mas quando ele resfriou novamente e perdeu todo o calor, torna-se duro novamente e retoma sua forma adequada. A este respeito, difere da pedra que derrete no fogo, pois embora este último recupere sua dureza, mas perde sua forma e propriedades intocadas.
Tradicionalmente há seis tipos diferentes de metais, nomeadamente ouro, prata, cobre, ferro, estanho e chumbo. Há realmente outros, para quicksilver é um metal, embora os alquimistas discordem conosco sobre este assunto, e o bismuth também é. Os antigos escritores gregos parecem ter sido ignorantes do bismute, pelo que Amônio afirma com razão que há muitas espécies de metais, animais e plantas que são desconhecidos para nós. Stibium quando fundido no caduco e refinado tem tanto direito de ser considerado como um metal adequado como é concedido para liderar por escritores. Se quando fundido, uma certa porção ser adicionada ao estanho, a liga de um livreiro é produzida a partir da qual o tipo é feito que é usado por aqueles que imprimem livros em papel.
Cada metal tem sua própria forma que preserva quando separado daqueles metais que foram misturados com ele. Portanto, nem electrum nem Stannum [não significando nossa lata] é de si mesmo um metal real, mas sim uma liga de dois metais. Electrum é uma liga de ouro e prata, Stannum de chumbo e prata. E, no entanto, se a prata se separar do electrum, então o ouro permanece e não electrum; se a prata ser tirada de Stannum, então chumbo permanece e não Stannum.
Se o bronze, no entanto, é encontrado como um metal nativo ou não, não pode ser verificado com qualquer certeza. Nós só sabemos do latão artificial, que consiste de cobre matizado com a cor da calamina mineral. E, no entanto, se algum deve ser desenterrado, seria um metal apropriado. O cobre preto e branco parecem ser diferentes do tipo vermelho.
O metal, portanto, é por natureza ou sólido, como eu disse, ou fluido, como no caso único de quicksilver.
Mas o suficiente agora sobre os tipos simples.
A platina, o terceiro metal precioso depois do ouro e da prata, foi descoberta no Equador durante o período de 1736 a 1744, pelo astrônomo espanhol Antonio de Ulloa e seu colega, o matemático Jorge Juan y Santacilia. Ulloa foi a primeira pessoa a escrever uma descrição científica do metal, em 1748.
Em 1789, o químico alemão Martin Heinrich Klaproth isolou um óxido de urânio, que ele pensou ser o próprio metal. Klaproth foi posteriormente creditado como o descobridor do urânio. Não foi até 1841 que o químico francês Eugène-Melchior Péligot preparou a primeira amostra de urânio metálico. Henri Becquerel posteriormente descobriu a radioatividade em 1896 usando urânio.
Na década de 1790, Joseph Priestley e o químico holandês Martinus van Marum observaram a ação transformadora de superfícies metálicas na desidrogenação do álcool, um desenvolvimento que posteriormente levou, em 1831, à síntese em escala industrial do ácido sulfúrico usando um catalisador de platina.
Em 1803, o cério foi o primeiro dos metais lantanídeos a ser descoberto, em Bastnäs, Suécia por Jöns Jakob Berzelius e Wilhelm Hisinger, e independentemente por Martin Heinrich Klaproth na Alemanha. Os metais lantanídeos foram amplamente considerados esquisitos até a década de 1960, quando foram desenvolvidos métodos para separá-los com mais eficiência. Posteriormente, eles encontraram uso em telefones celulares, ímãs, lasers, iluminação, baterias, conversores catalíticos e em outras aplicações que permitem tecnologias modernas.
Outros metais descobertos e preparados durante este tempo foram cobalto, níquel, manganês, molibdênio, tungstênio e cromo; e alguns dos metais do grupo da platina, paládio, ósmio, irídio e ródio.
Metais leves
Todos os metais descobertos até 1809 tinham densidades relativamente altas; seu peso era considerado um critério singularmente diferenciador. A partir de 1809, metais leves como sódio, potássio e estrôncio foram isolados. Suas baixas densidades desafiaram a sabedoria convencional quanto à natureza dos metais. No entanto, eles se comportaram quimicamente como metais e foram posteriormente reconhecidos como tal.
O alumínio foi descoberto em 1824, mas foi somente em 1886 que um método de produção industrial em larga escala foi desenvolvido. Os preços do alumínio caíram e o alumínio tornou-se amplamente utilizado em joias, itens do dia a dia, armações de óculos, instrumentos ópticos, utensílios de mesa e papel alumínio na década de 1890 e no início do século XX. A capacidade do alumínio de formar ligas duras, mas leves, com outros metais forneceu ao metal muitos usos na época. Durante a Primeira Guerra Mundial, os principais governos exigiram grandes remessas de alumínio para fuselagens fortes e leves. O metal mais comum em uso para a transmissão de energia elétrica atualmente é o condutor de alumínio reforçado com aço. Também vendo muito uso é o condutor de liga de alumínio. O alumínio é usado porque tem cerca de metade do peso de um cabo de cobre de resistência comparável (embora com diâmetro maior devido à menor condutividade específica), além de ser mais barato. O cobre era mais popular no passado e ainda é usado, especialmente em tensões mais baixas e para aterramento.
Embora o titânio metálico puro (99,9%) tenha sido preparado pela primeira vez em 1910, não foi usado fora do laboratório até 1932. Nas décadas de 1950 e 1960, a União Soviética foi pioneira no uso de titânio em aplicações militares e submarinas como parte de programas relacionados à Guerra Fria. A partir do início dos anos 1950, o titânio passou a ser amplamente utilizado na aviação militar, principalmente em jatos de alto desempenho, começando com aeronaves como o F-100 Super Sabre e o Lockheed A-12 e SR-71.
O escândio metálico foi produzido pela primeira vez em 1937. A primeira libra de escândio metálico 99% puro foi produzida em 1960. A produção de ligas de alumínio-escândio começou em 1971, seguindo uma patente dos EUA. Ligas de alumínio-escândio também foram desenvolvidas na URSS.
A era do aço
A era moderna da siderurgia começou com a introdução do processo Bessemer de Henry Bessemer em 1855, cuja matéria-prima era o ferro-gusa. Seu método permitia que ele produzisse aço em grandes quantidades a baixo custo, assim o aço macio passou a ser usado para a maioria dos propósitos para os quais o ferro forjado era usado anteriormente. O processo Gilchrist-Thomas (ou processo Bessemer básico) foi uma melhoria do processo Bessemer, feito revestindo o conversor com um material básico para remover o fósforo.
Devido à sua alta resistência à tração e baixo custo, o aço passou a ser um dos principais componentes utilizados em edifícios, infraestrutura, ferramentas, navios, automóveis, máquinas, eletrodomésticos e armas.
Em 1872, os ingleses Clark e Woods patentearam uma liga que hoje seria considerada um aço inoxidável. A resistência à corrosão das ligas de ferro-cromo foi reconhecida em 1821 pelo metalúrgico francês Pierre Berthier. Ele observou sua resistência ao ataque de alguns ácidos e sugeriu seu uso em talheres. Os metalúrgicos do século 19 eram incapazes de produzir a combinação de baixo teor de carbono e alto teor de cromo encontrada na maioria dos aços inoxidáveis modernos, e as ligas de alto teor de cromo que eles podiam produzir eram muito frágeis para serem práticas. Não foi até 1912 que a industrialização de ligas de aço inoxidável ocorreu na Inglaterra, Alemanha e Estados Unidos.
Os últimos elementos metálicos estáveis
Em 1900, três metais com números atômicos menores que o chumbo (#82), o metal estável mais pesado, ainda não foram descobertos: os elementos 71, 72, 75.
Von Welsbach, em 1906, provou que o antigo itérbio também continha um novo elemento (#71), que ele chamou de cassiopeium. Urbain provou isso simultaneamente, mas suas amostras eram muito impuras e continham apenas vestígios do novo elemento. Apesar disso, seu nome escolhido lutetium foi adotado.
Em 1908, Ogawa encontrou o elemento 75 na torianita, mas o atribuiu como elemento 43 em vez de 75 e o nomeou nipponium. Em 1925, Walter Noddack, Ida Eva Tacke e Otto Berg anunciaram sua separação da gadolinita e deram a ela o nome atual, rênio.
Georges Urbain afirmou ter encontrado o elemento 72 em resíduos de terras raras, enquanto Vladimir Vernadsky o encontrou independentemente em ortita. Nenhuma das alegações foi confirmada devido à Primeira Guerra Mundial e nenhuma delas pôde ser confirmada posteriormente, pois a química relatada por eles não corresponde à agora conhecida pelo háfnio. Após a guerra, em 1922, Coster e Hevesy o encontraram por análise espectroscópica de raios-X em zircão norueguês. O háfnio foi, portanto, o último elemento estável a ser descoberto, embora o rênio tenha sido o último a ser corretamente reconhecido.
No final da Segunda Guerra Mundial, os cientistas haviam sintetizado quatro elementos pós-urânio, todos metais radioativos (instáveis): neptúnio (em 1940), plutônio (1940–41) e cúrio e amerício (1944), representando os elementos 93 a 96. Os dois primeiros também foram encontrados na natureza. O cúrio e o amerício foram subprodutos do projeto Manhattan, que produziu a primeira bomba atômica do mundo em 1945. A bomba foi baseada na fissão nuclear do urânio, um metal que se pensava ter sido descoberto cerca de 150 anos antes.
Desenvolvimentos pós-Segunda Guerra Mundial
Superligas
As superligas compostas de combinações de Fe, Ni, Co e Cr, e quantidades menores de W, Mo, Ta, Nb, Ti e Al foram desenvolvidas logo após a Segunda Guerra Mundial para uso em motores de alto desempenho, operando em elevadas temperaturas (acima de 650 °C (1.200 °F)). Eles retêm a maior parte de sua resistência nessas condições, por períodos prolongados, e combinam boa ductilidade a baixa temperatura com resistência à corrosão ou oxidação. As superligas agora podem ser encontradas em uma ampla gama de aplicações, incluindo turbinas terrestres, marítimas e aeroespaciais e plantas químicas e petrolíferas.
Metais de transcúrio
O desenvolvimento bem-sucedido da bomba atômica no final da Segunda Guerra Mundial desencadeou mais esforços para sintetizar novos elementos, quase todos os quais são, ou espera-se que sejam, metais, e todos são radioativos. Não foi até 1949 que o elemento 97 (berquélio), logo após o elemento 96 (cúrio), foi sintetizado disparando partículas alfa em um alvo de amerício. Em 1952, o elemento 100 (férmio) foi encontrado nos destroços da primeira explosão da bomba de hidrogênio; o hidrogênio, um não-metal, havia sido identificado como um elemento quase 200 anos antes. Desde 1952, os elementos 101 (mendelévio) a 118 (oganesson) foram sintetizados.
Óculos metálicos a granel
Um vidro metálico (também conhecido como metal amorfo ou vítreo) é um material metálico sólido, geralmente uma liga, com uma estrutura desordenada em escala atômica. A maioria dos metais puros e ligados, em seu estado sólido, possui átomos arranjados em uma estrutura cristalina altamente ordenada. Os metais amorfos têm uma estrutura semelhante ao vidro não cristalino. Mas, ao contrário dos vidros comuns, como vidros de janelas, que normalmente são isolantes elétricos, os metais amorfos têm boa condutividade elétrica. Os metais amorfos são produzidos de várias maneiras, incluindo resfriamento extremamente rápido, deposição física de vapor, reação de estado sólido, irradiação de íons e liga mecânica. O primeiro vidro metálico relatado foi uma liga (Au75Si25) produzida na Caltech em 1960. Mais recentemente, lotes de aço amorfo com três vezes a resistência das ligas de aço convencionais foram produzidos. Atualmente, as aplicações mais importantes dependem das propriedades magnéticas especiais de alguns vidros metálicos ferromagnéticos. A baixa perda de magnetização é utilizada em transformadores de alta eficiência. Etiquetas de identificação de controle de roubo e outros esquemas de vigilância de artigos geralmente usam vidros metálicos devido a essas propriedades magnéticas.
Ligas com memória de forma
Uma liga com memória de forma (SMA) é uma liga que "lembra" sua forma original e quando deformado volta ao seu formato pré-deformado quando aquecido. Embora o efeito de memória de forma tenha sido observado pela primeira vez em 1932, em uma liga de Au-Cd, não foi até 1962, com a descoberta acidental do efeito em uma liga de Ni-Ti que a pesquisa começou a sério, e outros dez anos antes aplicações surgiram. Os SMA's têm aplicações em robótica e nas indústrias automotiva, aeroespacial e biomédica. Existe outro tipo de SMA, chamado de liga ferromagnética com memória de forma (FSMA), que muda de forma sob fortes campos magnéticos. Esses materiais são de particular interesse, pois a resposta magnética tende a ser mais rápida e eficiente do que as respostas induzidas pela temperatura.
Ligas quasicristalinas
Em 1984, o químico israelense Dan Shechtman descobriu uma liga de alumínio-manganês com simetria quíntupla, violando a convenção cristalográfica da época que dizia que as estruturas cristalinas só poderiam ter dois, três, quatro ou seis simetria da dobra. Por medo da reação da comunidade científica, ele demorou dois anos para publicar os resultados pelos quais recebeu o Prêmio Nobel de Química em 2011. Desde então, centenas de quasicristais foram relatados e confirmados. Eles existem em muitas ligas metálicas (e alguns polímeros). Quasicristais são encontrados com mais frequência em ligas de alumínio (Al-Li-Cu, Al-Mn-Si, Al-Ni-Co, Al-Pd-Mn, Al-Cu-Fe, Al-Cu-V, etc.), mas numerosas outras composições também são conhecidas (Cd-Yb, Ti-Zr-Ni, Zn-Mg-Ho, Zn-Mg-Sc, In-Ag-Yb, Pd-U-Si, etc.). Os quasicristais efetivamente têm células unitárias infinitamente grandes. Icosaedrita Al63Cu24Fe13, o primeiro quasicristal encontrado na natureza, foi descoberto em 2009. A maioria dos quasicristais tem propriedades semelhantes à cerâmica, incluindo baixo condutividade elétrica (aproximando-se dos valores vistos em isoladores) e baixa condutividade térmica, alta dureza, fragilidade e resistência à corrosão e propriedades antiaderentes. Quasicristais têm sido usados para desenvolver isolamento térmico, LEDs, motores a diesel e novos materiais que convertem calor em eletricidade. Novas aplicações podem aproveitar o baixo coeficiente de fricção e a dureza de alguns materiais quase cristalinos, por exemplo, incorporando partículas em plástico para fazer engrenagens de plástico fortes, resistentes e de baixo atrito. Outras aplicações potenciais incluem absorvedores solares seletivos para conversão de energia, refletores de amplo comprimento de onda e aplicações de reparo ósseo e próteses onde biocompatibilidade, baixo atrito e resistência à corrosão são necessários.
Ligas metálicas complexas
As ligas metálicas complexas (CMAs) são compostos intermetálicos caracterizados por grandes células unitárias compreendendo algumas dezenas até milhares de átomos; a presença de aglomerados de átomos bem definidos (frequentemente com simetria icosaédrica); e desordem parcial dentro de suas redes cristalinas. Eles são compostos de dois ou mais elementos metálicos, às vezes com metaloides ou calcogenetos adicionados. Eles incluem, por exemplo, NaCd2, com 348 átomos de sódio e 768 átomos de cádmio na célula unitária. Linus Pauling tentou descrever a estrutura do NaCd2 em 1923, mas não conseguiu até 1955. Inicialmente chamados de "cristais de células unitárias gigantes", o interesse pelos CMAs, à medida que ser chamado, não pegou até 2002, com a publicação de um artigo chamado "Structurally Complex Alloy Phases", apresentado na 8ª Conferência Internacional sobre Quasicristais. As aplicações potenciais de CMAs incluem como isolamento térmico; Aquecimento solar; refrigeradores magnéticos; usar o calor residual para gerar eletricidade; e revestimentos para pás de turbinas em motores militares.
Ligas de alta entropia
As ligas de alta entropia (HEAs), como AlLiMgScTi, são compostas de quantidades iguais ou quase iguais de cinco ou mais metais. Em comparação com as ligas convencionais com apenas um ou dois metais de base, os HEAs têm relações força-peso consideravelmente melhores, maior resistência à tração e maior resistência à fratura, corrosão e oxidação. Embora os HEAs tenham sido descritos já em 1981, um interesse significativo não se desenvolveu até a década de 2010; eles continuam a ser o foco da pesquisa em ciência e engenharia de materiais devido ao seu potencial para propriedades desejáveis.
Ligas de fase MAX
| Max. | M | A | X |
|---|---|---|---|
| Hf2SnC | Hf | Sn | C |
| Ti4AlN3 | Ti | Al. | N |
| Ti3SiC2 | Ti | Si | C |
| Ti2Alc | Ti | Al. | C |
| C.2Alc2 | C. | Al. | C |
| Ti3Alc2 | Ti | Al. | C |
Em uma liga de fase MAX, M é um metal de transição inicial, A é um elemento do grupo A (principalmente grupo IIIA e IVA, ou grupos 13 e 14), e X é carbono ou nitrogênio. Exemplos são Hf2SnC e Ti4AlN3. Essas ligas têm algumas das melhores propriedades de metais e cerâmicas. Essas propriedades incluem alta condutividade elétrica e térmica, resistência ao choque térmico, tolerância a danos, usinabilidade, alta rigidez elástica e baixos coeficientes de expansão térmica. Eles podem ser polidos para um brilho metálico por causa de suas excelentes condutividades elétricas. Durante o teste mecânico, descobriu-se que os cilindros policristalinos de Ti3SiC2 podem ser comprimidos repetidamente à temperatura ambiente, até tensões de 1 GPa, e se recuperar totalmente após a remoção da carga. Algumas fases MAX também são altamente resistentes ao ataque químico (por exemplo, Ti3SiC2) e à oxidação em alta temperatura no ar (Ti2AlC, Cr2AlC2 e Ti3AlC2). As aplicações potenciais para as ligas de fase MAX incluem: refratários tenazes, usináveis e resistentes a choques térmicos; elementos de aquecimento de alta temperatura; revestimentos para contatos elétricos; e peças resistentes à irradiação de nêutrons para aplicações nucleares. Embora as ligas de fase MAX tenham sido descobertas na década de 1960, o primeiro artigo sobre o assunto não foi publicado até 1996.
Contenido relacionado
Teoria formalista do cinema
Leonardo da Vinci
Célula eletroquímica
Cristal
Hélio