Malária
A malária é uma doença infecciosa transmitida por mosquitos que afeta humanos e outros animais. A malária causa sintomas que geralmente incluem febre, cansaço, vômitos e dores de cabeça. Em casos graves, pode causar icterícia, convulsões, coma ou morte. Os sintomas geralmente começam dez a quinze dias após a picada de um mosquito infectado. Se não for devidamente tratada, as pessoas podem ter recorrências da doença meses depois. Naqueles que sobreviveram recentemente a uma infecção, a reinfecção geralmente causa sintomas mais leves. Essa resistência parcial desaparece ao longo de meses a anos se a pessoa não tiver exposição contínua à malária.
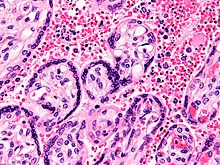
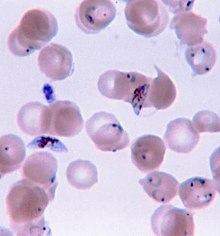
A malária é causada por microrganismos unicelulares do grupo Plasmodium. É transmitida exclusivamente por picadas de mosquitos Anopheles infectados. A picada do mosquito introduz os parasitas da saliva do mosquito no sangue de uma pessoa. Os parasitas viajam para o fígado, onde amadurecem e se reproduzem. Cinco espécies de Plasmodium podem infectar e ser transmitidas por humanos. A maioria das mortes é causada por P. falciparum, enquanto P. vivax, P. ovale e P. malariae geralmente causa uma forma mais branda de malária. A espécie P. knowlesi raramente causa doenças em humanos. A malária é tipicamente diagnosticada pelo exame microscópico do sangue usando esfregaços de sangue ou com testes de diagnóstico rápido baseados em antígenos. Métodos que usam a reação em cadeia da polimerase para detectar o DNA do parasita foram desenvolvidos, mas não são amplamente utilizados em áreas onde a malária é comum, devido ao seu custo e complexidade.
O risco de doenças pode ser reduzido prevenindo picadas de mosquitos por meio do uso de mosquiteiros e repelentes de insetos ou com medidas de controle de mosquitos, como pulverização de inseticidas e drenagem de água parada. Vários medicamentos estão disponíveis para prevenir a malária para viajantes em áreas onde a doença é comum. Doses ocasionais da medicação combinada sulfadoxina/pirimetamina são recomendadas em lactentes e após o primeiro trimestre de gravidez em áreas com altas taxas de malária. A partir de 2020, existe uma vacina que demonstrou reduzir o risco de malária em cerca de 40% em crianças na África. Um estudo de pré-impressão de outra vacina mostrou 77% de eficácia da vacina. Esforços para desenvolver vacinas mais eficazes estão em andamento. O tratamento recomendado para a malária é uma combinação de medicamentos antimaláricos que inclui artemisinina. O segundo medicamento pode ser mefloquina, lumefantrina ou sulfadoxina/pirimetamina. A quinina, junto com a doxiciclina, pode ser usada se a artemisinina não estiver disponível. Recomenda-se que em áreas onde a doença é comum, a malária seja confirmada, se possível, antes do início do tratamento devido a preocupações de aumento da resistência aos medicamentos. A resistência entre os parasitas desenvolveu-se a vários medicamentos antimaláricos; por exemplo, P resistente à cloroquina. falciparum se espalhou para a maioria das áreas de malária, e a resistência à artemisinina tornou-se um problema em algumas partes do Sudeste Asiático.
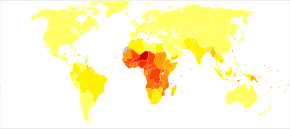
A doença é generalizada nas regiões tropicais e subtropicais que existem em uma ampla faixa ao redor do equador. Isso inclui grande parte da África subsaariana, Ásia e América Latina. Em 2021, houve 247 milhões de casos de malária em todo o mundo, resultando em cerca de 619.000 mortes. Aproximadamente 95% dos casos e mortes ocorreram na África subsaariana. As taxas da doença diminuíram de 2010 a 2014, mas aumentaram de 2015 a 2021. A malária é comumente associada à pobreza e tem um efeito negativo significativo no desenvolvimento econômico. Na África, estima-se que resulte em perdas de US$ 12 bilhões por ano devido ao aumento dos custos com saúde, perda de capacidade de trabalho e efeitos adversos no turismo.
Sinais e complicações
Os adultos com malária tendem a sentir calafrios e febre – classicamente em episódios intensos periódicos com duração de cerca de seis horas, seguidos de um período de sudorese e alívio da febre – além de dor de cabeça, fadiga, desconforto abdominal e dores musculares. As crianças tendem a ter sintomas mais gerais: febre, tosse, vômito e diarréia.
As manifestações iniciais da doença – comuns a todas as espécies de malária – são semelhantes aos sintomas da gripe e podem se assemelhar a outras condições, como sepse, gastroenterite e doenças virais. A apresentação pode incluir dor de cabeça, febre, calafrios, dor nas articulações, vômitos, anemia hemolítica, icterícia, hemoglobina na urina, danos na retina e convulsões.
O sintoma clássico da malária é o paroxismo—uma ocorrência cíclica de frio súbito seguido de calafrios e depois febre e sudorese, ocorrendo a cada dois dias (febre terçã) em P. vivax e P. ovale, e a cada três dias (febre quartan) para P. malária. P. falciparum pode causar febre recorrente a cada 36-48 horas, ou uma febre menos pronunciada e quase contínua.
Os sintomas geralmente começam 10 a 15 dias após a picada inicial do mosquito, mas podem ocorrer até vários meses após a infecção por algum P. vivax estirpes. Os viajantes que tomam medicamentos preventivos contra a malária podem desenvolver sintomas quando param de tomar os medicamentos.
A malária grave é geralmente causada por P. falciparum (muitas vezes referida como malária falciparum). Os sintomas da malária falciparum surgem 9 a 30 dias após a infecção. Indivíduos com malária cerebral frequentemente apresentam sintomas neurológicos, incluindo postura anormal, nistagmo, paralisia do olhar conjugado (incapacidade dos olhos de se virarem juntos na mesma direção), opistótono, convulsões ou coma.
Complicações
A malária tem várias complicações graves. Entre eles está o desenvolvimento de dificuldade respiratória, que ocorre em até 25% dos adultos e 40% das crianças com P grave. falciparum malária. As possíveis causas incluem compensação respiratória da acidose metabólica, edema pulmonar não cardiogênico, pneumonia concomitante e anemia grave. Embora rara em crianças pequenas com malária grave, a síndrome do desconforto respiratório agudo ocorre em 5 a 25% dos adultos e em até 29% das mulheres grávidas. A co-infecção do HIV com a malária aumenta a mortalidade. A insuficiência renal é uma característica da febre da água negra, em que a hemoglobina dos glóbulos vermelhos lisados vaza para a urina.
Infecção por P. falciparum pode resultar em malária cerebral, uma forma de malária grave que envolve encefalopatia. Está associada ao branqueamento da retina, que pode ser um sinal clínico útil para distinguir a malária de outras causas de febre. Pode ocorrer aumento do baço, aumento do fígado ou ambos, dor de cabeça intensa, baixo nível de açúcar no sangue e hemoglobina na urina com insuficiência renal. As complicações podem incluir sangramento espontâneo, coagulopatia e choque.
A malária em mulheres grávidas é uma causa importante de natimortos, mortalidade infantil, aborto espontâneo e baixo peso ao nascer, particularmente em P. falciparum, mas também com P. vivax.
Causa
A malária é causada pela infecção por parasitas do gênero Plasmodium. Em humanos, a malária é causada por seis espécies de Plasmodium: P. falciparum, P. malariae, P. ovale curtisi, P. ovale wallikeri, P. vivax e P. conhecimento. Entre os infectados, P. falciparum é a espécie mais comum identificada (~75%) seguida por P. vivax (~20%). Embora P. falciparum é tradicionalmente responsável pela maioria das mortes, evidências recentes sugerem que P. vivax a malária está associada a condições potencialmente fatais tão freqüentemente quanto com um diagnóstico de P. falciparum infecção. P. vivax proporcionalmente é mais comum fora da África. Foram documentadas infecções humanas com várias espécies de Plasmodium de macacos superiores; no entanto, exceto para P. knowlesi—uma espécie zoonótica que causa malária em macacos—estes são principalmente de importância limitada para a saúde pública.
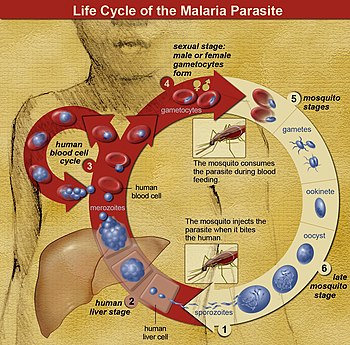
Os parasitas são normalmente introduzidos pela picada de um mosquito Anopheles infectado. O que esses parasitas inoculados, chamados de "esporozoítos", fazem exatamente na pele e nos vasos linfáticos, ainda não foi determinado com precisão. No entanto, uma porcentagem de esporozoítos segue a corrente sanguínea até o fígado, onde invadem os hepatócitos. Eles crescem e se dividem no fígado por 2 a 10 dias, com cada hepatócito infectado eventualmente abrigando até 40.000 parasitas. Os hepatócitos infectados se decompõem, liberando esta forma invasiva de células Plasmodium, chamadas de "merozoítos" na corrente sanguínea. No sangue, os merozoítos invadem rapidamente os glóbulos vermelhos individuais, replicando-se ao longo de 24 a 72 horas para formar 16 a 32 novos merozoítos. Os glóbulos vermelhos infectados sofrem lise e os novos merozoítos infectam novos glóbulos vermelhos, resultando em um ciclo que amplifica continuamente o número de parasitas em uma pessoa infectada. No entanto, a maioria dos P. vivax que replica a biomassa de merozoítos é agora (desde 2021) conhecido por estar escondido no baço e na medula óssea (talvez em outros lugares também), apoiando assim a teoria astuta, de longa data (desde 2011), mas anteriormente ignorada, de que a não circulação merozoítos são a fonte de muitos P. vivax recorrências de malária (consulte a seção “Malária recorrente” abaixo). Ao longo das rodadas desse ciclo de infecção de glóbulos vermelhos na corrente sanguínea e em outros lugares, uma pequena porção de parasitas não se replica, mas se desenvolve em parasitas em estágio sexual inicial chamados de "gametócitos" masculinos e femininos. Esses gametócitos se desenvolvem na medula óssea por 11 dias, depois retornam à circulação sanguínea para aguardar a captação pela picada de outro mosquito. Uma vez dentro de um mosquito, os gametócitos passam por reprodução sexual e eventualmente formam esporozoítos filhos que migram para as glândulas salivares do mosquito para serem injetados em um novo hospedeiro quando o mosquito pica.
A infecção hepática não causa sintomas; todos os sintomas da malária resultam da infecção dos glóbulos vermelhos. Os sintomas se desenvolvem quando há mais de 100.000 parasitas por mililitro de sangue. Muitos dos sintomas associados à malária grave são causados pela tendência de P. falciparum para se ligar às paredes dos vasos sanguíneos, resultando em danos aos vasos afetados e ao tecido circundante. Os parasitas sequestrados nos vasos sanguíneos do pulmão contribuem para a insuficiência respiratória. No cérebro, eles contribuem para o coma. Na placenta, eles contribuem para baixo peso ao nascer e trabalho de parto prematuro, e aumentam o risco de aborto e natimorto. A destruição de glóbulos vermelhos durante a infecção geralmente resulta em anemia, exacerbada pela produção reduzida de novos glóbulos vermelhos durante a infecção.
Somente mosquitos fêmeas se alimentam de sangue; mosquitos machos se alimentam de néctar de plantas e não transmitem a doença. As fêmeas do gênero de mosquito Anopheles preferem se alimentar à noite. Eles geralmente começam a procurar uma refeição ao entardecer e continuam durante a noite até conseguirem. Os parasitas da malária também podem ser transmitidos por transfusões de sangue, embora isso seja raro.
Malária recorrente
Os sintomas da malária podem reaparecer após vários períodos sem sintomas. Dependendo da causa, a recorrência pode ser classificada como recrudescência, recaída ou reinfecção. A recrudescência é quando os sintomas retornam após um período sem sintomas e a origem são parasitas que sobreviveram no sangue como resultado de tratamento inadequado ou ineficaz. A recaída é quando os sintomas reaparecem após os parasitas terem sido eliminados do sangue e a fonte de recorrência são parasitas ativados que persistiram como hipnozoítos dormentes nas células do fígado. A recidiva geralmente ocorre após 8–24 semanas e é frequentemente observada em P. vivax e P. ovale infecções. No entanto, P. vivax as recorrências provavelmente estão sendo atribuídas à ativação do hipnozoíto. Alguns deles podem ter origem extravascular ou merozoíta sequestrada, tornando essas recorrências recrudescências, não recidivas. Recentemente reconhecidas, não-hipnozoítas, possíveis fontes contribuintes para P periféricos recorrentes. vivax parasitemia são formas eritrocíticas na medula óssea e no baço. P. vivax casos de malária em áreas temperadas geralmente envolvem hibernação por hipnozoítos, com recaídas começando no ano após a picada do mosquito. Reinfecção significa que os parasitas responsáveis pela infecção anterior foram eliminados do corpo, mas um novo parasita foi introduzido. A reinfecção não pode ser facilmente distinguida da recidiva e recrudescência, embora a recorrência da infecção dentro de duas semanas após o tratamento para as manifestações iniciais da malária seja tipicamente atribuída ao fracasso do tratamento. Mas fazer isso não é necessariamente correto. As pessoas podem desenvolver alguma imunidade quando expostas a infecções frequentes.
Fisiopatologia
A infecção por malária se desenvolve em duas fases: uma que envolve o fígado (fase exoeritrocítica) e outra que envolve glóbulos vermelhos ou eritrócitos (fase eritrocítica). Quando um mosquito infectado perfura a pele de uma pessoa para se alimentar de sangue, os esporozoítos na saliva do mosquito entram na corrente sanguínea e migram para o fígado, onde infectam os hepatócitos, multiplicando-se assexuadamente e assintomaticamente por um período de 8 a 30 dias.
Após um potencial período de dormência no fígado, esses organismos se diferenciam para produzir milhares de merozoítos, que, após a ruptura de suas células hospedeiras, escapam para o sangue e infectam os glóbulos vermelhos para iniciar o estágio eritrocitário do ciclo de vida. O parasita escapa do fígado sem ser detectado, envolvendo-se na membrana celular da célula hepática hospedeira infectada.
Dentro dos glóbulos vermelhos, os parasitas se multiplicam ainda mais, novamente de forma assexuada, saindo periodicamente de suas células hospedeiras para invadir novos glóbulos vermelhos. Ocorrem vários desses ciclos de amplificação. Assim, as descrições clássicas de ondas de febre surgem de ondas simultâneas de merozoítos que escapam e infectam os glóbulos vermelhos.
Alguns P. vivax esporozoítos não se desenvolvem imediatamente em merozoítos de fase exoeritrocítica, mas, em vez disso, produzem hipnozoítos que permanecem dormentes por períodos que variam de vários meses (7 a 10 meses é típico) a vários anos. Após um período de dormência, eles se reativam e produzem merozoítos. Os hipnozoítos são responsáveis por longa incubação e recidivas tardias em P. vivax, embora sua existência em P. ovale é incerto.
O parasita é relativamente protegido do ataque do sistema imunológico do corpo porque, durante a maior parte de seu ciclo de vida humano, ele reside no fígado e nas células sanguíneas e é relativamente invisível à vigilância imunológica. No entanto, as células sanguíneas infectadas circulantes são destruídas no baço. Para evitar esse destino, o P. falciparum parasita exibe proteínas adesivas na superfície das células sanguíneas infectadas, fazendo com que as células sanguíneas grudem nas paredes de pequenos vasos sanguíneos, sequestrando assim a passagem do parasita pela circulação geral e pelo baço. O bloqueio da microvasculatura causa sintomas como os da malária placentária. Glóbulos vermelhos sequestrados podem romper a barreira hematoencefálica e causar malária cerebral.
Resistência genética
De acordo com uma revisão de 2005, devido aos altos níveis de mortalidade e morbidade causados pela malária—especialmente o P. falciparum espécie - colocou a maior pressão seletiva sobre o genoma humano na história recente. Vários fatores genéticos fornecem alguma resistência a ela, incluindo traço falciforme, traços de talassemia, deficiência de glicose-6-fosfato desidrogenase e ausência de antígenos Duffy nos glóbulos vermelhos.
O impacto do traço falciforme na imunidade contra a malária ilustra algumas compensações evolutivas que ocorreram devido à malária endêmica. O traço falciforme causa uma alteração na molécula de hemoglobina no sangue. Normalmente, os glóbulos vermelhos têm uma forma bicôncava muito flexível que lhes permite mover-se através de capilares estreitos; no entanto, quando as moléculas de hemoglobina S modificadas são expostas a baixas quantidades de oxigênio ou se aglomeram devido à desidratação, elas podem se unir formando filamentos que fazem com que a célula se distorça em uma forma de foice curva. Nessas cadeias, a molécula não é tão eficaz em captar ou liberar oxigênio, e a célula não é flexível o suficiente para circular livremente. Nos estágios iniciais da malária, o parasita pode causar a falcização dos glóbulos vermelhos infectados e, portanto, eles são removidos da circulação mais cedo. Isso reduz a frequência com que os parasitas da malária completam seu ciclo de vida na célula. Indivíduos homozigotos (com duas cópias do alelo beta da hemoglobina anormal) têm anemia falciforme, enquanto aqueles que são heterozigotos (com um alelo anormal e um alelo normal) apresentam resistência à malária sem anemia grave. Embora a expectativa de vida mais curta para aqueles com a condição homozigótica tendesse a desfavorecer a sobrevivência da característica, a característica é preservada em regiões propensas à malária por causa dos benefícios fornecidos pela forma heterozigótica.
Disfunção hepática
A disfunção hepática como resultado da malária é incomum e geralmente ocorre apenas em pessoas com outra condição hepática, como hepatite viral ou doença hepática crônica. A síndrome às vezes é chamada de hepatite malárica. Embora tenha sido considerada uma ocorrência rara, a hepatopatia malárica tem aumentado, particularmente no sudeste da Ásia e na Índia. O comprometimento do fígado em pessoas com malária se correlaciona com uma maior probabilidade de complicações e morte.
Diagnóstico
Devido à natureza inespecífica dos sintomas da malária, o diagnóstico é normalmente suspeitado com base nos sintomas e no histórico de viagens, e confirmado com um teste laboratorial para detectar a presença do parasita no sangue (teste parasitológico). Em áreas onde a malária é comum, a Organização Mundial da Saúde (OMS) recomenda que os médicos suspeitem da malária em qualquer pessoa que relate ter febre ou que tenha uma temperatura atual acima de 37,5°C sem qualquer outra causa óbvia. Deve-se suspeitar de malária em crianças com sinais de anemia: palmas das mãos pálidas ou um teste de laboratório mostrando níveis de hemoglobina abaixo de 8 gramas por decilitro de sangue. Em áreas do mundo com pouca ou nenhuma malária, a OMS recomenda testar apenas pessoas com possível exposição à malária (geralmente viajam para uma área endêmica de malária) e febre inexplicável.
A malária é geralmente confirmada pelo exame microscópico de esfregaços de sangue ou por testes de diagnóstico rápido (RDT) baseados em antígenos. A microscopia – ou seja, examinar o sangue manchado com Giemsa com um microscópio de luz – é o padrão-ouro para o diagnóstico da malária. Os microscopistas normalmente examinam tanto uma "película espessa" de sangue, permitindo-lhes escanear muitas células sanguíneas em um curto espaço de tempo, e um "filme fino" de sangue, permitindo que eles vejam claramente os parasitas individuais e identifiquem as espécies de Plasmodium infectantes. Em condições típicas de laboratório de campo, um microscopista pode detectar parasitas quando há pelo menos 100 parasitas por microlitro de sangue, que está em torno da faixa inferior de infecção sintomática. O diagnóstico microscópico é relativamente intensivo em recursos, exigindo pessoal treinado, equipamento específico, eletricidade e um suprimento consistente de lâminas e corantes de microscopia.
Em locais onde a microscopia não está disponível, a malária é diagnosticada com RDTs, testes rápidos de antígenos que detectam proteínas do parasita em uma amostra de sangue de picada no dedo. Uma variedade de RDTs está disponível comercialmente, visando as proteínas do parasita, proteína rica em histidina 2 (HRP2, detecta apenas P. falciparum), lactato desidrogenase ou aldolase. O teste HRP2 é amplamente utilizado na África, onde P. falciparum predomina. No entanto, como o HRP2 persiste no sangue por até cinco semanas após o tratamento da infecção, um teste de HRP2 às vezes não consegue distinguir se alguém tem malária no momento ou já teve. Além disso, alguns P. falciparum na região amazônica não possui o gene HRP2, dificultando a detecção. Os RDTs são implantados de forma rápida e fácil em locais sem laboratórios de diagnóstico completos. No entanto, eles fornecem consideravelmente menos informações do que a microscopia e, às vezes, variam em qualidade de produtor para produtor e de lote para lote.
Testes sorológicos para detectar anticorpos contra Plasmodium no sangue foram desenvolvidos, mas não são usados para o diagnóstico da malária devido à sua sensibilidade e especificidade relativamente baixas. Testes de amplificação de ácidos nucleicos altamente sensíveis foram desenvolvidos, mas não são usados clinicamente devido ao seu custo relativamente alto e baixa especificidade para infecções ativas.
Classificação
A malária é classificada em "grave" ou "descomplicado" pela Organização Mundial da Saúde (OMS). É considerado grave quando qualquer dos critérios a seguir está presente, caso contrário, é considerado não complicado.
- Consciência crescente
- fraqueza significativa tal que a pessoa é incapaz de andar
- Incapacidade de alimentar
- Duas ou mais convulsões
- Baixa pressão arterial (menos de 70 mmHg em adultos e 50 mmHg em crianças)
- Problemas de respiração
- Choque circular
- Falha renal ou hemoglobina na urina
- Bleeding problemas, ou hemoglobina menos de 50 g/L (5 g/dL)
- Oedema pulmonar
- glicose no sangue inferior a 2,2 mmol/L (40 mg/dL)
- Acidose ou níveis de lactato maiores que 5 mmol/L
- Um nível de parasita no sangue de mais de 100.000 por microlitros (μL) em áreas de transmissão de baixa intensidade, ou 250.000 por μL em áreas de transmissão de alta intensidade
A malária cerebral é definida como uma P. falciparum-malária apresentando sintomas neurológicos, incluindo coma (com escala de coma de Glasgow menor que 11, ou escala de coma de Blantyre menor que 3), ou coma que dura mais de 30 minutos após uma convulsão.
Prevenção
Os métodos usados para prevenir a malária incluem medicamentos, eliminação de mosquitos e prevenção de picadas. A partir de 2022, existe uma vacina para malária (conhecida como RTS,S) que está licenciada para uso. A presença da malária em uma área requer uma combinação de alta densidade populacional humana, alta densidade populacional de mosquitos Anopheles e altas taxas de transmissão de humanos para mosquitos e de mosquitos para humanos. Se algum deles for reduzido o suficiente, o parasita eventualmente desaparece dessa área, como aconteceu na América do Norte, Europa e partes do Oriente Médio. No entanto, a menos que o parasita seja eliminado de todo o mundo, ele pode se restabelecer se as condições reverterem para uma combinação que favoreça a reprodução do parasita. Além disso, o custo por pessoa para eliminar os mosquitos anófeles aumenta com a diminuição da densidade populacional, tornando-se economicamente inviável em algumas áreas.
A prevenção da malária pode ser mais econômica do que o tratamento da doença a longo prazo, mas os custos iniciais necessários estão fora do alcance de muitas das pessoas mais pobres do mundo. Há uma grande diferença nos custos de controle (ou seja, manutenção de baixa endemicidade) e programas de eliminação entre os países. Por exemplo, na China – cujo governo em 2010 anunciou uma estratégia para buscar a eliminação da malária nas províncias chinesas – o investimento necessário é uma pequena proporção dos gastos públicos com saúde. Em contraste, um programa semelhante na Tanzânia custaria cerca de um quinto do orçamento da saúde pública. Em 2021, a Organização Mundial da Saúde confirmou que a China eliminou a malária.
Em áreas onde a malária é comum, as crianças com menos de cinco anos de idade costumam ter anemia, que às vezes é causada pela malária. Administrar medicamentos antimaláricos preventivos a crianças com anemia nessas áreas melhora ligeiramente os níveis de glóbulos vermelhos, mas não afeta o risco de morte ou a necessidade de hospitalização.
Controle de mosquitos
Controle de vetores refere-se a métodos usados para diminuir a malária, reduzindo os níveis de transmissão por mosquitos. Para proteção individual, os repelentes de insetos mais eficazes são à base de DEET ou picaridina. No entanto, não há evidências suficientes de que repelentes de mosquitos possam prevenir a infecção por malária. Os mosquiteiros tratados com inseticida (ITNs) e a pulverização residual interna (IRS) são eficazes, têm sido comumente usados para prevenir a malária e seu uso contribuiu significativamente para a diminuição da malária no século XXI. ITNs e IRS podem não ser suficientes para eliminar a doença, pois estas intervenções dependem de quantas pessoas usam mosquiteiros, quantas lacunas de inseticida existem (áreas de baixa cobertura), se as pessoas não estão protegidas quando estão fora de casa e um aumento em mosquitos resistentes a inseticidas. Modificações nas casas das pessoas para evitar a exposição ao mosquito podem ser uma importante medida de prevenção a longo prazo.
Rede com inseticida
Os mosquiteiros ajudam a manter os mosquitos longe das pessoas e reduzem as taxas de infecção e transmissão da malária. As redes não são uma barreira perfeita e muitas vezes são tratadas com um inseticida projetado para matar o mosquito antes que ele tenha tempo de encontrar uma maneira de passar pela rede. Estima-se que os mosquiteiros tratados com inseticida (ITNs) sejam duas vezes mais eficazes que os mosquiteiros não tratados e ofereçam mais de 70% de proteção em comparação com nenhum mosquiteiro. Entre 2000 e 2008, o uso de ITNs salvou a vida de cerca de 250.000 bebês na África Subsaariana. Cerca de 13% das famílias nos países subsaarianos possuíam MTI em 2007 e estima-se que 31% das famílias africanas possuíam pelo menos uma MTI em 2008. Em 2000, 1,7 milhão (1,8%) crianças africanas vivendo em áreas do mundo onde a malária é comum foram protegidos por um ITN. Esse número aumentou para 20,3 milhões (18,5%) de crianças africanas usando ITNs em 2007, deixando 89,6 milhões de crianças desprotegidas e para 68% de crianças africanas usando mosquiteiros em 2015. A maioria das redes está impregnada com piretróides, uma classe de inseticidas com baixa toxicidade. Eles são mais eficazes quando usados do anoitecer ao amanhecer. Recomenda-se pendurar um grande "rede para cama" acima do centro de uma cama e dobre as bordas sob o colchão ou certifique-se de que seja grande o suficiente para tocar o chão. Os ITNs são benéficos para os resultados da gravidez em regiões endêmicas de malária na África, mas são necessários mais dados na Ásia e na América Latina.
Em áreas de alta resistência à malária, o butóxido de piperonila (PBO) combinado com piretróides em mosquiteiros é eficaz na redução das taxas de infecção por malária. Permanecem dúvidas sobre a durabilidade do PBO nas redes, pois o impacto na mortalidade do mosquito não foi sustentado após vinte lavagens em ensaios experimentais.
Pulverização residual interna
A pulverização residual interna é a pulverização de inseticidas nas paredes dentro de uma casa. Após a alimentação, muitos mosquitos descansam em uma superfície próxima enquanto digerem a refeição de sangue; portanto, se as paredes das casas forem revestidas com inseticidas, os mosquitos que descansam podem ser mortos antes que possam picar outra pessoa e transferir o parasita da malária. A partir de 2006, a Organização Mundial da Saúde recomendou 12 inseticidas em operações de IRS, incluindo DDT e os piretróides ciflutrina e deltametrina. Esse uso de saúde pública de pequenas quantidades de DDT é permitido pela Convenção de Estocolmo, que proíbe seu uso na agricultura. Um problema com todas as formas de IRS é a resistência a inseticidas. Os mosquitos afetados pela PRI tendem a descansar e viver dentro de casa, e devido à irritação causada pela pulverização, seus descendentes tendem a descansar e viver ao ar livre, o que os torna menos afetados pela PRI. Comunidades que usam mosquiteiros tratados com inseticida, além de pulverização residual interna com 'sem piretróide' inseticidas encontraram reduções associadas na malária. Além disso, o uso de 'tipo piretróide' inseticidas, além da pulverização residual interna, não resultaram em um benefício adicional detectável em comunidades que usam mosquiteiros tratados com inseticida.
Modificações de habitação
A habitação é um fator de risco para a malária e modificar a casa como medida de prevenção pode ser uma estratégia sustentável que não depende da eficácia de inseticidas como os piretróides. O ambiente físico dentro e fora de casa que pode melhorar a densidade de mosquitos são considerações. Exemplos de possíveis modificações incluem a proximidade da casa aos criadouros de mosquitos, drenagem e abastecimento de água perto de casa, disponibilidade de locais de descanso de mosquitos (vegetação ao redor da casa), proximidade de gado e animais domésticos e melhorias físicas ou modificações em o design da casa para evitar a entrada de mosquitos.
Outros métodos de controle de mosquitos
As pessoas tentaram vários outros métodos para reduzir as picadas de mosquito e retardar a propagação da malária. Esforços para diminuir as larvas do mosquito, diminuindo a disponibilidade de água aberta onde se desenvolvem, ou adicionando substâncias para diminuir seu desenvolvimento, são eficazes em alguns locais. Dispositivos eletrônicos repelentes de mosquitos, que emitem sons de alta frequência que deveriam manter os mosquitos fêmeas afastados, não têm evidências de eficácia. Há uma evidência de baixa certeza de que a nebulização pode ter um efeito na transmissão da malária. A administração manual de inseticidas químicos ou microbianos em corpos d'água contendo baixa distribuição de larvas pode reduzir a transmissão da malária. Não há evidências suficientes para determinar se os peixes larvívoros podem diminuir a densidade e a transmissão do mosquito na área.
Medicamentos
Existem vários medicamentos que podem ajudar a prevenir ou interromper a malária em viajantes para locais onde a infecção é comum. Muitos desses medicamentos também são usados no tratamento. Em locais onde o Plasmodium é resistente a um ou mais medicamentos, três medicamentos – mefloquina, doxiciclina ou a combinação de atovaquona/proguanil (Malarone) – são frequentemente usados para prevenção. A doxiciclina e a atovaquona/proguanil são mais bem toleradas, enquanto a mefloquina é tomada uma vez por semana. Áreas do mundo com malária sensível à cloroquina são incomuns. A administração em massa de medicamentos antimaláricos a uma população inteira ao mesmo tempo pode reduzir o risco de contrair malária na população; no entanto, a eficácia da administração de medicamentos em massa pode variar dependendo da prevalência da malária na área. Outros fatores, como a administração de medicamentos e outras medidas de proteção, como o controle de mosquitos, a proporção de pessoas tratadas na área e o risco de reinfecção com malária, podem desempenhar um papel na eficácia das abordagens de tratamento medicamentoso em massa.
O efeito protetor não começa imediatamente e as pessoas que visitam áreas onde existe malária geralmente começam a tomar os medicamentos uma a duas semanas antes de chegarem e continuam a tomá-los por quatro semanas após a partida (exceto para atovaquone/proguanil, que só precisa a ser iniciado dois dias antes e continuado por sete dias depois). O uso de medicamentos preventivos muitas vezes não é prático para quem mora em áreas onde existe malária, e seu uso geralmente é dado apenas a mulheres grávidas e visitantes de curto prazo. Isso se deve ao custo dos medicamentos, aos efeitos colaterais do uso prolongado e à dificuldade de obter medicamentos antimaláricos fora dos países ricos. Durante a gravidez, verificou-se que a medicação para prevenir a malária melhora o peso do bebê ao nascer e diminui o risco de anemia na mãe. O uso de medicamentos preventivos na presença de mosquitos transmissores da malária pode estimular o desenvolvimento de resistência parcial.
A administração de medicamentos antimaláricos a bebês por meio de terapia preventiva intermitente pode reduzir o risco de infecção por malária, internação hospitalar e anemia.
A mefloquina é mais eficaz do que a sulfadoxina-pirimetamina na prevenção da malária em mulheres grávidas HIV negativas. O cotrimoxazol é eficaz na prevenção da infecção por malária e reduz o risco de contrair anemia em mulheres HIV positivas. Administrar sulfadoxina-pirimetamina por três ou mais doses como terapia preventiva intermitente é superior a duas doses para mulheres HIV-positivas que vivem em áreas endêmicas de malária.
O tratamento imediato de casos confirmados com terapias combinadas à base de artemisinina (ACTs) também pode reduzir a transmissão.
Outros
A participação da comunidade e as estratégias de educação em saúde que promovem a conscientização sobre a malária e a importância das medidas de controle têm sido usadas com sucesso para reduzir a incidência da malária em algumas áreas do mundo em desenvolvimento. Reconhecer a doença nos estágios iniciais pode evitar que ela se torne fatal. A educação também pode informar as pessoas para cobrir áreas de água estagnada e parada, como tanques de água que são criadouros ideais para o parasita e o mosquito, reduzindo assim o risco de transmissão entre as pessoas. Isso geralmente é usado em áreas urbanas onde há grandes centros populacionais em um espaço confinado e a transmissão seria mais provável nessas áreas. A terapia preventiva intermitente é outra intervenção que tem sido usada com sucesso para controlar a malária em mulheres grávidas e bebês e em crianças em idade pré-escolar, onde a transmissão é sazonal.
Tratamento
A malária é tratada com medicamentos antimaláricos; os usados depende do tipo e gravidade da doença. Embora os medicamentos contra a febre sejam comumente usados, seus efeitos sobre os resultados não são claros. Fornecer medicamentos antimaláricos gratuitos para as famílias pode reduzir as mortes infantis quando usados adequadamente. Programas que presumivelmente tratam todas as causas de febre com antimaláricos podem levar ao uso excessivo de antimaláricos e subtratar outras causas de febre. No entanto, o uso de kits de diagnóstico rápido de malária pode ajudar a reduzir o uso excessivo de antimaláricos.
Malária não complicada
A malária simples ou não complicada pode ser tratada com medicamentos orais. Os medicamentos à base de artemisinina são eficazes e seguros no tratamento da malária não complicada. A artemisinina em combinação com outros antimaláricos (conhecida como terapia de combinação de artemisinina, ou ACT) é cerca de 90% eficaz quando usada para tratar a malária não complicada. O tratamento mais eficaz para P. falciparum é o uso de ACT, que diminui a resistência a qualquer componente único da droga. O arteméter-lumefantrina (regime de seis doses) é mais eficaz do que o arteméter-lumefantrina (regime de quatro doses) ou outros regimes que não contenham derivados de artemisinina no tratamento da malária falciparum. Outra combinação recomendada é dihidroartemisinina e piperaquina. A terapia combinada de artemisinina-naftoquina mostrou resultados promissores no tratamento da malária falciparum. No entanto, mais pesquisas são necessárias para estabelecer sua eficácia como um tratamento confiável. Artesunato mais mefloquina tem melhor desempenho do que mefloquina sozinha no tratamento de malária falciparum não complicada em ambientes de baixa transmissão. Atovaquone-proguanil é eficaz contra falciparum não complicado com uma possível taxa de falha de 5% a 10%; a adição de artesunato pode reduzir a taxa de falha. A monoterapia ou terapia combinada com azitromicina não demonstrou eficácia no tratamento da malária por plasmódio ou vivax. Amodiaquina mais sulfadoxina-pirimetamina pode alcançar menos falhas de tratamento quando comparada à sulfadoxina-pirimetamina sozinha na malária falciparum não complicada. Não há dados suficientes sobre clorproguanil-dapsona no tratamento da malária falciparum não complicada. A adição de primaquina à terapia combinada à base de artemisinina para malária falciparum reduz sua transmissão no dia 3-4 e no dia 8 da infecção. Sulfadoxina-pirimetamina mais artesunato é melhor do que sulfadoxina-pirimetamina mais amodiaquina no controle da falha do tratamento no dia 28. No entanto, o último é melhor do que o primeiro na redução de gametócitos no sangue no dia 7.
Infecção por P. vivax, P. ovale ou P. malariae geralmente não requer hospitalização. Tratamento de P. vivax requer tanto a eliminação dos estágios sanguíneos (usando cloroquina ou terapia combinada à base de artemisinina) quanto a eliminação das formas hepáticas com um agente 8-aminoquinolina, como primaquina ou tafenoquina.
A visão de que as drogas 8-aminoquinolina matam os parasitas no fígado é a convencional. No entanto, há razões para acreditar que a primaquina pode, em uma extensão atualmente desconhecida, também inativar merozoítos extra-hepáticos não circulantes (espera-se que em breve haja clareza a esse respeito).
Para tratar a malária durante a gravidez, a OMS recomenda o uso de quinino mais clindamicina no início da gravidez (1º trimestre) e ACT nas fases posteriores (2º e 3º trimestres). Existem dados limitados de segurança sobre os medicamentos antimaláricos na gravidez.
Malária grave e complicada
Casos de malária grave e complicada são quase sempre causados por infecção com P. falciparum. As outras espécies geralmente causam apenas doença febril. Casos graves e complicados de malária são emergências médicas, pois as taxas de mortalidade são altas (10% a 50%).
O tratamento recomendado para a malária grave é o uso intravenoso de medicamentos antimaláricos. Para a malária grave, o artesunato parenteral foi superior ao quinino em crianças e adultos. Em outra revisão sistemática, os derivados da artemisinina (artemeter e arteether) foram tão eficazes quanto o quinino no tratamento da malária cerebral em crianças. O tratamento da malária grave envolve medidas de suporte que são melhor executadas em uma unidade de terapia intensiva. Isso inclui o controle de febres altas e as convulsões que podem resultar disso. Também inclui monitoramento de esforço respiratório insuficiente, baixo nível de açúcar no sangue e baixo nível de potássio no sangue. Os derivados da artemisinina têm a mesma ou melhor eficácia do que as quinolonas na prevenção de mortes por malária grave ou complicada. A dose de ataque de quinina ajuda a encurtar a duração da febre e aumenta a depuração do parasita do corpo. Não há diferença na eficácia do uso de quinina intrarretal em comparação com a quinina intravenosa ou intramuscular no tratamento da malária falciparum não complicada/complicada. Não há evidências suficientes para arteether intramuscular para tratar a malária grave. O fornecimento de artesunato retal antes da transferência para o hospital pode reduzir a taxa de mortalidade de crianças com malária grave. Em crianças com malária e hipoglicemia concomitante, a administração sublingual de glicose parece resultar em melhores aumentos de açúcar no sangue após 20 minutos quando comparada à administração oral, com base em dados muito limitados.
A malária cerebral é a forma de malária grave e complicada com os piores sintomas neurológicos. Não há dados suficientes sobre se os agentes osmóticos, como manitol ou ureia, são eficazes no tratamento da malária cerebral. O fenobarbital de rotina na malária cerebral está associado a menos convulsões, mas possivelmente a mais mortes. Não há evidências de que os esteróides trariam benefícios no tratamento da malária cerebral.
Gerenciando a Malária Cerebral
A malária cerebral geralmente deixa o paciente em coma, se a causa do coma estiver em dúvida, o teste para outras causas localmente prevalentes de encefalopatia (infecção bacteriana, viral ou fúngica) deve ser realizado. Em áreas onde há uma alta prevalência de infecção por malária (por exemplo, região tropical), o tratamento pode começar sem testes prévios. Para controlar a malária cerebral quando confirmada, pode-se fazer o seguinte:
- Os pacientes em coma devem receber cuidados de enfermagem meticuloso (monitor sinais vitais, virar paciente a cada 2 horas, evitar mentir o paciente em uma cama molhada etc.)
- Um cateter uretral estéril deve ser inserido para ajudar a urinar
- Para aspirar o conteúdo do estômago, um tubo nasogástrico estéril deve ser inserido.
- Na ocasião de convulsões, uma injeção intravenosa lenta de benzodiazepina é administrada.
Não há evidências suficientes para mostrar que a transfusão de sangue é útil na redução de mortes de crianças com anemia grave ou na melhora do hematócrito em um mês. Não há evidências suficientes de que agentes quelantes de ferro, como deferoxamina e deferiprona, melhorem os resultados daqueles com infecção por malária falciparum.
Anticorpos monoclonais
Um ensaio clínico de 2022 mostra que um anticorpo monoclonal mAb L9LS oferece proteção contra a malária. Ele se liga à proteína circunsporozoíta do Plasmodium falciparum (CSP-1), essencial para a doença, e a torna ineficaz.
Resistência
A resistência aos medicamentos representa um problema crescente no tratamento da malária no século XXI. Nos anos 2000 (década), a malária com resistência parcial às artemisinas surgiu no Sudeste Asiático. Atualmente, a resistência é comum contra todas as classes de medicamentos antimaláricos, exceto as artemisininas. O tratamento de cepas resistentes tornou-se cada vez mais dependente dessa classe de drogas. O custo das artemisininas limita seu uso no mundo em desenvolvimento. Cepas de malária encontradas na fronteira Camboja-Tailândia são resistentes a terapias combinadas que incluem artemisininas e podem, portanto, ser intratáveis. A exposição da população de parasitas a monoterapias de artemisinina em doses subterapêuticas por mais de 30 anos e a disponibilidade de artemisininas abaixo do padrão provavelmente levaram à seleção do fenótipo resistente. A resistência à artemisinina foi detectada no Camboja, Mianmar, Tailândia e Vietnã, e tem havido resistência emergente no Laos. A resistência à combinação de artemisinina e piperaquina foi detectada pela primeira vez em 2013 no Camboja e, em 2019, havia se espalhado pelo Camboja e pelo Laos, Tailândia e Vietnã (com até 80% dos parasitas da malária resistentes em algumas regiões).
Não há evidências suficientes em medicamentos antimaláricos embalados unitários na prevenção de falhas no tratamento da infecção por malária. No entanto, se apoiado pelo treinamento dos profissionais de saúde e informações do paciente, há melhora na adesão dos que recebem o tratamento.
Prognóstico
Quando devidamente tratadas, as pessoas com malária geralmente podem esperar uma recuperação completa. No entanto, a malária grave pode progredir de forma extremamente rápida e causar a morte em horas ou dias. Nos casos mais graves da doença, as taxas de letalidade podem chegar a 20%, mesmo com tratamento e cuidados intensivos. A longo prazo, foram documentados problemas de desenvolvimento em crianças que tiveram episódios de malária grave. A infecção crônica sem doença grave pode ocorrer em uma síndrome de imunodeficiência associada a uma diminuição da capacidade de resposta à bactéria Salmonella e ao vírus Epstein-Barr.
Durante a infância, a malária causa anemia durante um período de rápido desenvolvimento cerebral e também danos cerebrais diretos resultantes da malária cerebral. Alguns sobreviventes de malária cerebral têm um risco aumentado de déficits neurológicos e cognitivos, distúrbios comportamentais e epilepsia. A profilaxia da malária demonstrou melhorar a função cognitiva e o desempenho escolar em ensaios clínicos quando comparada a grupos de placebo.
Epidemiologia
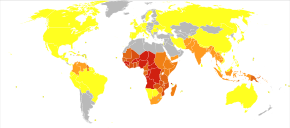
A OMS estima que em 2021 houve 247 milhões de novos casos de malária resultando em 619.000 mortes. As crianças menores de 5 anos são as mais afetadas, representando 67% das mortes por malária em todo o mundo em 2019. Cerca de 125 milhões de mulheres grávidas correm risco de infecção a cada ano; na África Subsaariana, a malária materna está associada a até 200.000 mortes infantis estimadas anualmente. Existem cerca de 10.000 casos de malária por ano na Europa Ocidental e 1.300 a 1.500 nos Estados Unidos. Os Estados Unidos erradicaram a malária como um grande problema de saúde pública em 1951, embora pequenos surtos persistam. Cerca de 900 pessoas morreram da doença na Europa entre 1993 e 2003. Tanto a incidência global da doença quanto a mortalidade resultante diminuíram nos últimos anos. De acordo com a OMS e a UNICEF, as mortes atribuíveis à malária em 2015 foram reduzidas em 60% de uma estimativa de 985.000 em 2000, em grande parte devido ao uso generalizado de mosquiteiros tratados com inseticida e terapias combinadas à base de artemisinina. Os esforços para diminuir a doença na África desde 2000 foram parcialmente eficazes, com taxas da doença caindo cerca de quarenta por cento no continente.
A malária é atualmente endêmica em uma ampla faixa ao redor do equador, em áreas das Américas, muitas partes da Ásia e grande parte da África; na África Subsaariana, ocorrem 85–90% das mortes por malária. Uma estimativa para 2009 relatou que os países com a maior taxa de mortalidade por 100.000 habitantes foram Costa do Marfim (86,15), Angola (56,93) e Burkina Faso (50,66). Uma estimativa de 2010 indicava que os países mais mortais por população eram Burkina Faso, Moçambique e Mali. O projeto Malaria Atlas visa mapear os níveis globais de malária, fornecendo uma maneira de determinar os limites espaciais globais da doença e avaliar a carga da doença. Este esforço levou à publicação de um mapa de P. falciparum endemicidade em 2010 e uma atualização em 2019. Em 2021, 84 países tinham malária endêmica.
A distribuição geográfica da malária dentro de grandes regiões é complexa, e as áreas afetadas pela malária e livres da malária são frequentemente encontradas próximas umas das outras. A malária é prevalente em regiões tropicais e subtropicais por causa das chuvas, altas temperaturas consistentes e alta umidade, juntamente com águas estagnadas onde as larvas do mosquito amadurecem prontamente, proporcionando-lhes o ambiente de que precisam para reprodução contínua. Em áreas mais secas, os surtos de malária foram previstos com razoável precisão pelo mapeamento das chuvas. A malária é mais comum nas áreas rurais do que nas cidades. Por exemplo, várias cidades na sub-região do Grande Mekong no Sudeste Asiático estão essencialmente livres de malária, mas a doença é prevalente em muitas regiões rurais, inclusive ao longo de fronteiras internacionais e orlas de florestas. Em contraste, a malária na África está presente tanto nas áreas rurais quanto nas urbanas, embora o risco seja menor nas grandes cidades.
Mudanças climáticas
É provável que a mudança climática afete a transmissão da malária, mas o grau de efeito e as áreas afetadas são incertos. Maior pluviosidade em certas áreas da Índia e após um evento El Niño está associado ao aumento do número de mosquitos.
Desde 1900 houve mudanças substanciais na temperatura e nas chuvas na África. No entanto, os fatores que contribuem para a forma como a chuva resulta em água para a reprodução do mosquito são complexos, incorporando a extensão em que ela é absorvida pelo solo e pela vegetação, por exemplo, ou taxas de escoamento superficial e evaporação. Pesquisas recentes forneceram uma imagem mais aprofundada das condições em toda a África, combinando um modelo de adequação climática da malária com um modelo de escala continental representando processos hidrológicos do mundo real.
História
Embora o parasita responsável por P. falciparum a malária existe há 50.000–100.000 anos, o tamanho da população do parasita não aumentou até cerca de 10.000 anos atrás, simultaneamente com os avanços na agricultura e o desenvolvimento de assentamentos humanos. Parentes próximos dos parasitas da malária humana permanecem comuns em chimpanzés. Algumas evidências sugerem que o P. falciparum malária pode ter se originado em gorilas.
Referências às únicas febres periódicas da malária são encontradas ao longo da história. Hipócrates descreveu as febres periódicas, rotulando-as de terçã, quartã, subterçã e cotidiana. A columela romana associava a doença a insetos de pântanos. A malária pode ter contribuído para o declínio do Império Romano e era tão difundida em Roma que era conhecida como a "febre romana". Várias regiões da Roma antiga foram consideradas de risco para a doença devido às condições favoráveis presentes para os vetores da malária. Isso incluiu áreas como o sul da Itália, a ilha da Sardenha, os pântanos de Pontine, as regiões baixas da costa da Etrúria e a cidade de Roma ao longo do Tibre. A presença de água parada nesses locais foi preferida pelos mosquitos para criadouros. Jardins irrigados, terrenos pantanosos, escoamento da agricultura e problemas de drenagem devido à construção de estradas levaram ao aumento da água parada.
O termo malária se origina do italiano medieval: mala aria—"mau ar", uma parte da teoria do miasma; a doença era anteriormente chamada de ague ou febre dos pântanos devido à sua associação com pântanos e pântanos. O termo apareceu em inglês pelo menos já em 1768. A malária já foi comum na maior parte da Europa e América do Norte, onde não é mais endêmica, embora ocorram casos importados.
A malária não é mencionada nos livros médicos dos maias ou astecas. Apesar disso, anticorpos contra a malária foram detectados em algumas múmias sul-americanas, indicando que algumas cepas de malária nas Américas podem ter origem pré-colombiana. Os colonos europeus e os africanos ocidentais que eles escravizaram provavelmente trouxeram a malária para as Américas a partir do século XVI.
Os estudos científicos sobre a malária tiveram seu primeiro avanço significativo em 1880, quando Charles Louis Alphonse Laveran - um médico do exército francês que trabalhava no hospital militar de Constantine, na Argélia - observou parasitas dentro dos glóbulos vermelhos de pessoas infectadas pela primeira vez. Ele, portanto, propôs que a malária é causada por esse organismo, a primeira vez que um protista foi identificado como causador da doença. Por esta e outras descobertas, ele recebeu o Prêmio Nobel de Fisiologia ou Medicina de 1907. Um ano depois, Carlos Finlay, um médico cubano que trata de pessoas com febre amarela em Havana, forneceu fortes evidências de que os mosquitos estavam transmitindo doenças de e para humanos. Este trabalho seguiu as sugestões anteriores de Josiah C. Nott e o trabalho de Sir Patrick Manson, o "pai da medicina tropical", sobre a transmissão da filariose.
Em abril de 1894, um médico escocês, Sir Ronald Ross, visitou Sir Patrick Manson em sua casa na Queen Anne Street, em Londres. Essa visita foi o início de quatro anos de colaboração e pesquisa intensa que culminaram em 1897, quando Ross, que trabalhava no Presidency General Hospital em Calcutá, comprovou o ciclo de vida completo do parasita da malária em mosquitos. Assim, ele provou que o mosquito era o vetor da malária em humanos, mostrando que certas espécies de mosquitos transmitem a malária às aves. Ele isolou parasitas da malária das glândulas salivares de mosquitos que se alimentaram de pássaros infectados. Por este trabalho, Ross recebeu o Prêmio Nobel de Medicina de 1902. Depois de se demitir do Indian Medical Service, Ross trabalhou na recém-criada Liverpool School of Tropical Medicine e dirigiu os esforços de controle da malária no Egito, Panamá, Grécia e Maurício. As descobertas de Finlay e Ross foram posteriormente confirmadas por um conselho médico chefiado por Walter Reed em 1900. Suas recomendações foram implementadas por William C. Gorgas nas medidas de saúde adotadas durante a construção do Canal do Panamá. Esse trabalho de saúde pública salvou a vida de milhares de trabalhadores e ajudou a desenvolver os métodos usados em futuras campanhas de saúde pública contra a doença.
Em 1896, Amico Bignami discutiu o papel dos mosquitos na malária. Em 1898, Bignami, Giovanni Battista Grassi e Giuseppe Bastianelli conseguiram mostrar experimentalmente a transmissão da malária em humanos, usando mosquitos infectados para contrair a malária, que apresentaram em novembro de 1898 à Accademia dei Lincei.
O primeiro tratamento eficaz para a malária veio da casca da cinchona, que contém quinino. Esta árvore cresce nas encostas dos Andes, principalmente no Peru. Os povos indígenas do Peru faziam uma tintura de cinchona para controlar a febre. Sua eficácia contra a malária foi constatada e os jesuítas introduziram o tratamento na Europa por volta de 1640; em 1677, foi incluído na London Pharmacopoeia como um tratamento antimalárico. Somente em 1820 o ingrediente ativo, o quinino, foi extraído da casca, isolado e nomeado pelos químicos franceses Pierre Joseph Pelletier e Joseph Bienaimé Caventou.
A quinina foi o medicamento predominante contra a malária até a década de 1920, quando outros medicamentos começaram a aparecer. Na década de 1940, a cloroquina substituiu o quinino no tratamento da malária não complicada e grave até que a resistência surgisse, primeiro no sudeste da Ásia e na América do Sul na década de 1950 e depois globalmente na década de 1980.
O valor medicinal da Artemisia annua tem sido usado por fitoterapeutas chineses em medicamentos tradicionais chineses há 2.000 anos. Em 1596, Li Shizhen recomendou chá feito de qinghao especificamente para tratar os sintomas da malária em seu "Compêndio de Matéria Médica". As artemisininas, descobertas pelo cientista chinês Tu Youyou e colegas na década de 1970 a partir da planta Artemisia annua, tornaram-se o tratamento recomendado para P. falciparum, administrado em casos graves em combinação com outros antimaláricos. Tu diz que foi influenciada por uma fonte de fitoterapia tradicional chinesa, O Manual de Prescrições para Tratamentos de Emergência, escrito em 340 por Ge Hong. Por seu trabalho sobre a malária, Tu Youyou recebeu o Prêmio Nobel de Fisiologia ou Medicina de 2015.
Plasmodium vivax foi usado entre 1917 e 1940 para malarioterapia - injeção deliberada de parasitas da malária para induzir febre para combater certas doenças, como a sífilis terciária. Em 1927, o inventor desta técnica, Julius Wagner-Jauregg, recebeu o Prêmio Nobel de Fisiologia ou Medicina por suas descobertas. A técnica era perigosa, matando cerca de 15% dos pacientes, por isso não está mais em uso.
O primeiro pesticida usado para pulverização residual interna foi o DDT. Embora inicialmente fosse usado exclusivamente para combater a malária, seu uso rapidamente se espalhou para a agricultura. Com o tempo, o controle de pragas, em vez do controle de doenças, passou a dominar o uso do DDT, e esse uso agrícola em larga escala levou à evolução de mosquitos resistentes a pesticidas em muitas regiões. A resistência ao DDT mostrada pelos mosquitos Anopheles pode ser comparada à resistência a antibióticos mostrada pelas bactérias. Durante a década de 1960, a conscientização sobre as consequências negativas de seu uso indiscriminado aumentou, levando à proibição de aplicações agrícolas de DDT em muitos países na década de 1970. Antes do DDT, a malária era eliminada ou controlada com sucesso em áreas tropicais como o Brasil e o Egito, removendo ou envenenando os criadouros dos mosquitos ou os habitats aquáticos dos estágios larvais, por exemplo, aplicando o composto altamente tóxico de arsênico Paris Green em locais com água.
As vacinas contra a malária têm sido outro objetivo da pesquisa. Os primeiros estudos promissores demonstrando o potencial de uma vacina contra a malária foram realizados em 1967, imunizando camundongos com esporozoítos vivos atenuados por radiação, que forneceram proteção significativa aos camundongos após injeção subsequente com esporozoítos viáveis normais. Desde a década de 1970, houve um progresso considerável no desenvolvimento de estratégias de vacinação semelhantes para humanos. A primeira vacina, chamada RTS,S, foi aprovada pelos reguladores europeus em 2015.
No total, a malária pode ter matado de 50 a 60 bilhões de pessoas ao longo da história, ou cerca de metade de todos os seres humanos que já viveram.
Nomes
Vários tipos de malária foram chamados pelos nomes abaixo:
| Nome | Patogenia | Notas |
|---|---|---|
| malária algida | Plasmodium falciparum | malária grave afetando o sistema cardiovascular e causando arrepios e choque circulatório |
| malária biliar | Plasmodium falciparum | malária grave afetando o fígado e causando vômitos e icterícia |
| malária cerebral | Plasmodium falciparum | malária severa que afeta o cerebrum |
| malária congênita | vários plasmodia | plasmodium introduzido a partir da mãe através da circulação fetal |
| malária perniciosa | Plasmodium falciparum | malária grave levando a doença grave |
| malária maligna | Plasmodium falciparum | malária severa levando à morte |
| falciparum malaria, Plasmodium falciparum malária, | Plasmodium falciparum | |
| ovale malaria, Plasmodium ovale malária | Plasmodium ovale | |
| malária, malária, malária, Malária de Plasmodium malária | Malária de Plasmodium | paroxysms a cada quarto dia (quartan), contando o dia da ocorrência como o primeiro dia |
| Bom dia. | Plasmodium falciparum, Plasmodium vivax, Produtos de plástico | paroxysms diário (quotidian) |
| terciário malária | Plasmodium falciparum, Plasmodium ovale, Plasmodium vivax | paroxismos a cada terceiro dia (terciano), contando o dia da ocorrência como o primeiro |
| malária de transfusão | vários plasmodia | plasmodium introduzido pela transfusão sanguínea, compartilhamento de agulhas ou lesão de agulha |
| vivax malaria, Plasmodium vivax malária | Plasmodium vivax |
Esforços de erradicação
A malária foi eliminada com sucesso ou reduzida significativamente em certas áreas, mas não globalmente. A malária já foi comum nos Estados Unidos, mas os EUA eliminaram a malária da maior parte do país no início do século 20 usando programas de controle de vetores, que combinavam o monitoramento e tratamento de humanos infectados, drenagem de áreas úmidas para agricultura e outras mudanças. nas práticas de gestão da água e avanços no saneamento, incluindo maior uso de janelas e telas de vidro nas residências. O uso do pesticida DDT e outros meios eliminaram a malária dos bolsões remanescentes nos estados do sul dos EUA na década de 1950, como parte do Programa Nacional de Erradicação da Malária. A maior parte da Europa, América do Norte, Austrália, Norte da África e Caribe, e partes da América do Sul, Ásia e África Austral também eliminaram a malária. A OMS define "eliminação" (ou "livre de malária") como sem transmissão doméstica (casos indígenas) nos últimos três anos. Eles também definem "pré-eliminação" e "eliminação" estágios em que um país tem menos de 5 ou 1, respectivamente, casos por 1.000 pessoas em risco por ano.
Em 1955, a OMS lançou o Programa Global de Erradicação da Malária (GMEP), que apoiou reduções substanciais nos casos de malária em alguns países, incluindo a Índia. No entanto, devido à resistência de vetores e parasitas e outros fatores, a viabilidade de erradicar a malária com a estratégia usada na época e os recursos disponíveis levaram à diminuição do apoio ao programa. A OMS suspendeu o programa em 1969.
A meta 6C dos Objetivos de Desenvolvimento do Milênio incluía a reversão do aumento global da incidência de malária até 2015, com metas específicas para crianças menores de 5 anos. Desde 2000, o apoio à erradicação da malária aumentou, embora alguns atores da comunidade global de saúde (incluindo vozes dentro da OMS) vejam a erradicação da malária como uma meta prematura e sugiram que o estabelecimento de prazos rígidos para a erradicação da malária pode ser contraproducente, pois provavelmente saudades.
Em 2006, a organização Malaria No More estabeleceu uma meta pública de eliminar a malária da África até 2015, e a organização afirmou que planejava se dissolver se essa meta fosse alcançada. Em 2007, o Dia Mundial da Malária foi estabelecido pela 60ª sessão da Assembleia Mundial da Saúde. A partir de 2018, eles ainda estão funcionando.
A partir de 2012, o Fundo Global de Combate à AIDS, Tuberculose e Malária distribuiu 230 milhões de mosquiteiros tratados com inseticida destinados a impedir a transmissão da malária por mosquitos. A Fundação Clinton, com sede nos Estados Unidos, tem trabalhado para administrar a demanda e estabilizar os preços no mercado de artemisinina. Outros esforços, como o Projeto Malaria Atlas, concentram-se na análise de informações climáticas e meteorológicas necessárias para prever com precisão a propagação da malária com base na disponibilidade de habitat de parasitas portadores da malária. O Malaria Policy Advisory Committee (MPAC) da Organização Mundial da Saúde (OMS) foi formado em 2012, "para fornecer aconselhamento estratégico e informações técnicas à OMS em todos os aspectos do controle e eliminação da malária". Em novembro de 2013, a OMS e o grupo de financiadores de vacinas contra a malária estabeleceram uma meta para desenvolver vacinas projetadas para interromper a transmissão da malária com a meta de longo prazo da erradicação da malária.
Em 2015, a OMS visava uma redução de 90% nas mortes por malária até 2030, e Bill Gates disse em 2016 que achava que a erradicação global seria possível até 2040. De acordo com o Relatório Mundial da Malária de 2015 da OMS, o a taxa de mortalidade por malária caiu 60% entre 2000 e 2015. A OMS apontou uma redução adicional de 90% entre 2015 e 2030, com uma redução de 40% e erradicação em 10 países até 2020. No entanto, a meta de 2020 foi perdida com um ligeiro aumento em casos em relação a 2015.
Antes de 2016, o Fundo Global contra HIV/AIDS, Tuberculose e Malária havia fornecido 659 milhões de MTI (mosquiteiros tratados com inseticida), organizando apoio e educação para prevenir a malária. Os desafios são grandes devido à falta de fundos, à frágil estrutura de saúde e à população indígena remota que pode ser difícil de alcançar e educar. A maioria da população indígena depende de autodiagnóstico, autotratamento, curandeiro e medicina tradicional. A OMS solicitou fundos à Fundação Gates que favorecem a ação de erradicação da malária em 2007. Seis países, Emirados Árabes Unidos, Marrocos, Armênia, Turcomenistão, Quirguistão e Sri Lanka conseguiram não ter casos endêmicos de malária por três anos consecutivos e certificado livre de malária pela OMS, apesar da estagnação do financiamento em 2010. O financiamento é essencial para financiar o custo da medicação e hospitalização não pode ser suportado pelos países pobres onde a doença está amplamente disseminada. A meta de erradicação não foi atingida; no entanto, a taxa de diminuição da doença é considerável.
Enquanto 31 dos 92 países endêmicos foram estimados como estando no caminho das metas da OMS para 2020, 15 países relataram um aumento de 40% ou mais entre 2015 e 2020. Entre 2000 e 30 de junho de 2021, doze países foram certificados pela a OMS como livre de malária. Argentina e Argélia foram declaradas livres de malária em 2019. El Salvador e China foram declaradas livres de malária no primeiro semestre de 2021.
As disparidades regionais eram evidentes: o Sudeste Asiático estava a caminho de atingir as metas da OMS para 2020, enquanto as regiões da África, Américas, Mediterrâneo Oriental e Pacífico Ocidental estavam fora do caminho. Os seis países da sub-região do Grande Mekong visam a eliminação da malária transmitida por P. falciparum até 2025 e a eliminação de toda a malária até 2030, tendo alcançado uma redução de 97% e 90% dos casos, respectivamente, desde 2000. Antes do Dia Mundial da Malária, 25 de abril de 2021, A OMS nomeou 25 países nos quais está trabalhando para eliminar a malária até 2025 como parte de sua iniciativa E-2025.
Um grande desafio para a eliminação da malária é a persistência da doença nas regiões fronteiriças, tornando crucial a cooperação internacional.
Uma das metas do Objetivo 3 dos Objetivos de Desenvolvimento Sustentável da ONU é acabar com a epidemia de malária em todos os países até 2030.
Em 2018, a OMS anunciou que o Paraguai estava livre da malária, após um esforço nacional de erradicação da malária iniciado em 1950.
A partir de 2019, o processo de erradicação está em andamento, mas será difícil alcançar um mundo livre de malária com as abordagens e ferramentas atuais. Apenas uma vacina contra a malária está licenciada para uso e mostra eficácia relativamente baixa, enquanto várias outras vacinas candidatas em ensaios clínicos visam fornecer proteção para crianças em áreas endêmicas e reduzir a velocidade de transmissão da malária. As abordagens podem exigir mais investimento em pesquisa e maior atenção primária à saúde. A vigilância contínua também será importante para prevenir o retorno da malária em países onde a doença foi eliminada.
Sociedade e cultura
Impacto econômico
A malária não é apenas uma doença comumente associada à pobreza: algumas evidências sugerem que ela também é uma causa da pobreza e um grande obstáculo ao desenvolvimento econômico. Embora as regiões tropicais sejam as mais afetadas, a maior influência da malária atinge algumas zonas temperadas que apresentam mudanças sazonais extremas. A doença tem sido associada a grandes efeitos econômicos negativos nas regiões onde é disseminada. Durante o final do século 19 e início do século 20, foi um fator importante no lento desenvolvimento econômico dos estados do sul dos Estados Unidos.
Uma comparação do PIB per capita médio em 1995, ajustado para paridade de poder de compra, entre países com malária e países sem malária dá uma diferença de cinco vezes (US$ 1.526 versus US$ 8.268). No período de 1965 a 1990, os países onde a malária era comum tiveram um PIB per capita médio que aumentou apenas 0,4% ao ano, em comparação com 2,4% ao ano em outros países.
A pobreza pode aumentar o risco de malária, uma vez que os pobres não têm capacidade financeira para prevenir ou tratar a doença. Em sua totalidade, estima-se que o impacto econômico da malária custe à África US$ 12 bilhões por ano. O impacto económico inclui os custos dos cuidados de saúde, dias de trabalho perdidos devido a doença, dias perdidos na educação, diminuição da produtividade devido a danos cerebrais causados pela malária cerebral e perda de investimento e turismo. A doença tem um fardo pesado em alguns países, onde pode ser responsável por 30 a 50% das internações hospitalares, até 50% das consultas ambulatoriais e até 40% dos gastos com saúde pública.
A malária cerebral é uma das principais causas de deficiências neurológicas em crianças africanas. Estudos comparando as funções cognitivas antes e depois do tratamento para malária grave continuaram a mostrar desempenho escolar e habilidades cognitivas significativamente prejudicados, mesmo após a recuperação. Consequentemente, a malária grave e cerebral tem consequências socioeconômicas de longo alcance que vão além dos efeitos imediatos da doença.
Medicamentos falsificados e abaixo do padrão
Falsificações sofisticadas foram encontradas em vários países asiáticos, como Camboja, China, Indonésia, Laos, Tailândia e Vietnã, e são uma das principais causas de morte evitável nesses países. A OMS disse que estudos indicam que até 40% dos medicamentos para malária à base de artesunato são falsificados, especialmente na região do Grande Mekong. Eles estabeleceram um sistema de alerta rápido para relatar rapidamente informações sobre medicamentos falsificados às autoridades relevantes nos países participantes. Não há uma maneira confiável de médicos ou leigos detectarem medicamentos falsificados sem a ajuda de um laboratório. As empresas estão tentando combater a persistência de medicamentos falsificados usando novas tecnologias para fornecer segurança desde a origem até a distribuição.
Outra preocupação clínica e de saúde pública é a proliferação de medicamentos antipalúdicos de qualidade inferior resultantes da concentração inadequada de ingredientes, contaminação com outros medicamentos ou impurezas tóxicas, ingredientes de baixa qualidade, baixa estabilidade e embalagem inadequada. Um estudo de 2012 demonstrou que cerca de um terço dos medicamentos antimaláricos no Sudeste Asiático e na África Subsaariana falharam na análise química, análise de embalagem ou foram falsificados.
Guerra
Ao longo da história, a contração da malária desempenhou um papel proeminente no destino de governantes, estados-nação, militares e ações militares. Em 1910, o ganhador do Prêmio Nobel de Medicina Ronald Ross (ele mesmo um sobrevivente da malária), publicou um livro intitulado A Prevenção da Malária que incluía um capítulo intitulado "A Prevenção da Malária na Guerra".;. O autor do capítulo, coronel C. H. Melville, professor de higiene no Royal Army Medical College em Londres, abordou o papel proeminente que a malária desempenhou historicamente durante as guerras: "A história da malária na guerra pode quase ser seja a própria história da guerra, certamente a história da guerra na era cristã.... É provavelmente o caso que muitas das chamadas febres de acampamento, e provavelmente também uma proporção considerável da disenteria de campo, das guerras dos séculos XVI, XVII e XVIII eram de origem malárica." Na Índia ocupada pelos britânicos, o coquetel de gim-tônica pode ter surgido como uma forma de tomar quinino, conhecido por suas propriedades antimaláricas.
A malária foi o perigo de saúde mais significativo encontrado pelas tropas americanas no Pacífico Sul durante a Segunda Guerra Mundial, onde cerca de 500.000 homens foram infectados. De acordo com Joseph Patrick Byrne, "Sessenta mil soldados americanos morreram de malária durante as campanhas na África e no Pacífico Sul".
Foram feitos investimentos financeiros significativos para adquirir os agentes antimaláricos existentes e criar novos. Durante a Primeira e a Segunda Guerras Mundiais, o fornecimento inconsistente de remédios naturais contra a malária, casca de cinchona e quinino, levou a um financiamento substancial para pesquisa e desenvolvimento de outros medicamentos e vacinas. As organizações militares americanas que conduzem tais iniciativas de pesquisa incluem o Centro de Pesquisa Médica da Marinha, o Instituto de Pesquisa do Exército Walter Reed e o Instituto de Pesquisa Médica de Doenças Infecciosas do Exército dos EUA das Forças Armadas dos EUA.
Além disso, foram fundadas iniciativas como o Controle da Malária em Áreas de Guerra (MCWA), estabelecido em 1942, e seu sucessor, o Centro de Doenças Transmissíveis (agora conhecido como Centros de Controle e Prevenção de Doenças, ou CDC) estabelecido em 1946 De acordo com o CDC, o MCWA "foi criado para controlar a malária em torno de bases de treinamento militar no sul dos Estados Unidos e seus territórios, onde a malária ainda era problemática".
Pesquisa
A iniciativa Malaria Eradication Research Agenda (malERA) foi um processo consultivo para identificar quais áreas de pesquisa e desenvolvimento (P&D) devem ser abordadas para a erradicação mundial da malária.
Vacina
Uma vacina contra a malária chamada RTS,S/AS01 (RTS,S) foi aprovada pelos reguladores europeus em 2015. A partir de 2019, ela está passando por testes piloto em 3 países da África Subsaariana – Gana, Quênia e Malawi – como parte do Programa de Implementação de Vacinas contra a Malária da OMS (MVIP).
Imunidade (ou, mais precisamente, tolerância) a P. falciparum a malária ocorre naturalmente, mas apenas em resposta a anos de infecção repetida. Um indivíduo pode ser protegido de um P. falciparum se receberem cerca de mil picadas de mosquitos que carregam uma versão do parasita tornada não infecciosa por uma dose de irradiação de raios-X. A natureza altamente polimórfica de muitos P. falciparum resulta em desafios significativos para o desenho de vacinas. Vacinas candidatas que visam antígenos em gametas, zigotos ou oocinetos no intestino médio do mosquito visam bloquear a transmissão da malária. Essas vacinas bloqueadoras da transmissão induzem anticorpos no sangue humano; quando um mosquito se alimenta de sangue de um indivíduo protegido, esses anticorpos impedem que o parasita complete seu desenvolvimento no mosquito. Outras vacinas candidatas, visando o estágio sanguíneo do ciclo de vida do parasita, foram inadequadas por conta própria. Por exemplo, o SPf66 foi testado extensivamente em áreas onde a doença era comum na década de 1990, mas os testes mostraram que não era suficientemente eficaz.
Em 2021, pesquisadores da Universidade de Oxford relataram resultados de um estudo de Fase IIb de uma vacina candidata contra a malária, R21/Matrix-M, que demonstrou eficácia de 77% ao longo de 12 meses de acompanhamento. Esta vacina é a primeira a atingir a meta do Roteiro de Tecnologia de Vacinas contra a Malária da Organização Mundial da Saúde de uma vacina com pelo menos 75% de eficácia.
Medicamentos
Os parasitas da malária contêm apicoplastos, organelos relacionados com os plastídeos encontrados nas plantas, completos com os seus próprios genomas. Acredita-se que esses apicoplastos tenham se originado através da endossimbiose de algas e desempenham um papel crucial em vários aspectos do metabolismo do parasita, como a biossíntese de ácidos graxos. Mais de 400 proteínas foram produzidas por apicoplastos e agora estão sendo investigadas como possíveis alvos para novos medicamentos antimaláricos.
Com o surgimento de parasitas Plasmodium resistentes a medicamentos, novas estratégias estão sendo desenvolvidas para combater a doença generalizada. Uma dessas abordagens reside na introdução de adutos sintéticos de piridoxal-aminoácidos, que são absorvidos pelo parasita e, por fim, interferem em sua capacidade de criar várias vitaminas B essenciais. Drogas antimaláricas que usam complexos sintéticos à base de metais estão atraindo interesse de pesquisa.
- (+)-SJ733: Parte de uma classe mais ampla de drogas experimentais chamadas espiroindolone. Inibe a proteína ATP4 de células vermelhas infectadas que fazem com que as células encolhem e se tornem rígidas como as células de envelhecimento. Isso desencadeia o sistema imunológico para eliminar as células infectadas do sistema como demonstrado em um modelo do mouse. A partir de 2014, um ensaio clínico Fase 1 para avaliar o perfil de segurança em humanos é planejado pelo Instituto Médico Howard Hughes.
- NITD246 e NITD609: Também pertencia à classe de espiroindolone e alvo a proteína ATP4.
Com base nos resultados de encaixe molecular, os compostos 3j, 4b, 4h, 4m exibiram seletividade para PfLDH. A análise pós-docking mostrou um comportamento dinâmico estável de todos os compostos selecionados em comparação com a cloroquina. A análise termodinâmica do estado final declarou o composto 3j como um inibidor seletivo e potente de PfLDH.
Novos alvos
O direcionamento seletivo de parasitas Plasmodium em estágio hepático está emergindo como uma estratégia alternativa diante da resistência às mais recentes terapias de combinação de linha de frente contra estágios sanguíneos do parasita.
Em uma pesquisa realizada em 2019, por meio de análises experimentais com mutantes knockout (KO) de Plasmodium berguei, os autores conseguiram identificar genes potencialmente essenciais na fase hepática. Além disso, eles geraram um modelo computacional para analisar o desenvolvimento pré-eritrocitário e o metabolismo no estágio hepático. Combinando os dois métodos, eles identificaram sete subsistemas metabólicos que se tornam essenciais em relação ao estágio sanguíneo. Algumas dessas vias metabólicas são síntese e alongamento de ácidos graxos, ácidos tricarboxílicos, aminoácidos e metabolismo do heme, entre outros.
Especificamente, eles estudaram 3 subsistemas: síntese e alongamento de ácidos graxos e biossíntese de aminoácidos. Para as duas primeiras vias, eles demonstraram uma clara dependência do estágio do fígado em seu próprio metabolismo de ácidos graxos.
Eles provaram pela primeira vez o papel crítico da biossíntese de aminoácidos no estágio hepático de P. berghei. A captação de N–acetil–glucosamina parece ser limitada na fase hepática, sendo sua síntese necessária para o desenvolvimento do parasito.
Essas descobertas e o modelo computacional fornecem uma base para o design de terapias antimaláricas direcionadas a proteínas metabólicas.
Outro
Uma estratégia de controle vetorial não químico envolve a manipulação genética dos mosquitos da malária. Os avanços nas tecnologias de engenharia genética possibilitam a introdução de DNA estranho no genoma do mosquito e diminuem o tempo de vida do mosquito ou o tornam mais resistente ao parasita da malária. A técnica do inseto estéril é um método de controle genético pelo qual um grande número de mosquitos machos estéreis é criado e liberado. O acasalamento com fêmeas selvagens reduz a população selvagem na geração subsequente; liberações repetidas eventualmente eliminam a população-alvo.
A genômica é fundamental para a pesquisa da malária. Com o sequenciamento de P. falciparum, um de seus vetores Anopheles gambiae, e o genoma humano, a genética de todos os três organismos no ciclo de vida da malária pode ser estudada. Outra nova aplicação da tecnologia genética é a capacidade de produzir mosquitos geneticamente modificados que não transmitem a malária, permitindo potencialmente o controle biológico da transmissão da malária.
Em um estudo, foi criada uma cepa geneticamente modificada de Anopheles stephensi que não suportava mais a transmissão da malária, e essa resistência foi transmitida aos descendentes do mosquito.
Gene drive é uma técnica de modificação de populações selvagens, por exemplo, para combater ou eliminar insetos para que não transmitam doenças (principalmente mosquitos nos casos de malária, zika, dengue e febre amarela).
Em dezembro de 2020, um artigo de revisão constatou que as regiões endêmicas de malária apresentavam taxas de mortalidade de casos de COVID-19 mais baixas, em média, do que regiões onde a malária não era endêmica.
Além disso, uma pesquisa realizada em 2015 demonstrou que, em camundongos, a co-infecção da malária com o nematóide Nippostrongylus brasiliensis, um helminto migratório pulmonar, amorteceu a virulência do Plasmodium parasita. Os pesquisadores demonstraram o controle de baixo para cima da infecção da malária pelo nematóide; especificamente, a infecção por nematoides leva ao aumento da destruição de eritrócitos. Sabe-se que o Plasmodium prefere eritrócitos hospedeiros mais velhos, que são mais fáceis de infectar, portanto, o aumento da destruição, causando subsequente aumento da eritropoiese, leva a uma população de eritrócitos mais jovens, resultando em uma diminuição do Plasmodium população. Curiosamente, o controle dessa doença é amplamente independente do controle imunológico do hospedeiro do Plasmodium e pode fornecer informações interessantes para tratamentos futuros.
Outros animais
Embora não existam reservatórios animais para as cepas de malária que causam infecções humanas, foram identificadas quase 200 espécies de Plasmodium parasitas que infectam aves, répteis e outros mamíferos, e cerca de 30 espécies infectam naturalmente primatas não humanos. Alguns parasitas da malária que afetam primatas não humanos (NHP) servem como organismos modelo para parasitas da malária humana, como P. coatneyi (um modelo para P. falciparum) e P. cynomolgi (P. vivax). As técnicas de diagnóstico usadas para detectar parasitas em NHP são semelhantes às empregadas para humanos. Os parasitas da malária que infectam roedores são amplamente utilizados como modelos em pesquisas, como P. berghei. A malária aviária afeta principalmente espécies da ordem Passeriformes e representa uma ameaça substancial para as aves do Havaí, Galápagos e outros arquipélagos. O parasita P. relictum é conhecido por desempenhar um papel na limitação da distribuição e abundância de aves endêmicas do Havaí. Espera-se que o aquecimento global aumente a prevalência e a distribuição global da malária aviária, pois as temperaturas elevadas fornecem condições ideais para a reprodução do parasita.
Contenido relacionado
Cólera
Endocitose
Nitrox