Liderar
Chumbo é um elemento químico com o símbolo Pb (do latim plumbum ) e número atômico 82. É um metal pesado mais denso que a maioria dos materiais comuns. O chumbo é macio e maleável e também tem um ponto de fusão relativamente baixo. Quando recém-cortado, o chumbo é um cinza brilhante com um toque de azul. Mancha para uma cor cinza opaca quando exposto ao ar. O chumbo tem o maior número atômico de qualquer elemento estável e três de seus isótopos são pontos finais das principais cadeias de decaimento nuclear de elementos mais pesados. O chumbo é tóxico, mesmo em pequenas quantidades, especialmente para crianças.
O chumbo é um metal pós-transição relativamente não reativo. Seu fraco caráter metálico é ilustrado por sua natureza anfotérica; chumbo e óxidos de chumbo reagem com ácidos e bases, e tende a formar ligações covalentes. Compostos de chumbo são geralmente encontrados no estado de oxidação +2 em vez do estado +4 comum com membros mais leves do grupo de carbono. As exceções são principalmente limitadas a compostos organochumbo. Como os membros mais leves do grupo, o chumbo tende a se ligar a si mesmo; pode formar cadeias e estruturas poliédricas.
Como o chumbo é facilmente extraído de seus minérios, os povos pré-históricos do Oriente Próximo sabiam disso. Galena é um minério principal de chumbo que geralmente contém prata. O interesse pela prata ajudou a iniciar a extração generalizada e o uso de chumbo na Roma antiga. A produção de chumbo diminuiu após a queda de Roma e não atingiu níveis comparáveis até a Revolução Industrial. Lider jogado um papel crucial no desenvolvimento da imprensa, pois os tipos móveis podiam ser fundidos com relativa facilidade a partir de ligas de chumbo. Em 2014, a produção global anual de chumbo foi de cerca de dez milhões de toneladas, mais da metade proveniente da reciclagem. A alta densidade do chumbo, baixo ponto de fusão, ductilidade e relativa inércia à oxidação o tornam útil. Essas propriedades, combinadas com sua relativa abundância e baixo custo, resultaram em seu uso extensivo em construção, encanamento, baterias, balas e granalhas, pesos, soldas, estanhos, ligas fusíveis, tintas brancas, gasolina com chumbo e proteção contra radiação.
A toxicidade do chumbo tornou-se amplamente reconhecida no final do século 19, embora vários escritores gregos e romanos antigos e bem-educados estivessem cientes desse fato e até conhecessem alguns dos sintomas de envenenamento por chumbo. O chumbo é uma neurotoxina que se acumula nos tecidos moles e nos ossos; danifica o sistema nervoso e interfere na função das enzimas biológicas, causando distúrbios neurológicos que vão desde problemas comportamentais até danos cerebrais, e também afeta a saúde geral, os sistemas cardiovascular e renal.
Propriedades físicas
Atômica
Um átomo de chumbo tem 82 elétrons, dispostos em uma configuração eletrônica de [Xe]4f145d106s26p 2. A soma da primeira e segunda energias de ionização do chumbo - a energia total necessária para remover os dois elétrons 6p - é próxima à do estanho, o vizinho superior do chumbo no grupo do carbono. Isso é incomum; as energias de ionização geralmente caem descendo um grupo, à medida que os elétrons externos de um elemento se tornam mais distantes do núcleo e mais protegidos por orbitais menores.
A soma das quatro primeiras energias de ionização do chumbo excede a do estanho, ao contrário do que as tendências periódicas previam. Isso é explicado pelos efeitos relativísticos, que se tornam significativos em átomos mais pesados, que contraem os orbitais s e p de tal forma que os elétrons 6s do chumbo têm energias de ligação maiores do que seus elétrons 5s. Uma consequência é o chamado efeito de par inerte: os elétrons 6s do chumbo tornam-se relutantes em participar da ligação, estabilizando o estado de oxidação +2 e tornando a distância entre os átomos mais próximos no chumbo cristalino extraordinariamente longa.
Os congêneres do grupo de carbono mais leve do chumbo formam alótropos estáveis ou metaestáveis com a estrutura cúbica de diamante coordenada tetraédrica e ligada covalentemente. Os níveis de energia de seus orbitais s e p externos são próximos o suficiente para permitir a mistura em quatro orbitais sp3 híbridos. No chumbo, o efeito do par inerte aumenta a separação entre seus orbitais s e p, e a lacuna não pode ser superada pela energia que seria liberada por ligações extras após a hibridação. Em vez de ter uma estrutura cúbica de diamante, o chumbo forma ligações metálicas nas quais apenas os elétrons p são deslocalizados e compartilhados entre os íons Pb2+. O chumbo, conseqüentemente, tem uma estrutura cúbica centrada na face, como os metais bivalentes de tamanho semelhante, cálcio e estrôncio.
Em massa
O chumbo puro tem uma aparência cinza brilhante com um toque de azul. Em contacto com o ar húmido, embaça e adquire um aspeto baço, cuja tonalidade depende das condições ambientais. As propriedades características do chumbo incluem alta densidade, maleabilidade, ductilidade e alta resistência à corrosão devido à passivação.
A estrutura cúbica compacta de face centrada do chumbo e o alto peso atômico resultam em uma densidade de 11,34 g/cm3, que é maior que a de metais comuns como o ferro (7,87 g/cm3), cobre (8,93 g/cm3) e zinco (7,14 g/cm3). Essa densidade é a origem da expressão passar como um balão de chumbo. Alguns metais mais raros são mais densos: o tungstênio e o ouro têm ambos 19,3 g/cm3, e o ósmio, o metal mais denso conhecido, tem uma densidade de 22,59 g/cm3, quase o dobro do chumbo.
O chumbo é um metal muito macio com dureza Mohs de 1,5; pode ser arranhado com a unha. É bastante maleável e um pouco dúctil. O módulo de massa do chumbo - uma medida de sua facilidade de compressibilidade - é 45,8 GPa. Em comparação, a do alumínio é de 75,2 GPa; cobre 137,8 GPa; e aço macio 160–169 GPa. A resistência à tração do chumbo, de 12 a 17 MPa, é baixa (a do alumínio é 6 vezes maior, do cobre 10 vezes e do aço macio 15 vezes maior); pode ser reforçado pela adição de pequenas quantidades de cobre ou antimônio.
O ponto de fusão do chumbo - a 327,5 °C (621,5 °F) - é muito baixo em comparação com a maioria dos metais. Seu ponto de ebulição de 1749 °C (3180 °F) é o mais baixo entre os elementos do grupo de carbono. A resistividade elétrica do chumbo a 20 °C é de 192 nanoohms, quase uma ordem de grandeza superior à de outros metais industriais (cobre em 15,43 nΩ·m; ouro 20,51 nΩ·m; e alumínio a 24,15 nΩ·m). O chumbo é um supercondutor em temperaturas inferiores a 7,19 K; esta é a temperatura crítica mais alta de todos os supercondutores do tipo I e a terceira mais alta dos supercondutores elementares.
Isótopos
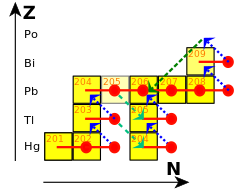
O chumbo natural consiste em quatro isótopos estáveis com números de massa de 204, 206, 207 e 208, e vestígios de cinco radioisótopos de vida curta. O alto número de isótopos é consistente com o número atômico do chumbo ser par. O chumbo tem um número mágico de prótons (82), para o qual o modelo do invólucro nuclear prevê com precisão um núcleo especialmente estável. O chumbo-208 tem 126 nêutrons, outro número mágico, que pode explicar por que o chumbo-208 é extraordinariamente estável.
Com seu alto número atômico, o chumbo é o elemento mais pesado cujos isótopos naturais são considerados estáveis; chumbo-208 é o núcleo estável mais pesado. (Esta distinção caiu anteriormente para o bismuto, com um número atômico de 83, até que seu único isótopo primordial, o bismuto-209, foi encontrado em 2003 para decair muito lentamente.) Os quatro isótopos estáveis de chumbo poderiam, teoricamente, sofrer decaimento alfa para isótopos de mercúrio. com liberação de energia, mas isso não foi observado para nenhum deles; suas meias-vidas previstas variam de 1035 a 10189 anos (pelo menos 1025 vezes a idade atual do universo).
Três dos isótopos estáveis são encontrados em três das quatro principais cadeias de decaimento: chumbo-206, chumbo-207 e chumbo-208 são os produtos finais de decaimento do urânio-238, urânio-235 e tório-232, respectivamente. Essas cadeias de decaimento são chamadas de cadeia de urânio, cadeia de actínio e cadeia de tório. Suas concentrações isotópicas em uma amostra de rocha natural dependem muito da presença desses três isótopos originais de urânio e tório. Por exemplo, a abundância relativa de chumbo-208 pode variar de 52% em amostras normais a 90% em minérios de tório; por esse motivo, o peso atômico padrão do chumbo é dado com apenas uma casa decimal. Com o passar do tempo, a proporção de chumbo-206 e chumbo-207 para chumbo-204 aumenta, uma vez que os dois primeiros são suplementados pelo decaimento radioativo de elementos mais pesados, enquanto o último não; isso permite a datação chumbo-chumbo. À medida que o urânio se decompõe em chumbo, suas quantidades relativas mudam; esta é a base para a datação de urânio-chumbo. O Chumbo-207 apresenta ressonância magnética nuclear, propriedade que tem sido utilizada para estudar seus compostos em solução e no estado sólido, inclusive no corpo humano.
Além dos isótopos estáveis, que compõem quase todo o chumbo que existe naturalmente, existem vestígios de alguns isótopos radioativos. Um deles é o chumbo-210; embora tenha uma meia-vida de apenas 22,2 anos, pequenas quantidades ocorrem na natureza porque o chumbo-210 é produzido por uma longa série de decaimentos que começa com o urânio-238 (que está presente há bilhões de anos na Terra). Chumbo-211, -212 e -214 estão presentes nas cadeias de decaimento de urânio-235, tório-232 e urânio-238, respectivamente, portanto, traços de todos esses três isótopos de chumbo são encontrados naturalmente. Traços minúsculos de chumbo-209 surgem do raríssimo enxame de rádio-223, um dos produtos filhos do urânio-235 natural, e da cadeia de decaimento do neptúnio-237, cujos vestígios são produzidos pela captura de nêutrons em minérios de urânio. O chumbo-210 é particularmente útil para ajudar a identificar as idades das amostras, medindo sua relação com o chumbo-206 (ambos os isótopos estão presentes em uma única cadeia de decaimento).
No total, 43 isótopos de chumbo foram sintetizados, com números de massa de 178 a 220. Chumbo-205 é o radioisótopo mais estável, com meia-vida em torno de 1,73×107 anos. O segundo mais estável é o chumbo-202, que tem uma meia-vida de cerca de 52.500 anos, mais longa do que qualquer um dos radioisótopos naturais.
Química
O chumbo a granel exposto ao ar úmido forma uma camada protetora de composição variável. O carbonato de chumbo(II) é um constituinte comum; o sulfato ou cloreto também pode estar presente em ambientes urbanos ou marítimos. Essa camada torna o chumbo a granel efetivamente inerte quimicamente no ar. O chumbo em pó fino, como acontece com muitos metais, é pirofórico e queima com uma chama branco-azulada.
O flúor reage com o chumbo à temperatura ambiente, formando fluoreto de chumbo(II). A reação com o cloro é semelhante, mas requer aquecimento, pois a camada de cloreto resultante diminui a reatividade dos elementos. O chumbo fundido reage com os calcogênios para formar calcogenetos de chumbo(II).
O chumbo metálico resiste aos ácidos sulfúrico e fosfórico, mas não aos ácidos clorídrico ou nítrico; o resultado depende da insolubilidade e subsequente passivação do sal do produto. Os ácidos orgânicos, como o ácido acético, dissolvem o chumbo na presença de oxigênio. Os álcalis concentrados dissolvem o chumbo e formam plumbites.
Compostos inorgânicos
O chumbo apresenta dois estados de oxidação principais: +4 e +2. O estado tetravalente é comum para o grupo de carbono. O estado bivalente é raro para o carbono e o silício, menor para o germânio, importante (mas não predominante) para o estanho e é o mais importante dos dois estados de oxidação para o chumbo. Isso é atribuível a efeitos relativísticos, especificamente o efeito de par inerte, que se manifesta quando há uma grande diferença de eletronegatividade entre chumbo e óxido, haleto ou ânions de nitreto, levando a uma carga positiva parcial significativa no chumbo. O resultado é uma contração mais forte do orbital 6s do chumbo do que no caso do orbital 6p, tornando-o bastante inerte em compostos iônicos. O efeito do par inerte é menos aplicável a compostos nos quais o chumbo forma ligações covalentes com elementos de eletronegatividade semelhante, como o carbono em compostos orgânicos de chumbo. Nestes, os orbitais 6s e 6p permanecem de tamanho semelhante e a hibridização sp3 ainda é energeticamente favorável. O chumbo, como o carbono, é predominantemente tetravalente em tais compostos.
Há uma diferença relativamente grande na eletronegatividade do chumbo(II) em 1,87 e do chumbo(IV) em 2,33. Essa diferença marca a reversão na tendência de aumento da estabilidade do estado de oxidação +4 descendo o grupo de carbono; o estanho, em comparação, tem valores de 1,80 no estado de oxidação +2 e 1,96 no estado +4.
Liderar(II)
Compostos de chumbo(II) são característicos da química inorgânica do chumbo. Mesmo agentes oxidantes fortes como flúor e cloro reagem com chumbo para dar apenas PbF2 e PbCl2. Os íons Chumbo(II) são geralmente incolores em solução e parcialmente hidrolisados para formar Pb(OH)+ e finalmente [Pb4(OH)4]4+ (nos quais os íons hidroxila atuam como ligantes em ponte), mas não são agentes redutores como os íons de estanho(II). As técnicas para identificar a presença do íon Pb2+ na água geralmente se baseiam na precipitação de cloreto de chumbo(II) usando ácido clorídrico diluído. Como o sal de cloreto é pouco solúvel em água, em soluções muito diluídas, a precipitação de sulfeto de chumbo(II) é obtida borbulhando sulfeto de hidrogênio através da solução.
O monóxido de chumbo existe em dois polimorfos, litargírio α-PbO (vermelho) e massicote β-PbO (amarelo), sendo este último estável apenas acima de cerca de 488 °C. Litargírio é o composto inorgânico de chumbo mais comumente usado. Não há hidróxido de chumbo(II); o aumento do pH de soluções de sais de chumbo (II) leva à hidrólise e condensação. O chumbo geralmente reage com calcogênios mais pesados. O sulfeto de chumbo é um semicondutor, um fotocondutor e um detector de radiação infravermelha extremamente sensível. Os outros dois calcogenetos, seleneto de chumbo e telureto de chumbo, também são fotocondutores. Eles são incomuns porque sua cor se torna mais clara ao longo do grupo.
Os di-halogenetos de chumbo são bem caracterizados; isso inclui o diastatide e haletos mistos, como PbFCl. A relativa insolubilidade deste último constitui uma base útil para a determinação gravimétrica do flúor. O difluoreto foi o primeiro composto sólido ionicamente condutor a ser descoberto (em 1834, por Michael Faraday). Os outros di-halogenetos se decompõem quando expostos à luz ultravioleta ou visível, especialmente o di-iodeto. Muitos pseudo-halogenetos de chumbo(II) são conhecidos, como cianeto, cianato e tiocianato. Chumbo(II) forma uma extensa variedade de complexos de coordenação de haletos, como [PbCl4]2−, [PbCl6] 4−, e o [Pb2Cl9]n5n− ânion da cadeia.
O sulfato de chumbo(II) é insolúvel em água, como os sulfatos de outros cátions divalentes pesados. O nitrato de chumbo(II) e o acetato de chumbo(II) são muito solúveis, e isso é explorado na síntese de outros compostos de chumbo.
Liderar(IV)
Poucos compostos inorgânicos de chumbo(IV) são conhecidos. Eles são formados apenas em soluções altamente oxidantes e normalmente não existem em condições padrão. O óxido de chumbo(II) dá um óxido misto em oxidação posterior, Pb3O4. É descrito como óxido de chumbo(II,IV), ou estruturalmente 2PbO·PbO2, e é o composto de chumbo de valência mista mais conhecido. O dióxido de chumbo é um forte agente oxidante, capaz de oxidar o ácido clorídrico a cloro gasoso. Isso ocorre porque o PbCl4 esperado que seria produzido é instável e se decompõe espontaneamente em PbCl2 e Cl2. Analogamente ao monóxido de chumbo, o dióxido de chumbo é capaz de formar ânions plumbato. O dissulfeto de chumbo e o disseleneto de chumbo são estáveis apenas em altas pressões. O tetrafluoreto de chumbo, um pó cristalino amarelo, é estável, mas menos do que o difluoreto. O tetracloreto de chumbo (um óleo amarelo) se decompõe à temperatura ambiente, o tetrabrometo de chumbo é ainda menos estável e a existência do tetraiodeto de chumbo é questionável.
Outros estados de oxidação
Alguns compostos de chumbo existem em estados de oxidação formal diferentes de +4 ou +2. Chumbo(III) pode ser obtido, como intermediário entre chumbo(II) e chumbo(IV), em complexos organochumbo maiores; este estado de oxidação não é estável, pois tanto o íon chumbo (III) quanto os complexos maiores que o contêm são radicais. O mesmo se aplica ao chumbo(I), que pode ser encontrado em tais espécies radicais.
Numerosos óxidos mistos de chumbo(II,IV) são conhecidos. Quando PbO2 é aquecido no ar, torna-se Pb12O19 a 293 °C, Pb12O 17 a 351 °C, Pb3O4 a 374 °C e, finalmente, PbO a 605 °C. Um outro sesquióxido, Pb2O3, pode ser obtido em alta pressão, juntamente com várias fases não estequiométricas. Muitos deles apresentam estruturas de fluorita defeituosas nas quais alguns átomos de oxigênio são substituídos por lacunas: PbO pode ser considerado como tendo tal estrutura, com cada camada alternada de átomos de oxigênio ausentes.
Estados de oxidação negativos podem ocorrer como fases Zintl, como ânions livres de chumbo, como em Ba2Pb, com o chumbo sendo formalmente chumbo(−IV), ou em forma de anel sensível ao oxigênio ou íons de agrupamento poliédrico, como o íon Pb52− trigonal bipiramidal, onde dois átomos de chumbo são chumbo(−I) e três são chumbo(0). Em tais ânions, cada átomo está em um vértice poliédrico e contribui com dois elétrons para cada ligação covalente ao longo de uma borda de seus orbitais híbridos sp3, sendo os outros dois um par externo solitário. Eles podem ser feitos em amônia líquida através da redução do chumbo pelo sódio.
Organochumbo
O chumbo pode formar cadeias com ligações múltiplas, uma propriedade que compartilha com seus homólogos mais leves no grupo do carbono. Sua capacidade de fazê-lo é muito menor porque a energia da ligação Pb-Pb é mais de três vezes e meia menor que a da ligação C-C. Com ele mesmo, o chumbo pode construir ligações metal-metal de ordem até três. Com o carbono, o chumbo forma compostos orgânicos de chumbo semelhantes, mas geralmente menos estáveis do que os compostos orgânicos típicos (devido à ligação Pb-C ser bastante fraca). Isso torna a química organometálica do chumbo muito menos ampla do que a do estanho. O chumbo forma predominantemente compostos organochumbo(IV), mesmo quando começa com reagentes inorgânicos de chumbo(II); muito poucos compostos organochumbo(II) são conhecidos. As exceções mais bem caracterizadas são Pb[CH(SiMe3)2]2 e Pb(η5-C5H5)2.
O análogo principal do composto orgânico mais simples, o metano, é o plumbano. O plumbane pode ser obtido em uma reação entre o chumbo metálico e o hidrogênio atômico. Dois derivados simples, tetrametilchumbo e tetraetila, são os compostos orgânicos de chumbo mais conhecidos. Esses compostos são relativamente estáveis: o chumbo tetraetila só começa a se decompor se for aquecido ou exposto à luz solar ou à luz ultravioleta. Com o sódio metálico, o chumbo forma prontamente uma liga equimolar que reage com os haletos de alquila para formar compostos organometálicos como o chumbo tetraetila. A natureza oxidante de muitos compostos organochumbo é explorada de forma útil: o tetraacetato de chumbo é um importante reagente de laboratório para a oxidação na síntese orgânica. O chumbo tetraetila, uma vez adicionado à gasolina, foi produzido em maiores quantidades do que qualquer outro composto organometálico. Outros compostos organochumbo são menos estáveis quimicamente. Para muitos compostos orgânicos, não existe um análogo de chumbo.
Origem e ocorrência
| Atómica número | Elemento | Relativo quantidade |
|---|---|---|
| 42 | Molibdênio | 0.798 |
| 46. | Palladium | 0 |
| 50 | Tintim | 1.146 |
| 78 | Platinum Platinum Platinum | 0 |
| 80 | Mercúrio | 0,127 |
| 82 | Liderança | 1 |
| 90 | Thorium | 0,011 |
| 92 | Uranium | 0,003 |
No espaço
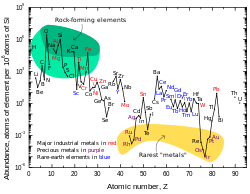
A abundância por partícula de chumbo no Sistema Solar é de 0,121 ppb (partes por bilhão). Esse número é duas vezes e meia maior que o da platina, oito vezes mais que o mercúrio e dezessete vezes mais que o ouro. A quantidade de chumbo no universo está aumentando lentamente à medida que os átomos mais pesados (todos instáveis) decaem gradualmente em chumbo. A abundância de chumbo no Sistema Solar desde sua formação há 4,5 bilhões de anos aumentou cerca de 0,75%. A tabela de abundâncias do sistema solar mostra que o chumbo, apesar de seu número atômico relativamente alto, é mais prevalente do que a maioria dos outros elementos com números atômicos superiores a 40.
O chumbo primordial - que compreende os isótopos chumbo-204, chumbo-206, chumbo-207 e chumbo-208 - foi criado principalmente como resultado de processos repetitivos de captura de nêutrons que ocorrem nas estrelas. Os dois principais modos de captura são os processos s e r.
No processo s (s significa "lento"), as capturas são separadas por anos ou décadas, permitindo que núcleos menos estáveis sofram decaimento beta. Um núcleo estável de tálio-203 pode capturar um nêutron e se tornar tálio-204; este sofre decaimento beta para dar chumbo-204 estável; ao capturar outro nêutron, torna-se chumbo-205, que tem meia-vida em torno de 15 milhões de anos. Outras capturas resultam em lead-206, lead-207 e lead-208. Ao capturar outro nêutron, o chumbo-208 torna-se chumbo-209, que rapidamente se decompõe em bismuto-209. O bismuto-209 também é radioativo e eventualmente se decompõe em tálio-205 se não for perturbado. Ao capturar outro nêutron, o bismuto-209 torna-se bismuto-210, e este beta decai para polônio-210, que alfa decai para chumbo-206. O ciclo, portanto, termina em chumbo-206, chumbo-207, chumbo-208 e tálio-205.
No processo r (r é para "rápido"), as capturas acontecem mais rapidamente do que os núcleos podem decair. Isso ocorre em ambientes com alta densidade de nêutrons, como uma supernova ou a fusão de duas estrelas de nêutrons. O fluxo de nêutrons envolvido pode ser da ordem de 1022 nêutrons por centímetro quadrado por segundo. O processo r não forma tanto chumbo quanto o processo s. Ele tende a parar quando os núcleos ricos em nêutrons atingem 126 nêutrons. Nesse ponto, os nêutrons estão dispostos em conchas completas no núcleo atômico e fica mais difícil acomodar energeticamente mais deles. Quando o fluxo de nêutrons diminui, esses núcleos beta decaem em isótopos estáveis de ósmio, irídio e platina.
Na Terra
O chumbo é classificado como calcófilo na classificação de Goldschmidt, o que significa que geralmente é encontrado combinado com enxofre. Raramente ocorre em sua forma metálica nativa. Muitos minerais de chumbo são relativamente leves e, ao longo da história da Terra, permaneceram na crosta em vez de afundar mais profundamente no interior da Terra. Isso explica a abundância crustal relativamente alta de 14 ppm; é o 38º elemento mais abundante na crosta.
O principal mineral de chumbo é a galena (PbS), que é encontrada principalmente com minérios de zinco. A maioria dos outros minerais de chumbo está relacionada com a galena de alguma forma; boulangerita, Pb5Sb4S11, é um sulfeto misto derivado da galena; anglesite, PbSO4, é um produto da oxidação da galena; e cerussita ou minério de chumbo branco, PbCO3, é um produto da decomposição da galena. Arsênico, estanho, antimônio, prata, ouro, cobre e bismuto são impurezas comuns em minerais de chumbo.
Os recursos mundiais de chumbo ultrapassam dois bilhões de toneladas. Depósitos significativos estão localizados na Austrália, China, Irlanda, México, Peru, Portugal, Rússia e Estados Unidos. As reservas globais - recursos economicamente viáveis para extração - totalizaram 88 milhões de toneladas em 2016, das quais a Austrália tinha 35 milhões, a China 17 milhões e a Rússia 6,4 milhões.
As concentrações típicas de chumbo não excedem 0,1 μg/m3 na atmosfera; 100 mg/kg no solo; 4 mg/kg na vegetação e 5 μg/L em água doce e água do mar.
Etimologia
A palavra inglesa moderna lead é de origem germânica; vem do inglês médio leed e do inglês antigo lēad (com o macron acima do "e" significando que o som da vogal daquele letra é longa). A palavra do inglês antigo é derivada do hipotético proto-germânico reconstruído *lauda- ('lead&# 39;). De acordo com a teoria lingüística, esta palavra gerou descendentes em várias línguas germânicas com exatamente o mesmo significado.
Não há consenso sobre a origem do proto-germânico *lauda-. Uma hipótese sugere que é derivado do proto-indo-europeu *lAudh- ('lead'; capitalização da vogal é equivalente ao macron). Outra hipótese sugere que é emprestado do proto-céltico *ɸloud-io- ('lead'). Esta palavra está relacionada ao latim plumbum, que deu ao elemento seu símbolo químico Pb. Acredita-se que a palavra *ɸloud-io- seja a origem do proto-germânico *bliwa- (que também significa 'chumbo'), do qual surgiu o alemão Blei.
O nome do elemento químico não tem relação com o verbo de mesma grafia, que é derivado do proto-germânico *laidijan- ('liderar').
História
Pré-história e história antiga
Contas metálicas de chumbo que datam de 7.000 a 6.500 aC foram encontradas na Ásia Menor e podem representar o primeiro exemplo de fundição de metal. Naquela época, o chumbo tinha poucas (ou nenhuma) aplicações devido à sua maciez e aparência opaca. A principal razão para a disseminação da produção de chumbo foi sua associação com a prata, que pode ser obtida pela queima da galena (um mineral comum de chumbo). Os antigos egípcios foram os primeiros a usar minerais de chumbo em cosméticos, uma aplicação que se espalhou para a Grécia Antiga e além; os egípcios podem ter usado chumbo para chumbadas em redes de pesca, esmaltes, vidros, esmaltes e ornamentos. Várias civilizações do Crescente Fértil usaram chumbo como material de escrita, como moedas e como material de construção. O chumbo era usado na antiga corte real chinesa como estimulante, como moeda e como contraceptivo; a civilização do Vale do Indo e os mesoamericanos a usavam para fazer amuletos; e os povos da África Oriental e Austral usavam chumbo na trefilação.
Era clássica
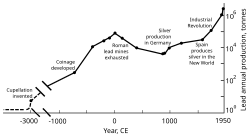
Como a prata era amplamente usada como material decorativo e meio de troca, os depósitos de chumbo passaram a ser trabalhados na Ásia Menor a partir de 3000 AEC; mais tarde, os depósitos de chumbo foram desenvolvidos no Egeu e Laurion. Essas três regiões dominaram coletivamente a produção de chumbo extraído até c. 1200 AEC. Começando por volta de 2.000 AEC, os fenícios trabalharam em depósitos na Península Ibérica; por volta de 1600 AEC, a mineração de chumbo existia em Chipre, Grécia e Sardenha.
A expansão territorial de Roma na Europa e no Mediterrâneo, e o desenvolvimento da mineração, levaram-na a se tornar o maior produtor de chumbo durante a era clássica, com uma produção anual estimada em 80.000 toneladas. Como seus predecessores, os romanos obtinham chumbo principalmente como subproduto da fundição de prata. A mineração de chumbo ocorreu na Europa Central, Grã-Bretanha, Bálcãs, Grécia, Anatólia e Hispânia, sendo esta última responsável por 40% da produção mundial.
Platas de chumbo eram comumente usadas como material para cartas. Caixões de chumbo, fundidos em formas planas de areia, com motivos intercambiáveis para se adequar à fé do falecido eram usados na antiga Judéia. O chumbo foi usado para fazer balas de estilingue desde o século 5 aC. Na época romana, as balas de funda de chumbo eram amplamente utilizadas e eram eficazes a uma distância entre 100 e 150 metros. Os fundibulários baleares, usados como mercenários nos exércitos cartaginês e romano, eram famosos por sua distância de tiro e precisão.
O chumbo era usado para fazer canos de água no Império Romano; a palavra latina para o metal, plumbum, é a origem da palavra inglesa "encanamento". Sua facilidade de trabalho, seu baixo ponto de fusão permitindo a fabricação fácil de juntas soldadas completamente à prova d'água e sua resistência à corrosão garantiram seu uso generalizado em outras aplicações, incluindo produtos farmacêuticos, coberturas, moeda e guerra. Escritores da época, como Catão, o Velho, Columela e Plínio, o Velho, recomendavam recipientes de chumbo (ou revestidos com chumbo) para a preparação de adoçantes e conservantes adicionados ao vinho e aos alimentos. O chumbo conferia um sabor agradável devido à formação de "açúcar de chumbo" (acetato de chumbo(II)), enquanto vasos de cobre ou bronze podem conferir um sabor amargo através da formação de azinhavre.
Este metal era de longe o material mais usado na antiguidade clássica, e é apropriado referir-se à idade de chumbo (Romano). O chumbo era para os romanos o que é plástico para nós.
Heinz Eschnauer e Markus Stoeppler
"Mulher - Um banco de espécime enológico", 1992
O autor romano Vitrúvio relatou os perigos do chumbo para a saúde e escritores modernos sugeriram que o envenenamento por chumbo desempenhou um papel importante no declínio do Império Romano. Outros pesquisadores criticaram tais alegações, apontando, por exemplo, que nem toda dor abdominal é causada por envenenamento por chumbo. De acordo com a pesquisa arqueológica, os canos de chumbo romanos aumentaram os níveis de chumbo na água da torneira, mas tal efeito era "improvável de ter sido realmente prejudicial". Quando ocorria envenenamento por chumbo, as vítimas eram chamadas de "saturninas", sombrias e cínicas, em homenagem ao macabro pai dos deuses, Saturno. Por associação, o chumbo foi considerado o pai de todos os metais. Seu status na sociedade romana era baixo, pois era prontamente disponível e barato.
Confusão com estanho e antimônio
Desde a Idade do Bronze, os metalúrgicos e engenheiros entenderam a diferença entre o estanho raro e valioso, essencial para a liga com o cobre para produzir bronze resistente e resistente à corrosão, e chumbo "barato e alegre". No entanto, a nomenclatura em alguns idiomas é semelhante. Os romanos chamavam chumbo plumbum nigrum ("chumbo preto") e estanho plumbum candidum ("chumbo brilhante"). A associação de chumbo e estanho pode ser vista em outras línguas: a palavra olovo em tcheco se traduz em "lead", mas em russo, seu cognato олово (olovo) significa "estanho". Para aumentar a confusão, o chumbo tinha uma estreita relação com o antimônio: ambos os elementos comumente ocorrem como sulfetos (galena e estibina), muitas vezes juntos. Plínio escreveu incorretamente que a estibina daria chumbo no aquecimento, em vez de antimônio. Em países como a Turquia e a Índia, o nome originalmente persa surma passou a se referir a sulfeto de antimônio ou sulfeto de chumbo e, em alguns idiomas, como o russo, deu seu nome ao antimônio (сурьма).
Idade Média e Renascimento
A mineração de chumbo na Europa Ocidental declinou após a queda do Império Romano Ocidental, sendo a Ibéria Arábica a única região com uma produção significativa. A maior produção de chumbo ocorreu no sul e leste da Ásia, especialmente China e Índia, onde a mineração de chumbo cresceu rapidamente.
Na Europa, a produção de chumbo começou a aumentar nos séculos 11 e 12, quando voltou a ser usado para telhados e tubulações. A partir do século 13, o chumbo foi usado para criar vitrais. Nas tradições de alquimia européias e árabes, o chumbo (símbolo ♄ na tradição européia) era considerado um metal impuro e básico que, pela separação, purificação e equilíbrio de suas essências constituintes, poderia ser transformado em ouro puro e incorruptível. Durante o período, o chumbo foi usado cada vez mais para adulterar o vinho. O uso desse vinho foi proibido para uso em ritos cristãos por uma bula papal em 1498, mas continuou a ser embebido e resultou em envenenamentos em massa até o final do século XVIII. O chumbo era um material essencial em partes da impressora, e o pó de chumbo era comumente inalado pelos impressores, causando envenenamento por chumbo. O chumbo também se tornou o principal material para a fabricação de balas de armas de fogo: era barato, danificava menos o cano das armas de ferro, tinha densidade maior (o que permitia uma melhor retenção de velocidade) e seu ponto de fusão mais baixo facilitava a produção de balas, pois poderia ser feito usando um fogo de madeira. O chumbo, na forma de ceruse veneziano, era amplamente utilizado em cosméticos pela aristocracia da Europa Ocidental, pois rostos brancos eram considerados um sinal de modéstia. Essa prática mais tarde se expandiu para perucas brancas e delineadores, e só desapareceu com a Revolução Francesa no final do século XVIII. Uma moda semelhante apareceu no Japão no século 18 com o surgimento das gueixas, uma prática que continuou por muito tempo no século 20. Os rostos brancos das mulheres "passaram a representar sua virtude feminina como as japonesas", sendo o chumbo comumente usado no branqueador.
Fora da Europa e Ásia
No Novo Mundo, a produção de chumbo foi registrada logo após a chegada dos colonos europeus. O registro mais antigo data de 1621 na colônia inglesa da Virgínia, quatorze anos após sua fundação. Na Austrália, a primeira mina aberta pelos colonos no continente foi uma mina de chumbo, em 1841. Na África, a mineração e fundição de chumbo eram conhecidas no Benue Trough e na baixa bacia do Congo, onde o chumbo era usado para comércio com os europeus e como uma moeda no século 17, bem antes da disputa pela África.
Revolução Industrial
Na segunda metade do século 18, a Grã-Bretanha e, posteriormente, a Europa continental e os Estados Unidos experimentaram a Revolução Industrial. Esta foi a primeira vez em que as taxas de produção de chumbo ultrapassaram as de Roma. A Grã-Bretanha era o principal produtor, perdendo esse status em meados do século XIX com o esgotamento de suas minas e o desenvolvimento da mineração de chumbo na Alemanha, Espanha e Estados Unidos. Em 1900, os Estados Unidos eram o líder na produção global de chumbo, e outras nações não européias - Canadá, México e Austrália - haviam iniciado uma produção significativa; a produção fora da Europa excedeu a interna. Uma grande parte da demanda de chumbo vinha do encanamento e da pintura - as tintas à base de chumbo eram usadas regularmente. Nessa época, mais pessoas (da classe trabalhadora) foram expostas ao metal e os casos de envenenamento por chumbo aumentaram. Isso levou a pesquisas sobre os efeitos da ingestão de chumbo. O chumbo provou ser mais perigoso em sua forma de fumaça do que como um metal sólido. Envenenamento por chumbo e gota foram associados; O médico britânico Alfred Baring Garrod observou que um terço de seus pacientes com gota eram encanadores e pintores. Os efeitos da ingestão crônica de chumbo, incluindo transtornos mentais, também foram estudados no século XIX. As primeiras leis destinadas a diminuir o envenenamento por chumbo nas fábricas foram promulgadas durante as décadas de 1870 e 1880 no Reino Unido.
Era moderna
Outras evidências da ameaça que o chumbo representava para os humanos foram descobertas no final do século 19 e início do século 20. Os mecanismos de dano foram melhor compreendidos, a cegueira por chumbo foi documentada e o elemento foi retirado de uso público nos Estados Unidos e na Europa. O Reino Unido introduziu inspeções fabris obrigatórias em 1878 e nomeou o primeiro inspetor médico de fábricas em 1898; como resultado, foi relatada uma diminuição de 25 vezes nos incidentes de envenenamento por chumbo de 1900 a 1944. A maioria dos países europeus proibiu a tinta com chumbo - comumente usada por causa de sua opacidade e resistência à água - para interiores em 1930.
A última grande exposição humana ao chumbo foi a adição de chumbo tetraetila à gasolina como agente antidetonante, uma prática que se originou nos Estados Unidos em 1921. Foi eliminada nos Estados Unidos e na União Européia em 2000.
Na década de 1970, os Estados Unidos e os países da Europa Ocidental introduziram legislação para reduzir a poluição do ar por chumbo. O impacto foi significativo: enquanto um estudo realizado pelos Centros de Controle e Prevenção de Doenças dos Estados Unidos em 1976-1980 mostrou que 77,8% da população apresentava níveis elevados de chumbo no sangue, em 1991-1994, um estudo do mesmo instituto mostrou a parcela de pessoas com níveis tão altos caiu para 2,2%. O principal produto feito de chumbo no final do século 20 era a bateria de chumbo-ácido.
De 1960 a 1990, a produção de chumbo no bloco ocidental cresceu cerca de 31%. A participação da produção mundial de chumbo pelo Bloco de Leste aumentou de 10% para 30%, de 1950 a 1990, sendo a União Soviética o maior produtor mundial em meados dos anos 1970 e 1980, e a China iniciando uma grande produção de chumbo no final do século 20. Ao contrário dos países comunistas europeus, a China era amplamente não industrializada em meados do século XX; em 2004, a China ultrapassou a Austrália como maior produtor de chumbo. Como foi o caso durante a industrialização européia, o chumbo teve um efeito negativo na saúde na China.
Produção
A partir de 2014, a produção de chumbo está aumentando em todo o mundo devido ao seu uso em baterias de chumbo-ácido. Existem duas categorias principais de produção: primária de minérios extraídos e secundária de sucata. Em 2014, 4,58 milhões de toneladas métricas vieram da produção primária e 5,64 milhões da produção secundária. Os três principais produtores de concentrado de chumbo extraído naquele ano foram China, Austrália e Estados Unidos. Os três maiores produtores de chumbo refinado foram China, Estados Unidos e Índia. De acordo com o relatório Metal Stocks in Society do International Resource Panel de 2010, a quantidade total de chumbo em uso, armazenado, descartado ou dissipado no meio ambiente, globalmente, é de 8 kg per capita. Muito disso ocorre em países mais desenvolvidos (20–150 kg per capita) e não nos menos desenvolvidos (1–4 kg per capita).
Os processos de produção de chumbo primário e secundário são semelhantes. Algumas fábricas de produção primária agora complementam suas operações com sucata de chumbo, e essa tendência provavelmente aumentará no futuro. Dadas as técnicas adequadas, o chumbo obtido através de processos secundários é indistinguível do chumbo obtido através de processos primários. A sucata de chumbo do comércio de construção geralmente é bastante limpa e é refundida sem a necessidade de fundição, embora o refino às vezes seja necessário. A produção secundária de chumbo é, portanto, mais barata, em termos de requisitos de energia, do que a produção primária, muitas vezes em 50% ou mais.
Principal
A maioria dos minérios de chumbo contém uma baixa porcentagem de chumbo (minérios ricos têm um teor típico de 3–8%) que deve ser concentrado para extração. Durante o processamento inicial, os minérios normalmente passam por britagem, separação de meio denso, moagem, flotação de espuma e secagem. O concentrado resultante, que tem um teor de chumbo de 30 a 80% em massa (normalmente 50 a 60%), é então transformado em metal de chumbo (impuro).
Há duas formas principais de fazer isso: um processo de duas etapas envolvendo ustulação seguida de extração em alto-forno, realizada em vasos separados; ou um processo direto em que a extração do concentrado ocorre em um único recipiente. Esta última tornou-se a rota mais comum, embora a primeira ainda seja significativa.
| Pais | Saída (mil toneladas) |
|---|---|
| 2.400 | |
| 500. | |
| 335 | |
| 310 | |
| 250 | |
| 225 | |
| 135 | |
| 80 | |
| 76 | |
| 75 | |
| 41 | |
| 41 | |
| 40 | |
| 40 | |
| 35 | |
| 33 | |
| 33 | |
| Outros países | 170 |
Processo de duas etapas
Primeiro, o concentrado de sulfeto é torrado ao ar para oxidar o sulfeto de chumbo:
- 2 PbS(s) + 3 O2(g) → 2 PbO(s) + 2 SO2(g)↑
Como o concentrado original não era sulfeto de chumbo puro, a torrefação produz não apenas o óxido de chumbo (II) desejado, mas uma mistura de óxidos, sulfatos e silicatos de chumbo e de outros metais contidos no minério. Este óxido de chumbo impuro é reduzido em um alto-forno a coque ao (novamente, impuro) metal:
- 2 PbO(s) + C(s) → 2 Pb(s) + CO2(g)↑
As impurezas são principalmente arsênico, antimônio, bismuto, zinco, cobre, prata e ouro. Normalmente, eles são removidos em uma série de processos pirometalúrgicos. O fundido é tratado em um forno reverberatório com ar, vapor e enxofre, que oxida as impurezas, exceto prata, ouro e bismuto. Os contaminantes oxidados flutuam para o topo do fundido e são removidos. A prata e o ouro metálicos são removidos e recuperados economicamente por meio do processo Parkes, no qual o zinco é adicionado ao chumbo. O zinco, imiscível com o chumbo, dissolve a prata e o ouro. A solução de zinco pode ser separada do chumbo e a prata e o ouro recuperados. O chumbo sem prata é liberado do bismuto pelo processo Betterton-Kroll, tratando-o com cálcio metálico e magnésio. A escória de bismuto resultante pode ser removida.
Em alternativa aos processos pirometalúrgicos, o chumbo muito puro pode ser obtido processando chumbo fundido eletroliticamente usando o processo Betts. Ânodos de chumbo impuro e cátodos de chumbo puro são colocados em um eletrólito de fluorossilicato de chumbo (PbSiF6). Uma vez que o potencial elétrico é aplicado, o chumbo impuro no ânodo se dissolve e se deposita no cátodo, deixando a maioria das impurezas em solução. Este é um processo de alto custo e, portanto, principalmente reservado para refino de lingotes contendo altas porcentagens de impurezas.
Processo direto
Neste processo, o lingote e a escória de chumbo são obtidos diretamente dos concentrados de chumbo. O concentrado de sulfeto de chumbo é fundido em um forno e oxidado, formando monóxido de chumbo. Carbono (como coque ou gás de carvão) é adicionado à carga fundida junto com agentes fundentes. O monóxido de chumbo é assim reduzido a chumbo metálico, no meio de uma escória rica em monóxido de chumbo.
Se o insumo for rico em chumbo, até 80% do chumbo original pode ser obtido como ouro; os 20% restantes formam uma escória rica em monóxido de chumbo. Para uma alimentação de baixo teor, todo o chumbo pode ser oxidado a uma escória com alto teor de chumbo. O chumbo metálico é ainda obtido das escórias com alto teor de chumbo (25-40%) por meio de combustão ou injeção de combustível submerso, redução assistida por um forno elétrico ou uma combinação de ambos.
Alternativas
A pesquisa sobre um processo de extração de chumbo mais limpo e menos intensivo em energia continua; uma grande desvantagem é que muito chumbo é perdido como desperdício ou as alternativas resultam em um alto teor de enxofre no metal de chumbo resultante. A extração hidrometalúrgica, na qual ânodos de chumbo impuro são imersos em um eletrólito e chumbo puro é depositado (eletroenrolado) em um cátodo, é uma técnica que pode ter potencial, mas atualmente não é econômica, exceto nos casos em que a eletricidade é muito barata.
Secundário
A fundição, que é uma parte essencial da produção primária, geralmente é omitida durante a produção secundária. Só é realizada quando o chumbo metálico sofreu oxidação significativa. O processo é semelhante ao da produção primária em alto-forno ou forno rotativo, com a diferença essencial sendo a maior variabilidade de rendimentos: os altos-fornos produzem chumbo duro (10% de antimônio), enquanto os fornos reverberatórios e rotativos produzem chumbo semimole (3-4% de antimônio).
O processo ISASMELT é um método de fundição mais recente que pode funcionar como uma extensão da produção primária; pasta de bateria de baterias de chumbo-ácido usadas (contendo sulfato de chumbo e óxidos de chumbo) tem seu sulfato removido por tratamento com álcali e é então tratada em um forno a carvão na presença de oxigênio, que produz chumbo impuro, com antimônio o impureza mais comum. O refino do chumbo secundário é semelhante ao do chumbo primário; alguns processos de refino podem ser ignorados dependendo do material reciclado e sua potencial contaminação.
Das fontes de chumbo para reciclagem, as baterias de chumbo-ácido são as mais importantes; tubos de chumbo, chapas e revestimentos de cabos também são significativos.
Aplicativos
Ao contrário da crença popular, os grafites dos lápis de madeira nunca foram feitos de grafite. Quando o lápis se originou como uma ferramenta de escrita de grafite embrulhado, o tipo específico de grafite usado foi denominado plumbago (literalmente, ato de chumbo ou maquete de chumbo).
Forma elementar
O chumbo metálico tem várias propriedades mecânicas úteis, incluindo alta densidade, baixo ponto de fusão, ductilidade e inércia relativa. Muitos metais são superiores ao chumbo em alguns desses aspectos, mas geralmente são menos comuns e mais difíceis de extrair dos minérios originais. A toxicidade do chumbo levou à sua eliminação progressiva para alguns usos.
O chumbo tem sido usado para balas desde sua invenção na Idade Média. É barato; seu baixo ponto de fusão significa que munição para armas pequenas e projéteis de espingarda podem ser lançados com o mínimo de equipamento técnico; e é mais denso que outros metais comuns, o que permite uma melhor retenção de velocidade. Continua sendo o principal material para balas, ligado a outros metais como endurecedores. Preocupações foram levantadas de que balas de chumbo usadas para caça podem prejudicar o meio ambiente.
A alta densidade e resistência à corrosão do chumbo foram exploradas em várias aplicações relacionadas. É utilizado como lastro em quilhas de veleiros; a sua densidade permite-lhe ocupar um pequeno volume e minimizar a resistência à água, contrabalançando assim o efeito de inclinação do vento nas velas. É usado em cintos de peso de mergulho para neutralizar a flutuabilidade do mergulhador. Em 1993, a base da Torre Inclinada de Pisa foi estabilizada com 600 toneladas de chumbo. Devido à sua resistência à corrosão, o chumbo é usado como uma bainha protetora para cabos subaquáticos.
O chumbo tem muitos usos na indústria da construção; folhas de chumbo são usadas como metais arquitetônicos em material de cobertura, revestimento, rufo, calhas e juntas de calhas e em parapeitos de telhado. O chumbo ainda é usado em estátuas e esculturas, inclusive para armaduras. Antigamente era muito usado para equilibrar as rodas dos carros; por razões ambientais, esse uso está sendo substituído por outros materiais.
O chumbo é adicionado às ligas de cobre, como latão e bronze, para melhorar a usinabilidade e por suas qualidades lubrificantes. Sendo praticamente insolúvel em cobre, o chumbo forma glóbulos sólidos em imperfeições ao longo da liga, como contornos de grão. Em baixas concentrações, além de atuar como lubrificante, os glóbulos impedem a formação de limalhas durante o trabalho da liga, melhorando a usinabilidade. Ligas de cobre com maiores concentrações de chumbo são usadas em rolamentos. O chumbo fornece lubrificação e o cobre fornece o suporte de carga.
A alta densidade, o número atômico e a conformabilidade do chumbo formam a base para o uso do chumbo como uma barreira que absorve som, vibração e radiação. O chumbo não possui frequências de ressonância natural; como resultado, o chumbo laminado é usado como uma camada de amortecimento de som nas paredes, pisos e tetos dos estúdios de som. Os tubos de órgão são frequentemente feitos de uma liga de chumbo, misturada com várias quantidades de estanho para controlar o tom de cada tubo. O chumbo é um material de proteção contra radiação estabelecido na ciência nuclear e em salas de raios-X devido à sua densidade e alto coeficiente de atenuação. Chumbo derretido tem sido usado como refrigerante para reatores rápidos resfriados por chumbo.
Baterias
O maior uso de chumbo no início do século 21 é em baterias de chumbo-ácido. O chumbo nas baterias não entra em contato direto com os seres humanos, portanto, há menos problemas de toxicidade. As pessoas que trabalham em fábricas de produção de baterias de chumbo podem ser expostas ao pó de chumbo e inalá-lo. As reações na bateria entre chumbo, dióxido de chumbo e ácido sulfúrico fornecem uma fonte confiável de tensão. Supercapacitores incorporando baterias de chumbo-ácido foram instalados em aplicações de escala de quilowatts e megawatts na Austrália, Japão e Estados Unidos em regulação de frequência, suavização e deslocamento solar, suavização de vento e outras aplicações. Essas baterias têm menor densidade de energia e eficiência de carga e descarga do que as baterias de íon-lítio, mas são significativamente mais baratas.
Revestimento para cabos
O chumbo é usado em cabos de alta tensão como material de revestimento para evitar a difusão de água no isolamento; esse uso está diminuindo à medida que o chumbo está sendo eliminado. Seu uso em solda para eletrônicos também está sendo eliminado por alguns países para reduzir a quantidade de resíduos perigosos para o meio ambiente. O chumbo é um dos três metais usados no teste Oddy para materiais de museus, ajudando a detectar ácidos orgânicos, aldeídos e gases ácidos.
Compostos
Além de ser a principal aplicação do chumbo metálico, as baterias de chumbo-ácido também são as principais consumidoras de compostos de chumbo. A reação de armazenamento/liberação de energia usada nesses dispositivos envolve sulfato de chumbo e dióxido de chumbo:
- PB(s) + PbO
2(s) + 2H. H. H.
2Então...
4(aq) → 2PbSO
4(s) + 2H. H. H.
2O(l)
Outras aplicações de compostos de chumbo são muito especializadas e muitas vezes desaparecem. Agentes corantes à base de chumbo são usados em esmaltes cerâmicos e vidros, especialmente para tons de vermelho e amarelo. Embora as tintas à base de chumbo sejam eliminadas na Europa e na América do Norte, elas permanecem em uso em países menos desenvolvidos, como China, Índia ou Indonésia. Tetraacetato de chumbo e dióxido de chumbo são usados como agentes oxidantes em química orgânica. O chumbo é freqüentemente usado no revestimento de cloreto de polivinila de cabos elétricos. Pode ser usado para tratar mechas de velas para garantir uma queima mais longa e uniforme. Devido à sua toxicidade, os fabricantes europeus e norte-americanos utilizam alternativas como o zinco. O vidro de chumbo é composto de 12 a 28% de óxido de chumbo, alterando suas características ópticas e reduzindo a transmissão de radiação ionizante, propriedade utilizada em TVs antigas e monitores de computador com tubos de raios catódicos. Semicondutores à base de chumbo, como telureto de chumbo e seleneto de chumbo, são usados em células fotovoltaicas e detectores infravermelhos.
Efeitos biológicos
O chumbo não tem papel biológico confirmado e não há nível seguro confirmado de exposição ao chumbo. Um estudo canadense-americano de 2009 concluiu que, mesmo em níveis considerados de pouco ou nenhum risco, o chumbo pode causar "resultados adversos à saúde mental". Sua prevalência no corpo humano - em uma média adulta de 120 mg - é superada apenas pelo zinco (2.500 mg) e ferro (4.000 mg) entre os metais pesados. Os sais de chumbo são absorvidos de forma muito eficiente pelo organismo. Uma pequena quantidade de chumbo (1%) é armazenada nos ossos; o restante é excretado na urina e nas fezes dentro de algumas semanas após a exposição. Apenas cerca de um terço do chumbo é excretado por uma criança. A exposição contínua pode resultar na bioacumulação de chumbo.
Toxicidade
O chumbo é um metal altamente venenoso (seja inalado ou ingerido), afetando quase todos os órgãos e sistemas do corpo humano. Em níveis no ar de 100 mg/m3, é imediatamente perigoso para a vida e a saúde. A maior parte do chumbo ingerido é absorvida pela corrente sanguínea. A principal causa de sua toxicidade é sua predileção por interferir no bom funcionamento das enzimas. Ele faz isso ligando-se aos grupos sulfidrila encontrados em muitas enzimas, ou imitando e deslocando outros metais que atuam como cofatores em muitas reações enzimáticas. Os metais essenciais com os quais o chumbo interage incluem cálcio, ferro e zinco. Altos níveis de cálcio e ferro tendem a fornecer alguma proteção contra envenenamento por chumbo; níveis baixos causam maior suscetibilidade.
Efeitos
O chumbo pode causar danos graves ao cérebro e aos rins e, por fim, à morte. Ao imitar o cálcio, o chumbo pode atravessar a barreira hematoencefálica. Ele degrada as bainhas de mielina dos neurônios, reduz seu número, interfere nas rotas de neurotransmissão e diminui o crescimento neuronal. No corpo humano, o chumbo inibe a porfobilinogênio sintase e a ferroquelatase, impedindo tanto a formação de porfobilinogênio quanto a incorporação de ferro na protoporfirina IX, a etapa final da síntese do heme. Isso causa síntese ineficaz de heme e anemia microcítica.
Os sintomas de envenenamento por chumbo incluem nefropatia, dores abdominais semelhantes a cólicas e possivelmente fraqueza nos dedos, pulsos ou tornozelos. Pequenos aumentos da pressão arterial, principalmente em pessoas de meia-idade e idosos, podem ser aparentes e causar anemia. Vários estudos, principalmente transversais, encontraram uma associação entre o aumento da exposição ao chumbo e a diminuição da variabilidade da frequência cardíaca. Em mulheres grávidas, altos níveis de exposição ao chumbo podem causar aborto espontâneo. Foi demonstrado que a exposição crônica de alto nível reduz a fertilidade em homens.
No cérebro em desenvolvimento de uma criança, o chumbo interfere na formação de sinapses no córtex cerebral, no desenvolvimento neuroquímico (incluindo o dos neurotransmissores) e na organização dos canais iônicos. A exposição na primeira infância tem sido associada a um risco aumentado de distúrbios do sono e sonolência diurna excessiva na infância posterior. Níveis sanguíneos elevados estão associados ao atraso da puberdade em meninas. O aumento e a queda na exposição ao chumbo transportado pelo ar a partir da combustão de chumbo tetraetila na gasolina durante o século 20 foram associados a aumentos e reduções históricas nos níveis de criminalidade.
Fontes de exposição
A exposição ao chumbo é um problema global, já que a mineração e fundição de chumbo e a fabricação, descarte e reciclagem de baterias são comuns em muitos países. O chumbo entra no corpo por inalação, ingestão ou absorção pela pele. Quase todo o chumbo inalado é absorvido pelo corpo; para ingestão, a taxa é de 20 a 70%, com as crianças absorvendo uma porcentagem maior do que os adultos.
O envenenamento geralmente resulta da ingestão de alimentos ou água contaminados com chumbo e, menos comumente, após a ingestão acidental de solo contaminado, poeira ou tinta à base de chumbo. Os produtos de água do mar podem conter chumbo se forem afetados por águas industriais próximas. Frutas e vegetais podem ser contaminados por altos níveis de chumbo nos solos em que foram cultivados. O solo pode ser contaminado por acúmulo de partículas de chumbo em canos, tinta com chumbo e emissões residuais da gasolina com chumbo.
O uso de chumbo para canos de água é um problema em áreas com água mole ou ácida. A água dura forma camadas protetoras insolúveis na superfície interna dos canos, enquanto a água mole e ácida dissolve os canos de chumbo. O dióxido de carbono dissolvido na água transportada pode resultar na formação de bicarbonato de chumbo solúvel; a água oxigenada pode dissolver o chumbo da mesma forma que o hidróxido de chumbo (II). Beber essa água, com o tempo, pode causar problemas de saúde devido à toxicidade do chumbo dissolvido. Quanto mais dura a água, mais bicarbonato e sulfato de cálcio ela conterá, e mais o interior dos canos será revestido com uma camada protetora de carbonato de chumbo ou sulfato de chumbo.
A ingestão de tinta à base de chumbo aplicada é a principal fonte de exposição para crianças: uma fonte direta está mastigando velhos peitoris de janela pintados. Como alternativa, à medida que a tinta seca aplicada se deteriora, ela descasca, é pulverizada em pó e entra no corpo por meio do contato das mãos com a boca ou com alimentos, água ou álcool contaminados. A ingestão de certos remédios caseiros pode resultar em exposição ao chumbo ou seus compostos.
A inalação é a segunda maior via de exposição, afetando fumantes e especialmente trabalhadores em ocupações relacionadas ao chumbo. A fumaça do cigarro contém, entre outras substâncias tóxicas, chumbo-210 radioativo. “Como resultado dos esforços regulatórios da EPA, os níveis de chumbo no ar [nos Estados Unidos] diminuíram 86% entre 2010 e 2020”. A concentração de chumbo no ar nos Estados Unidos caiu abaixo do padrão nacional de 0,15 μg/m3 em 2014.
A exposição da pele pode ser significativa para pessoas que trabalham com compostos orgânicos de chumbo. A taxa de absorção pela pele é menor para o chumbo inorgânico.
Chumbo nos alimentos
O chumbo pode ser encontrado nos alimentos quando os alimentos são cultivados em solo com alto teor de chumbo, o chumbo transportado pelo ar contamina as plantações, os animais comem chumbo em sua dieta ou o chumbo entra nos alimentos a partir do que foi armazenado ou cozido. de tintas com chumbo e baterias também é uma via de exposição para o gado, que pode posteriormente afetar os seres humanos. O leite produzido por gado contaminado pode ser diluído para uma concentração menor de chumbo e vendido para consumo.
Em Bangladesh, compostos de chumbo foram adicionados ao açafrão para torná-lo mais amarelo. Acredita-se que isso tenha começado na década de 1980 e continue até 2019. Acredita-se que seja uma das principais fontes de altos níveis de chumbo no país. Em Hong Kong, o máximo permitido de partes de chumbo por milhão é 6 em alimentos sólidos e 1 em alimentos líquidos.
Em dezembro de 2022, a Consumer Reports testou 28 marcas de chocolate amargo e descobriu que 23 delas continham níveis potencialmente nocivos de chumbo, cádmio ou ambos. Eles instaram os fabricantes de chocolate a reduzir o nível de chumbo, que pode ser prejudicial a certas pessoas, especialmente mulheres grávidas. A poeira contendo chumbo pode assentar na secagem dos grãos de cacau quando eles são colocados ao ar livre perto de plantas industriais poluidoras.
Chumbo em brinquedos de plástico
De acordo com o Centro de Controle de Doenças dos Estados Unidos, o uso de chumbo em plásticos não foi proibido. O chumbo amolece o plástico e torna-o mais flexível para que possa voltar à sua forma original. Também pode ser usado em brinquedos de plástico para estabilizar as moléculas do calor. Pó de chumbo pode ser formado quando o plástico é exposto à luz solar, ar e detergentes que quebram a ligação química entre o chumbo e os plásticos.
Tratamento
O tratamento para envenenamento por chumbo normalmente envolve a administração de dimercaprol e succimer. Casos agudos podem requerer o uso de edetato de cálcio dissódico, quelato de cálcio e sal dissódico do ácido etilenodiaminotetracético (EDTA). Tem maior afinidade pelo chumbo do que pelo cálcio, de modo que o quelato de chumbo é formado por troca e excretado na urina, deixando para trás o cálcio inofensivo.
Efeitos ambientais
A extração, produção, uso e descarte de chumbo e seus produtos causaram contaminação significativa dos solos e águas da Terra. As emissões atmosféricas de chumbo atingiram seu pico durante a Revolução Industrial e o período da gasolina com chumbo na segunda metade do século XX.
As liberações de chumbo são originárias de fontes naturais (ou seja, concentração do chumbo que ocorre naturalmente), produção industrial, incineração e reciclagem e mobilização de chumbo previamente enterrado. Em particular, como o chumbo foi eliminado de outros usos, no Sul Global, as operações de reciclagem de chumbo projetadas para extrair chumbo barato usado para fabricação global tornaram-se uma fonte de exposição bem documentada. Concentrações elevadas de chumbo persistem em solos e sedimentos em áreas urbanas e pós-industriais; as emissões industriais, inclusive as decorrentes da queima de carvão, continuam em muitas partes do mundo, principalmente nos países em desenvolvimento.
O chumbo pode acumular-se nos solos, especialmente naqueles com alto teor orgânico, onde permanece durante centenas a milhares de anos. O chumbo ambiental pode competir com outros metais encontrados nas superfícies das plantas, potencialmente inibindo a fotossíntese e em concentrações altas o suficiente, afetando negativamente o crescimento e a sobrevivência das plantas. A contaminação de solos e plantas pode permitir que o chumbo ascenda na cadeia alimentar afetando microrganismos e animais. Em animais, o chumbo apresenta toxicidade em muitos órgãos, danificando os sistemas nervoso, renal, reprodutivo, hematopoiético e cardiovascular após ingestão, inalação ou absorção pela pele. Os peixes absorvem chumbo da água e dos sedimentos; a bioacumulação na cadeia alimentar representa um perigo para peixes, aves e mamíferos marinhos.
O chumbo antropogênico inclui o chumbo do tiro e chumbadas. Estes estão entre as fontes mais potentes de contaminação por chumbo, juntamente com os locais de produção de chumbo. O chumbo foi banido por arremessos e chumbadas nos Estados Unidos em 2017, embora essa proibição tenha durado apenas um mês, e uma proibição semelhante está sendo considerada na União Europeia.
Os métodos analíticos para a determinação de chumbo no ambiente incluem espectrofotometria, fluorescência de raios-X, espectroscopia atômica e métodos eletroquímicos. Foi desenvolvido um eletrodo íon-seletivo específico baseado no ionóforo S,S'-metilenobis (N,N-diisobutilditiocarbamato). Um importante ensaio de biomarcador para envenenamento por chumbo são os níveis de ácido δ-aminolevulínico no plasma, soro e urina.
Restrição e correção
Em meados da década de 1980, houve um declínio significativo no uso de chumbo na indústria. Nos Estados Unidos, as regulamentações ambientais reduziram ou eliminaram o uso de chumbo em produtos não relacionados a baterias, incluindo gasolina, tintas, soldas e sistemas de água. Dispositivos de controle de partículas foram instalados em usinas a carvão para capturar as emissões de chumbo. Em 1992, o Congresso dos EUA exigiu que a Agência de Proteção Ambiental reduzisse os níveis de chumbo no sangue das crianças do país. O uso de chumbo foi ainda mais restringido pela Diretiva de Restrição de Substâncias Perigosas da União Européia de 2003. Uma grande queda na deposição de chumbo ocorreu na Holanda após a proibição nacional de 1993 do uso de chumbo para caça e tiro esportivo: de 230 toneladas em 1990 para 47,5 toneladas em 1995.
Nos Estados Unidos, o limite de exposição permitido para chumbo no local de trabalho, incluindo chumbo metálico, compostos inorgânicos de chumbo e sabões de chumbo, foi definido em 50 μg/m3 durante um período de 8 horas dia de trabalho e o limite de nível de chumbo no sangue em 5 μg por 100 g de sangue em 2012. Chumbo ainda pode ser encontrado em quantidades perigosas em grés, vinil (como o usado para tubos e isolamento de cabos elétricos) e latão chinês. Casas antigas ainda podem conter tinta com chumbo. A tinta de chumbo branco foi retirada da venda nos países industrializados, mas permanecem usos especializados de outros pigmentos, como cromato de chumbo amarelo. A remoção de tinta velha por meio de lixamento produz poeira que pode ser inalada. Programas de redução de chumbo foram exigidos por algumas autoridades em propriedades onde vivem crianças pequenas.
Os resíduos de chumbo, dependendo da jurisdição e da natureza dos resíduos, podem ser tratados como resíduos domésticos (para facilitar as atividades de redução de chumbo) ou resíduos potencialmente perigosos que requerem tratamento ou armazenamento especializado. O chumbo é liberado no ambiente em locais de tiro e várias práticas de gerenciamento de chumbo foram desenvolvidas para combater a contaminação por chumbo. A migração de chumbo pode ser aumentada em solos ácidos; para combater isso, é aconselhável tratar os solos com cal para neutralizar os solos e evitar a lixiviação do chumbo.
Estão sendo realizadas pesquisas sobre como remover o chumbo dos biossistemas por meios biológicos: Ossos de peixes estão sendo pesquisados quanto à sua capacidade de biorremediar o chumbo em solo contaminado. O fungo Aspergillus versicolor é eficaz na absorção de íons de chumbo de resíduos industriais antes de serem liberados em corpos d'água. Várias bactérias foram pesquisadas por sua capacidade de remover chumbo do ambiente, incluindo as bactérias redutoras de sulfato Desulfovibrio e Desulfomaculum, ambas altamente eficazes em soluções aquosas.
Contenido relacionado
Criptoanálise
Processo endotérmico
Bomba de difusão