Lantânio
Lantânio é um elemento químico com o símbolo La e número atômico 57. É um metal macio, dúctil, branco prateado que escurece lentamente quando exposto ao ar. É o epônimo da série dos lantanídeos, um grupo de 15 elementos semelhantes entre o lantânio e o lutécio na tabela periódica, da qual o lantânio é o primeiro e o protótipo. Lantânio é tradicionalmente contado entre os elementos de terras raras. Como a maioria dos outros elementos de terras raras, o estado de oxidação usual é +3, embora alguns compostos sejam conhecidos com estado de oxidação +2. Lantânio não tem papel biológico em humanos, mas é essencial para algumas bactérias. Não é particularmente tóxico para os seres humanos, mas mostra alguma atividade antimicrobiana.
Lantânio geralmente ocorre junto com cério e outros elementos de terras raras. O lantânio foi encontrado pela primeira vez pelo químico sueco Carl Gustaf Mosander em 1839 como uma impureza no nitrato de cério – daí o nome lantânio, do grego antigo λανθάνειν (lanthanein), que significa 'ficar escondido'. Embora seja classificado como um elemento de terras raras, o lantânio é o 28º elemento mais abundante na crosta terrestre, quase três vezes mais abundante que o chumbo. Em minerais como monazita e bastnäsite, o lantânio compõe cerca de um quarto do conteúdo de lantanídeos. É extraído desses minerais por um processo de tal complexidade que o lantânio metálico puro não foi isolado até 1923.
Compostos de lantânio têm inúmeras aplicações como catalisadores, aditivos em vidro, lâmpadas de arco de carbono para luzes de estúdio e projetores, elementos de ignição em isqueiros e tochas, cátodos de elétrons, cintiladores, eletrodos de soldagem a arco de gás tungstênio e outras coisas. O carbonato de lantânio é usado como aglutinante de fosfato em casos de altos níveis de fosfato no sangue observados com insuficiência renal.
Características
Físico
Lantânio é o primeiro elemento e protótipo da série dos lantanídeos. Na tabela periódica, aparece à direita do bário de metal alcalino-terroso e à esquerda do cério lantanídeo. O lantânio é geralmente considerado o primeiro dos elementos do bloco f pelos autores que escrevem sobre o assunto. Os 57 elétrons de um átomo de lantânio estão dispostos na configuração [Xe]5d16s2, com três elétrons de valência fora do núcleo do gás nobre. Nas reações químicas, o lantânio quase sempre cede esses três elétrons de valência das subcamadas 5d e 6s para formar o estado de oxidação +3, alcançando a configuração estável do gás nobre anterior xenônio. Alguns compostos de lantânio (II) também são conhecidos, mas geralmente são muito menos estáveis. O monóxido de lantânio (LaO) produz fortes bandas de absorção em alguns espectros estelares.
Entre os lantanídeos, o lantânio é excepcional, pois não possui elétrons 4f como um único átomo na fase gasosa. Assim, é apenas muito fracamente paramagnético, ao contrário dos lantanídeos fortemente paramagnéticos posteriores (com exceção dos dois últimos, itérbio e lutécio, onde a camada 4f está completamente cheia). No entanto, a casca 4f do lantânio pode ficar parcialmente ocupada em ambientes químicos e participar de ligações químicas. Por exemplo, os pontos de fusão dos lantanídeos trivalentes (todos menos európio e itérbio) estão relacionados à extensão da hibridização dos elétrons 6s, 5d e 4f (diminuindo com o aumento do envolvimento de 4f), e o lantânio tem o segundo ponto de fusão mais baixo entre eles: 920 °C. (Európio e itérbio têm pontos de fusão mais baixos porque deslocalizam cerca de dois elétrons por átomo em vez de três). resultado de forte repulsão intereletrônica tornando menos lucrativo ocupar a camada 4f, pois é pequena e próxima aos elétrons do núcleo).
Os lantanídeos tornam-se mais duros à medida que a série é percorrida: como esperado, o lantânio é um metal macio. O lantânio tem uma resistividade relativamente alta de 615 nΩm à temperatura ambiente; em comparação, o valor para o alumínio bom condutor é de apenas 26,50 nΩm. O lantânio é o menos volátil dos lantanídeos. Como a maioria dos lantanídeos, o lantânio tem uma estrutura cristalina hexagonal à temperatura ambiente. A 310 °C, o lantânio muda para uma estrutura cúbica de face centrada e, a 865 °C, muda para uma estrutura cúbica de corpo centrado.
Químico
Como esperado das tendências periódicas, o lantânio tem o maior raio atômico dos lantanídeos. Portanto, é o mais reativo entre eles, embaçando rapidamente no ar, escurecendo completamente após várias horas e pode facilmente queimar para formar óxido de lantânio (III), La2O3, que é quase tão básico quanto o óxido de cálcio. Uma amostra de lantânio do tamanho de um centímetro corroerá completamente em um ano, pois seu óxido se desprende como a ferrugem do ferro, em vez de formar um revestimento protetor de óxido como alumínio, escândio, ítrio e lutécio. O lantânio reage com os halogênios à temperatura ambiente para formar os tri-haletos e, após o aquecimento, formará compostos binários com os não-metais nitrogênio, carbono, enxofre, fósforo, boro, selênio, silício e arsênico. Lantânio reage lentamente com água para formar hidróxido de lantânio(III), La(OH)3. Em ácido sulfúrico diluído, o lantânio forma prontamente o íon tripositivo aquado [La(H2O)9]3+: é incolor em solução aquosa, pois La3+ não possui elétrons d ou f. O lantânio é a base mais forte e dura entre os elementos de terras raras, o que é novamente esperado por ser o maior deles.
Alguns compostos de lantânio (II) também são conhecidos, mas são muito menos estáveis. Portanto, ao nomear oficialmente compostos de lantânio, seu número de oxidação sempre deve ser mencionado.
Isótopos
O lantânio natural é composto de dois isótopos, o estável 139La e o primordial radioisótopo de vida longa 138La. 139La é de longe o mais abundante, constituindo 99,910% do lantânio natural: é produzido no processo s (captura lenta de nêutrons, que ocorre em estrelas de baixa a média massa) e o r-process (captura rápida de nêutrons, que ocorre em supernovas de colapso do núcleo). É o único isótopo estável do lantânio. O isótopo muito raro 138La é um dos poucos núcleos primordiais ímpares, com uma longa meia-vida de 1,05×1011 anos. É um dos núcleos p ricos em prótons que não podem ser produzidos nos processos s ou r. 138La, junto com o ainda mais raro 180mTa, é produzido no processo ν, onde neutrinos interagem com núcleos estáveis. Todos os outros isótopos de lantânio são sintéticos: com exceção de 137La com meia-vida de cerca de 60.000 anos, todos eles têm meia-vida inferior a um dia e a maioria tem meia-vida inferior a um minuto. Os isótopos 139La e 140La ocorrem como produtos de fissão do urânio.
Compostos
O óxido de lantânio é um sólido branco que pode ser preparado pela reação direta de seus elementos constituintes. Devido ao grande tamanho do íon La3+, La2O3 adota uma estrutura hexagonal de 7 coordenadas que muda para 6- estrutura coordenada de óxido de escândio (Sc2O3) e óxido de ítrio (Y2O3) em alta temperatura. Quando reage com a água, forma-se hidróxido de lantânio: muito calor é liberado na reação e um som sibilante é ouvido. O hidróxido de lantânio reagirá com o dióxido de carbono atmosférico para formar o carbonato básico.
O fluoreto de lantânio é insolúvel em água e pode ser usado como um teste qualitativo para a presença de La3+. Os haletos mais pesados são todos compostos deliquescentes muito solúveis. Os haletos anidros são produzidos por reação direta de seus elementos, pois o aquecimento dos hidratos causa hidrólise: por exemplo, o aquecimento do LaCl3 hidratado produz LaOCl.
O lantânio reage exotermicamente com o hidrogênio para produzir o dihidreto LaH2, um composto condutor preto, pirofórico, quebradiço, com estrutura de fluoreto de cálcio. Este é um composto não estequiométrico, e a absorção adicional de hidrogênio é possível, com uma perda concomitante de condutividade elétrica, até que o LaH3 mais semelhante ao sal seja alcançado. Como LaI2 e LaI, LaH2 é provavelmente um composto de eletreto.
Devido ao grande raio iônico e grande eletropositividade de La3+, não há muita contribuição covalente para sua ligação e, portanto, tem uma química de coordenação limitada, como o ítrio e os outros lantanídeos. Oxalato de lantânio não se dissolve muito em soluções de oxalato de metal alcalino, e [La(acac)3(H2O)2] se decompõe em torno de 500 °C. O oxigênio é o átomo doador mais comum nos complexos de lantânio, que são em sua maioria iônicos e geralmente possuem números de coordenação altos acima de 6: 8 é o mais característico, formando estruturas antiprismáticas quadradas e dodecadeltádricas. Estas espécies de alta coordenação, chegando até o número de coordenação 12 com o uso de ligantes quelantes como em La2(SO4)3· 9H2O, muitas vezes têm um baixo grau de simetria devido a fatores estereoquímicos.
A química do lantânio tende a não envolver ligações π devido à configuração eletrônica do elemento: assim, sua química organometálica é bastante limitada. Os compostos organolântanos mais bem caracterizados são o complexo ciclopentadienil La(C5H5)3, que é produzido pela reação do LaCl3 anidro com NaC5H5 em tetrahidrofurano e seus derivados substituídos por metila.
História
Em 1751, o mineralogista sueco Axel Fredrik Cronstedt descobriu um mineral pesado da mina de Bastnäs, mais tarde denominado cerita. Trinta anos depois, Wilhelm Hisinger, de quinze anos, da família proprietária da mina, enviou uma amostra para Carl Scheele, que não encontrou nenhum elemento novo. Em 1803, depois que Hisinger se tornou um mestre do ferro, ele voltou ao mineral com Jöns Jacob Berzelius e isolou um novo óxido que eles chamaram de ceria em homenagem ao planeta anão Ceres, que havia sido descoberto dois anos antes. Ceria foi isolada simultaneamente de forma independente na Alemanha por Martin Heinrich Klaproth. Entre 1839 e 1843, a ceria foi demonstrada como uma mistura de óxidos pelo cirurgião e químico sueco Carl Gustaf Mosander, que viveu na mesma casa que Berzelius e estudou com ele: ele separou dois outros óxidos que chamou de lanthana e didímia. Ele decompôs parcialmente uma amostra de nitrato de cério torrando-a ao ar e depois tratando o óxido resultante com ácido nítrico diluído. Nesse mesmo ano, Axel Erdmann, aluno também do Instituto Karolinska, descobriu o lantânio em um novo mineral da ilha de Låven, localizada em um fiorde norueguês.
Finalmente, Mosander explicou seu atraso, dizendo que havia extraído um segundo elemento do cério, e a isso ele chamou de didímio. Embora ele não percebesse, o didímio também era uma mistura e, em 1885, foi separado em praseodímio e neodímio.
Como as propriedades do lantânio diferiam apenas ligeiramente das do cério e ocorriam com ele em seus sais, ele o nomeou do grego antigo λανθάνειν [lanthanein] (lit. ficar escondido). O metal lantânio relativamente puro foi isolado pela primeira vez em 1923.
Ocorrência e produção
O lantânio é o terceiro mais abundante de todos os lantanídeos, perfazendo 39 mg/kg da crosta terrestre, atrás do neodímio com 41,5 mg/kg e do cério com 66,5 mg/kg. É quase três vezes mais abundante que o chumbo na crosta terrestre. Apesar de estar entre os chamados "metais de terras raras", o lantânio não é nada raro, mas é historicamente assim chamado porque é mais raro do que as "terras comuns" como cal e magnésia, e historicamente apenas alguns depósitos eram conhecidos. O lantânio é considerado um metal de terras raras porque o processo de mineração é difícil, demorado e caro. O lantânio raramente é o lantanídeo dominante encontrado nos minerais de terras raras e, em suas fórmulas químicas, geralmente é precedido pelo cério. Exemplos raros de minerais La-dominantes são monazita-(La) e lantanita-(La).
O íon La3+ tem tamanho semelhante aos lantanídeos iniciais do grupo cério (aqueles até samário e európio) que seguem imediatamente na tabela periódica e, portanto, tende a ocorrer junto com em minerais de fosfato, silicato e carbonato, como monazita (MIIIPO4) e bastnäsita (MIIICO3F), onde M refere-se a todos os metais de terras raras, exceto o escândio e o promécio radioativo (principalmente Ce, La e Y). Bastnäsite é geralmente carente de tório e dos lantanídeos pesados, e a purificação dos lantanídeos leves é menos envolvida. O minério, depois de triturado e moído, é primeiro tratado com ácido sulfúrico concentrado quente, liberando dióxido de carbono, fluoreto de hidrogênio e tetrafluoreto de silício: o produto é então seco e lixiviado com água, deixando os primeiros íons lantanídeos, incluindo lantânio, em solução.
O procedimento para a monazita, que geralmente contém todas as terras raras, bem como o tório, é mais complexo. A monazita, devido às suas propriedades magnéticas, pode ser separada por repetidas separações eletromagnéticas. Após a separação, é tratado com ácido sulfúrico concentrado quente para produzir sulfatos solúveis em água de terras raras. Os filtrados ácidos são parcialmente neutralizados com hidróxido de sódio para pH 3–4. O tório precipita da solução como hidróxido e é removido. Depois disso, a solução é tratada com oxalato de amônio para converter as terras raras em seus oxalatos insolúveis. Os oxalatos são convertidos em óxidos por recozimento. Os óxidos são dissolvidos em ácido nítrico que exclui um dos principais componentes, o cério, cujo óxido é insolúvel em HNO3. Lantânio é separado como um sal duplo com nitrato de amônio por cristalização. Este sal é relativamente menos solúvel do que outros sais duplos de terras raras e, portanto, permanece no resíduo. Deve-se ter cuidado ao manusear alguns dos resíduos, pois eles contêm 228Ra, filha de 232Th, que é um forte emissor gama. O lantânio é relativamente fácil de extrair, pois possui apenas um lantanídeo vizinho, o cério, que pode ser removido fazendo uso de sua capacidade de ser oxidado ao estado +4; depois disso, o lantânio pode ser separado pelo método histórico de cristalização fracionada de La(NO3)3·2NH4NO3 ·4H2O, ou por técnicas de troca iônica quando maior pureza é desejada.
O lantânio metálico é obtido de seu óxido aquecendo-o com cloreto de amônio ou fluoreto e ácido fluorídrico a 300-400 °C para produzir o cloreto ou fluoreto:
- La2O3 + 6 NH4Cl → 2 LaCl3 + 6 NH3 + 3 H2O
Isto é seguido por redução com metais alcalinos ou alcalino-terrosos no vácuo ou atmosfera de argônio:
- LaCl3 + 3 Li → La + 3 LiCl
Além disso, o lantânio puro pode ser produzido por eletrólise de mistura fundida de LaCl3 anidro e NaCl ou KCl a temperaturas elevadas.
Aplicativos
A primeira aplicação histórica do lantânio foi em mantos de lanternas a gás. Carl Auer von Welsbach usou uma mistura de óxido de lantânio e óxido de zircônio, que ele chamou de Actinophor e patenteou em 1886. Os mantos originais davam uma luz esverdeada e não tiveram muito sucesso, e sua primeira empresa, que estabeleceu uma fábrica em Atzgersdorf em 1887, faliu em 1889.
Usos modernos de lantânio incluem:
- Um material usado para o material anódico de baterias de hidreto de níquel-metal é La(Ni)
3.6Mn.
0Al.
0Co
0). Devido ao alto custo para extrair os outros lantânidas, um mischmetal com mais de 50% de lantânio é usado em vez de puro lantânio. O composto é um componente intermetálico do AB
5 Tipo. Baterias NiMH podem ser encontradas em muitos modelos do Toyota Prius vendidos nos EUA. Estas baterias de hidreto de níquel-metal maiores exigem quantidades maciças de lantânio para a produção. A bateria Toyota Prius NiMH 2008 requer 10 a 15 quilogramas (22 a 33 lb) de lantânio. Como os engenheiros empurram a tecnologia para aumentar a eficiência do combustível, duas vezes essa quantidade de lantânio poderia ser necessária por veículo. - Ligas de esponja de hidrogênio podem conter lantânio. Estas ligas são capazes de armazenar até 400 vezes o seu próprio volume de gás de hidrogênio em um processo de adsorção reversível. A energia térmica é liberada toda vez que o fazem; portanto, essas ligas têm possibilidades em sistemas de conservação de energia.
- Mischmetal, uma liga piropórica usada em flints mais leves, contém 25% a 45% de lantânio.
- O óxido de lantânio e o borreto são usados em tubos de vácuo eletrônicos como materiais de cátodo quente com forte emissividade de elétrons. Cristais de LaB6 são usados em fontes de emissão de elétrons de alta tensão, vida prolongada, termiônica para microscópios de elétrons e propulsores de efeitos de Hall.
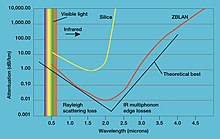
- Trifluoreto de Lantânio (LaF
3) é um componente essencial de um vidro de fluoreto pesado chamado ZBLAN. Este vidro tem transmissão superior na gama infravermelha e é, portanto, usado para sistemas de comunicação de fibra óptica. - O brometo de lantânio e o cloreto de lantânio dopado por Cerium são os recentes scintillators inorgânicos, que têm uma combinação de alto rendimento de luz, melhor resolução de energia e resposta rápida. Seu alto rendimento converte-se em resolução de energia superior; além disso, a saída de luz é muito estável e bastante alta sobre uma ampla gama de temperaturas, tornando-se particularmente atraente para aplicações de alta temperatura. Estes scintillators já são amplamente utilizados comercialmente em detectores de neutrões ou raios gama.
- As lâmpadas de arco de carbono usam uma mistura de elementos de terra raros para melhorar a qualidade da luz. Esta aplicação, especialmente pela indústria cinematográfica para iluminação e projeção de estúdio, consumiu cerca de 25% dos compostos rara-terra produzidos até a fase fora de lâmpadas de arco de carbono.
- óxido de lantânio (III) (La
2O
3) melhora a resistência alcalino de vidro e é usado na fabricação de óculos ópticos especiais, como vidro de absorção de infravermelhos, bem como lentes de câmera e telescópio, por causa do alto índice de refração e baixa dispersão de óculos de terra rara. O óxido de lantânio também é usado como aditivo de crescimento de grão durante a sinterização de fase líquida de nitreto de silício e diborídeo de zircônio. - Pequenas quantidades de lantânio adicionado ao aço melhora sua maleabilidade, resistência ao impacto e ductilidade, enquanto a adição de lantânio ao molibdênio diminui sua dureza e sensibilidade às variações de temperatura.
- Pequenas quantidades de lantânio estão presentes em muitos produtos de piscina para remover os fosfatos que alimentam algas.
- Aditivo de óxido de lantânio para tungstênio é usado em eletrodos de soldagem de arco de tungstênio gás, como um substituto para o tório radioativo.
- Vários compostos de lantânio e outros elementos de terra rara (óxidos, cloretos, triflatos, etc.) são componentes de várias catálise, como catalisadores de cracking de petróleo.
- Lanthanum-barium radiometric namoro é usado para estimar a idade de rochas e minérios, embora a técnica tem popularidade limitada.
- O carbonato de Lantânio foi aprovado como um medicamento (Fosrenol, Shire Pharmaceuticals) para absorver o excesso de fosfato em casos de hiperfosfatemia observada na doença renal de última fase.
- Fluoreto de Lantânio é usado em revestimentos de lâmpada de fósforo. Misturado com fluoreto de europium, também é aplicado na membrana de cristal de eléctrodos fluoretos-seletivos.
- Como peroxidase rábano, o lantânio é usado como um rastreador de densidade eletrônica em biologia molecular.
- O bentonita modificado por Lantânio (ou foslock) é usado para remover fosfatos da água em tratamentos do lago.
- Lanthanum telluride (La3Te4) é considerado para ser aplicado no campo do sistema de energia radioisótopo (planta de energia nuclear) devido às suas capacidades significativas de conversão. Os elementos transmutados e isótopos no segmento não reagirão com o próprio material, não apresentando nenhum dano à segurança da usina. Embora iodo, que pode ser gerado durante a transmutação, é suspeito de reagir com La3Te4 segmento, a quantidade de iodo é pequena o suficiente para não representar nenhuma ameaça ao sistema de energia.
Papel biológico
Lantânio não tem nenhum papel biológico conhecido em humanos. O elemento é muito mal absorvido após administração oral e quando injetado sua eliminação é muito lenta. O carbonato de lantânio (Fosrenol) foi aprovado como aglutinante de fosfato para absorver o excesso de fosfato em casos de doença renal terminal.
Embora o lantânio tenha efeitos farmacológicos em vários receptores e canais iônicos, sua especificidade para o receptor GABA é única entre os cátions trivalentes. O lantânio atua no mesmo local modulatório no receptor GABA que o zinco, um conhecido modulador alostérico negativo. O cátion lantânio La3+ é um modulador alostérico positivo em receptores GABA nativos e recombinantes, aumentando o tempo de canal aberto e diminuindo a dessensibilização de maneira dependente da configuração da subunidade.
Lantânio é um cofator essencial para a metanol desidrogenase da bactéria metanotrófica Metilacidiphilum fumariolicum SolV, embora a grande semelhança química dos lantanídeos signifique que pode ser substituído por cério, praseodímio ou neodímio sem problemas efeitos colaterais, e com o menor samário, európio ou gadolínio não dando nenhum efeito colateral além de um crescimento mais lento.
Precauções
Lantânio tem um nível de toxicidade baixo a moderado e deve ser manuseado com cuidado. A injeção de soluções de lantânio produz hiperglicemia, hipotensão, degeneração do baço e alterações hepáticas. A aplicação na luz do arco de carbono levou à exposição das pessoas a óxidos e fluoretos de elementos de terras raras, o que às vezes levava à pneumoconiose. Como o íon La3+ é semelhante em tamanho ao íon Ca2+, às vezes é usado como um substituto facilmente rastreável para o último em estudos médicos. O lantânio, como os outros lantanídeos, é conhecido por afetar o metabolismo humano, diminuindo os níveis de colesterol, pressão arterial, apetite e risco de coagulação sanguínea. Quando injetado no cérebro, atua como um analgésico, semelhante à morfina e outros opiáceos, embora o mecanismo por trás disso ainda seja desconhecido.
Preços
O preço de uma tonelada (métrica) [1000 kg] de óxido de lantânio 99% (FOB China em USD/Mt) é dado pelo Instituto de Elementos de Terras Raras e Metais Estratégicos abaixo de $ 2.000 durante a maior parte do período desde o início de 2001 até setembro de 2010 (em US$ 10.000 no curto prazo em 2008); subiu abruptamente para $ 140.000 em meados de 2011 e caiu com a mesma rapidez para $ 38.000 no início de 2012. O preço médio dos últimos seis meses (abril a setembro de 2022) é dado pelo Instituto da seguinte forma: Óxido de Lantânio - 99,9 %min FOB China - 1308 EUR/mt e para Lantânio Metal - 99%min FOB China - 3706 EUR/mt.
Contenido relacionado
Grupo hidroxi
Anfetamina
Ânodo