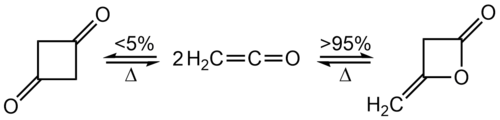Ketene
Em química orgânica, um ceteno é um composto orgânico na forma RR'C=C=O, onde R e R& #39; são dois grupos químicos monovalentes arbitrários (ou dois sítios de substituição separados na mesma molécula). O nome também pode se referir ao composto específico etenona H2C=C=O, o ceteno mais simples.
Embora sejam altamente úteis, a maioria dos cetenos são instáveis. Quando usados como reagentes em um procedimento químico, eles são normalmente gerados quando necessários e consumidos assim que (ou enquanto) são produzidos.
História
Os ketenes foram estudados pela primeira vez como uma classe por Hermann Staudinger antes de 1905.
Ketenes foram sistematicamente investigados por Hermann Staudinger em 1905 na forma de diphenylketene (conversão de α α - Sim.-cloreto de acetil clorodifenil com zinco). Staudinger foi inspirado pelos primeiros exemplos de intermediários orgânicos reativos e radicais estáveis descobertos por Moses Gomberg em 1900 (compostos com grupo triphenylmethyl).
Em 2022, pesquisadores da Portland State University que examinaram a presença de ceteno reagido como N-benzilacetamida relataram que o acetato de vitamina E, acetato de CBD, acetato de CBN e acetato de THC-O, um canabinóide sintético comumente encontrado na maioria tabacarias locais e nacionais que cumprem a Lei Agrícola de 2018 nos Estados Unidos podem quebrar e liberar gás ceteno quando aquecidas a 340°C (644°F).
Propriedades
As cetenas são altamente eletrofílicas no átomo de carbono ligado ao heteroátomo, devido ao seu caráter sp. O ceteno pode ser formado com diferentes heteroátomos ligados ao átomo de carbono sp, como O, S ou Se, denominados respectivamente ceteno, tioceteno e selenoceteno.
Etenona, o ceteno mais simples, tem diferentes comprimentos experimentais para cada uma das ligações duplas; a ligação C=O é 1,160Å e a ligação C=C é 1,314Å. O ângulo entre os dois átomos de H é de 121,5°, semelhante ao ângulo teoricamente ideal formado em alcenos entre sp2 átomo de carbono e substituintes de H.
As cetenas são instáveis e não podem ser armazenadas. Na ausência de nucleófilos com os quais reagir, a etenona dimeriza para dar β-lactona, um éster cíclico. Se o ceteno for dissubstituído, o produto da dimerização é uma ciclobutadiona substituída. Para cetenos monossubstituídos, a dimerização pode gerar o produto éster ou dicetona.
Síntese
A etenona pode ser gerada pela pirólise (craqueamento térmico) da acetona:
- CH3-CO-CH3 → CH2C=O + CH4
Esta reação é chamada de síntese de Schmidlin ceteno.
Outros cetenos podem ser preparados a partir de cloretos de acila por uma reação de eliminação na qual o HCl é perdido:
Nesta reação, uma base, geralmente trietilamina, remove o próton alfa ácido para o grupo carbonila, induzindo a formação da ligação dupla carbono-carbono e a perda de um íon cloreto:
As cetenas também podem ser formadas a partir de α-diazocetonas por rearranjo de Wolff.
Outra forma de gerar cetenos é através de termólise a vácuo flash (FVT) com 2-piridilaminas. Plüg e Wentrup desenvolveram um método em 1997 que melhorou as reações de FVT para produzir cetenos com um FVT estável que é insensível à umidade, usando condições amenas (480°C). As N-piridilaminas são preparadas através de uma condensação com R-malonatos com N-amino(pirideno) e DCC como solvente.
Um método mais robusto para a preparação de cetenos é a carbonilação de carbenos metálicos e a reação in situ dos cetenos altamente reativos assim produzidos com reagentes adequados, como iminas, aminas ou álcoois. Este método é um protocolo tandem eficiente da carbonilação de compostos α-diazocarbonil e uma variedade de N-tosil-hidrazonas catalisadas por metalorradicais Co(II)-porfirina levando à formação de cetenos, que subsequentemente reagem com uma variedade de nucleófilos e iminas para formar ésteres, amidas e β-lactâmicos. Este sistema tem um amplo escopo de substrato e pode ser aplicado a várias combinações de precursores de carbeno, nucleófilos e iminas.
Reações e aplicações
Devido às duplas ligações acumuladas, os cetenos são muito reativos.
Formação de ésteres de ácido carboxílico
Por reação com álcoois, ésteres de ácidos carboxílicos são formados:
Formação de anidridos carboxílicos
As cetenas reagem com ácidos carboxílicos para formar anidridos de ácido carboxílico:
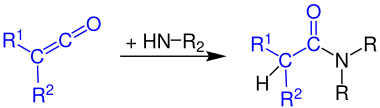
Formação de amidas de ácido carboxílico
As cetenas reagem com amônia a amidas primárias:
A reação de cetenos com aminas primárias produz amidas secundárias:
As cetenas reagem com aminas secundárias para formar amidas terciárias:
Hidrólise
Pela reação com a água, ácidos carboxílicos são formados a partir de cetenos
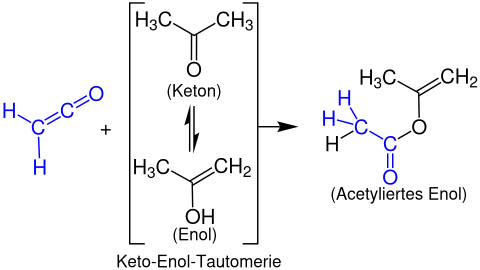
Formação de enol ésteres
Ésteres de enol são formados a partir de cetenos com compostos carbonílicos enolizáveis. O exemplo a seguir mostra a reação de etenona com acetona para formar um acetato de propen-2-il:
Dimerização
À temperatura ambiente, o ceteno dimeriza rapidamente em diceteno, mas o ceteno pode ser recuperado por aquecimento:
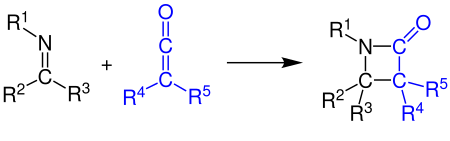
[2+2]-cicloadição
Os cetenos podem reagir com alcenos, compostos carbonílicos, carbodiimidas e iminas em uma cicloadição [2+2]. O exemplo mostra a síntese de um β-lactâmico pela reação de um ceteno com uma imina (ver Síntese de Staudinger):
Aplicativos
As cetenas são geralmente muito reativas e participam de várias cicloadições. Um processo importante é a dimerização para dar propiolactonas. Um exemplo específico é a dimerização do ceteno do ácido esteárico para se obter dímeros de alquil ceteno, amplamente utilizados na indústria de papel. AKD's reagem com os grupos hidroxila na celulose via reação de esterificação.
Eles também sofrerão [2+2] reações de cicloadição com alcinos ricos em elétrons para formar ciclobutenonas, ou grupos carbonílicos para formar beta-lactonas. Com iminas, beta-lactâmicos são formados. Esta é a síntese de Staudinger, uma rota fácil para esta importante classe de compostos. Com acetona, ceteno reage para dar acetato de isopropenila.
Uma variedade de compostos hidroxílicos pode se adicionar como nucleófilos, formando produtos enol ou éster. Como exemplos, uma molécula de água se adiciona facilmente ao ceteno para dar 1,1-dihidroxieteno e o anidrido acético é produzido pela reação do ácido acético com o ceteno. Reações entre dióis (HO−R−OH) e bis-cetenos (O=C=CH−R'−CH= C=O) produzem poliésteres com uma unidade repetida de (−O−R−O−CO−R'−CO).
Etil acetoacetato, um importante material de partida na síntese orgânica, pode ser preparado usando um diceteno em reação com etanol. Eles formam diretamente o acetoacetato de etila, e o rendimento é alto quando realizado sob circunstâncias controladas; este método é, portanto, usado industrialmente.
Contenido relacionado
Ouro
Contagem de elétrons
Dieno