Isomeria cis-trans
Isomerismo cis–trans, também conhecido como isomerismo geométrico ou isomerismo configuracional, é um termo usado em química que diz respeito ao arranjo espacial dos átomos dentro das moléculas. Os prefixos "cis" e "trans" são do latim: "este lado de" e "o outro lado de", respectivamente. No contexto da química, cis indica que os grupos funcionais (substituintes) estão no mesmo lado de algum plano, enquanto trans indica que eles estão em lados opostos (transversais). Os isômeros Cis–trans são estereoisômeros, ou seja, pares de moléculas que possuem a mesma fórmula, mas cujos grupos funcionais estão em diferentes orientações no espaço tridimensional. A notação Cis-trans nem sempre corresponde ao isomerismo E–Z, que é uma descrição estereoquímica absoluta. Em geral, os estereoisômeros cis–trans contêm ligações duplas que não giram ou podem conter estruturas em anel, onde a rotação das ligações é restrita ou impedida. Os isômeros Cis e trans ocorrem tanto em moléculas orgânicas quanto em complexos de coordenação inorgânicos. Os descritores Cis e trans não são usados para casos de isomerismo conformacional onde as duas formas geométricas se interconvertem facilmente, como a maioria das estruturas de ligação simples de cadeia aberta; em vez disso, os termos "syn" e "anti" são usados.
O termo "isomerismo geométrico" é considerado pela IUPAC como um sinônimo obsoleto de "cis–trans isomerismo".
Química orgânica
Quando os grupos substituintes são orientados na mesma direção, o diastereômero é referido como cis, enquanto que, quando os substituintes são orientados em direções opostas, o diastereômero é referido como trans . Um exemplo de um pequeno hidrocarboneto exibindo isomerismo cis–trans é o but-2-eno.
Compostos alicíclicos também podem exibir isomeria cis–trans. Como exemplo de um isômero geométrico devido a uma estrutura em anel, considere o 1,2-diclorociclohexano:
  |   |
| trans-1,2-dichlorocyclohexane | Cis-1,2-dichlorocyclohexane |
Comparação de propriedades físicas
Os isômerosCis e trans geralmente têm propriedades físicas diferentes. As diferenças entre os isômeros, em geral, surgem das diferenças na forma da molécula ou no momento dipolar geral.
 |  |
| Cis- 2-pentene | trans- 2-pentene |
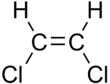 |  |
| Cis-1,2-dichloroethene | trans-1,2-dichloroethene |
Essas diferenças podem ser muito pequenas, como no caso do ponto de ebulição de alcenos de cadeia linear, como o pent-2-eno, que é 37 °C no isômero cis e 36 °C no isômero trans. As diferenças entre os isômeros cis e trans podem ser maiores se houver ligações polares, como nos 1,2-dicloroetenos. O isômero cis neste caso tem um ponto de ebulição de 60,3 °C, enquanto o isômero trans tem um ponto de ebulição de 47,5 °C. No isômero cis, os dois momentos polares de dipolo da ligação C-Cl se combinam para formar um dipolo molecular geral, de modo que existem forças dipolo-dipolo intermoleculares (ou forças de Keesom), que se somam às forças de dispersão de London e aumente o ponto de ebulição. No isômero trans, por outro lado, isso não ocorre porque os dois momentos da ligação C−Cl se cancelam e a molécula tem um momento dipolar líquido zero (no entanto, tem um momento quadrupolo diferente de zero).
 |  |
| Cis- ácido butenodioico (ácido metálico) | trans- ácido butenodioico (ácido fúmico) |
 |  |
| Cis- 9-octadecenoica Ácido (ácido acólico) | trans- 9-octadecenoica Ácido (ácido estelaídico) |
Os dois isômeros do ácido butenodióico têm diferenças tão grandes em propriedades e reatividades que receberam nomes completamente diferentes. O isômero cis é chamado ácido maleico e o isômero trans ácido fumárico. A polaridade é fundamental para determinar o ponto de ebulição relativo, pois causa aumento das forças intermoleculares, aumentando assim o ponto de ebulição. Da mesma forma, a simetria é fundamental para determinar o ponto de fusão relativo, pois permite um melhor empacotamento no estado sólido, mesmo que não altere a polaridade da molécula. Um exemplo disso é a relação entre o ácido oleico e o ácido elaídico; o ácido oleico, o isômero cis, tem um ponto de fusão de 13,4 °C, tornando-o um líquido à temperatura ambiente, enquanto o isômero trans, ácido elaídico, tem o muito mais alto ponto de fusão de 43 °C, devido ao isômero trans mais reto ser capaz de se compactar mais firmemente e é sólido à temperatura ambiente.
Assim, os alcenos trans, que são menos polares e mais simétricos, têm pontos de ebulição mais baixos e pontos de fusão mais altos, e os alcenos cis, que geralmente são mais polares e menos simétricas, têm pontos de ebulição mais altos e pontos de fusão mais baixos.
No caso de isômeros geométricos que são consequência de ligações duplas e, em particular, quando ambos os substituintes são iguais, algumas tendências gerais geralmente se mantêm. Essas tendências podem ser atribuídas ao fato de que os dipolos dos substituintes em um isômero cis irão se somar para dar um dipolo molecular geral. Em um isômero trans, os dipolos dos substituintes se anulam por estarem em lados opostos da molécula. Os isômeros trans também tendem a ter densidades mais baixas do que os isômeros cis.
Como tendência geral, os alcenos trans tendem a ter pontos de fusão mais altos e menor solubilidade em solventes inertes, já que os alcenos trans, em geral, são mais simétricos que cis alcenos.
As constantes de acoplamento vicinal (3JHH), medidas por espectroscopia de NMR, são maiores para trans (intervalo: 12–18 Hz; típico: 15 Hz) do que para isômeros cis (intervalo: 0–12 Hz; típico: 8 Hz).
Estabilidade
Normalmente, para sistemas acíclicos, os isômeros trans são mais estáveis do que os isômeros cis. Isto é tipicamente devido ao aumento da interação estérica desfavorável dos substituintes no isômero cis. Portanto, os isômeros trans têm um calor de combustão menos exotérmico, indicando maior estabilidade termoquímica. No conjunto de dados de aditividade do grupo de calor de formação de Benson, os isômeros cis sofrem uma penalidade de estabilidade de 1,10 kcal/mol. Exceções a esta regra existem, como 1,2-difluoroetileno, 1,2-difluorodiazeno (FN=NF) e vários outros etilenos substituídos por halogênio e oxigênio. Nesses casos, o isômero cis é mais estável que o isômero trans. Esse fenômeno é chamado de efeito cis.
Notação E–Z
A notaçãoCis–trans não pode ser usada para alcenos com mais de dois substituintes diferentes. Em vez disso, a notação E–Z é usada com base na prioridade dos substituintes usando as regras de prioridade Cahn–Ingold–Prelog (CIP) para configuração absoluta. As designações padrão da IUPAC E e Z são inequívocas em todos os casos e, portanto, são especialmente úteis para alcenos tri e tetrassubstituídos para evitar qualquer confusão sobre quais grupos estão sendo identificados como cis ou trans entre si.
Z (do alemão zusammen) significa "juntos& #34;. E (do alemão entgegen) significa "oposto" no sentido de "oposto". Ou seja, Z tem os grupos de maior prioridade cis entre si e E tem os grupos de maior prioridade trans um ao outro. Se uma configuração molecular é designada E ou Z é determinada pelas regras CIP; números atômicos mais altos recebem maior prioridade. Para cada um dos dois átomos na ligação dupla, é necessário determinar a prioridade de cada substituinte. Se ambos os substituintes de maior prioridade estiverem do mesmo lado, o arranjo é Z; se em lados opostos, o arranjo é E.
Como os sistemas cis–trans e E–Z comparam grupos diferentes no alceno, é não é estritamente verdade que Z corresponde a cis e E corresponde a trans. Por exemplo, trans-2-clorobut-2-eno (os dois grupos metil, C1 e C4, no esqueleto do but-2-eno são trans entre si) é (Z)-2-clorobut-2-eno (o cloro e C4 estão juntos porque C1 e C4 são opostos).
Química inorgânica
O isomerismoCis–trans também pode ocorrer em compostos inorgânicos, principalmente em diazenos e compostos de coordenação.
Diazenos
Diazenes (e os difosfenos relacionados) também podem exibir isomerismo cis–trans. Assim como os compostos orgânicos, o isômero cis é geralmente o mais reativo dos dois, sendo o único isômero que pode reduzir alcenos e alcinos a alcanos, mas por um motivo diferente: o isômero trans não pode alinhar seus hidrogênios adequadamente para reduzir o alceno, mas o isômero cis, tendo uma forma diferente, pode.
  |   |
| trans-diazeno | Cis-diazeno |
Complexos de coordenação
Nos complexos de coordenação inorgânicos com geometrias octaédricas ou planares quadradas, também existem isômeros cis nos quais ligantes semelhantes estão mais próximos e isômeros trans nos quais eles estão mais distantes.
Por exemplo, existem dois isômeros de quadrado planar Pt(NH3)2Cl2, conforme explicado por Alfred Werner em 1893 O isômero cis, cujo nome completo é cis-diaminodicloroplatina(II), foi demonstrado em 1969 por Barnett Rosenberg como tendo atividade antitumoral e agora é um medicamento quimioterápico conhecido por o nome abreviado cisplatina. Em contraste, o isômero trans (transplatina) não tem atividade anticancerígena útil. Cada isômero pode ser sintetizado usando o efeito trans para controlar qual isômero é produzido.
Para complexos octaédricos de fórmula MX4Y2, também existem dois isômeros. (Aqui M é um átomo de metal, e X e Y são dois tipos diferentes de ligantes.) No isômero cis, os dois ligantes Y são adjacentes um ao outro em 90°, como é verdade para o dois átomos de cloro mostrados em verde em cis-[Co(NH3)4Cl2] +, à esquerda. No isômero trans mostrado à direita, os dois átomos de Cl estão em lados opostos do átomo central de Co.
Um tipo relacionado de isomerismo em complexos octaédricos MX3Y3 é isomerismo facial–meridional (ou fac–mer), no qual números diferentes de ligantes são cis ou trans para uns aos outros. Compostos carbonílicos metálicos podem ser caracterizados como fac ou mer usando espectroscopia de infravermelho.
Contenido relacionado
Johann Bayer
Teoria acústica
Alain Connes





