Glândula adrenal
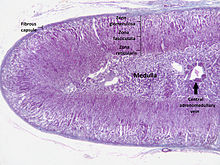
As glândulas adrenais (também conhecidas como glândulas suprarrenais) são glândulas endócrinas que produzem uma variedade de hormônios, incluindo adrenalina e os esteroides aldosterona e cortisol. Eles são encontrados acima dos rins. Cada glândula tem um córtex externo que produz hormônios esteróides e uma medula interna. O próprio córtex adrenal é dividido em três zonas principais: a zona glomerulosa, a zona fasciculada e a zona reticular.
O córtex adrenal produz três tipos principais de hormônios esteróides: mineralocorticóides, glicocorticóides e andrógenos. Os mineralocorticoides (como a aldosterona) produzidos na zona glomerulosa ajudam na regulação da pressão sanguínea e do equilíbrio eletrolítico. Os glicocorticóides cortisol e cortisona são sintetizados na zona fasciculada; suas funções incluem a regulação do metabolismo e a supressão do sistema imunológico. A camada mais interna do córtex, a zona reticular, produz andrógenos que são convertidos em hormônios sexuais totalmente funcionais nas gônadas e em outros órgãos-alvo. A produção de hormônios esteróides é chamada de esteroidogênese e envolve uma série de reações e processos que ocorrem nas células corticais. A medula produz as catecolaminas, que funcionam para produzir uma resposta rápida em todo o corpo em situações de estresse.
Várias doenças endócrinas envolvem disfunções da glândula adrenal. A superprodução de cortisol leva à síndrome de Cushing, enquanto a produção insuficiente está associada à doença de Addison. A hiperplasia adrenal congênita é uma doença genética produzida pela desregulação dos mecanismos de controle endócrino. Uma variedade de tumores pode surgir do tecido adrenal e são comumente encontrados em imagens médicas ao procurar outras doenças.
Estrutura
As glândulas adrenais estão localizadas em ambos os lados do corpo no retroperitônio, acima e ligeiramente medial aos rins. Nos humanos, a glândula adrenal direita tem formato piramidal, enquanto a esquerda tem formato semilunar ou crescente e um pouco maior. As glândulas adrenais medem aproximadamente 5 cm de comprimento, 3 cm de largura e até 1 cm de espessura. Seu peso combinado em um ser humano adulto varia de 7 a 10 gramas. As glândulas são de cor amarelada.
As glândulas adrenais são cercadas por uma cápsula gordurosa e ficam dentro da fáscia renal, que também envolve os rins. Um septo (parede) fraco de tecido conjuntivo separa as glândulas dos rins. As glândulas adrenais estão diretamente abaixo do diafragma e estão ligadas às cruras do diafragma pela fáscia renal.
Cada glândula adrenal tem duas partes distintas, cada uma com uma função única, o córtex adrenal externo e a medula interna, ambas produtoras de hormônios.
Córtex adrenal
O córtex adrenal é a região externa e também a maior parte de uma glândula adrenal. É dividida em três zonas distintas: zona glomerulosa, zona fasciculada e zona reticular. Cada zona é responsável pela produção de hormônios específicos. O córtex adrenal é a camada mais externa da glândula adrenal. Dentro do córtex existem três camadas, chamadas "zonas". Quando vistas ao microscópio, cada camada tem uma aparência distinta e cada uma tem uma função diferente. O córtex adrenal é dedicado à produção de hormônios, como aldosterona, cortisol e andrógenos.
Zona glomerulosa
A zona mais externa do córtex adrenal é a zona glomerulosa. Encontra-se imediatamente sob a cápsula fibrosa da glândula. As células nesta camada formam grupos ovais, separados por fios finos de tecido conjuntivo da cápsula fibrosa da glândula e carregam capilares largos.
Esta camada é o principal local de produção de aldosterona, um mineralocorticóide, pela ação da enzima aldosterona sintase. A aldosterona desempenha um papel importante na regulação a longo prazo da pressão arterial.
Zona fasciculada
A zona fasciculada está situada entre a zona glomerulosa e a zona reticular. As células dessa camada são responsáveis pela produção de glicocorticoides, como o cortisol. É a maior das três camadas, respondendo por quase 80% do volume do córtex. Na zona fasciculada, as células estão dispostas em colunas orientadas radialmente em direção à medula. As células contêm numerosas gotículas lipídicas, mitocôndrias abundantes e um retículo endoplasmático liso complexo.
Zona reticular
A camada cortical mais interna, a zona reticular, fica diretamente adjacente à medula. Produz andrógenos, principalmente dehidroepiandrosterona (DHEA), sulfato de DHEA (DHEA-S) e androstenediona (o precursor da testosterona) em humanos. Suas pequenas células formam cordões e aglomerados irregulares, separados por capilares e tecido conjuntivo. As células contêm quantidades relativamente pequenas de citoplasma e gotículas lipídicas e, às vezes, exibem pigmento marrom de lipofuscina.
Medula
A medula adrenal está no centro de cada glândula adrenal e é cercada pelo córtex adrenal. As células cromafins da medula são a principal fonte do organismo das catecolaminas, como adrenalina e noradrenalina, liberadas pela medula. Aproximadamente 20% de noradrenalina (norepinefrina) e 80% de adrenalina (epinefrina) são secretados aqui.
A medula adrenal é conduzida pelo sistema nervoso simpático através de fibras pré-ganglionares originárias da medula espinhal torácica, das vértebras T5–T11. Por ser inervada por fibras nervosas pré-ganglionares, a medula adrenal pode ser considerada um gânglio simpático especializado. Ao contrário de outros gânglios simpáticos, no entanto, a medula adrenal carece de sinapses distintas e libera suas secreções diretamente no sangue.
Suprimento de sangue
As glândulas adrenais têm uma das maiores taxas de suprimento de sangue por grama de tecido de qualquer órgão: até 60 pequenas artérias podem entrar em cada glândula. Três artérias geralmente suprem cada glândula adrenal:
- A artéria suprarrenal superior, um ramo da artéria frénica inferior
- A artéria suprarrenal média, ramo direto da aorta abdominal
- A artéria suprarrenal inferior, um ramo da artéria renal
Esses vasos sanguíneos suprem uma rede de pequenas artérias dentro da cápsula das glândulas supra-renais. Fios finos da cápsula entram nas glândulas, levando sangue para elas.
O sangue venoso é drenado das glândulas pelas veias suprarrenais, geralmente uma para cada glândula:
- A veia suprarenal direita drena na veia cava inferior
- A veia suprarrenal esquerda drena na veia renal esquerda ou a veia phrenic inferior esquerda.
A veia adrenomedular central, na medula adrenal, é um tipo incomum de vaso sanguíneo. Sua estrutura é diferente das outras veias porque o músculo liso em sua túnica média (a camada intermediária do vaso) está disposto em feixes visíveis e orientados longitudinalmente.
Variabilidade
As glândulas adrenais podem não se desenvolver ou podem estar fundidas na linha média atrás da aorta. Estes estão associados a outras anormalidades congênitas, como falha no desenvolvimento dos rins ou rins fundidos. A glândula pode se desenvolver com ausência parcial ou completa do córtex, ou pode se desenvolver em um local incomum.
Função
A glândula adrenal secreta vários hormônios diferentes que são metabolizados por enzimas dentro da glândula ou em outras partes do corpo. Esses hormônios estão envolvidos em várias funções biológicas essenciais.
Corticosteróides
Os corticosteróides são um grupo de hormonas esteróides produzidas a partir do córtex da glândula supra-renal, que lhes dá o nome.
- Mineralocorticoides como aldosterona regulam o equilíbrio de sal ("mineral") e pressão arterial
- Glucocorticóides como cortisol influenciam as taxas metabólicas de proteínas, gorduras e açúcares ("glucose").
- Andrógenos como desidroepiandrosterona.
- Produtos de plástico
A glândula adrenal produz aldosterona, um mineralocorticóide, que é importante na regulação do equilíbrio de sal ("mineral") e do volume sanguíneo. Nos rins, a aldosterona atua nos túbulos contorcidos distais e nos ductos coletores, aumentando a reabsorção de sódio e a excreção de íons potássio e hidrogênio. A aldosterona é responsável pela reabsorção de cerca de 2% do filtrado glomerular filtrado. A retenção de sódio também é uma resposta do cólon distal e das glândulas sudoríparas à estimulação do receptor de aldosterona. A angiotensina II e o potássio extracelular são os dois principais reguladores da produção de aldosterona. A quantidade de sódio presente no corpo afeta o volume extracelular, que por sua vez influencia a pressão arterial. Portanto, os efeitos da aldosterona na retenção de sódio são importantes para a regulação da pressão arterial.
- Produtos químicos
O cortisol é o principal glicocorticóide em humanos. Em espécies que não produzem cortisol, esse papel é desempenhado pela corticosterona. Os glicocorticóides têm muitos efeitos sobre o metabolismo. Como o próprio nome sugere, eles aumentam o nível circulante de glicose. Isso é resultado de um aumento na mobilização de aminoácidos das proteínas e da estimulação da síntese de glicose a partir desses aminoácidos no fígado. Além disso, aumentam os níveis de ácidos graxos livres, que as células podem utilizar como alternativa à glicose para obter energia. Os glicocorticóides também têm efeitos não relacionados à regulação dos níveis de açúcar no sangue, incluindo a supressão do sistema imunológico e um potente efeito anti-inflamatório. O cortisol reduz a capacidade dos osteoblastos de produzir novo tecido ósseo e diminui a absorção de cálcio no trato gastrointestinal.
A glândula adrenal secreta um nível basal de cortisol, mas também pode produzir picos do hormônio em resposta ao hormônio adrenocorticotrófico (ACTH) da hipófise anterior. O cortisol não é liberado uniformemente durante o dia – suas concentrações no sangue são mais altas no início da manhã e mais baixas à noite, como resultado do ritmo circadiano da secreção de ACTH. A cortisona é um produto inativo da ação da enzima 11β-HSD sobre o cortisol. A reação catalisada pelo 11β-HSD é reversível, o que significa que pode transformar a cortisona administrada em cortisol, o hormônio biologicamente ativo.
- Formação
Todos os hormônios corticosteróides compartilham o colesterol como um precursor comum. Portanto, o primeiro passo na esteroidogênese é a captação ou síntese do colesterol. As células que produzem hormônios esteróides podem adquirir colesterol por duas vias. A principal fonte é através do colesterol dietético transportado através do sangue como ésteres de colesterol dentro de lipoproteínas de baixa densidade (LDL). O LDL entra nas células através de endocitose mediada por receptor. A outra fonte de colesterol é a síntese no retículo endoplasmático da célula. A síntese pode compensar quando os níveis de LDL estão anormalmente baixos. No lisossomo, os ésteres de colesterol são convertidos em colesterol livre, que é então usado para a esteroidogênese ou armazenado na célula.
A parte inicial da conversão do colesterol em hormônios esteróides envolve uma série de enzimas da família do citocromo P450 que estão localizadas na membrana interna das mitocôndrias. O transporte de colesterol da membrana externa para a interna é facilitado pela proteína reguladora aguda esteroidogênica e é a etapa limitante da síntese de esteroides.
As camadas da glândula adrenal diferem em função, com cada camada tendo enzimas distintas que produzem diferentes hormônios a partir de um precursor comum. A primeira etapa enzimática na produção de todos os hormônios esteróides é a clivagem da cadeia lateral do colesterol, uma reação que forma a pregnenolona como produto e é catalisada pela enzima P450scc, também conhecida como colesterol desmolase. Após a produção de pregnenolona, enzimas específicas de cada camada cortical a modificam ainda mais. As enzimas envolvidas neste processo incluem P450s mitocondrial e microssomal e hidroxiesteróides desidrogenases. Normalmente, uma série de etapas intermediárias nas quais a pregnenolona é modificada várias vezes são necessárias para formar os hormônios funcionais. Enzimas que catalisam reações nessas vias metabólicas estão envolvidas em várias doenças endócrinas. Por exemplo, a forma mais comum de hiperplasia adrenal congênita se desenvolve como resultado da deficiência de 21-hidroxilase, uma enzima envolvida em uma etapa intermediária da produção de cortisol.
- Regulamento
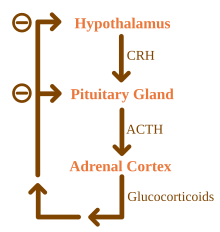
Os glicocorticóides estão sob a influência reguladora do eixo hipotálamo-hipófise-adrenal (HPA). A síntese de glicocorticóides é estimulada pelo hormônio adrenocorticotrófico (ACTH), um hormônio liberado na corrente sanguínea pela hipófise anterior. Por sua vez, a produção de ACTH é estimulada pela presença do hormônio liberador de corticotropina (CRH), que é liberado por neurônios do hipotálamo. O ACTH atua nas células adrenais primeiro aumentando os níveis de StAR dentro das células e, em seguida, de todas as enzimas esteroidogênicas P450. O eixo HPA é um exemplo de sistema de feedback negativo, no qual o próprio cortisol atua como um inibidor direto da síntese de CRH e ACTH. O eixo HPA também interage com o sistema imunológico por meio do aumento da secreção de ACTH na presença de certas moléculas da resposta inflamatória.
A secreção de mineralocorticoides é regulada principalmente pelo sistema renina-angiotensina-aldosterona (SRAA), pela concentração de potássio e, em menor grau, pela concentração de ACTH. Sensores de pressão arterial no aparelho justaglomerular dos rins liberam a enzima renina no sangue, que inicia uma cascata de reações que levam à formação de angiotensina II. Os receptores de angiotensina nas células da zona glomerulosa reconhecem a substância e, ao se ligarem, estimulam a liberação de aldosterona.
Andrógenos
Células na zona reticular das glândulas supra-renais produzem hormônios sexuais masculinos, ou andrógenos, sendo o mais importante o DHEA. Em geral, esses hormônios não têm efeito global no corpo masculino, e são convertidos em andrógenos mais potentes, como testosterona e DHT, ou em estrogênios (hormônios sexuais femininos) nas gônadas, agindo assim como um intermediário metabólico.
Catecolaminas
Principalmente referidas nos Estados Unidos como epinefrina e norepinefrina, adrenalina e noradrenalina são catecolaminas, compostos solúveis em água que possuem uma estrutura feita de um grupo catecol e um grupo amina. As glândulas adrenais são responsáveis pela maior parte da adrenalina que circula no corpo, mas apenas por uma pequena quantidade de noradrenalina circulante. Esses hormônios são liberados pela medula adrenal, que contém uma densa rede de vasos sanguíneos. A adrenalina e a noradrenalina atuam interagindo com os adrenoreceptores em todo o corpo, com efeitos que incluem aumento da pressão arterial e da frequência cardíaca. As ações da adrenalina e da noradrenalina são responsáveis pela reação de luta ou fuga, caracterizada pela aceleração da respiração e dos batimentos cardíacos, aumento da pressão sanguínea e constrição dos vasos sanguíneos em muitas partes do corpo.
- Formação
As catecolaminas são produzidas nas células cromafins da medula da glândula adrenal, a partir da tirosina, um aminoácido não essencial derivado da alimentação ou produzido a partir da fenilalanina no fígado. A enzima tirosina hidroxilase converte tirosina em L-DOPA na primeira etapa da síntese de catecolaminas. A L-DOPA é então convertida em dopamina antes de ser transformada em noradrenalina. No citosol, a noradrenalina é convertida em epinefrina pela enzima feniletanolamina N-metiltransferase (PNMT) e armazenada em grânulos. Os glicocorticóides produzidos no córtex adrenal estimulam a síntese de catecolaminas, aumentando os níveis de tirosina hidroxilase e PNMT.
A liberação de catecolaminas é estimulada pela ativação do sistema nervoso simpático. Os nervos esplâncnicos do sistema nervoso simpático inervam a medula da glândula adrenal. Quando ativado, provoca a liberação de catecolaminas dos grânulos de armazenamento, estimulando a abertura de canais de cálcio na membrana celular.
Expressão de genes e proteínas
O genoma humano inclui aproximadamente 20.000 genes codificadores de proteínas e 70% desses genes são expressos nas glândulas adrenais adultas normais. Apenas cerca de 250 genes são expressos mais especificamente nas glândulas supra-renais em comparação com outros órgãos e tecidos. Os genes específicos da glândula adrenal com o mais alto nível de expressão incluem membros da superfamília de enzimas do citocromo P450. Proteínas correspondentes são expressas nos diferentes compartimentos da glândula adrenal, como CYP11A1, HSD3B2 e FDX1 envolvidas na síntese de hormônios esteróides e expressas nas camadas celulares corticais, e PNMT e DBH envolvidas na síntese de noradrenalina e adrenalina e expressas na medula.
Desenvolvimento
As glândulas adrenais são compostas por dois tipos heterogêneos de tecido. No centro está a medula adrenal, que produz adrenalina e noradrenalina e as libera na corrente sanguínea, como parte do sistema nervoso simpático. Ao redor da medula está o córtex, que produz uma variedade de hormônios esteróides. Esses tecidos vêm de diferentes precursores embriológicos e têm caminhos de desenvolvimento pré-natal distintos. O córtex da glândula adrenal é derivado do mesoderma, enquanto a medula é derivada da crista neural, que é de origem ectodérmica.
As glândulas supra-renais em um bebê recém-nascido são muito maiores em proporção ao tamanho do corpo do que em um adulto. Por exemplo, aos três meses de idade, as glândulas têm quatro vezes o tamanho dos rins. O tamanho das glândulas diminui relativamente após o nascimento, principalmente por causa do encolhimento do córtex. O córtex, que desaparece quase completamente por volta de 1 ano de idade, volta a se desenvolver dos 4 aos 5 anos de idade. As glândulas pesam cerca de 1 g no nascimento e atingem um peso adulto de cerca de 4 gramas cada. Em um feto, as glândulas são detectadas pela primeira vez após a sexta semana de desenvolvimento.
Córtex
O tecido do córtex adrenal é derivado do mesoderma intermediário. Aparece pela primeira vez 33 dias após a fertilização, mostra capacidade de produção de hormônios esteróides na oitava semana e sofre um rápido crescimento durante o primeiro trimestre da gravidez. O córtex adrenal fetal é diferente de sua contraparte adulta, pois é composto de duas zonas distintas: a interna "fetal" zona, que carrega a maior parte da atividade de produção de hormônios, e a zona externa "definitiva" zona, que se encontra em fase proliferativa. A zona fetal produz grandes quantidades de andrógenos adrenais (hormônios sexuais masculinos) que são usados pela placenta para a biossíntese de estrogênio. O desenvolvimento cortical da glândula adrenal é regulado principalmente pelo ACTH, um hormônio produzido pela glândula pituitária que estimula a síntese de cortisol. Durante o meio da gestação, a zona fetal ocupa a maior parte do volume cortical e produz 100–200 mg/dia de DHEA-S, um andrógeno e precursor de andrógenos e estrogênios (hormônios sexuais femininos). Os hormônios adrenais, especialmente os glicocorticoides, como o cortisol, são essenciais para o desenvolvimento pré-natal dos órgãos, principalmente para a maturação dos pulmões. A glândula adrenal diminui de tamanho após o nascimento devido ao rápido desaparecimento da zona fetal, com uma diminuição correspondente na secreção de andrógenos.
Adrenarca
Durante a primeira infância, a síntese e a secreção de andrógenos permanecem baixas, mas vários anos antes da puberdade (de 6 a 8 anos de idade) ocorrem alterações nos aspectos anatômicos e funcionais da produção cortical de andrógenos que levam ao aumento da secreção dos esteróides DHEA e DHEA -S. Essas mudanças fazem parte de um processo chamado adrenarca, que só foi descrito em humanos e alguns outros primatas. Adrenarca é independente de ACTH ou gonadotrofinas e se correlaciona com um espessamento progressivo da camada da zona reticular do córtex. Funcionalmente, a adrenarca fornece uma fonte de andrógenos para o desenvolvimento de pelos axilares e pubianos antes do início da puberdade.
Medula
A medula adrenal é derivada de células da crista neural, que vêm da camada ectodérmica do embrião. Essas células migram de sua posição inicial e se agregam nas proximidades da aorta dorsal, um vaso sanguíneo primitivo, que ativa a diferenciação dessas células por meio da liberação de proteínas conhecidas como BMPs. Essas células então sofrem uma segunda migração da aorta dorsal para formar a medula adrenal e outros órgãos do sistema nervoso simpático. As células da medula adrenal são chamadas de células cromafins porque contêm grânulos que se coram com sais de cromo, uma característica que não está presente em todos os órgãos simpáticos. Os glicocorticóides produzidos no córtex adrenal já foram considerados responsáveis pela diferenciação das células cromafins. Pesquisas mais recentes sugerem que a BMP-4 secretada no tecido adrenal é a principal responsável por isso, e que os glicocorticóides apenas desempenham um papel no desenvolvimento subsequente das células.
Significado clínico
A função normal da glândula adrenal pode ser prejudicada por condições como infecções, tumores, distúrbios genéticos e doenças autoimunes ou como efeito colateral da terapia médica. Esses distúrbios afetam a glândula diretamente (como em infecções ou doenças autoimunes) ou como resultado da desregulação da produção hormonal (como em alguns tipos de síndrome de Cushing), levando a um excesso ou insuficiência de hormônios adrenais e os relacionados sintomas.
Superprodução de corticosteróides
Síndrome de Cushing
A síndrome de Cushing é a manifestação do excesso de glicocorticoides. Pode ser resultado de um tratamento prolongado com glicocorticóides ou ser causada por uma doença de base que produz alterações no eixo HPA ou na produção de cortisol. As causas podem ser classificadas em dependentes de ACTH ou independentes de ACTH. A causa mais comum da síndrome de Cushing endógena é um adenoma hipofisário que causa uma produção excessiva de ACTH. A doença produz uma grande variedade de sinais e sintomas que incluem obesidade, diabetes, aumento da pressão arterial, excesso de pelos corporais (hirsutismo), osteoporose, depressão e, principalmente, estrias na pele, causadas por seu afinamento progressivo.
Aldosteronismo primário
Quando a zona glomerulosa produz excesso de aldosterona, o resultado é o aldosteronismo primário. As causas dessa condição são hiperplasia bilateral (crescimento excessivo de tecido) das glândulas ou adenomas produtores de aldosterona (uma condição chamada síndrome de Conn). O aldosteronismo primário produz hipertensão e desequilíbrio eletrolítico, aumentando a retenção de sódio por depleção de potássio.
Insuficiência adrenal
A insuficiência adrenal (a deficiência de glicocorticóides) ocorre em cerca de 5 em 10.000 na população em geral. Doenças classificadas como insuficiência adrenal primária (incluindo doença de Addison e causas genéticas) afetam diretamente o córtex adrenal. Se um problema que afeta o eixo hipotálamo-hipófise-adrenal surge fora da glândula, é uma insuficiência adrenal secundária.
Doença de Addison
A doença de Addison refere-se ao hipoadrenalismo primário, que é uma deficiência na produção de glicocorticóides e mineralocorticóides pela glândula adrenal. No mundo ocidental, a doença de Addison é mais comumente uma condição autoimune, na qual o corpo produz anticorpos contra células do córtex adrenal. Em todo o mundo, a doença é mais freqüentemente causada por infecção, especialmente por tuberculose. Uma característica distintiva da doença de Addison é a hiperpigmentação da pele, que se apresenta com outros sintomas inespecíficos, como fadiga.
Uma complicação observada na doença de Addison não tratada e em outros tipos de insuficiência adrenal primária é a crise adrenal, uma emergência médica na qual baixos níveis de glicocorticóides e mineralocorticóides resultam em choque hipovolêmico e sintomas como vômitos e febre. Uma crise adrenal pode levar progressivamente ao estupor e ao coma. O manejo das crises adrenais inclui a aplicação de injeções de hidrocortisona.
Insuficiência adrenal secundária
Na insuficiência adrenal secundária, uma disfunção do eixo hipotálamo-hipófise-adrenal leva à diminuição da estimulação do córtex adrenal. Além da supressão do eixo pela terapia com glicocorticóides, a causa mais comum de insuficiência adrenal secundária são os tumores que afetam a produção do hormônio adrenocorticotrófico (ACTH) pela glândula pituitária. Esse tipo de insuficiência adrenal geralmente não afeta a produção de mineralocorticóides, que estão sob regulação do sistema renina-angiotensina.
Hiperplasia adrenal congênita
A hiperplasia adrenal congênita é uma doença congênita na qual mutações de enzimas que produzem hormônios esteróides resultam em deficiência de glicocorticóides e mau funcionamento do ciclo de feedback negativo do eixo HPA. No eixo HPA, o cortisol (um glicocorticoide) inibe a liberação de CRH e ACTH, hormônios que, por sua vez, estimulam a síntese de corticosteroides. Como o cortisol não pode ser sintetizado, esses hormônios são liberados em grandes quantidades e estimulam a produção de outros esteróides adrenais. A forma mais comum de hiperplasia adrenal congênita é devido à deficiência de 21-hidroxilase. A 21-hidroxilase é necessária para a produção de mineralocorticóides e glicocorticóides, mas não de andrógenos. Portanto, a estimulação com ACTH do córtex adrenal induz a liberação de quantidades excessivas de andrógenos adrenais, o que pode levar ao desenvolvimento de genitália ambígua e características sexuais secundárias.
Tumores adrenais
Os tumores adrenais são comumente encontrados como incidentalomas, tumores assintomáticos inesperados encontrados durante a imagiologia médica. Eles são vistos em cerca de 3,4% das tomografias computadorizadas e, na maioria dos casos, são adenomas benignos. Os carcinomas adrenais são muito raros, com incidência de 1 caso por milhão por ano.
Feocromocitomas são tumores da medula adrenal que surgem a partir de células cromafins. Eles podem produzir uma variedade de sintomas inespecíficos, que incluem dores de cabeça, sudorese, ansiedade e palpitações. Sinais comuns incluem hipertensão e taquicardia. A cirurgia, especialmente a laparoscopia adrenal, é o tratamento mais comum para pequenos feocromocitomas.
História
Bartolomeo Eustachi, um anatomista italiano, é creditado com a primeira descrição das glândulas supra-renais em 1563–4. No entanto, essas publicações faziam parte da biblioteca papal e não receberam a atenção do público, que foi recebida pela primeira vez com as ilustrações de Caspar Bartholin, o Velho, em 1611.
As glândulas supra-renais são nomeadas por sua localização em relação aos rins. O termo "adrenal" vem do latim ad, "próximo", e ren, "rim". Da mesma forma, "suprarenal", como denominado por Jean Riolan, o Jovem, em 1629, é derivado do latim supra, "acima" e ren, "rim", também. A natureza suprarrenal das glândulas não foi verdadeiramente aceita até o século 19, quando os anatomistas esclareceram a natureza sem ductos das glândulas e seu provável papel secretor - antes disso, havia algum debate sobre se as glândulas eram de fato suprarrenais ou parte do rim.
Um dos trabalhos mais reconhecidos sobre as glândulas supra-renais surgiu em 1855 com a publicação de On the Constitutional and Local Effects of Disease of the Suprarenal Capsule, do médico inglês Thomas Addison. Em sua monografia, Addison descreveu o que o médico francês George Trousseau mais tarde chamaria de doença de Addison, um epônimo usado ainda hoje para uma condição de insuficiência adrenal e suas manifestações clínicas relacionadas. Em 1894, os fisiologistas ingleses George Oliver e Edward Schafer estudaram a ação dos extratos adrenais e observaram seus efeitos pressores. Nas décadas seguintes, vários médicos experimentaram extratos do córtex adrenal para tratar a doença de Addison. Edward Calvin Kendall, Philip Hench e Tadeusz Reichstein receberam o Prêmio Nobel de Fisiologia ou Medicina de 1950 por suas descobertas sobre a estrutura e os efeitos dos hormônios adrenais.
Contenido relacionado
Urubu comum
Protea cynaroides
John Abercrombie (médico)