Éster
Em química, um éster é um composto derivado de um ácido (orgânico ou inorgânico) no qual o átomo de hidrogênio (H) de pelo menos um grupo hidroxila ácido (−OH) desse ácido é substituído por um grupo organil (−R). Análogos derivados do oxigênio substituídos por outros calcogênios também pertencem à categoria éster (ou seja, ésteres de ácidos −SH, −SeH, grupos −TeH, −PoH e −LvH). Segundo alguns autores, os derivados organil do hidrogênio ácido de outros ácidos também são ésteres (por exemplo, amidas), mas não de acordo com a IUPAC.
Os glicerídeos são ésteres de glicerol de ácidos graxos; eles são importantes na biologia, sendo uma das principais classes de lipídios e compreendendo a maior parte das gorduras animais e óleos vegetais. As lactonas são ésteres carboxílicos cíclicos; as lactonas que ocorrem naturalmente são principalmente lactonas de anéis de 5 e 6 membros. As lactonas contribuem para o aroma de frutas, manteiga, queijo, vegetais como aipo e outros alimentos.
Os ésteres podem ser formados a partir de oxoácidos (por exemplo, ésteres de ácido acético, ácido carbônico, ácido sulfúrico, ácido fosfórico, ácido nítrico, ácido xântico), mas também de ácidos que não contêm oxigênio (por exemplo, ésteres de ácido tiociânico e ácido tritiocarbônico)). Um exemplo de formação de éster é a reação de substituição entre um ácido carboxílico (R−C(=O)−OH) e um álcool (R'OH), formando um éster (R−C(=O)−O−R'), onde R representa qualquer grupo (orgânico ou inorgânico) e R′ representa o grupo organil.
Ésteres organílicos de ácidos carboxílicos normalmente têm um cheiro agradável; aqueles de baixo peso molecular são comumente usados como fragrâncias e são encontrados em óleos essenciais e feromônios. Eles funcionam como solventes de alto grau para uma ampla gama de plásticos, plastificantes, resinas e lacas, e são uma das maiores classes de lubrificantes sintéticos no mercado comercial. Os poliésteres são plásticos importantes, com monômeros ligados por porções de éster. Ésteres de ácido fosfórico formam a espinha dorsal das moléculas de DNA. Ésteres de ácido nítrico, como a nitroglicerina, são conhecidos por suas propriedades explosivas.
Existem compostos em que um hidrogênio ácido dos ácidos mencionados neste artigo não são substituídos por um organil, mas por algum outro grupo. Segundo alguns autores, esses compostos também são ésteres (por exemplo, segundo eles, acetato de trimetilestanil (ou acetato de trimetilestanho) CH3COOSn(CH3)3 é um éster trimetilestanílico de ácido acético, e dilaurato de dibutilestanho (CH3(CH2)10COO)2Sn((CH2)3CH3)2 é um éster dibutilestannyleno de ácido láurico).
Nomenclatura
Etimologia
A palavra éster foi cunhada em 1848 pelo químico alemão Leopold Gmelin, provavelmente como uma contração do alemão Essigäther, "éter acético".
Nomenclatura IUPAC
Os nomes dos ésteres que são formados a partir de um álcool e um ácido são derivados do álcool original e do ácido original, onde o último pode ser orgânico ou inorgânico. Os ésteres derivados dos ácidos carboxílicos mais simples são comumente nomeados de acordo com os chamados "nomes triviais" mais tradicionais. por exemplo. como formato, acetato, propionato e butirato, em oposição à nomenclatura IUPAC metanoato, etanoato, propanoato e butanoato. Ésteres derivados de ácidos carboxílicos mais complexos são, por outro lado, mais freqüentemente nomeados usando o nome IUPAC sistemático, baseado no nome do ácido seguido pelo sufixo -oato. Por exemplo, o éster hexil octanoato, também conhecido pelo nome trivial hexil caprilato, tem a fórmula CH3(CH2)6CO2(CH2)5CH3.
As fórmulas químicas de ésteres orgânicos formados a partir de ácidos carboxílicos e álcoois geralmente assumem a forma RCO2R' ou RCOOR', onde R e R' são as partes organil do ácido carboxílico e do álcool, respectivamente, e R pode ser um hidrogênio no caso de ésteres de ácido fórmico. Por exemplo, acetato de butila (sistematicamente butil etanoato), derivado do butanol e ácido acético (sistematicamente ácido etanóico) seria escrito CH3CO2(CH2)3CH3. Apresentações alternativas são comuns, incluindo BuOAc e CH3COO(CH2 )3CH3.
Os ésteres cíclicos são chamados de lactonas, independentemente de serem derivados de um ácido orgânico ou inorgânico. Um exemplo de uma lactona orgânica é a γ-valerolactona.
Ortoésteres
Uma classe incomum de ésteres são os ortoésteres. Um deles são os ésteres de ácidos ortocarboxílicos. Esses ésteres têm a fórmula RC(OR′)3, onde R representa qualquer grupo (orgânico ou inorgânico) e R' representa o grupo organila. Por exemplo, ortoformato de trietila (HC(OCH2CH3)3) é derivado, em termos de seu nome (mas não de sua síntese), da esterificação do ácido ortofórmico (HC(OH)3) com etanol.
Ésteres de ácidos inorgânicos
Ésteres também podem ser derivados de ácidos inorgânicos.
- O ácido fosfórico forma ésteres fosfatos, por exemplo, fosfato triphenil (O=P (OC)6H. H. H.5)3) e fosfato de diidrogénio metilo (O=P (OCH)3(OH)2)
- Ácido sulfúrico forma ésteres sulfatos, por exemplo, sulfato dimetil ((CH)3O)2Então...2) e metil bisulfato (CH3OSO2Oh!)
- O ácido nítrico forma ésteres de nitrato, por exemplo, nitrato metílico (CH3- Não.2) e nitroglicerina (CH (−O−NO2)2- Não.2)2)
- Ácido bórico forma ésteres boratos, por exemplo, trimetil borate (B (OCH3)3)
- O ácido carbono forma ésteres de carbonato, por exemplo, carbonato de etileno ((CH)2O)2C.) (se um classifica o ácido carbônico como um composto inorgânico)
- O ácido tritiocarbono forma ésteres tritiocarbonatos, por exemplo, tritiocarbonato dimetil ((CH)3S)2C.) (se um classifica o ácido tritiocarbono como um composto inorgânico)
- O ácido tiocianato forma ésteres tiocianatos, por exemplo, tiocianato metil (CH3-S−C≡N) (se um classifica o ácido tiociânico como um composto inorgânico)
Os ácidos inorgânicos que existem como tautômeros formam dois ou mais tipos de ésteres.
- O ácido fosforoso forma dois tipos de ésteres: ésteres de fosfito, por exemplo, fosfito de triethyl (P (OCH2CH3)3), e ésteres de fosforato, por exemplo, fosforato de dietil (HP(=O)(−OCH2CH3)2)
- O ácido tiosulfúrico forma dois tipos de ésteres tiossulfatos, por exemplo. O,O- tiossulfato de metilo ((CH)3-O−)2C.) e O,S- tiossulfato de metilo (CH3−O−C(=O)−S−CH3)
Alguns ácidos inorgânicos que são instáveis ou evasivos formam ésteres estáveis.
- Ácido crómico, que nunca foi detectado, forma cromato di-tert-butil ((CH)3)3CO)2Crônica2)
- Ácido sulfúrico, que é raro, forma sulfito dimetil ((CH)3O)2S.)
Em princípio, todos os alcóxidos metálicos e metalóides, dos quais muitas centenas são conhecidas, podem ser classificados como ésteres dos ácidos hipotéticos, por exemplo, trietóxido de alumínio (Al(OCH2CH3)3) pode ser classificado como um éster de ácido aluminico que é hidróxido de alumínio, ortossilicato de tetraetila (Si (OCH2CH3) 4) pode ser classificado como um éster de ácido ortossilícico e etóxido de titânio (Ti(OCH2CH3)4) pode ser classificado como um éster de ácido ortotitânico.
Estrutura e ligação
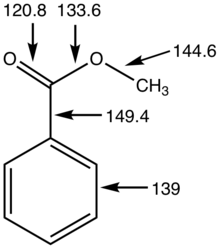
Ésteres derivados de ácidos carboxílicos e álcoois contêm um grupo carbonílico C=O, que é um grupo divalente no átomo de C, que dá origem a ângulos de 120° C–C–O e O–C–O. Ao contrário das amidas, os ésteres de ácidos carboxílicos são grupos funcionais estruturalmente flexíveis porque a rotação em torno das ligações C-O-C tem uma barreira baixa. Sua flexibilidade e baixa polaridade se manifestam em suas propriedades físicas; eles tendem a ser menos rígidos (ponto de fusão mais baixo) e mais voláteis (ponto de ebulição mais baixo) do que as amidas correspondentes. O pKa dos alfa-hidrogênios nos ésteres é de cerca de 25.
Muitos ésteres de ácidos carboxílicos têm potencial para isomerismo conformacional, mas tendem a adotar uma conformação S-cis (ou Z) em vez do que a alternativa S-trans (ou E), devido a uma combinação de hiperconjugação e efeitos de minimização de dipolo. A preferência pela conformação Z é influenciada pela natureza dos substituintes e do solvente, se presente. Lactonas com pequenos anéis são restritas à conformação s-trans (ou seja, E) devido à sua estrutura cíclica.
Propriedades físicas e caracterização
Ésteres derivados de ácidos carboxílicos e álcoois são mais polares que os éteres, mas menos polares que os álcoois. Eles participam de pontes de hidrogênio como aceptores de pontes de hidrogênio, mas não podem atuar como doadores de pontes de hidrogênio, ao contrário de seus álcoois originais. Essa capacidade de participar da ligação de hidrogênio confere alguma solubilidade em água. Devido à sua falta de capacidade de doação de pontes de hidrogênio, os ésteres não se auto-associam. Consequentemente, os ésteres são mais voláteis do que os ácidos carboxílicos de peso molecular semelhante.
Caracterização e análise
Os ésteres são geralmente identificados por cromatografia gasosa, tirando partido da sua volatilidade. Os espectros de IV para ésteres apresentam uma banda aguda intensa na faixa de 1730–1750 cm−1 atribuída a νC=O. Este pico muda dependendo dos grupos funcionais ligados à carbonila. Por exemplo, um anel de benzeno ou ligação dupla em conjugação com o carbonil reduzirá o número de onda em cerca de 30 cm−1.
Aplicações e ocorrências
Ésteres são comuns na natureza e são amplamente utilizados na indústria. Na natureza, as gorduras são, em geral, triésteres derivados do glicerol e dos ácidos graxos. Os ésteres são responsáveis pelo aroma de muitas frutas, incluindo maçãs, duriões, peras, bananas, abacaxis e morangos. Vários bilhões de quilos de poliésteres são produzidos industrialmente anualmente, sendo produtos importantes o tereftalato de polietileno, ésteres de acrilato e acetato de celulose.
Preparação
Esterificação é o nome geral para uma reação química na qual dois reagentes (tipicamente um álcool e um ácido) formam um éster como produto da reação. Os ésteres são comuns na química orgânica e em materiais biológicos e geralmente têm um odor frutado característico e agradável. Isso leva ao seu uso extensivo na indústria de fragrâncias e sabores. As ligações éster também são encontradas em muitos polímeros.
Esterificação de ácidos carboxílicos com álcoois
A síntese clássica é a esterificação de Fischer, que envolve o tratamento de um ácido carboxílico com um álcool na presença de um agente desidratante:
- RCO2H + R'OH RCO2R' + H2O
A constante de equilíbrio para tais reações é de cerca de 5 para ésteres típicos, por exemplo, acetato de etila. A reação é lenta na ausência de um catalisador. O ácido sulfúrico é um catalisador típico para esta reação. Muitos outros ácidos também são usados, como ácidos sulfônicos poliméricos. Como a esterificação é altamente reversível, o rendimento do éster pode ser melhorado usando o princípio de Le Chatelier:
- Usando o álcool em grande excesso (isto é, como um solvente).
- Usando um agente desidratante: ácido sulfúrico não só catalisa a reação, mas sequestres água (um produto de reação). Outros agentes de secagem como peneiras moleculares também são eficazes.
- Remoção de água por meios físicos, como destilação como um azeotropes com tolueno, em conjunto com um aparelho Dean-Stark.
São conhecidos reagentes que conduzem à desidratação de misturas de álcoois e ácidos carboxílicos. Um exemplo é a esterificação Steglich, que é um método de formação de ésteres em condições amenas. O método é popular na síntese de peptídeos, onde os substratos são sensíveis a condições adversas, como altas temperaturas. DCC (diciclohexilcarbodiimida) é usado para ativar o ácido carboxílico para posterior reação. 4-dimetilaminopiridina (DMAP) é usado como um catalisador de transferência de acil.
Outro método para a desidratação de misturas de álcoois e ácidos carboxílicos é a reação de Mitsunobu:
- RCO2H + R'OH + P(C6H. H. H.5)3 + R2N2 → RCO2R' + OP(C)6H. H. H.5)3 + R2N2H. H. H.2
Os ácidos carboxílicos podem ser esterificados usando diazometano:
- RCO2H + CH2N2 → RCO2CH3 + N2
Usando este diazometano, misturas de ácidos carboxílicos podem ser convertidas em seus ésteres metílicos em rendimentos quase quantitativos, por exemplo, para análise por cromatografia gasosa. O método é útil em operações sintéticas orgânicas especializadas, mas é considerado muito perigoso e caro para aplicações em larga escala.
Esterificação de ácidos carboxílicos com epóxidos
Os ácidos carboxílicos são esterificados por tratamento com epóxidos, dando β-hidroxiésteres:
- RCO2H + RCHCH2O → RCO2CH2CH(OH)R
Esta reação é empregada na produção de resina de éster vinílico a partir do ácido acrílico.
Alcoólise de cloretos de acila e anidridos ácidos
Os álcoois reagem com cloretos de acila e anidridos ácidos para dar ésteres:
- RCOCl + R'OH → RCO2R' + HCl
- (RCO)2O + R'OH → RCO2R' + RCO2H. H. H.
As reações são irreversíveis, simplificando o processamento. Uma vez que os cloretos de acilo e os anidridos de ácido também reagem com a água, as condições anidras são preferidas. As acilações análogas de aminas para formar amidas são menos sensíveis porque as aminas são nucleófilos mais fortes e reagem mais rapidamente do que a água. Este método é empregado apenas para procedimentos em escala laboratorial, pois é caro.
Alquilação de sais de carboxilato
Embora não sejam amplamente empregados para esterificações, sais de ânions carboxilato podem ser agentes alquilantes com haletos de alquila para dar ésteres. No caso de ser utilizado um cloreto de alquila, um sal de iodeto pode catalisar a reação (reação de Finkelstein). O sal carboxilato é frequentemente gerado in situ. Em casos difíceis, pode-se utilizar o carboxilato de prata, pois o íon prata se coordena ao haleto auxiliando na sua saída e melhorando a velocidade da reação. Esta reação pode sofrer de problemas de disponibilidade de ânions e, portanto, pode se beneficiar da adição de catalisadores de transferência de fase ou solventes apróticos altamente polares, como DMF.
Transesterificação
A transesterificação, que envolve a transformação de um éster em outro, é amplamente praticada:
- RCO2R' + CH3OH → RCO2CH3 + R'OH
Assim como a hidrolisação, a transesterificação é catalisada por ácidos e bases. A reação é amplamente utilizada para degradar triglicerídeos, e. na produção de ésteres e álcoois de ácidos graxos. Poli(etileno tereftalato) é produzido pela transesterificação de dimetil tereftalato e etilenoglicol:
- (C)6H. H. H.4(CO)2CH3)2 + 2 C2H. H. H.4(OH)2 → 1/n(C)6H. H. H.4(CO)2)2(C)2H. H. H.4)n + 2 CH3Oh!
Um subconjunto da transesterificação é a alcoólise do diceteno. Esta reação fornece 2-cetoésteres.
- (CH)2CO)2 + ROH → CH3C(O)CH2CO2R
Carbonilação
Alcenos sofrem "hidroesterificação" na presença de catalisadores carbonílicos metálicos. Ésteres de ácido propanóico são produzidos comercialmente por este método:
- H. H. H.2C.2 + ROH + CO → CH3CH2CO2R
Uma preparação de propionato de metila é um exemplo ilustrativo.
- H. H. H.2C.2 + CO + CH3OH → CH3CH2CO2CH3
A carbonilação do metanol produz formato de metila, que é a principal fonte comercial de ácido fórmico. A reação é catalisada pelo metóxido de sódio:
- CH3OH + CO → HCO2CH3
Adição de ácidos carboxílicos a alcenos e alcinos
Na hidroesterificação, alcenos e alcinos se inserem na ligação O−H dos ácidos carboxílicos. O acetato de vinila é produzido industrialmente pela adição de ácido acético ao acetileno na presença de catalisadores de acetato de zinco: Atualmente, o acetato de zinco é usado como catalisador:
- H. H. H.2C.2 + CH3CO2H → CH3CO2CH2
O acetato de vinila também pode ser produzido pela reação catalisada por paládio de etileno, ácido acético e oxigênio:
- 2 H2C.2 + 2 CH3CO2H + O2 → 2 CH3CO2CH2 + 2 H2O
O ácido silicotungstico é usado para fabricar acetato de etila pela alquilação do ácido acético pelo etileno:
- H. H. H.2C.2 + CH3CO2H → CH3CO2CH2CH3
De aldeídos
A reação de Tishchenko envolve a desproporção de um aldeído na presença de uma base anidra para dar um éster. Os catalisadores são alcóxidos de alumínio ou alcóxidos de sódio. O benzaldeído reage com o benzilóxido de sódio (gerado a partir de sódio e álcool benzílico) para gerar benzoato de benzila. O método é usado na produção de acetato de etila a partir de acetaldeído.
Outros métodos
- Reorganização Favorskii de α-haloketones na presença de base
- Baeyer–Oxidação de Villiger de cetonas com peróxidos
- Reação Pinner de nitrículas com álcool
- Abstração nucleofílica de um complexo metal-acyl
- Hidrólise de ortões em ácido aquoso
- Celulólise através da esterificação
- Ozonólise de alcenos usando um trabalho acima na presença de ácido clorídrico e vários álcool.
- Oxidação anódica de cetonas metil levando a ésteres metil.
- A interessanteificação troca os grupos de ácidos graxos de diferentes ésteres.
Reações
Ésteres reagem com nucleófilos no carbono carbonílico. A carbonila é fracamente eletrofílica, mas é atacada por nucleófilos fortes (aminas, alcóxidos, fontes de hidretos, compostos de organolítio, etc.). As ligações C-H adjacentes à carbonila são fracamente ácidas, mas sofrem desprotonação com bases fortes. Este processo é o que geralmente inicia as reações de condensação. O oxigênio da carbonila nos ésteres é fracamente básico, menos do que o oxigênio da carbonila nas amidas devido à doação por ressonância de um par de elétrons do nitrogênio nas amidas, mas forma adutos.
Hidrólise e saponificação
A esterificação é uma reação reversível. Os ésteres sofrem hidrólise em condições ácidas e básicas. Sob condições ácidas, a reação é a reação inversa da esterificação de Fischer. Sob condições básicas, o hidróxido atua como um nucleófilo, enquanto um alcóxido é o grupo abandonador. Essa reação, a saponificação, é a base da fabricação do sabão.
O grupo alcóxido também pode ser deslocado por nucleófilos mais fortes, como amônia ou aminas primárias ou secundárias para dar amidas: (reação de amonólise)
- RCO2R' + NH2R′′ → RCONHR′′′ + R'OH
Esta reação geralmente não é reversível. Hidrazinas e hidroxilamina podem ser usadas no lugar de aminas. Ésteres podem ser convertidos em isocianatos através de ácidos hidroxâmicos intermediários no rearranjo de Lossen.
Fontes de nucleófilos de carbono, por exemplo, reagentes de Grignard e compostos de organolítio, adicionam-se prontamente ao carbonil.
Redução
Em comparação com cetonas e aldeídos, os ésteres são relativamente resistentes à redução. A introdução da hidrogenação catalítica no início do século 20 foi um avanço; ésteres de ácidos graxos são hidrogenados a álcoois graxos.
- RCO2R' + 2 H2 → RCH2OH + R'OH
Um catalisador típico é a cromita de cobre. Antes do desenvolvimento da hidrogenação catalítica, os ésteres eram reduzidos em grande escala usando a redução Bouveault-Blanc. Esse método, em grande parte obsoleto, usa sódio na presença de fontes de prótons.
Especialmente para sínteses de química fina, o hidreto de alumínio e lítio é usado para reduzir ésteres a dois álcoois primários. O reagente relacionado borohidreto de sódio é lento nesta reação. DIBAH reduz ésteres a aldeídos.
A redução direta para dar o éter correspondente é difícil, pois o hemiacetal intermediário tende a se decompor para dar um álcool e um aldeído (que é rapidamente reduzido para dar um segundo álcool). A reação pode ser realizada usando trietilsilano com uma variedade de ácidos de Lewis.
Condensação de Claisen e reações relacionadas
Quanto aos aldeídos, os átomos de hidrogênio no carbono adjacente ("α a") ao grupo carboxila nos ésteres são suficientemente ácidos para sofrer desprotonação, o que, por sua vez, leva a uma variedade de reações úteis. A desprotonação requer bases relativamente fortes, como alcóxidos. A desprotonação dá um enolato nucleofílico, que pode ainda reagir, por exemplo, a condensação de Claisen e seu equivalente intramolecular, a condensação de Dieckmann. Essa conversão é explorada na síntese do éster malônico, em que o diéster do ácido malônico reage com um eletrófilo (por exemplo, haleto de alquila) e é subsequentemente descarboxilado. Outra variação é a alquilação Fráter-Seebach.
Outras reações
- Os ésteres de metil são frequentemente suscetíveis à descarboxilação no descarboxilamento de Krapcho.
- Ésteres Phenyl reagem a hidroxiarylketones no rearrangement Fries.
- Ésteres específicos são funcionalizados com um grupo α-hidroxil no rearranjo Chan.
- Esters com átomos de β-hidrogênio podem ser convertidos em alcalinos em pirólise de éster.
- Uma conversão direta de ésteres a nitriles.
- Par de ésteres são acoplados para dar α-hidroxiketones na condensação de aciclina
Proteção de grupos
Como classe, os ésteres servem como grupos protetores para os ácidos carboxílicos. Proteger um ácido carboxílico é útil na síntese de peptídeos, para evitar auto-reações dos aminoácidos bifuncionais. Ésteres metílicos e etílicos estão comumente disponíveis para muitos aminoácidos; o éster t-butílico tende a ser mais caro. No entanto, ésteres t-butílicos são particularmente úteis porque, sob condições fortemente ácidas, os ésteres t-butílicos sofrem eliminação para dar o ácido carboxílico e isobutileno, simplificando o processamento.
Perigos
Ésteres reagem com ácidos oxidantes fortes, o que pode causar uma reação violenta que é suficientemente exotérmica para inflamar os ésteres e os produtos da reação. O calor também é gerado pela interação de ésteres com soluções alcalinas. Gás hidrogênio muito inflamável é gerado pela mistura de ésteres com metais alcalinos e hidretos iônicos.
Lista de odorantes de éster
Muitos ésteres têm odores distintos de frutas e muitos ocorrem naturalmente nos óleos essenciais das plantas. Isso também levou ao seu uso comum em aromas e fragrâncias artificiais que visam imitar esses odores.
Contenido relacionado
Érbio
Metallocene
Calcogênio