Equilíbrio químico
Em uma reação química, equilíbrio químico é o estado em que tanto os reagentes quanto os produtos estão presentes em concentrações que não têm mais tendência a mudar com o tempo, de modo que não há mudança observável no propriedades do sistema. Esse estado ocorre quando a reação direta ocorre na mesma velocidade que a reação inversa. As taxas de reação das reações direta e inversa geralmente não são zero, mas são iguais. Assim, não há mudanças líquidas nas concentrações dos reagentes e produtos. Tal estado é conhecido como equilíbrio dinâmico.
Introdução histórica
O conceito de equilíbrio químico foi desenvolvido em 1803, depois que Berthollet descobriu que algumas reações químicas são reversíveis. Para que qualquer mistura de reação exista em equilíbrio, as taxas das reações direta e inversa (reversa) devem ser iguais. Na equação química a seguir, as setas apontam para os dois lados para indicar o equilíbrio. A e B são espécies químicas reagentes, S e T são espécies de produtos e α, β, σ e τ são os coeficientes estequiométricos dos respectivos reagentes e produtos:
- αA + βB. σS + ?T
Diz-se que a posição de concentração de equilíbrio de uma reação está "muito à direita" se, no equilíbrio, quase todos os reagentes são consumidos. Por outro lado, diz-se que a posição de equilíbrio é "muito à esquerda" se quase nenhum produto for formado a partir dos reagentes.
Guldberg e Waage (1865), com base nas ideias de Berthollet, propuseram a lei da ação das massas:
- taxa de reação= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =k+Aα α Bβ β taxa de reação atrasada= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =k- Sim. - Sim. Sσ σ T? ? {displaystyle {begin{aligned}{text{forward react rate}}&=k_{+}{ce {A}}^{alpha }{ce {B}}^{beta }\{text{reação para trás rate}}&=k_{-}{ce {S}}^{sigma }{ce {T}}^{tau }end{aligned}}}
onde A, B, S e T são massas ativas e k+ e k− são taxas constantes. Como no equilíbrio as taxas para frente e para trás são iguais:
- k+(A?α α (B?β β = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =k- Sim. - Sim. (S?σ σ (T?? ? Não. k_{+}left{{ce {A}}right}^{alpha }left{{ce {B}}right}^{beta }=k_{-}left{{ce {S}}right}^{sigma }left{{ce {T}}right}^{tau }}
e a razão das constantes de velocidade também é uma constante, agora conhecida como constante de equilíbrio.
- KKc= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =k+k- Sim. - Sim. = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =(S?σ σ (T?? ? (A?α α (B?β β Não. K_{c} = {k_{+}}{k_{-}}}={frac Não. {S}}}^{sigma ? {T}}}^{tau) {A}}}^{alpha ? {B}}}^{beta Sim.
Por convenção, os produtos formam o numerador. No entanto, a lei da ação das massas é válida apenas para reações concertadas de uma etapa que passam por um único estado de transição e não é válida em geral porque as equações de velocidade não seguem, em geral, a estequiometria do reação como Guldberg e Waage haviam proposto (ver, por exemplo, substituição alifática nucleofílica por SN1 ou reação de hidrogênio e bromo para formar brometo de hidrogênio). A igualdade das taxas de reação direta e inversa, no entanto, é uma condição necessária para o equilíbrio químico, embora não seja suficiente para explicar por que o equilíbrio ocorre.
Apesar das limitações desta derivação, a constante de equilíbrio para uma reação é de fato uma constante, independente das atividades das várias espécies envolvidas, embora dependa da temperatura observada pela equação de van 't Hoff. A adição de um catalisador afetará tanto a reação direta quanto a reação inversa da mesma maneira e não afetará a constante de equilíbrio. O catalisador acelerará ambas as reações, aumentando assim a velocidade na qual o equilíbrio é alcançado.
Embora as concentrações macroscópicas de equilíbrio sejam constantes no tempo, as reações ocorrem no nível molecular. Por exemplo, no caso do ácido acético dissolvido em água e formando íons acetato e hidrônio,
- CH3CO2H + H2O quê?3CO- Sim.2 + H3O+
um próton pode pular de uma molécula de ácido acético para uma molécula de água e depois para um ânion acetato para formar outra molécula de ácido acético e deixar o número de moléculas de ácido acético inalterado. Este é um exemplo de equilíbrio dinâmico. Equilíbrios, como o restante da termodinâmica, são fenômenos estatísticos, médias de comportamento microscópico.
Princípio de Le Châtelier (1884) prevê o comportamento de um sistema em equilíbrio quando ocorrem mudanças em suas condições de reação. Se um equilíbrio dinâmico é perturbado pela mudança das condições, a posição de equilíbrio move-se para reverter parcialmente a mudança. Por exemplo, adicionar mais S (à reação química acima) de fora causará um excesso de produtos, e o sistema tentará neutralizar isso aumentando a reação inversa e empurrando o ponto de equilíbrio para trás (embora a constante de equilíbrio permaneça o mesmo).
Se o ácido mineral for adicionado à mistura de ácido acético, aumentando a concentração do íon hidrônio, a quantidade de dissociação deve diminuir à medida que a reação é direcionada para a esquerda de acordo com este princípio. Isso também pode ser deduzido da expressão da constante de equilíbrio para a reação:
- KK= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =(CH3CO2- Sim. - Sim. ?(H. H. H.3O+?(CH3CO2H. H. H.?- Sim. Não. {CH3CO2-}}}{{ce {H3O+}}}}{{ce ({CH3CO2H}}}}}})
Se {H3O+} aumenta, {CH3CO2H} deve aumentar e CH3CO− 2 deve diminuir. O H2O é deixado de fora, pois é o solvente e sua concentração permanece alta e quase constante.
Uma versão quantitativa é dada pelo quociente de reação.
J. W. Gibbs sugeriu em 1873 que o equilíbrio é alcançado quando a energia livre de Gibbs do sistema está em seu valor mínimo (assumindo que a reação é realizada a temperatura e pressão constantes). O que isso significa é que a derivada da energia de Gibbs em relação à coordenada da reação (uma medida da extensão da reação que ocorreu, variando de zero para todos os reagentes a um máximo para todos os produtos) desaparece (porque dG = 0), sinalizando um ponto estacionário. Essa derivada é chamada de energia de Gibbs da reação (ou mudança de energia) e corresponde à diferença entre os potenciais químicos dos reagentes e produtos na composição da mistura reacional. Este critério é necessário e suficiente. Se uma mistura não está em equilíbrio, a liberação do excesso de energia de Gibbs (ou energia de Helmholtz em reações a volume constante) é a "força motriz" para que a composição da mistura mude até que o equilíbrio seja alcançado. A constante de equilíbrio pode ser relacionada à variação de energia livre de Gibbs padrão para a reação pela equação
- ? ? RG⊖ ⊖ = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =- Sim. - Sim. RTI KKeq{displaystyle Delta _{r}G^{ominus }=-RTln K_{mathrm {eq} }}
onde R é a constante universal dos gases e T a temperatura.
Quando os reagentes são dissolvidos em um meio de alta força iônica, o quociente dos coeficientes de atividade pode ser considerado constante. Nesse caso, o quociente de concentração, Kc,
- KKc= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Não.S]σ σ Não.T]? ? Não.A]α α Não.B]β β Não. K_{ce {c}}={frac {[{ce {S}}]^{sigma }[{ce {T}}]^{tau }}{[{ce {A}}}^{alpha }[{ce {B}}]^{beta Sim.
onde [A] é a concentração de A, etc., é independente da concentração analítica dos reagentes. Por esta razão, as constantes de equilíbrio para soluções são geralmente determinadas em meios de alta força iônica. Kc varia com a força iônica, temperatura e pressão (ou volume). Da mesma forma Kp para gases depende da pressão parcial. Essas constantes são mais fáceis de medir e encontradas em cursos de química do ensino médio.
Termodinâmica
Em temperatura e pressão constantes, deve-se considerar a energia livre de Gibbs, G, enquanto em temperatura e volume constantes, deve-se considerar a energia livre de Helmholtz, A, para a reação; e com energia interna e volume constantes, deve-se considerar a entropia, S, para a reação.
O caso de volume constante é importante em geoquímica e química atmosférica onde as variações de pressão são significativas. Observe que, se reagentes e produtos estivessem no estado padrão (completamente puros), não haveria reversibilidade e nem equilíbrio. Na verdade, eles necessariamente ocupariam volumes de espaço disjuntos. A mistura dos produtos e reagentes contribui com um grande aumento de entropia (conhecido como entropia de mistura) para estados contendo mistura igual de produtos e reagentes e dá origem a um mínimo distinto na energia de Gibbs em função da extensão da reação. A mudança de energia de Gibbs padrão, juntamente com a energia de Gibbs de mistura, determinam o estado de equilíbrio.
Neste artigo, apenas o caso de pressão constante é considerado. A relação entre a energia livre de Gibbs e a constante de equilíbrio pode ser encontrada considerando potenciais químicos.
Em temperatura e pressão constantes na ausência de uma tensão aplicada, a energia livre de Gibbs, G, para a reação depende apenas da extensão da reação: ξ (letra grega xi), e só pode diminuir de acordo com a segunda lei da termodinâmica. Isso significa que a derivada de G em relação a ξ deve ser negativa se a reação ocorrer; no equilíbrio esta derivada é igual a zero.
- (DGD? ? )T,p= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =0{displaystyle left({frac) {dG}{dxi }}right):equilíbrio
Para atender à condição termodinâmica de equilíbrio, a energia de Gibbs deve ser estacionária, o que significa que a derivada de G em relação à extensão da reação, ξ, deve ser zero. Pode-se mostrar que, neste caso, a soma dos potenciais químicos vezes os coeficientes estequiométricos dos produtos é igual à soma dos correspondentes aos reagentes. Portanto, a soma das energias de Gibbs dos reagentes deve ser igual à soma das energias de Gibbs dos produtos.
- α α μ μ A+β β μ μ B= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =σ σ μ μ S+? ? μ μ T{displaystyle alpha mu _{mathrm {A} }+beta mu _{mathrm {B} }=sigma mu _{mathrm {S} }+tau mu _{mathrm {T} },}
onde μ é neste caso uma energia de Gibbs molar parcial, um potencial químico. O potencial químico de um reagente A é uma função da atividade, {A} desse reagente.
- μ μ A= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =μ μ A⊖ ⊖ +RTI (A?{displaystyle mu _{mathrm - Não. _{A}^{ominus }+RTln******************************************************************************************************************************************************************************************************************************************************** {A} },}
(onde μo
A é o potencial químico padrão).
A definição da equação de energia de Gibbs interage com a relação termodinâmica fundamental para produzir
- DG= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =VDp- Sim. - Sim. SDT+Gerenciamento Gerenciamento Eu...= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1kμ μ Eu...DNEu...Não. DG=Vdp-SdT+sum _{i=1}^{k}mu _{i}dN_{i}}.
Inserção DNEu...= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = ProcessoEu...Não. na equação acima dá um coeficiente stoichiometric (Processo Processo Eu...- Sim.) e um diferencial que denota a reação que ocorre em uma extensão infinitesimal (Não.). A pressão constante e a temperatura as equações acima podem ser escritas como
- (DGD? ? )T,p= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Gerenciamento Gerenciamento Eu...= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1kμ μ Eu...Processo Processo Eu...= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =? ? RGT,p{displaystyle left({frac) {dG}{dxi }}right) _{i=1}^{k}mu _{i}nu _{i}=Delta _{mathrm {r} }G_{T,p}}
que é a "variação de energia livre de Gibbs para a reação. Isso resulta em:
- ? ? RGT,p= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =σ σ μ μ S+? ? μ μ T- Sim. - Sim. α α μ μ A- Sim. - Sim. β β μ μ BNão. Delta _{mathrm {r} }G_{T,p}=sigma mu _{mathrm {S} }+tau mu _{mathrm {T} }-alpha mu _{mathrm {A} }-beta mu _{mathrm {B} },}.
Substituindo os potenciais químicos:
- ? ? RGT,p= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =(σ σ μ μ S⊖ ⊖ +? ? μ μ T⊖ ⊖ )- Sim. - Sim. (α α μ μ A⊖ ⊖ +β β μ μ B⊖ ⊖ )+(σ σ RTI (S?+? ? RTI (T?)- Sim. - Sim. (α α RTI (A?+β β RTI (B?)Não. Delta _{mathrm {r} }G_{T,p}=(sigma mu _{mathrm {S} }^{ominus }+tau mu _{mathrm {T} }^{ominus })-(alpha mu _{mathrm {A} }^{ominus }+beta mu _{mathrm (B} }^{ominus })+(sigma RTln{mathrm (S} }+tau RTln{mathrm {T} })-(alpha RTln{mathrm (A} }+beta RTln{mathrm {B} })},
o relacionamento se torna:
- ? ? RGT,p= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Gerenciamento Gerenciamento Eu...= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1kμ μ Eu...⊖ ⊖ Processo Processo Eu...+RTI (S?σ σ (T?? ? (A?α α (B?β β Não. Delta _{mathrm {r} }G_{T,p}=sum _{i=1}^{k}mu _{i}^{ominus }nu _{i}+RTln Não. {S} }^{sigma }mathrm {T} }^{tau - Sim. {A} }^{alpha }mathrm {B} }^{beta Sim.
- Gerenciamento Gerenciamento Eu...= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1kμ μ Eu...⊖ ⊖ Processo Processo Eu...= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =? ? RG⊖ ⊖ {displaystyle sum _{i=1}^{k}mu _{i}^{ominus }nu _{i}=Delta _{mathrm {r} }G^{ominus }}:
que é a variação de energia de Gibbs padrão para a reação que pode ser calculada usando tabelas termodinâmicas. O quociente de reação é definido como:
- QR= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =(S?σ σ (T?? ? (A?α α (B?β β Não. ? Não. {S} }^{sigma }mathrm {T} }^{tau - Sim. {A} }^{alpha }mathrm {B} }^{beta Sim.
Portanto,
- (DGD? ? )T,p= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =? ? RGT,p= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =? ? RG⊖ ⊖ +RTI QR{displaystyle left({frac) {dG}{dxi }}right)_{T,p}=Delta _{mathrm {r} }G_{T,p}= Delta _{mathrm {r} }G^{ominus }+RTln Q_{mathrm {r} }}
No equilíbrio:
- (DGD? ? )T,p= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =? ? RGT,p= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =0{displaystyle left({frac) {dG}{dxi }}right)_{T,p}=Delta _{mathrm {r} }G_{T,p}=0}
conduzindo a:
- 0= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =? ? RG⊖ ⊖ +RTI KKeqNão. 0=Delta _{mathrm {r} }G^{ominus }+RTln K_{mathrm {eq} }}
e
- ? ? RG⊖ ⊖ = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =- Sim. - Sim. RTI KKeqNão. Delta _{mathrm {r} }G^{ominus }=-RTln K_{mathrm {eq} }}
A obtenção do valor da variação da energia de Gibbs padrão permite o cálculo da constante de equilíbrio.
Adição de reagentes ou produtos
Para um sistema reacional em equilíbrio: Qr = Keq; ξ = ξeq.
- Se as atividades dos constituintes forem modificadas, o valor da reação quociente muda e se torna diferente da constante equilíbrio: QR≠KKeq e(DGD? ? )T,p= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =? ? RG⊖ ⊖ +RTI QR{displaystyle left({frac) {dG}{dxi }}right)_{T,p}=Delta _{mathrm {r} }G^{ominus }+RTln Q_{mathrm }então? ? RG⊖ ⊖ = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =- Sim. - Sim. RTI KKeqNão. Delta _{mathrm {r} }G^{ominus }=-RTln K_{eq ~ }(DGD? ? )T,p= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =RTI (QRKKeq){displaystyle left({frac) {dG}{dxi }}right)_{T,p}=RTln left({frac {Q_{mathrm {r}) }}{K_{mathrm {eq} }}}right)~}
- Se a atividade de um reagente Eu... aumentos a reação quociente diminui. Então...QR= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =? ? (umJJ)Processo Processo JJ? ? (umEu...)Processo Processo Eu...,{displaystyle Q_{mathrm {r} }={frac {prod (a_{j})^{nu _{j}}}{prod (a_{i})^{nu _{i}}~,}e<math alttext="{displaystyle Q_{mathrm {r} }QR<KKeqNão. - Sim.<img alt="{displaystyle Q_{mathrm {r} }A reação mudará para a direita (ou seja, na direção dianteira, e assim mais produtos formarão).<math alttext="{displaystyle left({frac {dG}{dxi }}right)_{T,p}(DGD? ? )T,p<0{displaystyle left({frac) {dG}{dxi }}right)<img alt="{displaystyle left({frac {dG}{dxi }}right)_{T,p}
- Se atividade de um produto JJ aumenta, então eK_{mathrm {eq} }~}" display="block" xmlns="http://www.w3.org/1998/Math/MathML">QR>KKeq- Sim. K_{mathrm
K_{mathrm {eq} }~}" aria-hidden="true" class="mwe-math-fallback-image-display" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/1c712cabbcd8232733ceef132c807675cd9c637e" style="vertical-align: -1.005ex; width:10.209ex; height:2.843ex;"/>
A reação mudará para a esquerda (ou seja, na direção reversa, e assim menos produtos formarão).0~}" display="block" xmlns="http://www.w3.org/1998/Math/MathML">(DGD? ? )T,p>0{displaystyle left({frac) {dG}{dxi }}right)0~}" aria-hidden="true" class="mwe-math-fallback-image-display" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/b31683ea47379fb55171d7a91a5962b9b1a41228" style="vertical-align: -2.838ex; width:14.815ex; height:6.509ex;"/>
Observe que as atividades e as constantes de equilíbrio são números adimensionais.
Tratamento da atividade
A expressão para a constante de equilíbrio pode ser reescrita como o produto de um quociente de concentração, Kc e um quociente de coeficiente de atividade, Γ.
- KK= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Não.S]σ σ Não.T]? ? ...Não.A]α α Não.B]β β ...× × γ γ Sσ σ γ γ T? ? ...γ γ Aα α γ γ Bβ β ...= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =KKc)) - Sim. ([mathrm {S} ]^{sigma }[mathrm {T} ]^{tau }...}{[mathrm {A}}^{alpha }[mathrm {B} ]^{beta }...}}times [{gamma] {S} }}^{sigma ? - Sim. {T} }}^{tau }...}{{gamma - Sim. {A} }}^{alpha ? - Sim. {B} }}^{beta }...}}=K_{mathrm {c} }Gamma }
[A] é a concentração do reagente A, etc. Em princípio é possível obter valores dos coeficientes de atividade, γ. Para soluções, equações como a equação de Debye–Hückel ou extensões como a teoria de interação de íons específicos da equação de Davies ou equações de Pitzer podem ser usadas.Software (abaixo) No entanto, isso nem sempre é possível. É prática comum assumir que Γ é uma constante e usar o quociente de concentração no lugar da constante de equilíbrio termodinâmico. Também é prática geral usar o termo constante de equilíbrio em vez do quociente de concentração mais preciso. Esta prática será seguida aqui.
Para reações na fase gasosa, a pressão parcial é usada no lugar da concentração e o coeficiente de fugacidade no lugar do coeficiente de atividade. No mundo real, por exemplo, ao produzir amônia na indústria, os coeficientes de fugacidade devem ser levados em consideração. A fugacidade, f, é o produto da pressão parcial e do coeficiente de fugacidade. O potencial químico de uma espécie na fase gasosa real é dado por
- μ μ = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =μ μ ⊖ ⊖ +RTI (fb)umR)= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =μ μ ⊖ ⊖ +RTI (pb)umR)+RTI γ γ {displaystyle mu =mu ^{ominus }+RTln left({frac {f}{mathrm {bar} }}right)=mu ^{ominus }+RTln left({frac {p}{mathrm {bar} }}right)+RTln gamma ?
portanto, a expressão geral que define uma constante de equilíbrio é válida para as fases de solução e gás.
Quocientes de concentração
Em solução aquosa, as constantes de equilíbrio são geralmente determinadas na presença de uma substância "inerte" eletrólito como nitrato de sódio, NaNO3, ou perclorato de potássio, KClO4. A força iônica de uma solução é dada por
- Eu...= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =12Gerenciamento Gerenciamento Eu...= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1NcEu...zangão.Eu...2{displaystyle I={frac {1}{2}}sum _{i=1}^{N}c_{i}z_{i}^{2}}
onde ci e zi representam a concentração e a carga iônica do tipo de íon i, e a soma é feita sobre todos os N tipos de espécies carregadas em solução. Quando a concentração de sal dissolvido é muito maior do que as concentrações analíticas dos reagentes, os íons provenientes do sal dissolvido determinam a força iônica, e a força iônica é efetivamente constante. Como os coeficientes de atividade dependem da força iônica, os coeficientes de atividade das espécies são efetivamente independentes da concentração. Assim, a suposição de que Γ é constante é justificada. O quociente de concentração é um múltiplo simples da constante de equilíbrio.
- KKc= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =KK)) - Sim. - Não. Não. Gamma)
No entanto, Kc irá variar com a força iônica. Se for medido em uma série de diferentes forças iônicas, o valor pode ser extrapolado para força iônica zero. O quociente de concentração assim obtido é conhecido, paradoxalmente, como constante de equilíbrio termodinâmico.
Antes de usar um valor publicado de uma constante de equilíbrio em condições de força iônica diferentes das condições usadas em sua determinação, o valor deve ser ajustadoSoftware (abaixo).
Misturas metaestáveis
Uma mistura pode parecer não ter tendência a mudar, embora não esteja em equilíbrio. Por exemplo, uma mistura de SO2 e O2 é metaestável porque existe uma barreira cinética à formação do produto, SO3.
- 22 + O2 O que é?3
A barreira pode ser superada quando um catalisador também está presente na mistura como no processo de contato, mas o catalisador não afeta as concentrações de equilíbrio.
Da mesma forma, a formação de bicarbonato a partir de dióxido de carbono e água é muito lenta em condições normais
- CO2 + 2 H2O que fazer?- Sim.3 + H3O+
mas quase instantânea na presença da enzima catalítica anidrase carbônica.
Substâncias puras
Quando substâncias puras (líquidas ou sólidas) estão envolvidas em equilíbrio, suas atividades não aparecem na constante de equilíbrio porque seus valores numéricos são considerados um.
Aplicando a fórmula geral para uma constante de equilíbrio ao caso específico de uma solução diluída de ácido acético em água obtém-se
- CH3CO2H + H2O quê?3CO2- Sim. + H3O+
- KKc= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Não.CH. H. H.3CO2- Sim. - Sim. ]Não.H. H. H.3O+]Não.CH. H. H.3CO2H. H. H.]Não.H. H. H.2O]- Sim. - Não. {[{CH_{3}CO_{2}}^{-}][{H_{3}O}^{+}}]} }{mathrm {{{CH_{3}CO_{2}H}][{H_{2}O}}}]})
Para todas as soluções, exceto as muito concentradas, a água pode ser considerada uma água "pura" líquido e, portanto, tem uma atividade de um. A expressão da constante de equilíbrio é, portanto, geralmente escrita como
- KK= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Não.CH. H. H.3CO2- Sim. - Sim. ]Não.H. H. H.3O+]Não.CH. H. H.3CO2H. H. H.]= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =KKc- Sim. [{{CH_{3}CO_{2}}^{-}][{H_{3}O}^{+}}]} }{mathrm {{{CH_{3}CO_{2}H}}}}} }}=K_{mathrm {c} }}.
Um caso particular é a auto-ionização da água
- 2 H2O quê?3O+ + OH- Sim.
Como a água é o solvente e tem uma atividade de um, a constante de autoionização da água é definida como
- KKO quê?= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Não.H. H. H.+]Não.OH. H. H.- Sim. - Sim. ]- Sim. [H^{+}] OH^{-}
É perfeitamente legítimo escrever [H+] para a concentração do íon hidrônio, uma vez que o estado de solvatação do próton é constante (em soluções diluídas) e, portanto, não afeta as concentrações de equilíbrio. Kw varia com a variação na força iônica e/ou temperatura.
As concentrações de H+ e OH− não são quantidades independentes. Mais comumente [OH−] é substituído por Kw[H+]−1 em expressões constantes de equilíbrio que, de outra forma, incluiriam íon hidróxido.
Sólidos também não aparecem na expressão da constante de equilíbrio, se forem considerados puros e, portanto, suas atividades forem consideradas uma. Um exemplo é a reação de Boudouard:
- 2 CO2 + C
para o qual a equação (sem carbono sólido) é escrita como:
- KKc= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Não.CO2]Não.CO]2- Sim. {c} }={frac {mathrm {[CO_{2}}} }{mathrm {[CO]^{2}})
Múltiplos equilíbrios
Considere o caso de um ácido dibásico H2A. Quando dissolvida em água, a mistura conterá H2A, HA− e A2−. Este equilíbrio pode ser dividido em duas etapas em cada uma das quais um próton é liberado.
- <math alttext="{displaystyle {begin{array}{rl}{ce {H2A HA^- + H+}}:&K_{1}={frac {{ce {[HA-][H+]}}}{{ce {[H2A]}}}}\{ce {HA- A^2- + H+}}:&K_{2}={frac {{ce {[A^{2-}][H+]}}}{{ce {[HA-]}}}}end{array}}}" xmlns="http://www.w3.org/1998/Math/MathML">H. H. H.2A↽ ↽ - Sim. - Sim. - Sim. - Sim. ⇀ ⇀ HAIA- Sim. - Sim. +H. H. H.+:KK1= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Não.HAIA- Sim. - Sim. ]Não.H. H. H.+]Não.H. H. H.2A]HAIA- Sim. - Sim. ↽ ↽ - Sim. - Sim. - Sim. - Sim. ⇀ ⇀ A2- Sim. - Sim. +H. H. H.+:KK2= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Não.A2- Sim. - Sim. ]Não.H. H. H.+]Não.HAIA- Sim. - Sim. ]{displaystyle {begin{array}{rl}{ce {H2A HA^- + H+}}:&K_{1}={frac ([HA-][H+]}}}, {[H2A]}}\{ce {HA- A^2- + H+}}:&K_{2}={frac [A^{2-}] H+}}} ([HA-]}}end{array}}}<img alt="{displaystyle {begin{array}{rl}{ce {H2A HA^- + H+}}:&K_{1}={frac {{ce {[HA-][H+]}}}{{ce {[H2A]}}}}\{ce {HA- A^2- + H+}}:&K_{2}={frac {{ce {[A^{2-}][H+]}}}{{ce {[HA-]}}}}end{array}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/964f444d4c5ff73dc96c30e9eca7e742a64c7cbc" style="vertical-align: -4.419ex; margin-bottom: -0.252ex; width:39.616ex; height:10.509ex;"/>
K1 e K2 são exemplos de constantes de equilíbrio stepwise. A constante de equilíbrio global, βD, é o produto das constantes graduais.
- <math alttext="{displaystyle {ce {{H2A}{A^{2-}}+{2H+}}}}" xmlns="http://www.w3.org/1998/Math/MathML">H. H. H.2A↽ ↽ - Sim. - Sim. - Sim. - Sim. ⇀ ⇀ A2- Sim. - Sim. +2H. H. H.+({H2A}{A^{2-}}+{2H+}}}}<img alt="{displaystyle {ce {{H2A}{A^{2-}}+{2H+}}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/a482f908f1eb2a0713600eb64da4a43ec0d0ead8" style="vertical-align: -1.005ex; width:21.295ex; height:3.343ex;"/>:β β D= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Não.A2- Sim. - Sim. ]Não.H. H. H.+]2Não.H. H. H.2A]= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =KK1KK2{displaystyle beta _{{ce Não. ([A^{2-}][H^+]^2}}}{{ce {[H_2A]}}=K_{1}K_{2}}
Observe que essas constantes são constantes de dissociação porque os produtos no lado direito da expressão de equilíbrio são produtos de dissociação. Em muitos sistemas, é preferível usar constantes de associação.
- <math alttext="{displaystyle {begin{array}{ll}{ce {A^2- + H+ HA-}}:&beta _{1}={frac {{ce {[HA^-]}}}{{ce {[A^{2-}][H+]}}}}\{ce {A^2- + 2H+ H2A}}:&beta _{2}={frac {{ce {[H2A]}}}{{ce {[A^{2-}][H+]^2}}}}end{array}}}" xmlns="http://www.w3.org/1998/Math/MathML">A2- Sim. - Sim. +H. H. H.+↽ ↽ - Sim. - Sim. - Sim. - Sim. ⇀ ⇀ HAIA- Sim. - Sim. :β β 1= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Não.HAIA- Sim. - Sim. ]Não.A2- Sim. - Sim. ]Não.H. H. H.+]A2- Sim. - Sim. +2H. H. H.+↽ ↽ - Sim. - Sim. - Sim. - Sim. ⇀ ⇀ H. H. H.2A:β β 2= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Não.H. H. H.2A]Não.A2- Sim. - Sim. ]Não.H. H. H.+]2Não. {A^2- + H+ HA-}}:&beta - Sim. {{ce {[HA^]}}}{{ce {[A^{2-}][ H+]}}\{ce {A^2- + 2H+ H2A}}:&beta _{2}={frac {{ce {[H2A]}}}{{ce {[A^{2-}][H+]^2}}end{array}}}}}<img alt="{displaystyle {begin{array}{ll}{ce {A^2- + H+ HA-}}:&beta _{1}={frac {{ce {[HA^-]}}}{{ce {[A^{2-}][H+]}}}}\{ce {A^2- + 2H+ H2A}}:&beta _{2}={frac {{ce {[H2A]}}}{{ce {[A^{2-}][H+]^2}}}}end{array}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/266ddb8f43fb05b0d3a3195274e597a4fd3d6f37" style="vertical-align: -4.838ex; width:40.164ex; height:10.843ex;"/>
β1 e β2 são exemplos de constantes de associação. Claramente β1 = 1/K2 e β2 = 1/βD ; log β1 = pK2 e log β2 = pK2 + pK1 Para sistemas de equilíbrio múltiplo, veja também: teoria das reações de resposta.
Efeito da temperatura
O efeito da mudança de temperatura em uma constante de equilíbrio é dado pela equação de van 't Hoff
- DI KKDT= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =? ? H. H. H.m⊖ ⊖ RT2(em inglês) - Não. Não. Não. }}{RT^{2}}
Assim, para reações exotérmicas (ΔH é negativo), K diminui com o aumento da temperatura, mas, para reações endotérmicas, (ΔH é positivo) K aumenta com o aumento da temperatura. Uma formulação alternativa é
- DI KKD(T- Sim. - Sim. 1)= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =- Sim. - Sim. ? ? H. H. H.m⊖ ⊖ R(em inglês) K}{d(T^{-1})}}=-{frac Não. Não.)
À primeira vista, isso parece oferecer um meio de obter a entalpia molar padrão da reação, estudando a variação de K com a temperatura. Na prática, porém, o método não é confiável porque a propagação de erros quase sempre gera erros muito grandes nos valores calculados dessa maneira.
Efeito de campos elétricos e magnéticos
O efeito do campo elétrico no equilíbrio foi estudado por Manfred Eigen, entre outros.
Tipos de equilíbrio
- N2 (g)2 (adsorvido)
- N2 (adsorvido) 2 N (adsorvido)
- H. H. H.2 (g)2 (adsorvido)
- H. H. H.2 (adsorvido) 2 H (adsorvido)
- N (adsorbed) + 3 H (adsorbed) Servidor NH3 (adsorvido)
- NH3 (adsorvido)3 (g)
O equilíbrio pode ser amplamente classificado como equilíbrio heterogêneo e homogêneo. O equilíbrio homogêneo consiste em reagentes e produtos pertencentes à mesma fase, enquanto o equilíbrio heterogêneo ocorre para reagentes e produtos em fases diferentes.
- Na fase de gás: motores de foguete
- A síntese industrial como a amônia no processo Haber-Bosch (direito desprezado) ocorre através de uma sucessão de etapas de equilíbrio, incluindo processos de adsorção
- Química atmosférica
- Água do mar e outras águas naturais: oceanografia química
- Distribuição entre duas fases
- coeficiente de distribuição de log D: importante para os produtos farmacêuticos onde a lipoficiência é uma propriedade significativa de uma droga
- Extração líquida-líquida, troca de iões, cromatografia
- Produto de Solubilidade
- Captura e liberação de oxigênio por hemoglobina no sangue
- Equilíbrio ácido-base: constante de dissociação ácido, hidrólise, soluções de buffer, indicadores, homeostase ácido-base
- Complexação de metal-ligand: agentes sequestradores, terapia de quilatação, reagentes de contraste de RM, equilíbrio de Schlenk
- Formação do produto: química hospedeiro-convidado, química supramolecular, reconhecimento molecular, tetroxide dinitrogênio
- Em certas reações oscilantes, a aproximação ao equilíbrio não é assintoticamente, mas na forma de uma oscilação amortizada.
- A equação Nernst relacionada na eletroquímica dá a diferença no potencial do eletrodo como uma função de concentrações redox.
- Quando as moléculas de cada lado do equilíbrio são capazes de reagir irreversivelmente em reações secundárias, a relação final do produto é determinada de acordo com o princípio Curtin-Hammett.
Nessas aplicações, termos como constante de estabilidade, constante de formação, constante de ligação, constante de afinidade, constante de associação e constante de dissociação são usados. Em bioquímica, é comum dar unidades para constantes de ligação, que servem para definir as unidades de concentração usadas quando o valor da constante foi determinado.
Composição de uma mistura
Quando o único equilíbrio é o da formação de um aduto 1:1 como composição de uma mistura, há muitas maneiras de calcular a composição de uma mistura. Por exemplo, veja a tabela ICE para um método tradicional de cálculo do pH de uma solução de um ácido fraco.
Existem três abordagens para o cálculo geral da composição de uma mistura em equilíbrio.
- A abordagem mais básica é manipular as várias constantes de equilíbrio até que as concentrações desejadas sejam expressas em termos de constantes de equilíbrio medidas (equivalentes à medição de potenciais químicos) e condições iniciais.
- Minimize a energia de Gibbs do sistema.
- Satisfazer a equação do equilíbrio de massa. As equações do equilíbrio de massa são simplesmente declarações que demonstram que a concentração total de cada reagente deve ser constante pela lei da conservação da massa.
Equações de balanço de massa
Em geral, os cálculos são bastante complicados ou complexos. Por exemplo, no caso de um ácido dibásico, H2A dissolvido em água, os dois reagentes podem ser especificados como a base conjugada, A2−, e o próton, H+. As seguintes equações de balanço de massa podem ser aplicadas igualmente bem a uma base como o 1,2-diaminoetano, caso em que a própria base é designada como o reagente A:
- TA= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Não.A]+Não.H. H. H.A]+Não.H. H. H.2A]- Não. {A} }=mathrm {[A]+[HA]+[H_{2}A} ,}
- TH. H. H.= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Não.H. H. H.]+Não.H. H. H.A]+2Não.H. H. H.2A]- Sim. - Sim. Não.OH. H. H.]- Não. {H} }=mathrm {[H]+[HA]+2[H_{2}A]-[OH]} ,}
com TA a concentração total da espécie A. Observe que é comum omitir as cargas iônicas ao escrever e usar essas equações.
Quando as constantes de equilíbrio são conhecidas e as concentrações totais são especificadas, há duas equações em duas "concentrações livres" [A] e [H]. Isso decorre do fato de que [HA] = β1[A][H], [H2A] = β 2[A][H]2 e [OH] = Kw[H] -1
- TA= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Não.A]+β β 1Não.A]Não.H. H. H.]+β β 2Não.A]Não.H. H. H.]2Não. {A} }=mathrm {[A]} +beta _{1}mathrm {[A][H]} +beta _{2}mathrm {[A][H]} ^{2},}
- TH. H. H.= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Não.H. H. H.]+β β 1Não.A]Não.H. H. H.]+2β β 2Não.A]Não.H. H. H.]2- Sim. - Sim. KKO quê?Não.H. H. H.]- Sim. - Sim. 1Não. {H} }=mathrm {[H]} +beta _{1}mathrm {[A][H]} +2beta _{2}mathrm {[A][H]} ^{2}-K_{w}[mathrm {H} ]^{-1},}
então as concentrações dos "complexos" são calculados a partir das concentrações livres e das constantes de equilíbrio. As expressões gerais aplicáveis a todos os sistemas com dois reagentes, A e B, seriam
- TA= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Não.A]+Gerenciamento Gerenciamento Eu...pEu...β β Eu...Não.A]pEu...Não.B]qEu...- Não. - Sim. _{i}p_{i}beta _{i}[mathrm {A} ]^{p_{i}}[mathrm (B)^{q_{i}}}
- TB= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Não.B]+Gerenciamento Gerenciamento Eu...qEu...β β Eu...Não.A]pEu...Não.B]qEu...- Não. Não, não. _{i}q_{i}beta _{i}[mathrm {A} ]^{p_{i}}[mathrm (B)^{q_{i}}}
É fácil ver como isso pode ser estendido para três ou mais reagentes.
Ácidos polibásicos
A composição de soluções contendo os reagentes A e H é fácil de calcular em função de p[H]. Quando [H] é conhecido, a concentração livre [A] é calculada a partir da equação de balanço de massa em A.
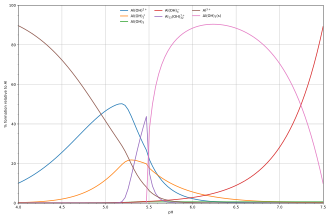
O diagrama ao lado mostra um exemplo da hidrólise do alumínio Ácido de Lewis Al3+(aq) mostra as concentrações de espécies para um 5 × 10 −6 M solução de um sal de alumínio em função do pH. Cada concentração é mostrada como uma porcentagem do alumínio total.
Solução e precipitação
O diagrama acima ilustra o ponto em que um precipitado que não é uma das espécies principais no equilíbrio da solução pode ser formado. Em pH logo abaixo de 5,5, as principais espécies presentes em uma solução de 5 μM de Al3+ são os hidróxidos de alumínio Al(OH)2+, AlOH+2 e Al13(OH)7+32, mas ao aumentar o pH Al(OH)3 precipita da solução. Isso ocorre porque Al(OH)3 tem uma energia de rede muito grande. À medida que o pH aumenta cada vez mais Al(OH)3 sai da solução. Este é um exemplo do princípio de Le Châtelier em ação: aumentar a concentração do íon hidróxido faz com que mais hidróxido de alumínio precipite, o que remove o hidróxido da solução. Quando a concentração de hidróxido se torna suficientemente alta, o aluminato solúvel, Al(OH)−4, é formado.
Outro caso comum em que ocorre precipitação é quando um cátion metálico interage com um ligante aniônico para formar um complexo eletricamente neutro. Se o complexo for hidrofóbico, precipitará da água. Isso ocorre com o íon níquel Ni2+ e dimetilglioxima, (dmgH2): neste caso, a energia de rede do sólido não é particularmente grande, mas excede em muito a energia de solvatação da molécula Ni(dmgH)2.
Minimização da energia de Gibbs
No equilíbrio, a uma temperatura e pressão especificadas e sem forças externas, a energia livre de Gibbs G é mínima:
- DG= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Gerenciamento Gerenciamento JJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1mμ μ JJDNJJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =0Não. DG = _{j=1}^{m}mu _{j},dN_{j}=0}
onde μj é o potencial químico da espécie molecular j e Nj é a quantidade de espécie molecular j. Pode ser expresso em termos de atividade termodinâmica como:
- μ μ JJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =μ μ JJ⊖ ⊖ +RTI AJJ{displaystyle mu _{j}=mu _{j}^{ominus }+RTln {A_{j}}}
Onde? μ μ JJ⊖ ⊖ {displaystyle mu _{j}^{ominus }} é o potencial químico no estado padrão, R é a constante do gás T é a temperatura absoluta, e AJJ é a atividade.
Para um sistema fechado, nenhuma partícula pode entrar ou sair, embora elas possam se combinar de várias maneiras. O número total de átomos de cada elemento permanecerá constante. Isso significa que a minimização acima deve estar sujeita às restrições:
- Gerenciamento Gerenciamento JJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1mumEu...JJNJJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =b)Eu...0{displaystyle sum _{j=1}^{m}a_{ij}N_{j}=b_{i}^{0}}
onde aij é o número de átomos do elemento i na molécula j e b 0
i é o número total de átomos do elemento i, que é uma constante, pois o sistema está fechado. Se houver um total de k tipos de átomos no sistema, então haverá k tais equações. Se houver íons envolvidos, uma linha adicional é adicionada à matriz aij especificando a respectiva carga em cada molécula que somará zero.
Este é um problema padrão em otimização, conhecido como minimização restrita. O método mais comum de resolvê-lo é usar o método dos multiplicadores de Lagrange (embora outros métodos possam ser usados).
Definir:
- G= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =G+Gerenciamento Gerenciamento Eu...= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1kλ λ Eu...(Gerenciamento Gerenciamento JJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1mumEu...JJNJJ- Sim. - Sim. b)Eu...0)= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =0{displaystyle {mathcal {G}}=G+sum _{i=1}^{k}lambda _{i}left(sum _{j=1}^{m}a_{ij}N_{j}-b_{i}^{0}right)=0}
onde os λi são os multiplicadores de Lagrange, um para cada elemento. Isso permite que cada um dos Nj e λj sejam tratados independentemente e podem ser mostrados usando o ferramentas de cálculo multivariado que a condição de equilíbrio é dada por
- 0= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =∂ ∂ G∂ ∂ NJJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =μ μ JJ+Gerenciamento Gerenciamento Eu...= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1kλ λ Eu...umEu...JJNão. O quê? - Sim. {G}}} N_{j}}}=mu _{j}+sum _{i=1}^{k}lambda _{i}a_{ij}}
- 0= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =∂ ∂ G∂ ∂ λ λ Eu...= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Gerenciamento Gerenciamento JJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1mumEu...JJNJJ- Sim. - Sim. b)Eu...0Não. O quê? - Sim. {G}}} lambda parcial _{i}}}=sum _{j=1}^{m}a_{ij}N_{j}-b_{i}^{0}}
(Para prova, veja multiplicadores de Lagrange.) Este é um conjunto de (m + k) equações em (m + k) desconhecidos (o Nj e o λi) e podem, portanto, ser resolvido para as concentrações de equilíbrio Nj, desde que as atividades químicas sejam conhecidas como funções das concentrações na temperatura e pressão dadas. (No caso ideal, as atividades são proporcionais às concentrações.) (Consulte Bancos de dados termodinâmicos para substâncias puras.) Observe que a segunda equação é apenas as restrições iniciais para minimização.
Este método de cálculo de concentrações químicas de equilíbrio é útil para sistemas com um grande número de moléculas diferentes. O uso de equações de conservação de elementos atômicos k para a restrição de massa é direto e substitui o uso das equações de coeficiente estequiométrico. Os resultados são consistentes com aqueles especificados pelas equações químicas. Por exemplo, se o equilíbrio é especificado por uma única equação química:,
- Gerenciamento Gerenciamento JJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =0mProcesso Processo JJRJJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =0{displaystyle sum _{j=0}^{m}nu _{j}R_{j}=0}
onde νj é o coeficiente estequiométrico para a molécula j (negativo para reagentes, positivo para produtos) e Rj é o símbolo para a molécula j, uma equação devidamente balanceada obedecerá:
- Gerenciamento Gerenciamento JJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1mumEu...JJProcesso Processo JJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =0{displaystyle sum _{j=1}^{m}a_{ij}nu _{j}=0}
Multiplicando a primeira condição de equilíbrio por νj e usando a equação acima, obtém-se:
- 0= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Gerenciamento Gerenciamento JJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1mProcesso Processo JJμ μ JJ+Gerenciamento Gerenciamento JJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1mGerenciamento Gerenciamento Eu...= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1kProcesso Processo JJλ λ Eu...umEu...JJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Gerenciamento Gerenciamento JJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1mProcesso Processo JJμ μ JJ{displaystyle 0=sum _{j=1}^{m}nu _{j}mu _{j}+sum _{j=1}^{m}sum _{i=1}^{k}nu _{j}lambda _{i}a_{ij}=sum _{j=1}^{m}nu _{j}mu _{j}}
Como acima, definindo ΔG
- ? ? G= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Gerenciamento Gerenciamento JJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1mProcesso Processo JJμ μ JJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =Gerenciamento Gerenciamento JJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1mProcesso Processo JJ(μ μ JJ⊖ ⊖ +RTI ((RJJ?))= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =? ? G⊖ ⊖ +RTI (? ? JJ= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =1m(RJJ?Processo Processo JJ)= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =? ? G⊖ ⊖ +RTI (KKc)Não. Delta G=sum _{j=1}^{m}nu _{j}mu _{j}=sum _{j=1}^{m}nu _{j}(mu _{j}^{ominus }+RTln({R_{j}})=Delta G^{ominus }+RTln left(prod _{j=1}^{m}{R_{j}}^{nu _{j}}right)= Delta G^{ominus }+RTln(K_{c})}
onde Kc é a constante de equilíbrio e ΔG será zero no equilíbrio.
Existem procedimentos análogos para a minimização de outros potenciais termodinâmicos.
Contenido relacionado
Fulereno
Química do ácido ascórbico
Elemento químico





![{displaystyle K_{ce {c}}={frac {[{ce {S}}]^{sigma }[{ce {T}}]^{tau }}{[{ce {A}}]^{alpha }[{ce {B}}]^{beta }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c2ac61ea07e9614e7c3e261d737d856396c1b178)















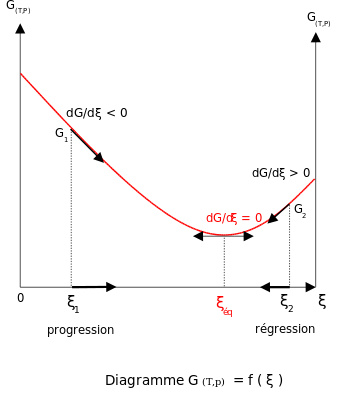




![{displaystyle K={frac {[mathrm {S} ]^{sigma }[mathrm {T} ]^{tau }...}{[mathrm {A} ]^{alpha }[mathrm {B} ]^{beta }...}}times {frac {{gamma _{mathrm {S} }}^{sigma }{gamma _{mathrm {T} }}^{tau }...}{{gamma _{mathrm {A} }}^{alpha }{gamma _{mathrm {B} }}^{beta }...}}=K_{mathrm {c} }Gamma }](https://wikimedia.org/api/rest_v1/media/math/render/svg/160fbc88403a037161d2c9a44d10cd44746215e8)



![{displaystyle K_{mathrm {c} }={frac {mathrm {[{CH_{3}CO_{2}}^{-}][{H_{3}O}^{+}]} }{mathrm {[{CH_{3}CO_{2}H}][{H_{2}O}]} }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/53b93bf6dae8354f02ab3e935fca63b9bd4a16c4)
![{displaystyle K={frac {mathrm {[{CH_{3}CO_{2}}^{-}][{H_{3}O}^{+}]} }{mathrm {[{CH_{3}CO_{2}H}]} }}=K_{mathrm {c} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/472d349477dcf83e95cb3c3423e8ba247ff1d23a)
![{displaystyle K_{mathrm {w} }=mathrm {[H^{+}][OH^{-}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/02e72380cadad70b38e1a6f42ce8b217618bc11f)
![{displaystyle K_{mathrm {c} }={frac {mathrm {[CO_{2}]} }{mathrm {[CO]^{2}} }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/df7ff1e7f45707791cfd9dd8e697fe5695e94f60)
![{displaystyle beta _{{ce {D}}}={frac {{ce {[A^{2-}][H^+]^2}}}{{ce {[H_2A]}}}}=K_{1}K_{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c204101410770f2cc038f6d29c1a7a0da1d363a1)


![{displaystyle T_{mathrm {A} }=mathrm {[A]+[HA]+[H_{2}A]} ,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b4caf4ff0552bd0430f4b305b3b92c05aef15aa2)
![{displaystyle T_{mathrm {H} }=mathrm {[H]+[HA]+2[H_{2}A]-[OH]} ,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/094ecf5d3e87ba5a02d744835486f24086804cfc)
![{displaystyle T_{mathrm {A} }=mathrm {[A]} +beta _{1}mathrm {[A][H]} +beta _{2}mathrm {[A][H]} ^{2},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6ae376d767bfb698f8d771a8aa374366c647255)
![{displaystyle T_{mathrm {H} }=mathrm {[H]} +beta _{1}mathrm {[A][H]} +2beta _{2}mathrm {[A][H]} ^{2}-K_{w}[mathrm {H} ]^{-1},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/25502da2d24e51d7cb6c53782a5392673c4b0819)
![{displaystyle T_{mathrm {A} }=[mathrm {A} ]+sum _{i}p_{i}beta _{i}[mathrm {A} ]^{p_{i}}[mathrm {B} ]^{q_{i}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/de4c20306740d1b3f30387f17ac264b500d313b8)
![{displaystyle T_{mathrm {B} }=[mathrm {B} ]+sum _{i}q_{i}beta _{i}[mathrm {A} ]^{p_{i}}[mathrm {B} ]^{q_{i}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4c9dea321370bf3d5b01364cfed9dbe3c941ce31)