Engenharia genética
Engenharia genética, também chamada de modificação genética ou manipulação genética, é a modificação e manipulação dos genes de um organismo usando tecnologia. É um conjunto de tecnologias usadas para mudar a composição genética das células, incluindo a transferência de genes dentro e através das fronteiras das espécies para produzir organismos novos ou melhorados. O novo DNA é obtido isolando e copiando o material genético de interesse usando métodos de DNA recombinante ou sintetizando artificialmente o DNA. Uma construção geralmente é criada e usada para inserir esse DNA no organismo hospedeiro. A primeira molécula de DNA recombinante foi feita por Paul Berg em 1972, combinando o DNA do vírus de macaco SV40 com o vírus lambda. Além de inserir genes, o processo pode ser usado para remover ou "nocautear" genes. O novo DNA pode ser inserido aleatoriamente ou direcionado para uma parte específica do genoma.
Um organismo gerado por engenharia genética é considerado geneticamente modificado (GM) e a entidade resultante é um organismo geneticamente modificado (OGM). O primeiro OGM foi uma bactéria gerada por Herbert Boyer e Stanley Cohen em 1973. Rudolf Jaenisch criou o primeiro animal GM quando inseriu DNA estranho em um camundongo em 1974. A primeira empresa a se concentrar em engenharia genética, a Genentech, foi fundada em 1976 e iniciou a produção de proteínas humanas. A insulina humana geneticamente modificada foi produzida em 1978 e as bactérias produtoras de insulina foram comercializadas em 1982. Alimentos geneticamente modificados são vendidos desde 1994, com o lançamento do tomate Flavr Savr. O Flavr Savr foi projetado para ter uma vida útil mais longa, mas a maioria das culturas GM atuais são modificadas para aumentar a resistência a insetos e herbicidas. O GloFish, o primeiro OGM projetado como animal de estimação, foi vendido nos Estados Unidos em dezembro de 2003. Em 2016, o salmão modificado com hormônio de crescimento foi vendido.
A engenharia genética tem sido aplicada em vários campos, incluindo pesquisa, medicina, biotecnologia industrial e agricultura. Na pesquisa, os OGMs são usados para estudar a função e expressão de genes por meio de experimentos de perda de função, ganho de função, rastreamento e expressão. Ao eliminar genes responsáveis por certas condições, é possível criar organismos-modelo animal de doenças humanas. Além de produzir hormônios, vacinas e outros medicamentos, a engenharia genética tem o potencial de curar doenças genéticas por meio da terapia gênica. As mesmas técnicas usadas para produzir medicamentos também podem ter aplicações industriais, como a produção de enzimas para sabão em pó, queijos e outros produtos.
O surgimento de culturas geneticamente modificadas comercializadas forneceu benefícios econômicos aos agricultores em muitos países diferentes, mas também tem sido a fonte da maior parte da controvérsia em torno da tecnologia. Isso está presente desde seu uso inicial; os primeiros testes de campo foram destruídos por ativistas anti-GM. Embora haja um consenso científico de que os alimentos atualmente disponíveis derivados de culturas transgênicas não representam maior risco à saúde humana do que os alimentos convencionais, os críticos consideram a segurança dos alimentos transgênicos uma das principais preocupações. O fluxo gênico, o impacto em organismos não-alvo, o controle do suprimento de alimentos e os direitos de propriedade intelectual também foram levantados como possíveis problemas. Essas preocupações levaram ao desenvolvimento de uma estrutura regulatória, que começou em 1975. Isso levou a um tratado internacional, o Protocolo de Cartagena sobre Biossegurança, que foi adotado em 2000. Cada país desenvolveu seus próprios sistemas regulatórios sobre OGMs, com o diferenças mais marcantes que ocorrem entre os EUA e a Europa.
Engenharia genética: Processo de inserção de novas informações genéticas em células existentes, a fim de modificar um organismo específico com o propósito de mudar suas características.
Nota: Adaptado do ref.
Visão geral
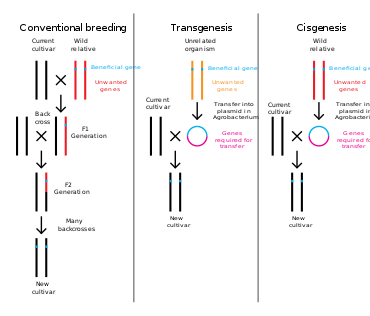
A engenharia genética é um processo que altera a estrutura genética de um organismo, removendo ou introduzindo DNA, ou modificando o material genético existente in situ. Ao contrário da criação tradicional de animais e plantas, que envolve fazer múltiplos cruzamentos e depois selecionar o organismo com o fenótipo desejado, a engenharia genética pega o gene diretamente de um organismo e o entrega ao outro. Isso é muito mais rápido, pode ser usado para inserir quaisquer genes de qualquer organismo (mesmo aqueles de domínios diferentes) e evita que outros genes indesejáveis também sejam adicionados.
A engenharia genética poderia corrigir distúrbios genéticos graves em humanos, substituindo o gene defeituoso por um funcional. É uma importante ferramenta de pesquisa que permite estudar a função de genes específicos. Drogas, vacinas e outros produtos foram colhidos de organismos modificados para produzi-los. Foram desenvolvidas culturas que ajudam na segurança alimentar, aumentando o rendimento, o valor nutricional e a tolerância a estresses ambientais.
O DNA pode ser introduzido diretamente no organismo hospedeiro ou em uma célula que é então fundida ou hibridizada com o hospedeiro. Isso se baseia em técnicas de ácidos nucleicos recombinantes para formar novas combinações de material genético hereditário, seguidas pela incorporação desse material indiretamente por meio de um sistema vetorial ou diretamente por meio de microinjeção, macroinjeção ou microencapsulamento.
A engenharia genética normalmente não inclui reprodução tradicional, fertilização in vitro, indução de poliploidia, mutagênese e técnicas de fusão celular que não usam ácidos nucleicos recombinantes ou um organismo geneticamente modificado no processo. No entanto, algumas definições amplas de engenharia genética incluem reprodução seletiva. A clonagem e a pesquisa com células-tronco, embora não sejam consideradas engenharia genética, estão intimamente relacionadas e a engenharia genética pode ser usada dentro delas. A biologia sintética é uma disciplina emergente que leva a engenharia genética um passo adiante, introduzindo material sintetizado artificialmente em um organismo.
Plantas, animais ou microorganismos que foram alterados por meio de engenharia genética são denominados organismos geneticamente modificados ou OGMs. Se o material genético de outra espécie for adicionado ao hospedeiro, o organismo resultante é chamado de transgênico. Se for usado material genético da mesma espécie ou de uma espécie que pode se reproduzir naturalmente com o hospedeiro, o organismo resultante é chamado de cisgênico. Se a engenharia genética for usada para remover o material genético do organismo alvo, o organismo resultante é chamado de organismo nocaute. Na Europa, a modificação genética é sinônimo de engenharia genética, enquanto nos Estados Unidos da América e no Canadá a modificação genética também pode ser usada para se referir a métodos de reprodução mais convencionais.
História
Os humanos alteraram os genomas das espécies por milhares de anos por meio de reprodução seletiva ou seleção artificial em contraste com a seleção natural. Mais recentemente, a criação de mutações usou a exposição a produtos químicos ou radiação para produzir uma alta frequência de mutações aleatórias, para fins de reprodução seletiva. A engenharia genética como a manipulação direta do DNA por humanos fora da reprodução e das mutações só existe desde a década de 1970. O termo "engenharia genética" foi cunhado pela primeira vez por Jack Williamson em seu romance de ficção científica Dragon's Island, publicado em 1951 - um ano antes do papel do DNA na hereditariedade ser confirmado por Alfred Hershey e Martha Chase, e dois anos antes de James Watson e Francis Crick mostrarem que a molécula de DNA tem uma estrutura de dupla hélice – embora o conceito geral de manipulação genética direta tenha sido explorado de forma rudimentar na história de ficção científica de 1936 de Stanley G. Weinbaum Proteus Ilha.
Em 1972, Paul Berg criou as primeiras moléculas de DNA recombinante combinando o DNA do vírus de macaco SV40 com o do vírus lambda. Em 1973, Herbert Boyer e Stanley Cohen criaram o primeiro organismo transgênico inserindo genes de resistência a antibióticos no plasmídeo de uma bactéria Escherichia coli. Um ano depois, Rudolf Jaenisch criou um camundongo transgênico introduzindo DNA estranho em seu embrião, tornando-o o primeiro animal transgênico do mundo. na Conferência de Asilomar em 1975. Uma das principais recomendações dessa reunião foi que a supervisão governamental da pesquisa de DNA recombinante deveria ser estabelecida até que a tecnologia fosse considerada segura.
Em 1976, a Genentech, a primeira empresa de engenharia genética, foi fundada por Herbert Boyer e Robert Swanson e um ano depois a empresa produziu uma proteína humana (somatostatina) em E. coli. A Genentech anunciou a produção de insulina humana geneticamente modificada em 1978. Em 1980, a Suprema Corte dos EUA no caso Diamond v. Chakrabarty decidiu que a vida geneticamente alterada poderia ser patenteada. A insulina produzida por bactérias foi aprovada para liberação pela Food and Drug Administration (FDA) em 1982.
Em 1983, uma empresa de biotecnologia, a Advanced Genetic Sciences (AGS) solicitou autorização do governo dos EUA para realizar testes de campo com a cepa sem gelo de Pseudomonas syringae para proteger as plantações da geada, mas grupos ambientais e os manifestantes atrasaram os testes de campo por quatro anos com contestações legais. Em 1987, a cepa gelo-menos de P. syringae tornou-se o primeiro organismo geneticamente modificado (OGM) a ser liberado no meio ambiente quando um campo de morango e um campo de batata na Califórnia foram pulverizados com ele. Ambos os campos de teste foram atacados por grupos ativistas na noite anterior aos testes: "O primeiro local de teste do mundo atraiu o primeiro lixo de campo do mundo".
Os primeiros testes de campo de plantas geneticamente modificadas ocorreram na França e nos Estados Unidos em 1986, plantas de tabaco foram projetadas para serem resistentes a herbicidas. A República Popular da China foi o primeiro país a comercializar plantas transgênicas, introduzindo um tabaco resistente a vírus em 1992. Em 1994, a Calgene obteve aprovação para lançar comercialmente o primeiro alimento geneticamente modificado, o Flavr Savr, um tomate modificado para ter uma vida útil mais longa. Em 1994, a União Européia aprovou o tabaco modificado para ser resistente ao herbicida bromoxinil, tornando-se a primeira cultura geneticamente modificada comercializada na Europa. Em 1995, a batata Bt foi aprovada como segura pela Agência de Proteção Ambiental, depois de ter sido aprovada pelo FDA, tornando-se a primeira cultura produtora de pesticidas a ser aprovada nos EUA. Em 2009, 11 culturas transgênicas foram cultivadas comercialmente em 25 países, sendo que os maiores em área cultivada foram os Estados Unidos, Brasil, Argentina, Índia, Canadá, China, Paraguai e África do Sul.
Em 2010, cientistas do J. Craig Venter Institute criaram o primeiro genoma sintético e o inseriram em uma célula bacteriana vazia. A bactéria resultante, batizada de Mycoplasma laboratorium, poderia se replicar e produzir proteínas. Quatro anos depois, isso deu um passo adiante quando foi desenvolvida uma bactéria que replicava um plasmídeo contendo um par de bases único, criando o primeiro organismo modificado para usar um alfabeto genético expandido. Em 2012, Jennifer Doudna e Emmanuelle Charpentier colaboraram para desenvolver o sistema CRISPR/Cas9, uma técnica que pode ser usada para alterar fácil e especificamente o genoma de quase qualquer organismo.
Processo
A criação de um OGM é um processo de várias etapas. Os engenheiros genéticos devem primeiro escolher qual gene desejam inserir no organismo. Isso é impulsionado por qual é o objetivo do organismo resultante e é construído em pesquisas anteriores. As telas genéticas podem ser realizadas para determinar os genes potenciais e outros testes, em seguida, usados para identificar os melhores candidatos. O desenvolvimento de microarrays, transcriptômica e sequenciamento do genoma tornou muito mais fácil encontrar genes adequados. A sorte também desempenha seu papel; o gene Roundup Ready foi descoberto depois que os cientistas notaram uma bactéria prosperando na presença do herbicida.
Isolamento e clonagem de genes
O próximo passo é isolar o gene candidato. A célula que contém o gene é aberta e o DNA é purificado. O gene é separado usando enzimas de restrição para cortar o DNA em fragmentos ou reação em cadeia da polimerase (PCR) para amplificar o segmento do gene. Esses segmentos podem então ser extraídos por meio de eletroforese em gel. Se o gene escolhido ou o genoma do organismo doador tiver sido bem estudado, pode já estar acessível a partir de uma biblioteca genética. Se a sequência de DNA for conhecida, mas nenhuma cópia do gene estiver disponível, ela também pode ser sintetizada artificialmente. Uma vez isolado, o gene é ligado a um plasmídeo que é então inserido em uma bactéria. O plasmídeo é replicado quando a bactéria se divide, garantindo que cópias ilimitadas do gene estejam disponíveis. O plasmídeo RK2 é notável por sua capacidade de se replicar em uma ampla variedade de organismos unicelulares, o que o torna adequado como uma ferramenta de engenharia genética.
Antes de o gene ser inserido no organismo alvo, ele deve ser combinado com outros elementos genéticos. Estes incluem um promotor e uma região terminadora, que iniciam e terminam a transcrição. Um gene marcador selecionável é adicionado, o que na maioria dos casos confere resistência a antibióticos, para que os pesquisadores possam determinar facilmente quais células foram transformadas com sucesso. O gene também pode ser modificado nesta fase para melhor expressão ou eficácia. Essas manipulações são realizadas usando técnicas de DNA recombinante, como digestões de restrição, ligações e clonagem molecular.
Inserção de DNA no genoma do hospedeiro
Existem várias técnicas usadas para inserir material genético no genoma do hospedeiro. Algumas bactérias podem absorver naturalmente o DNA estranho. Essa capacidade pode ser induzida em outras bactérias por meio de estresse (por exemplo, choque térmico ou elétrico), o que aumenta a permeabilidade da membrana celular ao DNA; O DNA captado pode se integrar ao genoma ou existir como DNA extracromossômico. O DNA é geralmente inserido em células animais usando microinjeção, onde pode ser injetado através do envelope nuclear da célula diretamente no núcleo, ou através do uso de vetores virais.
Os genomas de plantas podem ser modificados por métodos físicos ou pelo uso de Agrobacterium para a entrega de sequências hospedadas em vetores binários de T-DNA. Em plantas, o DNA é frequentemente inserido usando transformação mediada por Agrobacterium, aproveitando a sequência de T-DNA do Agrobacterium que permite a inserção natural de material genético nas células vegetais. Outros métodos incluem a biolística, em que partículas de ouro ou tungstênio são revestidas com DNA e depois injetadas em células vegetais jovens, e a eletroporação, que envolve o uso de um choque elétrico para tornar a membrana celular permeável ao DNA plasmidial.
Como apenas uma única célula é transformada com material genético, o organismo deve ser regenerado a partir dessa única célula. Nas plantas, isso é feito por meio do uso de cultura de tecidos. Em animais é necessário garantir que o DNA inserido esteja presente nas células-tronco embrionárias. As bactérias consistem em uma única célula e se reproduzem clonalmente, portanto, a regeneração não é necessária. Marcadores selecionáveis são usados para diferenciar facilmente células transformadas de células não transformadas. Esses marcadores geralmente estão presentes no organismo transgênico, embora várias estratégias tenham sido desenvolvidas para remover o marcador selecionável da planta transgênica madura.
Mais testes usando PCR, hibridação Southern e sequenciamento de DNA são conduzidos para confirmar que um organismo contém o novo gene. Esses testes também podem confirmar a localização cromossômica e o número de cópias do gene inserido. A presença do gene não garante que ele será expresso em níveis adequados no tecido-alvo, por isso métodos que procuram e medem os produtos gênicos (RNA e proteína) também são usados. Estes incluem hibridação Northern, RT-PCR quantitativo, Western blot, imunofluorescência, ELISA e análise fenotípica.
O novo material genético pode ser inserido aleatoriamente no genoma do hospedeiro ou direcionado para um local específico. A técnica de direcionamento de genes usa recombinação homóloga para fazer as alterações desejadas em um gene endógeno específico. Isso tende a ocorrer com uma frequência relativamente baixa em plantas e animais e geralmente requer o uso de marcadores selecionáveis. A frequência de direcionamento de genes pode ser bastante aprimorada por meio da edição do genoma. A edição do genoma usa nucleases projetadas artificialmente que criam quebras específicas de fita dupla em locais desejados no genoma e usam os mecanismos endógenos da célula para reparar a quebra induzida pelos processos naturais de recombinação homóloga e junção de extremidade não homóloga. Existem quatro famílias de nucleases manipuladas: meganucleases, nucleases de dedo de zinco, nucleases efetoras do tipo ativador de transcrição (TALENs) e o sistema Cas9-guideRNA (adaptado de CRISPR). TALEN e CRISPR são os dois mais comumente usados e cada um tem suas próprias vantagens. Os TALENs têm maior especificidade de alvo, enquanto o CRISPR é mais fácil de projetar e mais eficiente. Além de melhorar o direcionamento de genes, as nucleases modificadas podem ser usadas para introduzir mutações em genes endógenos que geram um nocaute de gene.
Aplicativos
A engenharia genética tem aplicações na medicina, pesquisa, indústria e agricultura e pode ser usada em uma ampla gama de plantas, animais e microorganismos. As bactérias, os primeiros organismos a serem geneticamente modificados, podem ter DNA plasmidial inserido contendo novos genes que codificam medicamentos ou enzimas que processam alimentos e outros substratos. As plantas foram modificadas para proteção contra insetos, resistência a herbicidas, resistência a vírus, nutrição aprimorada, tolerância a pressões ambientais e produção de vacinas comestíveis. A maioria dos OGMs comercializados são plantas cultivadas resistentes a insetos ou tolerantes a herbicidas. Animais geneticamente modificados têm sido usados para pesquisa, animais modelo e produção de produtos agrícolas ou farmacêuticos. Os animais geneticamente modificados incluem animais com genes desativados, maior suscetibilidade a doenças, hormônios para crescimento extra e capacidade de expressar proteínas em seu leite.
Medicina
A engenharia genética tem muitas aplicações na medicina que incluem a fabricação de medicamentos, a criação de modelos animais que imitam as condições humanas e a terapia genética. Um dos primeiros usos da engenharia genética foi a produção em massa de insulina humana em bactérias. Esta aplicação já foi aplicada a hormônios de crescimento humano, hormônios folículo estimulantes (para tratamento de infertilidade), albumina humana, anticorpos monoclonais, fatores anti-hemofílicos, vacinas e muitas outras drogas. Hibridomas de camundongos, células fundidas para criar anticorpos monoclonais, foram adaptados por meio de engenharia genética para criar anticorpos monoclonais humanos. Estão sendo desenvolvidos vírus geneticamente modificados que ainda podem conferir imunidade, mas não possuem as sequências infecciosas.
A engenharia genética também é usada para criar modelos animais de doenças humanas. Camundongos geneticamente modificados são o modelo animal geneticamente modificado mais comum. Eles têm sido usados para estudar e modelar o câncer (oncomouse), obesidade, doenças cardíacas, diabetes, artrite, abuso de substâncias, ansiedade, envelhecimento e doença de Parkinson. Curas potenciais podem ser testadas contra esses modelos de camundongos.
A terapia genética é a engenharia genética de seres humanos, geralmente substituindo genes defeituosos por outros eficazes. A pesquisa clínica usando terapia genética somática foi realizada com várias doenças, incluindo SCID ligada ao cromossomo X, leucemia linfocítica crônica (CLL) e doença de Parkinson. Em 2012, o Alipogene tiparvovec tornou-se o primeiro tratamento de terapia genética a ser aprovado para uso clínico. Em 2015, um vírus foi usado para inserir um gene saudável nas células da pele de um menino que sofria de uma rara doença de pele, a epidermólise bolhosa, para crescer e, em seguida, enxertar pele saudável em 80% do corpo do menino, que foi acometido pela doença.
A terapia genética germinal resultaria em qualquer alteração hereditária, o que levantou preocupações na comunidade científica. Em 2015, o CRISPR foi usado para editar o DNA de embriões humanos não viáveis, levando cientistas das principais academias mundiais a pedir uma moratória nas edições hereditárias do genoma humano. Também há preocupações de que a tecnologia possa ser usada não apenas para tratamento, mas para aprimoramento, modificação ou alteração da saúde de um ser humano. aparência, adaptabilidade, inteligência, caráter ou comportamento. A distinção entre cura e melhoria também pode ser difícil de estabelecer. Em novembro de 2018, He Jiankui anunciou que havia editado os genomas de dois embriões humanos para tentar desativar o gene CCR5, que codifica um receptor que o HIV usa para entrar nas células. O trabalho foi amplamente condenado como antiético, perigoso e prematuro. Atualmente, a modificação da linhagem germinativa é proibida em 40 países. Os cientistas que fazem esse tipo de pesquisa geralmente deixam os embriões crescerem por alguns dias sem permitir que se transformem em um bebê.
Pesquisadores estão alterando o genoma de porcos para induzir o crescimento de órgãos humanos, com o objetivo de aumentar o sucesso do transplante de órgãos de porco para humano. Os cientistas estão criando "gene drives", alterando os genomas dos mosquitos para torná-los imunes à malária e, em seguida, procurando espalhar os mosquitos geneticamente modificados por toda a população de mosquitos na esperança de eliminar a doença.
Pesquisa
A engenharia genética é uma ferramenta importante para os cientistas naturais, sendo a criação de organismos transgênicos uma das ferramentas mais importantes para a análise da função gênica. Genes e outras informações genéticas de uma ampla gama de organismos podem ser inseridos em bactérias para armazenamento e modificação, criando bactérias geneticamente modificadas no processo. As bactérias são baratas, fáceis de crescer, clonais, multiplicam-se rapidamente, relativamente fáceis de transformar e podem ser armazenadas a -80 °C quase indefinidamente. Uma vez que um gene é isolado, ele pode ser armazenado dentro da bactéria, fornecendo um suprimento ilimitado para pesquisa.
Os organismos são geneticamente modificados para descobrir as funções de certos genes. Este pode ser o efeito no fenótipo do organismo, onde o gene é expresso ou com quais outros genes ele interage. Esses experimentos geralmente envolvem perda de função, ganho de função, rastreamento e expressão.
- Perda de experiências de função, como em um experimento de knockout gene, em que um organismo é projetado para faltar a atividade de um ou mais genes. Em um simples knockout uma cópia do gene desejado foi alterada para torná-lo não funcional. As células-tronco embrionárias incorporam o gene alterado, que substitui a cópia funcional já presente. Estas células-tronco são injetadas em blastocysts, que são implantadas em mães substitutos. Isso permite que o experimentador analise os defeitos causados por esta mutação e, assim, determine o papel de genes particulares. É usado especialmente frequentemente na biologia do desenvolvimento. Quando isso é feito criando uma biblioteca de genes com mutações de ponto em todas as posições na área de interesse, ou mesmo em todas as posições em todo o gene, isso é chamado de "motagênese escaldante". O método mais simples, e o primeiro a ser usado, é "alanina digitalização", onde cada posição por sua vez é mutada para a alanina de aminoácidos não reativa.
- Ganho de experimentos de função, a contraparte lógica de knockouts. Estas são às vezes realizadas em conjunto com experimentos de knockout para estabelecer mais finamente a função do gene desejado. O processo é muito o mesmo que na engenharia de knockout, exceto que o construto é projetado para aumentar a função do gene, geralmente fornecendo cópias extras do gene ou induzindo a síntese da proteína com mais frequência. O ganho de função é usado para dizer se uma proteína é ou não suficiente para uma função, mas nem sempre significa que é necessário, especialmente quando se trata de redundância genética ou funcional.
- Experiências de rastreamento, que buscam obter informações sobre a localização e interação da proteína desejada. Uma maneira de fazer isso é substituir o gene do tipo selvagem com um gene de "fusão", que é uma justaposição do gene do tipo selvagem com um elemento de relatório como a proteína fluorescente verde (GFP) que permitirá facilitar a visualização dos produtos da modificação genética. Embora esta seja uma técnica útil, a manipulação pode destruir a função do gene, criando efeitos secundários e possivelmente colocando em questão os resultados do experimento. Técnicas mais sofisticadas estão agora em desenvolvimento que podem rastrear produtos proteicos sem mitigar sua função, como a adição de pequenas sequências que servirão como motivos de ligação para anticorpos monoclonais.
- Estudos de expressão visa descobrir onde e quando as proteínas específicas são produzidas. Nestes experimentos, a sequência de DNA antes do DNA que codifica para uma proteína, conhecida como promotora de um gene, é reintroduzida em um organismo com a região de codificação de proteínas substituída por um gene de repórter, como GFP ou uma enzima que catalisa a produção de um corante. Assim, o tempo e o lugar onde uma proteína específica é produzida podem ser observados. Os estudos de expressão podem ser tomados um passo mais adiante alterando o promotor para encontrar quais peças são cruciais para a expressão adequada do gene e são realmente ligados por proteínas do fator de transcrição; este processo é conhecido como iscação promotor.
Industrial
Os organismos podem ter suas células transformadas com um gene que codifica uma proteína útil, como uma enzima, para que superexpressem a proteína desejada. Quantidades em massa da proteína podem então ser fabricadas cultivando o organismo transformado em equipamento de biorreator usando fermentação industrial e, em seguida, purificando a proteína. Alguns genes não funcionam bem em bactérias, então leveduras, células de insetos ou células de mamíferos também podem ser usadas. Essas técnicas são utilizadas para produzir medicamentos como insulina, hormônio do crescimento humano e vacinas, suplementos como o triptofano, auxiliar na produção de alimentos (quimosina na fabricação de queijos) e combustíveis. Outras aplicações com bactérias geneticamente modificadas podem envolver fazê-las executar tarefas fora de seu ciclo natural, como produzir biocombustíveis, limpar derramamentos de óleo, carbono e outros resíduos tóxicos e detectar arsênico na água potável. Certos micróbios geneticamente modificados também podem ser usados na biomineração e na biorremediação, devido à sua capacidade de extrair metais pesados de seu ambiente e incorporá-los em compostos mais facilmente recuperáveis.
Na ciência dos materiais, um vírus geneticamente modificado foi usado em um laboratório de pesquisa como um andaime para a montagem de uma bateria de íons de lítio mais ecológica. As bactérias também foram projetadas para funcionar como sensores, expressando uma proteína fluorescente sob certas condições ambientais.
Agricultura
Uma das aplicações mais conhecidas e controversas da engenharia genética é a criação e uso de culturas geneticamente modificadas ou gado geneticamente modificado para produzir alimentos geneticamente modificados. As culturas foram desenvolvidas para aumentar a produção, aumentar a tolerância a estresses abióticos, alterar a composição dos alimentos ou produzir novos produtos.
As primeiras culturas a serem lançadas comercialmente em larga escala ofereciam proteção contra pragas de insetos ou tolerância a herbicidas. Culturas resistentes a fungos e vírus também foram desenvolvidas ou estão em desenvolvimento. Isso facilita o manejo de insetos e ervas daninhas nas lavouras e pode aumentar indiretamente o rendimento das lavouras. As culturas GM que melhoram diretamente o rendimento acelerando o crescimento ou tornando a planta mais resistente (melhorando a tolerância ao sal, ao frio ou à seca) também estão em desenvolvimento. Em 2016, o salmão foi geneticamente modificado com hormônios de crescimento para atingir o tamanho adulto normal muito mais rápido.
Foram desenvolvidos OGM que modificam a qualidade dos produtos, aumentando o valor nutricional ou fornecendo qualidades ou quantidades mais úteis industrialmente. A batata Amflora produz uma mistura de amidos mais útil industrialmente. A soja e a canola foram geneticamente modificadas para produzir óleos mais saudáveis. O primeiro alimento GM comercializado foi um tomate que atrasou o amadurecimento, aumentando sua vida útil.
Plantas e animais foram projetados para produzir materiais que normalmente não fabricam. A Pharming usa plantações e animais como biorreatores para produzir vacinas, intermediários de drogas ou as próprias drogas; o produto útil é purificado da colheita e depois usado no processo de produção farmacêutica padrão. Vacas e cabras foram modificadas para expressar drogas e outras proteínas em seu leite e, em 2009, o FDA aprovou uma droga produzida em leite de cabra.
Outras aplicações
A engenharia genética tem aplicações potenciais na conservação e gestão de áreas naturais. A transferência de genes por meio de vetores virais foi proposta como um meio de controlar espécies invasoras, bem como vacinar a fauna ameaçada contra doenças. Árvores transgênicas têm sido sugeridas como forma de conferir resistência a patógenos em populações silvestres. Com os riscos crescentes de má adaptação em organismos como resultado da mudança climática e outras perturbações, a adaptação facilitada por meio de ajustes genéticos pode ser uma solução para reduzir os riscos de extinção. As aplicações da engenharia genética na conservação são, até agora, principalmente teóricas e ainda precisam ser colocadas em prática.
A engenharia genética também está sendo usada para criar arte microbiana. Algumas bactérias foram geneticamente modificadas para criar fotografias em preto e branco. Itens inovadores, como cravos cor de lavanda, rosas azuis e peixes brilhantes, também foram produzidos por meio de engenharia genética.
Regulamento
A regulamentação da engenharia genética diz respeito às abordagens adotadas pelos governos para avaliar e gerenciar os riscos associados ao desenvolvimento e liberação de OGMs. O desenvolvimento de uma estrutura regulatória começou em 1975, em Asilomar, Califórnia. A reunião da Asilomar recomendou um conjunto de diretrizes voluntárias sobre o uso da tecnologia recombinante. À medida que a tecnologia melhorou, os EUA estabeleceram um comitê no Escritório de Ciência e Tecnologia, que atribuiu a aprovação regulatória de alimentos GM ao USDA, FDA e EPA. O Protocolo de Cartagena sobre Biossegurança, um tratado internacional que rege a transferência, manuseio e uso de OGMs, foi adotado em 29 de janeiro de 2000. Cento e cinquenta e sete países são membros do Protocolo, e muitos o usam como ponto de referência para seus próprios regulamentos.
O status legal e regulamentar dos alimentos transgênicos varia de acordo com o país, com algumas nações proibindo ou restringindo-os, e outras permitindo-os com graus de regulamentação amplamente diferentes. Alguns países permitem a importação de alimentos transgênicos com autorização, mas não permitem seu cultivo (Rússia, Noruega, Israel) ou têm provisões para o cultivo mesmo que nenhum produto transgênico ainda seja produzido (Japão, Coreia do Sul). A maioria dos países que não permite o cultivo de OGM permite a pesquisa. Algumas das diferenças mais marcantes ocorrem entre os EUA e a Europa. A política dos Estados Unidos se concentra no produto (não no processo), analisa apenas os riscos cientificamente verificáveis e usa o conceito de equivalência substancial. A União Européia, por outro lado, tem possivelmente os regulamentos de OGM mais rigorosos do mundo. Todos os OGM, juntamente com os alimentos irradiados, são considerados "novos alimentos" e sujeito a avaliação alimentar extensa, caso a caso, com base científica pela Autoridade Europeia para a Segurança dos Alimentos. Os critérios para autorização se enquadram em quatro grandes categorias: "segurança", "liberdade de escolha", "rotulagem" e "rastreabilidade". O nível de regulamentação em outros países que cultivam OGMs situa-se entre a Europa e os Estados Unidos.
| Região | Reguladores | Notas |
|---|---|---|
| EUA | USDA, FDA e EPA | |
| Europa | Autoridade Europeia para a Segurança Alimentar | |
| Canadá | Saúde Canadá e Agência Canadense de Inspeção de Alimentos | Produtos regulados com novas características, independentemente do método de origem |
| África | Mercado Comum da África Oriental e Austral | A decisão final é de cada país. |
| China | Escritório de Engenharia Genética Agrícola Administração de Biossegurança | |
| Índia | Comité de Biossegurança Institucional, Comité de Revisão do Comité de Manipulação Genética e Engenharia Genética | |
| Argentina | Agricultura nacional Comité Consultivo de Biotecnologia (impacto ambiental), Serviço Nacional de Qualidade da Saúde e do Agronegócio (segurança alimentar) e Direção Nacional do Agronegócio (efeito no comércio) | Decisão final da Secretaria de Agricultura, Pecuária, Pesca e Alimentação. |
| Brasil | Comissão Técnica de Biossegurança Nacional (segurança ambiental e alimentar) e Conselho de Ministros (questões comerciais e econômicas) | |
| Austrália | Escritório do Regulador de Tecnologia Gene (supera todos os produtos GM), Administração de Bens Terapêuticos (medicinas GM) e Normas Alimentares Austrália Nova Zelândia (comida GM). | Os governos estaduais individuais podem então avaliar o impacto da liberação nos mercados e no comércio e aplicar mais legislação para controlar produtos geneticamente modificados aprovados. |
Uma das principais questões relativas aos reguladores é se os produtos GM devem ser rotulados. A Comissão Europeia diz que a rotulagem obrigatória e a rastreabilidade são necessárias para permitir uma escolha informada, evitar possíveis propagandas enganosas e facilitar a retirada de produtos se forem descobertos efeitos adversos à saúde ou ao meio ambiente. A Associação Médica Americana e a Associação Americana para o Avanço da Ciência afirmam que, na ausência de evidências científicas de danos, mesmo a rotulagem voluntária é enganosa e alarmará falsamente os consumidores. A rotulagem de produtos transgênicos no mercado é exigida em 64 países. A rotulagem pode ser obrigatória até um limite de nível de conteúdo GM (que varia entre os países) ou voluntária. No Canadá e nos Estados Unidos, a rotulagem de alimentos transgênicos é voluntária, enquanto na Europa todos os alimentos (incluindo alimentos processados) ou rações que contenham mais de 0,9% de transgênicos aprovados devem ser rotulados.
Controvérsia
Os críticos se opuseram ao uso da engenharia genética por vários motivos, incluindo preocupações éticas, ecológicas e econômicas. Muitas dessas preocupações envolvem culturas GM e se os alimentos produzidos a partir delas são seguros e qual o impacto que seu cultivo terá no meio ambiente. Essas controvérsias levaram a litígios, disputas comerciais internacionais e protestos, e à regulamentação restritiva de produtos comerciais em alguns países.
Acusações de que os cientistas estão "brincando de Deus" e outras questões religiosas foram atribuídas à tecnologia desde o início. Outras questões éticas levantadas incluem o patenteamento da vida, o uso dos direitos de propriedade intelectual, o nível de rotulagem dos produtos, o controle do fornecimento de alimentos e a objetividade do processo regulatório. Embora dúvidas tenham sido levantadas, economicamente a maioria dos estudos descobriu que o cultivo de transgênicos é benéfico para os agricultores.
O fluxo gênico entre culturas GM e plantas compatíveis, juntamente com o aumento do uso de herbicidas seletivos, pode aumentar o risco de "superervas daninhas" em desenvolvimento. Outras preocupações ambientais envolvem impactos potenciais em organismos não-alvo, incluindo micróbios do solo, e um aumento de pragas de insetos secundários e resistentes. Muitos dos impactos ambientais relativos às culturas GM podem levar muitos anos para serem compreendidos e também são evidentes nas práticas agrícolas convencionais. Com a comercialização de peixes geneticamente modificados, há preocupações sobre quais serão as consequências ambientais caso escapem.
Existem três preocupações principais sobre a segurança dos alimentos geneticamente modificados: se podem provocar uma reação alérgica; se os genes poderiam ser transferidos da comida para as células humanas; e se os genes não aprovados para consumo humano poderiam cruzar para outras culturas. Existe um consenso científico de que os alimentos atualmente disponíveis derivados de culturas GM não representam maior risco à saúde humana do que os alimentos convencionais, mas que cada alimento GM precisa ser testado caso a caso antes da introdução. No entanto, os membros do público têm menos probabilidade do que os cientistas de perceber os alimentos transgênicos como seguros.
Na cultura popular
A engenharia genética aparece em muitas histórias de ficção científica. O romance de Frank Herbert The White Plague descreve o uso deliberado de engenharia genética para criar um patógeno que mata especificamente mulheres. Outra das criações de Herbert, a série de romances Dune, usa engenharia genética para criar o poderoso Tleilaxu. Poucos filmes informaram o público sobre engenharia genética, com exceção de Os Garotos do Brasil, de 1978, e Parque Jurássico, de 1993, ambos com uma lição, uma demonstração, e um clipe de filme científico. Os métodos de engenharia genética são pouco representados no cinema; Michael Clark, escrevendo para o Wellcome Trust, chama o retrato da engenharia genética e da biotecnologia "seriamente distorcido" em filmes como O 6º Dia. Na visão de Clark, a biotecnologia é tipicamente "dada formas fantásticas, mas visualmente atraentes" enquanto a ciência é relegada a segundo plano ou ficcionalizada para atender a um público jovem.
No videogame de 2007, BioShock, a engenharia genética desempenha um papel importante no enredo central e no universo. O jogo se passa na fictícia distopia subaquática Rapture, na qual seus habitantes possuem habilidades genéticas sobre-humanas após se injetarem com “plasmídeos”, um soro que concede tais poderes. Também na cidade de Rapture estão as “Little Sisters”, garotinhas que são geneticamente modificadas, bem como uma trama secundária em que uma cantora de cabaré vende seu feto para cientistas genéticos que implantam falsas memórias no recém-nascido e o manipulam geneticamente para crescer. em um adulto.
Contenido relacionado
EFTPOS
Teste de Ames
Antimatéria