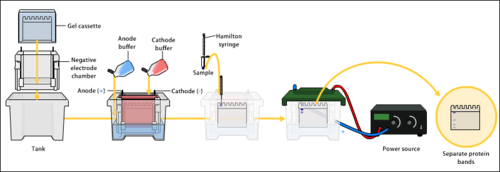
Eletroforese em gel
- O ADN é extraído.
- Isolamento e amplificação do ADN.
- DNA adicionado aos poços de gel.
- Corrente elétrica aplicada ao gel.
- As bandas de DNA são separadas por tamanho.
- As bandas de ADN estão manchadas.
Eletroforese em gel é um método de separação e análise de biomacromoléculas (DNA, RNA, proteínas, etc.) e seus fragmentos, com base em seu tamanho e carga. É usado em química clínica para separar proteínas por carga ou tamanho (IEF agarose, essencialmente independente do tamanho) e em bioquímica e biologia molecular para separar uma população mista de fragmentos de DNA e RNA por comprimento, para estimar o tamanho dos fragmentos de DNA e RNA ou para separar as proteínas por carga.
As moléculas de ácido nucleico são separadas pela aplicação de um campo elétrico para mover as moléculas carregadas negativamente através de uma matriz de agarose ou outras substâncias. As moléculas mais curtas movem-se mais rapidamente e migram mais longe do que as mais longas porque as moléculas mais curtas migram mais facilmente através dos poros do gel. Este fenômeno é chamado de peneiramento. As proteínas são separadas pela carga em agarose porque os poros do gel são muito pequenos para peneirar as proteínas. A eletroforese em gel também pode ser usada para a separação de nanopartículas.
A eletroforese em gel usa um gel como meio anticonvectivo ou meio de peneiramento durante a eletroforese, o movimento de uma partícula carregada em uma corrente elétrica. Os géis suprimem a convecção térmica causada pela aplicação do campo elétrico, podendo também atuar como meio de peneiramento, retardando a passagem de moléculas; os géis também podem servir simplesmente para manter a separação final, de modo que uma coloração pós-eletroforese possa ser aplicada. A eletroforese em gel de DNA geralmente é realizada para fins analíticos, geralmente após a amplificação do DNA por meio da reação em cadeia da polimerase (PCR), mas pode ser usada como uma técnica preparatória antes do uso de outros métodos, como espectrometria de massa, RFLP, PCR, clonagem, sequenciamento de DNA, ou Southern blotting para caracterização adicional.
Base física
A eletroforese é um processo que permite a classificação de moléculas com base no tamanho. Usando um campo elétrico, moléculas (como o DNA) podem se mover através de um gel feito de agarose ou poliacrilamida. O campo elétrico consiste em uma carga negativa em uma extremidade que empurra as moléculas através do gel e uma carga positiva na outra extremidade que puxa as moléculas através do gel. As moléculas que estão sendo classificadas são dispensadas em um poço no material de gel. O gel é colocado em uma câmara de eletroforese, que é então conectada a uma fonte de energia. Quando o campo elétrico é aplicado, as moléculas maiores se movem mais lentamente através do gel, enquanto as moléculas menores se movem mais rapidamente. As moléculas de tamanhos diferentes formam bandas distintas no gel.
O termo "gel" neste caso, refere-se à matriz usada para conter e, em seguida, separar as moléculas alvo. Na maioria dos casos, o gel é um polímero reticulado cuja composição e porosidade são escolhidas com base no peso específico e na composição do alvo a ser analisado. Ao separar proteínas ou pequenos ácidos nucléicos (DNA, RNA ou oligonucleotídeos), o gel geralmente é composto por diferentes concentrações de acrilamida e um reticulador, produzindo redes de malha de tamanhos diferentes de poliacrilamida. Ao separar ácidos nucleicos maiores (mais do que algumas centenas de bases), a matriz preferida é agarose purificada. Em ambos os casos, o gel forma uma matriz sólida, porém porosa. A acrilamida, ao contrário da poliacrilamida, é uma neurotoxina e deve ser manuseada com as devidas precauções de segurança para evitar envenenamento. A agarose é composta por longas cadeias não ramificadas de carboidratos não carregados sem ligações cruzadas resultando em um gel com poros grandes permitindo a separação de macromoléculas e complexos macromoleculares.
Eletroforese refere-se à força eletromotriz (EMF) que é usada para mover as moléculas através da matriz de gel. Ao colocar as moléculas em poços no gel e aplicar um campo elétrico, as moléculas se moverão através da matriz em taxas diferentes, determinadas em grande parte por sua massa quando a razão carga/massa (Z) de todas as espécies é uniforme. No entanto, quando as cargas não são todas uniformes, o campo elétrico gerado pelo procedimento de eletroforese fará com que as moléculas migrem diferencialmente de acordo com a carga. Espécies com carga líquida positiva migrarão para o cátodo que é carregado negativamente (porque esta é uma célula eletrolítica em vez de galvânica), enquanto as espécies com carga líquida negativa migrarão para o ânodo carregado positivamente. A massa continua sendo um fator na velocidade com que essas moléculas não uniformemente carregadas migram através da matriz em direção aos seus respectivos eletrodos.
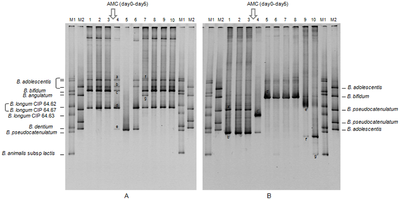
Se várias amostras tiverem sido carregadas em poços adjacentes no gel, elas correrão paralelamente em pistas individuais. Dependendo do número de moléculas diferentes, cada pista mostra a separação dos componentes da mistura original como uma ou mais bandas distintas, uma banda por componente. A separação incompleta dos componentes pode levar a bandas sobrepostas ou manchas indistinguíveis representando vários componentes não resolvidos. Bandas em pistas diferentes que terminam na mesma distância do topo contêm moléculas que passaram pelo gel na mesma velocidade, o que geralmente significa que elas têm aproximadamente o mesmo tamanho. Existem marcadores de tamanho de peso molecular disponíveis que contêm uma mistura de moléculas de tamanhos conhecidos. Se tal marcador foi executado em uma pista no gel paralelamente às amostras desconhecidas, as bandas observadas podem ser comparadas com as desconhecidas para determinar seu tamanho. A distância que uma banda percorre é aproximadamente inversamente proporcional ao logaritmo do tamanho da molécula (alternativamente, isso pode ser declarado como a distância percorrida é inversamente proporcional ao logaritmo do peso molecular das amostras).
Existem limites para as técnicas eletroforéticas. Como a passagem de uma corrente através de um gel causa aquecimento, os géis podem derreter durante a eletroforese. A eletroforese é realizada em soluções tampão para reduzir as mudanças de pH devido ao campo elétrico, o que é importante porque a carga do DNA e do RNA depende do pH, mas funcionar por muito tempo pode esgotar a capacidade tampão da solução. Também existem limitações na determinação do peso molecular por SDS-PAGE, especialmente ao tentar encontrar o MW de uma proteína desconhecida. Certas variáveis biológicas são difíceis ou impossíveis de minimizar e podem afetar a migração eletroforética. Tais fatores incluem estrutura da proteína, modificações pós-traducionais e composição de aminoácidos. Por exemplo, a tropomiosina é uma proteína ácida que migra anormalmente em géis SDS-PAGE. Isso ocorre porque os resíduos ácidos são repelidos pelo SDS carregado negativamente, levando a uma relação massa-carga imprecisa e migração. Além disso, diferentes preparações de material genético podem não migrar consistentemente umas com as outras, por razões morfológicas ou outras.
Tipos de gel
Os tipos de gel mais comumente usados são os géis de agarose e poliacrilamida. Cada tipo de gel é adequado para diferentes tipos e tamanhos do analito. Os géis de poliacrilamida são geralmente usados para proteínas e têm poder de resolução muito alto para pequenos fragmentos de DNA (5-500 pb). Os géis de agarose, por outro lado, têm menor poder de resolução para o DNA, mas têm uma maior faixa de separação e, portanto, são usados para fragmentos de DNA geralmente de 50 a 20.000 pb de tamanho, mas a resolução de mais de 6 Mb é possível com campo pulsado eletroforese em gel (PFGE). Os géis de poliacrilamida são executados em uma configuração vertical, enquanto os géis de agarose são normalmente executados horizontalmente em um modo submarino. Eles também diferem em sua metodologia de fundição, pois a agarose endurece termicamente, enquanto a poliacrilamida se forma em uma reação de polimerização química.
Agarose
Géis de agarose são feitos de polímeros de polissacarídeos naturais extraídos de algas marinhas. Os géis de agarose são facilmente fundidos e manuseados em comparação com outras matrizes porque a configuração do gel é uma alteração física e não química. As amostras também são facilmente recuperadas. Após o término do experimento, o gel resultante pode ser armazenado em um saco plástico na geladeira.
Géis de agarose não têm um tamanho de poro uniforme, mas são ideais para eletroforese de proteínas maiores que 200 kDa. A eletroforese em gel de agarose também pode ser utilizada para a separação de fragmentos de DNA que variam de 50 pares de bases a várias megabases (milhões de bases), sendo que a maior delas requer aparelhos especializados. A distância entre as bandas de DNA de diferentes comprimentos é influenciada pela porcentagem de agarose no gel, com porcentagens mais altas exigindo tempos de execução mais longos, às vezes dias. Em vez disso, os géis de agarose de alta porcentagem devem ser executados com uma eletroforese de campo pulsado (PFE) ou eletroforese de inversão de campo.
"A maioria dos géis de agarose é feita com entre 0,7% (boa separação ou resolução de grandes fragmentos de DNA de 5–10kb) e 2% (boa resolução para pequenos fragmentos de 0,2–1kb) de agarose dissolvida em tampão de eletroforese. Até 3% pode ser usado para separar fragmentos muito pequenos, mas um gel de poliacrilamida vertical é mais apropriado neste caso. Os géis de baixa porcentagem são muito fracos e podem quebrar quando você tenta levantá-los. Os géis de alta porcentagem geralmente são quebradiços e não se fixam uniformemente. Os géis a 1% são comuns para muitas aplicações."
Poliacrilamida
A eletroforese em gel de poliacrilamida (PAGE) é usada para separar proteínas que variam em tamanho de 5 a 2.000 kDa devido ao tamanho uniforme dos poros fornecido pelo gel de poliacrilamida. O tamanho dos poros é controlado modulando as concentrações de pó de acrilamida e bis-acrilamida usadas na criação de um gel. Deve-se ter cuidado ao criar esse tipo de gel, pois a acrilamida é uma neurotoxina potente em suas formas líquida e em pó.
Técnicas tradicionais de sequenciamento de DNA, como os métodos Maxam-Gilbert ou Sanger, usavam géis de poliacrilamida para separar fragmentos de DNA que diferem em um único par de bases de comprimento para que a sequência pudesse ser lida. A maioria dos métodos modernos de separação de DNA agora usa géis de agarose, exceto para fragmentos de DNA particularmente pequenos. Atualmente é mais usado no campo da imunologia e análise de proteínas, muitas vezes usado para separar diferentes proteínas ou isoformas da mesma proteína em bandas separadas. Estes podem ser transferidos para uma membrana de nitrocelulose ou PVDF para serem sondados com anticorpos e marcadores correspondentes, como em um western blot.
Normalmente, os géis de resolução são feitos em 6%, 8%, 10%, 12% ou 15%. O gel de empilhamento (5%) é derramado sobre o gel de resolução e um pente de gel (que forma os poços e define as pistas onde as proteínas, tampão de amostra e escadas serão colocados) é inserido. A porcentagem escolhida depende do tamanho da proteína que se deseja identificar ou sondar na amostra. Quanto menor o peso conhecido, maior a porcentagem que deve ser utilizada. Alterações no sistema tampão do gel podem ajudar a resolver ainda mais proteínas de tamanhos muito pequenos.
Amido
O amido de batata parcialmente hidrolisado é outro meio não tóxico para a eletroforese de proteínas. Os géis são ligeiramente mais opacos do que acrilamida ou agarose. As proteínas não desnaturadas podem ser separadas de acordo com a carga e o tamanho. Eles são visualizados usando coloração Napthal Black ou Amido Black. As concentrações típicas de gel de amido são de 5% a 10%.
Condições do gel
Desnaturação
Os géis desnaturadores são executados sob condições que atrapalham a estrutura natural do analito, fazendo com que ele se desdobra em uma cadeia linear. Assim, a mobilidade de cada macromolécula depende apenas do seu comprimento linear e de sua taxa de massa / carga. Assim, os níveis secundários, terciários e quaternários da estrutura biomolecular são interrompidos, deixando apenas a estrutura primária a ser analisada.
Os ácidos nucleicos são frequentemente desnaturados, incluindo a uréia no tampão, enquanto as proteínas são desnaturadas usando dodecilsulfato de sódio, geralmente como parte do processo de SDS-PAGE. Para a desnaturação total das proteínas, também é necessário reduzir as ligações dissulfeto covalentes que estabilizam sua estrutura terciária e quaternária, um método chamado página de redução. As condições de redução são geralmente mantidas pela adição de beta-mercaptoetanol ou ditiotreitol. Para uma análise geral das amostras de proteínas, a redução da página é a forma mais comum de eletroforese de proteínas. As condições de desnaturação são necessárias para a estimativa adequada do peso molecular do RNA. O RNA é capaz de formar interações mais intramoleculares do que o DNA, o que pode resultar em mudança de sua mobilidade eletroforética. Urerea, DMSO e Glyoxal são os agentes desnaturantes mais usados para interromper a estrutura do RNA. Originalmente, o hidróxido de metilmercúrio altamente tóxico era frequentemente usado na eletroforese de RNA desnaturante, mas pode ser o método de escolha para algumas amostras.Eletroforese em gel desnaturador é usado nos métodos de gel de temperatura de DNA e RNA e eletroforese em gradiente de temperatura (TGGE) e eletroforese em gel de gradiente de desnaturação (DGGE).
nativo
Os géis nativos são executados em condições de não denúncia, para que a estrutura natural do Analyte seja mantida. Isso permite que o tamanho físico do complexo dobrado ou montado afete a mobilidade, permitindo a análise dos quatro níveis da estrutura biomolecular. Para amostras biológicas, os detergentes são utilizados apenas na medida em que são necessários para lyse membranas lipídicas na célula. Os complexos permanecem - na maioria das vezes - associados e dobrados como estariam na célula. Uma desvantagem, no entanto, é que os complexos podem não se separar de maneira limpa ou previsível, pois é difícil prever como a forma e o tamanho da molécula afetarão sua mobilidade. Abordar e resolver esse problema é um objetivo importante da página nativa quantitativa.
Ao contrário dos métodos de desnaturação, a eletroforese em gel nativa não usa um agente desnaturador carregado. As moléculas sendo separadas (geralmente proteínas ou ácidos nucleicos), portanto, diferem não apenas apenas na massa molecular e na carga intrínseca, mas também na área transversal, e, portanto, experimentam diferentes forças eletroforéticas dependentes da forma da estrutura geral. Para as proteínas, uma vez que permanecem no estado nativo, podem ser visualizadas não apenas por reagentes gerais de coloração de proteínas, mas também por coloração específica de enzima.
Um exemplo de experimento específico de uma aplicação de eletroforese em gel nativo é verificar se há atividade enzimática para verificar a presença da enzima na amostra durante a purificação de proteínas. Por exemplo, para a proteína fosfatase alcalina, a solução de coloração é uma mistura de sal 4-cloro-2-2MetilbenzenEdiazonium com ácido 3-fosfo-2-naftóico-2 ' -4 ' -dimetil anilina no tampão Tris. Essa mancha é vendida comercialmente como um kit para manchas de géis. Se a proteína estiver presente, o mecanismo da reação ocorre na seguinte ordem: começa com a desposforilação do ácido 3-fosfo-2-naftoico-2--4; (É necessária água para a reação). O grupo fosfato é liberado e substituído por um grupo de álcool da água. O eletrofilo 4- cloro-2-2 metilbenzenenzonium (sal de diazônio vermelho TR vermelho rápido) desloca o grupo de álcool que forma o corante azo vermelho final. Como o próprio nome indica, este é o produto final vermelho-visível da reação. Na experimentação acadêmica de graduação da purificação de proteínas, o gel geralmente é executado ao lado de amostras purificadas comerciais para visualizar os resultados e concluir se a purificação foi ou não bem -sucedida.
A eletroforese em gel nativa é normalmente usada em proteômica e metalômica. No entanto, a página nativa também é usada para digitalizar genes (DNA) em busca de mutações desconhecidas como no polimorfismo de conformação de fita única.
Buffers
Os tampões na eletroforese em gel são usados para fornecer íons que carregam uma corrente e para manter o pH em um valor relativamente constante. Esses buffers contêm muitos íons, o que é necessário para a passagem de eletricidade por eles. Algo como água destilada ou benzeno contém poucos íons, o que não é ideal para uso em eletroforese. Há uma série de tampões usados para eletroforese. Sendo os mais comuns, para os ácidos nucléicos Tris/Acetate/EDTA (TAE), Tris/Borate/EDTA (TBE). Muitos outros buffers foram propostos, por ex. borato de lítio, que raramente é usado, com base em citações do Pubmed (LB), histidina isoelétrica, tampões de bens compatíveis com pK, etc.; na maioria dos casos, a lógica pretendida é menor corrente (menos calor) com mobilidades de íons combinados, o que leva a uma vida útil mais longa do buffer. O borato é problemático; O borato pode polimerizar ou interagir com dióis cis, como os encontrados no RNA. TAE tem a menor capacidade de tamponamento, mas fornece a melhor resolução para DNA maior. Isso significa uma tensão mais baixa e mais tempo, mas um produto melhor. LB é relativamente novo e é ineficaz na resolução de fragmentos maiores que 5 kbp; No entanto, com sua baixa condutividade, uma voltagem muito maior poderia ser usada (até 35 V/cm), o que significa um tempo de análise menor para eletroforese de rotina. Uma diferença de tamanho tão baixa quanto um par de bases pode ser resolvida em gel de agarose a 3% com um meio de condutividade extremamente baixa (borato de lítio 1 mM).
A maioria das separações de proteínas SDS-PAGE são realizadas usando um filtro "descontínuo" (ou DISC) sistema tampão que aumenta significativamente a nitidez das bandas dentro do gel. Durante a eletroforese em um sistema de gel descontínuo, um gradiente de íons é formado no estágio inicial da eletroforese que faz com que todas as proteínas se concentrem em uma única banda nítida em um processo chamado isotacoforese. A separação das proteínas por tamanho é alcançada na parte inferior, "resolvendo" região do gel. O gel de resolução normalmente tem um tamanho de poro muito menor, o que leva a um efeito de peneiramento que agora determina a mobilidade eletroforética das proteínas.
Visualização
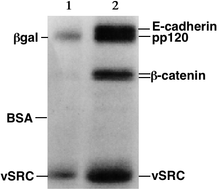
Após a conclusão da eletroforese, as moléculas no gel podem ser coradas para torná-las visíveis. O DNA pode ser visualizado usando brometo de etídio que, quando intercalado no DNA, fluoresce sob luz ultravioleta, enquanto a proteína pode ser visualizada usando coloração de prata ou corante azul brilhante de Coomassie. Outros métodos também podem ser usados para visualizar a separação dos componentes da mistura no gel. Se as moléculas a serem separadas contiverem radioatividade, por exemplo, em um gel de sequenciamento de DNA, um autorradiograma pode ser registrado do gel. As fotografias podem ser tiradas de géis, muitas vezes usando um sistema Gel Doc. Os géis são comumente rotulados para apresentação e registros científicos no popular site de criação de figuras, SciUGo.
Processamento downstream
Após a separação, um método de separação adicional pode ser usado, como foco isoelétrico ou SDS-PAGE. O gel será fisicamente cortado e os complexos proteicos extraídos de cada porção separadamente. Cada extrato pode então ser analisado, como por impressão digital de massa peptídica ou sequenciamento de peptídeo de novo após digestão no gel. Isso pode fornecer uma grande quantidade de informações sobre as identidades das proteínas em um complexo.
APLICAÇÕES
- Estimativa do tamanho das moléculas de DNA após a digestão da enzima de restrição, por exemplo, no mapeamento de restrição do DNA clonado.
- Análise de produtos PCR, por exemplo, em diagnóstico genético molecular ou impressões digitais genéticas
- Separação de DNA genômico restrito antes da transferência do sul, ou de RNA antes da transferência do norte.
Dependendo do tipo de análise que está sendo realizada, outras técnicas são frequentemente implementadas em conjunto com os resultados da eletroforese em gel, fornecendo uma ampla gama de aplicações específicas de campo.
Ácidos nucleicos
No caso dos ácidos nucléicos, a direção da migração, de eletrodos negativos para positivos, deve-se à carga negativa natural transportada por seu esqueleto de açúcar-fosfato.
Fragmentos de DNA de fita dupla se comportam naturalmente como hastes longas, então sua migração através do gel é relativa ao seu tamanho ou, para fragmentos cíclicos, ao seu raio de giro. O DNA circular, como os plasmídeos, no entanto, pode mostrar bandas múltiplas, a velocidade de migração pode depender se é relaxado ou superenrolado. O DNA ou RNA de fita simples tende a se dobrar em moléculas com formas complexas e migrar através do gel de maneira complicada com base em sua estrutura terciária. Portanto, agentes que rompem as ligações de hidrogênio, como hidróxido de sódio ou formamida, são usados para desnaturar os ácidos nucléicos e fazer com que eles se comportem novamente como hastes longas.
A eletroforese em gel de DNA ou RNA grande geralmente é feita por eletroforese em gel de agarose. Consulte o "Método de terminação em cadeia" página para um exemplo de um gel de sequenciamento de DNA de poliacrilamida. A caracterização através da interação do ligante de ácidos nucleicos ou fragmentos pode ser realizada por eletroforese de afinidade com mudança de mobilidade.
A eletroforese de amostras de RNA pode ser usada para verificar a contaminação do DNA genômico e também a degradação do RNA. O RNA de organismos eucarióticos mostra bandas distintas de rRNA 28s e 18s, sendo a banda 28s aproximadamente duas vezes mais intensa que a banda 18s. O RNA degradado tem bandas menos definidas, tem uma aparência manchada e a proporção de intensidade é inferior a 2:1.
Proteínas
As proteínas, ao contrário dos ácidos nucleicos, podem ter cargas variadas e formas complexas, portanto, podem não migrar para o gel de poliacrilamida em taxas semelhantes ou todas ao colocar um EMF negativo para positivo na amostra. As proteínas, portanto, são geralmente desnaturadas na presença de um detergente, como dodecil sulfato de sódio (SDS), que reveste as proteínas com uma carga negativa. Geralmente, a quantidade de SDS ligada é relativa ao tamanho da proteína (geralmente 1,4 g de SDS por grama de proteína), de modo que as proteínas desnaturadas resultantes tenham uma carga global negativa e todas as proteínas tenham uma carga semelhante à massa razão. Uma vez que as proteínas desnaturadas agem como hastes longas em vez de terem uma forma terciária complexa, a taxa na qual as proteínas revestidas com SDS resultantes migram no gel é relativa apenas ao seu tamanho e não à sua carga ou forma.
As proteínas são geralmente analisadas por eletroforese em gel de dodecil sulfato de sódio e poliacrilamida (SDS-PAGE), por eletroforese em gel nativo, por eletroforese em gel preparativa (QPNC-PAGE) ou por eletroforese 2-D.
A caracterização através da interação do ligante pode ser realizada por eletroblotting ou por eletroforese de afinidade em agarose ou por eletroforese capilar para estimativa de constantes de ligação e determinação de características estruturais como conteúdo de glicano através da ligação de lectina.
Nanopartículas
Uma nova aplicação para eletroforese em gel é a separação ou caracterização de nanopartículas de metal ou óxido metálico (por exemplo, Au, Ag, ZnO, SiO2) em relação ao tamanho, forma ou química da superfície das nanopartículas. O escopo é obter uma amostra mais homogênea (por exemplo, distribuição de tamanho de partícula mais estreita), que pode ser usada em outros produtos/processos (por exemplo, processos de automontagem). Para a separação de nanopartículas dentro de um gel, o parâmetro chave é a razão entre o tamanho da partícula e o tamanho da malha, onde dois mecanismos de migração foram identificados: o mecanismo irrestrito, onde o tamanho da partícula << tamanho da malha e o mecanismo restrito, onde o tamanho da partícula é semelhante ao tamanho da malha.
História
- 1930 – primeiros relatos do uso de sacarose para eletroforese gel
- 1955 — introdução de géis de amido, separação medíocre (Smithies)
- 1959 – introdução de geles de acrilamida; eletroforese de disco (Ornstein e Davis); controle preciso de parâmetros como tamanho e estabilidade de poros; e (Raymond e Weintraub)
- 1966 – primeiro uso de géis de agar
- 1969 – introdução de agentes desnaturadores especialmente a separação do SDS da subunidade proteica (Weber e Osborn)
- 1970 – Laemmli separou 28 componentes de phage T4 usando um gel de empilhamento e SDS
- 1972 – géis de agarose com mancha de brometo de etídio
- 1975 – géis bidimensionais (O’Farrell); focagem isoelétrica, em seguida, eletroforese de gel SDS
- 1977 – gel de sequenciamento
- 1983 – a eletroforese de gel de campo pulsada permite a separação de moléculas de DNA grandes
- 1983 — introdução da electroforese capilar
- 2004 – introdução de um tempo padronizado de polimerização de géis de acrilamida permite a separação limpa e previsível de proteínas nativas (Kastenholz)
Um livro de 1959 sobre eletroforese por Milan Bier cita referências de 1800. No entanto, Oliver Smithies fez contribuições significativas. Bier States: " O método de Smithies... está encontrando ampla aplicação por causa de seu poder separatório exclusivo. " Tomado em contexto, Bier implica claramente que Smithies ' O método é uma melhoria.
Contenido relacionado
Zebrafish
Retículo endoplasmático
Grupo funcional