Cúrio
Cúrio é um elemento químico radioativo transurânico com o símbolo Cm e número atômico 96. Este elemento actinídeo recebeu o nome dos eminentes cientistas Marie e Pierre Curie, ambos conhecidos por suas pesquisas sobre radioatividade. O cúrio foi feito intencionalmente pela equipe de Glenn T. Seaborg, Ralph A. James e Albert Ghiorso em 1944, usando o ciclotron em Berkeley. Eles bombardearam o recém-descoberto elemento plutônio (o isótopo 239Pu) com partículas alfa. Este foi então enviado para o Laboratório Metalúrgico da Universidade de Chicago, onde uma pequena amostra de cúrio foi finalmente separada e identificada. A descoberta foi mantida em segredo até depois do fim da Segunda Guerra Mundial. A notícia foi divulgada ao público em novembro de 1947. A maior parte do cúrio é produzida pelo bombardeio de urânio ou plutônio com nêutrons em reatores nucleares – uma tonelada de combustível nuclear usado contém aproximadamente 20 gramas de cúrio.
O cúrio é um metal duro, denso e prateado com alto ponto de fusão e ebulição para um actinídeo. É paramagnético em condições ambientais, mas torna-se antiferromagnético após o resfriamento, e outras transições magnéticas também são vistas em muitos compostos de cúrio. Em compostos, o cúrio geralmente tem valência +3 e às vezes +4; a valência +3 é predominante nas soluções. O cúrio oxida facilmente e seus óxidos são uma forma dominante desse elemento. Forma complexos fortemente fluorescentes com vários compostos orgânicos, mas não há evidências de sua incorporação em bactérias e archaea. Se entrar no corpo humano, o cúrio se acumula nos ossos, pulmões e fígado, onde promove o câncer.
Todos os isótopos conhecidos de cúrio são radioativos e têm pequena massa crítica para uma reação nuclear em cadeia. Eles emitem principalmente partículas α; geradores termoelétricos de radioisótopos podem usar o calor desse processo, mas isso é dificultado pela raridade e alto custo do cúrio. O cúrio é usado na fabricação de actinídeos mais pesados e o radionuclídeo 238Pu para fontes de energia em marcapassos cardíacos artificiais e RTGs para espaçonaves. Serviu como fonte α nos espectrômetros de raios X de partículas alfa de várias sondas espaciais, incluindo Sojourner, Spirit, Opportunity e Os rovers Curiosity de Marte e a sonda Philae no cometa 67P/Churyumov–Gerasimenko, para analisar a composição e estrutura da superfície.
História
Embora o cúrio provavelmente tenha sido produzido em experimentos nucleares anteriores, bem como no reator de fissão nuclear natural em Oklo, Gabão, foi intencionalmente sintetizado, isolado e identificado pela primeira vez em 1944, na Universidade da Califórnia, Berkeley, por Glenn T. Seaborg, Ralph A. James e Albert Ghiorso. Em seus experimentos, eles usaram um ciclotron de 60 polegadas (150 cm).
O cúrio foi identificado quimicamente no Laboratório Metalúrgico (agora Argonne National Laboratory), da Universidade de Chicago. Foi o terceiro elemento transurânico a ser descoberto, embora seja o quarto da série – o elemento mais leve, o amerício, ainda era desconhecido.
A amostra foi preparada da seguinte forma: primeiro a solução de nitrato de plutônio foi revestida em uma folha de platina de ~0,5 cm2 área, a solução foi evaporada e o resíduo foi convertido em óxido de plutônio (IV) (PuO2) por recozimento. Após a irradiação do óxido pelo ciclotron, o revestimento foi dissolvido com ácido nítrico e então precipitado como o hidróxido usando solução aquosa concentrada de amônia. O resíduo foi dissolvido em ácido perclórico e posterior separação foi feita por troca iônica para produzir um certo isótopo de cúrio. A separação de cúrio e amerício foi tão meticulosa que o grupo de Berkeley inicialmente chamou esses elementos de pandemônio (do grego para todos os demônios ou inferno) e < i>delírio (do latim para loucura).
Curium-242 foi feito em julho-agosto de 1944 bombardeando 239Pu com partículas α para produzir cúrio com a liberação de um nêutron:
O cúrio-242 foi identificado de forma inequívoca pela energia característica das partículas α emitidas durante o decaimento:
A meia-vida desse decaimento alfa foi medida primeiro como 150 dias e depois corrigida para 162,8 dias.
Outro isótopo 240Cm foi produzido em uma reação semelhante em março de 1945:
A meia-vida de decaimento α de 240Cm foi determinada corretamente como 26,7 dias.
A descoberta de cúrio e amerício em 1944 estava intimamente relacionada ao Projeto Manhattan, então os resultados foram confidenciais e desclassificados apenas em 1945. Seaborg vazou a síntese dos elementos 95 e 96 no programa de rádio americano para crianças, o Quiz Kids, cinco dias antes da apresentação oficial em uma reunião da American Chemical Society em 11 de novembro de 1945, quando um ouvinte perguntou se algum novo elemento transurânico além do plutônio e do neptúnio havia sido descoberto durante a guerra. A descoberta do cúrio (242Cm e 240Cm), sua produção e seus compostos foram posteriormente patenteados listando apenas Seaborg como inventor.
O elemento recebeu o nome de Marie Curie e seu marido Pierre Curie, conhecidos pela descoberta do rádio e por seu trabalho em radioatividade. Seguiu o exemplo do gadolínio, um elemento lantanídeo acima do cúrio na tabela periódica, que recebeu o nome do explorador de elementos de terras raras Johan Gadolin:
- "Como o nome para o elemento do número atômico 96, devemos propor "curium", com símbolo Cm. A evidência indica que o elemento 96 contém sete elétrons 5f e é, portanto, análogo ao elemento gadolínio, com seus sete elétrons 4f na série de terra rara regular. Nesta base o elemento 96 é nomeado após as Curies de uma maneira análoga ao nome do gadolínio, em que o químico Gadolin foi honrado."
As primeiras amostras de cúrio eram pouco visíveis e foram identificadas por sua radioatividade. Louis Werner e Isadore Perlman fizeram a primeira amostra substancial de 30 µg de hidróxido de cúrio-242 na Universidade da Califórnia, Berkeley, em 1947, bombardeando o amerício-241 com nêutrons. Quantidades macroscópicas de fluoreto de cúrio(III) foram obtidas em 1950 por W. W. T. Crane, J. C. Wallmann e B. B. Cunningham. Sua suscetibilidade magnética era muito próxima à do GdF3, fornecendo a primeira evidência experimental da valência +3 do cúrio em seus compostos. O cúrio metálico foi produzido apenas em 1951 pela redução de CmF3 com bário.
Características
Físico
Um elemento radioativo sintético, o cúrio é um metal duro e denso com uma aparência branca prateada e propriedades físicas e químicas semelhantes ao gadolínio. Seu ponto de fusão de 1344 °C é significativamente maior que o dos elementos anteriores neptúnio (637 °C), plutônio (639 °C) e amerício (1176 °C). Em comparação, o gadolínio funde a 1312 °C. O cúrio ferve a 3556 °C. Com uma densidade de 13,52 g/cm3, o cúrio é mais leve que o neptúnio (20,45 g/cm3) e o plutônio (19,8 g/cm3), mas mais pesado que a maioria dos outros metais. De duas formas cristalinas de cúrio, α-Cm é mais estável em condições ambientais. Tem uma simetria hexagonal, grupo espacial P63/mmc, parâmetros de rede a = 365 pm e c = 1182 pm e quatro unidades de fórmula por célula unitária. O cristal consiste em empacotamento duplo hexagonal com a sequência de camadas ABAC e, portanto, é isotípico com α-lantânio. À pressão >23 GPa, à temperatura ambiente, α-Cm torna-se β-Cm, que tem simetria cúbica centrada na face, grupo espacial Fm3m e constante de rede a = 493 pm. Em compressão adicional para 43 GPa, o cúrio torna-se uma estrutura γ-Cm ortorrômbica semelhante ao α-urânio, sem outras transições observadas até 52 GPa. Essas três fases do cúrio também são chamadas de Cm I, II e III.
O cúrio tem propriedades magnéticas peculiares. Seu elemento vizinho, amerício, não mostra desvio do paramagnetismo Curie-Weiss em toda a faixa de temperatura, mas α-Cm se transforma em um estado antiferromagnético ao resfriar para 65–52 K, e β-Cm exibe uma transição ferrimagnética a ~205 K. Pnictides de cúrio mostram transições ferromagnéticas após o resfriamento: 244CmN e 244CmAs a 109 K, 248CmP a 73 K e 248 CmSb a 162 K. O análogo lantanídeo de cúrio, gadolínio e seus pnictídeos também mostra transições magnéticas após o resfriamento, mas o caráter de transição é um pouco diferente: Gd e GdN tornam-se ferromagnéticos e GdP, GdAs e GdSb mostram ordenação antiferromagnética.
De acordo com dados magnéticos, a resistividade elétrica do cúrio aumenta com a temperatura - cerca de duas vezes entre 4 e 60 K - e então é quase constante até a temperatura ambiente. Há um aumento significativo na resistividade ao longo do tempo (~10 µΩ·cm/h) devido à auto -dano da rede cristalina por decaimento alfa. Isso torna incerta a verdadeira resistividade do cúrio (~125 µΩ·cm). A resistividade do cúrio é semelhante à do gadolínio e dos actinídeos plutônio e neptúnio, mas significativamente maior do que a do amerício, urânio, polônio e tório.
Sob iluminação ultravioleta, os íons de cúrio(III) mostram fluorescência amarelo-laranja forte e estável com um máximo na faixa de 590–640 nm, dependendo do ambiente. A fluorescência se origina das transições do primeiro estado excitado 6D7/2 e do estado fundamental 8S7/2< /sub>. A análise dessa fluorescência permite monitorar as interações entre os íons Cm(III) em complexos orgânicos e inorgânicos.
Químico
O íon cúrio em solução quase sempre tem um estado de oxidação +3, o estado de oxidação mais estável para o cúrio. Um estado de oxidação +4 é visto principalmente em algumas fases sólidas, como CmO2 e CmF4. O cúrio(IV) aquoso só é conhecido na presença de oxidantes fortes, como o persulfato de potássio, e é facilmente reduzido a cúrio(III) por radiólise e até pela própria água. O comportamento químico do cúrio é diferente dos actinídeos tório e urânio, e é semelhante ao amerício e muitos lantanídeos. Em solução aquosa, o íon Cm3+ é incolor a verde pálido; Cm4+ é amarelo pálido. A absorção óptica do íon Cm3+ contém três picos agudos em 375,4, 381,2 e 396,5 nm e sua força pode ser convertida diretamente na concentração dos íons. O estado de oxidação +6 foi relatado apenas uma vez em solução em 1978, como o íon curila (CmO2+
2): isso foi preparado a partir do decaimento beta do amerício-242 no íon amerício(V) 242
AmO+
2< /span>. A falha em obter Cm(VI) da oxidação de Cm(III) e Cm(IV) pode ser devido ao alto potencial de ionização Cm4+/Cm3+ e ao instabilidade de Cm(V).
Íons de cúrio são ácidos de Lewis duros e, portanto, formam complexos mais estáveis com bases duras. A ligação é principalmente iônica, com um pequeno componente covalente. O cúrio em seus complexos geralmente exibe um ambiente de coordenação de 9 vezes, com uma geometria molecular prismática trigonal tricapeada.
Isótopos
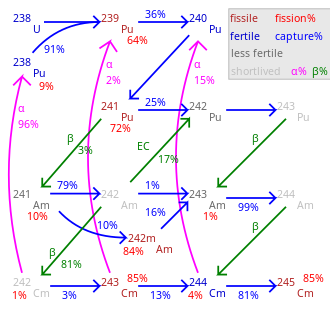
Cerca de 19 radioisótopos e 7 isômeros nucleares, 233Cm a 251Cm, são conhecidos; nenhum é estável. As meias-vidas mais longas são de 15,6 milhões de anos (247Cm) e 348.000 anos (248Cm). Outros longevos são 245Cm (8500 anos), 250Cm (8300 anos) e 246Cm (4760 anos). O cúrio-250 é incomum: na maior parte (~ 86%) decai por fissão espontânea. Os isótopos mais usados são 242Cm e 244Cm com meias-vidas de 162,8 dias e 18,1 anos, respectivamente.
| Seções transversais de neutrões térmicos (barnos) | ||||||
|---|---|---|---|---|---|---|
| 242Cm | 243Cm | 244Cm | 245Cm | 246Cm | 247Cm | |
| Fissão | 5 | 617 | 1.04 | 2145 | 0,14 | 81.90 |
| Captura | 16. | 130 | 15.20 | 369 | 1.22 | 57 |
| Relação C/F | 3.20 | 0,21 | 14.62 | 0,17 | 8.71 | 0.70 |
| LEU gastou combustível nuclear 20 anos após 53 MWd/kg de queimação | ||||||
| 3 isótopos comuns | 51 | 3700 | 390 | |||
| Fast-neutron reactor MOX combustível (avg 5 amostras, queimar 66–120 GWd/t) | ||||||
| Cálcio total 3.09×10.-3% | 27.64% | 70.16% | 2.166% | 0,0376% | 0,000928% | |
| Isotope | 242Cm | 243Cm | 244Cm | 245Cm | 246Cm | 247Cm | 248Cm | 250Cm |
| Massa crítica, kg | 25 | 7.5 | 33 | 6.8 | 39 | 7 | 40.4 | Países Baixos |
Todos os isótopos 242Cm-248Cm e 250Cm sofrem uma reação nuclear em cadeia autossustentável e, portanto, em princípio, podem ser um combustível nuclear em um reator. Como na maioria dos elementos transurânicos, a seção de choque da fissão nuclear é especialmente alta para os isótopos de cúrio de massa ímpar 243Cm, 245Cm e 247Cm. Estes podem ser usados em reatores de nêutrons térmicos, enquanto uma mistura de isótopos de cúrio é adequada apenas para reatores de reprodução rápida, uma vez que os isótopos de massa uniforme não são físseis em um reator térmico e se acumulam à medida que a queima aumenta. O combustível de óxido misto (MOX), que deve ser usado em reatores de energia, deve conter pouco ou nenhum cúrio porque a ativação de nêutrons de 248Cm criará califórnio. O califórnio é um forte emissor de nêutrons e poluiria o final do ciclo do combustível e aumentaria a dose para o pessoal do reator. Portanto, se os actinídeos menores forem usados como combustível em um reator de nêutrons térmicos, o cúrio deve ser excluído do combustível ou colocado em barras de combustível especiais onde é o único actinídeo presente.
A tabela ao lado lista as massas críticas dos isótopos de cúrio para uma esfera, sem moderador ou refletor. Com um refletor de metal (30 cm de aço), as massas críticas dos isótopos ímpares são de cerca de 3–4 kg. Ao usar água (espessura ~20–30 cm) como refletor, a massa crítica pode ser tão pequena quanto 59 gramas para 245Cm, 155 gramas para 243Cm e 1550 grama para 247Cm. Há uma incerteza significativa nesses valores de massa crítica. Embora geralmente seja da ordem de 20%, os valores para 242Cm e 246Cm foram listados como 371 kg e 70,1 kg, respectivamente, por alguns grupos de pesquisa.
O cúrio atualmente não é usado como combustível nuclear devido à sua baixa disponibilidade e alto preço. 245Cm e 247Cm têm massa crítica muito pequena e, portanto, podem ser usados em armas nucleares táticas, mas não se sabe de nenhuma delas. O cúrio-243 não é adequado para tal, devido à sua curta meia-vida e forte emissão de α, o que causaria calor excessivo. O cúrio-247 seria altamente adequado devido à sua longa meia-vida, que é 647 vezes maior que o plutônio-239 (usado em muitas armas nucleares existentes).
Ocorrência
O isótopo de vida mais longa, 247Cm, tem meia-vida de 15,6 milhões de anos; portanto, qualquer cúrio primordial, isto é, presente na Terra quando se formou, já deveria ter decaído. Sua presença passada como um radionuclídeo extinto é detectável como um excesso de sua filha primordial e longeva 235U. Traços de cúrio podem ocorrer naturalmente em minerais de urânio devido à captura de nêutrons e decaimento beta, embora isso não tenha sido confirmado. Traços de 247Cm também são provavelmente trazidos para a Terra em raios cósmicos, mas novamente isso não foi confirmado.
O cúrio é produzido artificialmente em pequenas quantidades para fins de pesquisa. Também ocorre como um dos resíduos do combustível nuclear irradiado. O cúrio está presente na natureza em algumas áreas usadas para testes de armas nucleares. A análise dos detritos no local de teste dos Estados Unidos' primeira arma termonuclear, Ivy Mike, (1 de novembro de 1952, Enewetak Atoll), além de einstênio, férmio, plutônio e amerício também revelou isótopos de berquélio, califórnio e cúrio, em particular 245Cm, 246 Cm e quantidades menores de 247Cm, 248Cm e 249Cm.
Compostos atmosféricos de cúrio são pouco solúveis em solventes comuns e aderem principalmente às partículas do solo. A análise do solo revelou uma concentração de cúrio cerca de 4.000 vezes maior nas partículas de solo arenoso do que na água presente nos poros do solo. Uma proporção ainda maior de cerca de 18.000 foi medida em solos argilosos.
Os elementos transurânicos do amerício ao férmio, incluindo o cúrio, ocorreram naturalmente no reator de fissão nuclear natural em Oklo, mas não o fazem mais.
O cúrio e outros actinídeos não primordiais também foram detectados no espectro da estrela de Przybylski.
Síntese
Preparação de isótopos
O cúrio é produzido em pequenas quantidades em reatores nucleares, e até agora apenas quilogramas de 242Cm e 244Cm foram acumulados, e gramas ou mesmo miligramas para isótopos mais pesados. Daí o alto preço do cúrio, cotado em 160–185 USD por miligrama, com uma estimativa mais recente de US$ 2.000/g para 242Cm e US$ 170/g para 244< /sup>Cm. Em reatores nucleares, o cúrio é formado a partir de 238U em uma série de reações nucleares. Na primeira cadeia, 238U captura um nêutron e se converte em 239U, que via decaimento β− se transforma em 239Np e 239Pu.
- (os tempos são meias-vidas).
(1)
Mais captura de nêutrons seguida por β--decaimento dá amerício (241Am) que se torna ainda mais 242Cm:
- .
(2)
Para fins de pesquisa, o cúrio é obtido irradiando não urânio, mas plutônio, que está disponível em grandes quantidades a partir de combustível nuclear usado. Um fluxo de nêutrons muito maior é usado para a irradiação que resulta em uma cadeia de reação diferente e formação de 244Cm:
(3)
Cúrio-244 alfa decai para 240Pu, mas também absorve nêutrons, daí uma pequena quantidade de isótopos de cúrio mais pesados. Destes, 247Cm e 248Cm são populares na pesquisa científica devido às suas meias-vidas longas. Mas a taxa de produção de 247Cm em reatores de nêutrons térmicos é baixa porque é propensa à fissão devido a nêutrons térmicos. A síntese de 250Cm por captura de nêutrons é improvável devido à meia-vida curta do intermediário 249Cm (64 min), que β− decai para o isótopo de berquélio 249Bk.
(4)
A cascata de reações (n,γ) acima fornece uma mistura de diferentes isótopos de cúrio. Sua separação pós-síntese é incômoda, então uma síntese seletiva é desejada. Curium-248 é favorecido para fins de pesquisa devido à sua longa meia-vida. A maneira mais eficiente de preparar este isótopo é pelo decaimento α do isótopo californiano 252Cf, que está disponível em quantidades relativamente grandes devido à sua longa meia-vida (2,65 anos). Cerca de 35–50 mg de 248Cm são produzidos assim, por ano. A reação associada produz 248Cm com pureza isotópica de 97%.
(5)
Outro isótopo, 245Cm, pode ser obtido para pesquisa, a partir do α-decay de 249Cf; o último isótopo é produzido em pequenas quantidades de β--decaimento de 249Bk.
(6)
Preparação de metal
A maioria das rotinas de síntese produz uma mistura de isótopos de actinídeos como óxidos, dos quais um determinado isótopo de cúrio precisa ser separado. Um exemplo de procedimento poderia ser dissolver combustível de reator usado (por exemplo, combustível MOX) em ácido nítrico e remover a maior parte do urânio e plutônio usando um PUREX (Plutônio – UR anium EXtração) tipo extração com fosfato de tributil em um hidrocarboneto. Os lantanídeos e os actinídeos restantes são então separados do resíduo aquoso (refinado) por uma extração à base de diamida para dar, após a separação, uma mistura de actinídeos e lantanídeos trivalentes. Um composto de cúrio é então extraído seletivamente usando técnicas cromatográficas e de centrifugação em várias etapas com um reagente apropriado. O complexo bis-triazinilbipiridina foi recentemente proposto como tal reagente, que é altamente seletivo para o cúrio. A separação do cúrio do amerício quimicamente muito semelhante também pode ser feita tratando uma pasta de seus hidróxidos em bicarbonato de sódio aquoso com ozônio a temperatura elevada. Tanto o amerício quanto o cúrio estão presentes em soluções principalmente no estado de valência +3; o amerício oxida a complexos Am(IV) solúveis, mas o cúrio permanece inalterado e, portanto, pode ser isolado por centrifugação repetida.
O cúrio metálico é obtido pela redução de seus compostos. Inicialmente, o fluoreto de cúrio(III) foi usado para esse fim. A reação foi feita em ambiente livre de água e oxigênio, em um aparato feito de tântalo e tungstênio, usando bário elementar ou lítio como agentes redutores.
Outra possibilidade é a redução do óxido de cúrio (IV) usando uma liga de magnésio-zinco em uma fusão de cloreto de magnésio e fluoreto de magnésio.
Compostos e reações
Óxidos
O cúrio reage prontamente com o oxigênio formando principalmente os óxidos Cm2O3 e CmO2, mas o óxido divalente CmO também é conhecido. Black CmO2 pode ser obtido pela queima de oxalato de cúrio (Cm< /sup>
2(C
2 O
4)
3), nitrato (Cm(NO
3)
3), ou hidróxido em oxigênio puro. Ao aquecer a 600–650 °C no vácuo (cerca de 0,01 Pa), ele se transforma no esbranquiçado Cm2O3:
- .
Ou, Cm2O3 pode ser obtido reduzindo CmO2 com hidrogênio molecular:
Além disso, vários óxidos ternários do tipo M(II)CmO3 são conhecidos, onde M representa um metal divalente, como o bário.
A oxidação térmica de vestígios de hidreto de cúrio (CmH2–3) foi relatada para dar uma forma volátil de CmO2 e o trióxido volátil CmO 3, um dos dois exemplos conhecidos do raro estado +6 do cúrio. Outra espécie observada foi relatada como se comportando de forma semelhante a um suposto tetróxido de plutônio e foi provisoriamente caracterizada como CMO4, com cúrio no estado extremamente raro +8; mas novos experimentos parecem indicar que CmO4 não existe, e lançaram dúvidas sobre a existência de PuO4 também.
Haletos
O fluoreto de cúrio(III) incolor (CmF3) pode ser feito adicionando íons de flúor em soluções contendo cúrio(III). O fluoreto de cúrio(IV) tetravalente marrom (CmF4), por outro lado, só é obtido pela reação do fluoreto de cúrio(III) com o flúor molecular:
Uma série de fluoretos ternários é conhecida na forma A7Cm6F31 (A = metal alcalino).
O cloreto de cúrio(III) incolor (CmCl3) é feito pela reação de hidróxido de cúrio (Cm(OH)3) com gás cloreto de hidrogênio anidro. Pode ser posteriormente transformado em outros haletos, como brometo de cúrio (III) (incolor a verde claro) e iodeto de cúrio (III) (incolor), reagindo-o com o sal de amônia do haleto correspondente a temperaturas de ~ 400–450 ° C:
Ou, pode-se aquecer o óxido de cúrio a ~600°C com o ácido correspondente (como bromídrico para brometo de cúrio). A hidrólise em fase de vapor do cloreto de cúrio(III) dá oxicloreto de cúrio:
Calcogenídeos e pnictídeos
Sulfetos, selenetos e teluretos de cúrio foram obtidos por tratamento de cúrio com enxofre gasoso, selênio ou telúrio no vácuo a temperatura elevada. Os pnictídeos de cúrio do tipo CmX são conhecidos por nitrogênio, fósforo, arsênico e antimônio. Eles podem ser preparados pela reação de hidreto de cúrio(III) (CmH3) ou cúrio metálico com esses elementos em temperatura elevada.
Compostos organocúricos e aspectos biológicos
Complexos organometálicos análogos ao uranoceno são conhecidos também para outros actinídeos, como tório, protactínio, neptúnio, plutônio e amerício. A teoria orbital molecular prevê um "curoceno" complexo (η8-C8H8)2Cm, mas ainda não foi relatado experimentalmente.
Formação dos complexos do tipo Cm(n-C
3H
7-BTP)
3 (BTP = 2,6-di(1,2,4-triazin-3-il)piridina), em soluções contendo íons n-C3H7-BTP e Cm3+ foi confirmado pelo EXAFS. Alguns desses complexos do tipo BTP interagem seletivamente com o cúrio e, portanto, são úteis para separá-lo dos lantanídeos e de outros actinídeos. Os íons Cm3+ dissolvidos ligam-se a muitos compostos orgânicos, como ácido hidroxâmico, uréia, fluoresceína e trifosfato de adenosina. Muitos desses compostos estão relacionados à atividade biológica de diversos microrganismos. Os complexos resultantes apresentam forte emissão amarelo-laranja sob excitação de luz ultravioleta, o que é conveniente não apenas para sua detecção, mas também para o estudo das interações entre o íon Cm3+ e os ligantes por meio de mudanças na semi- vida (da ordem de ~0,1 ms) e espectro da fluorescência.
O cúrio não tem significado biológico. Existem alguns relatos sobre a biossorção de Cm3+ por bactérias e archaea, mas nenhuma evidência de incorporação de cúrio nelas.
Aplicativos
Radionuclídeos
O cúrio é um dos elementos isoláveis mais radioativos. Seus dois isótopos mais comuns 242Cm e 244Cm são fortes emissores alfa (energia 6 MeV); eles têm meias-vidas bastante curtas, 162,8 dias e 18,1 anos, e fornecem até 120 W/ge 3 W/g de calor, respectivamente. Portanto, o cúrio pode ser usado em sua forma de óxido comum em geradores termoelétricos de radioisótopos como aqueles em naves espaciais. Esta aplicação foi estudada para o isótopo 244Cm, enquanto o 242Cm foi abandonado devido ao seu preço proibitivo, em torno de 2.000 USD/g. 243Cm com meia-vida de ~30 anos e bom rendimento energético de ~1,6 W/g pode ser um combustível adequado, mas fornece quantidades significativas de raios gama e beta nocivos de produtos de decaimento radioativo. Como um emissor α, 244Cm precisa de muito menos blindagem de radiação, mas tem uma alta taxa de fissão espontânea e, portanto, muitos nêutrons e radiação gama. Comparado a um isótopo de gerador termoelétrico concorrente, como 238Pu, 244Cm emite 500 vezes mais nêutrons, e sua maior emissão gama requer um escudo 20 vezes mais espesso - 2 polegadas (51 mm) de chumbo para uma fonte de 1 kW, em comparação com 0,1 polegadas (2,5 mm) para 238Pu. Portanto, esse uso de cúrio é atualmente considerado impraticável.
Um uso mais promissor de 242Cm é para fazer 238Pu, um radioisótopo melhor para geradores termoelétricos, como em marca-passos cardíacos. As rotas alternativas para 238Pu usam a reação (n,γ) de 237Np, ou bombardeio de deutério de urânio, embora ambas as reações sempre produzam 236Pu como um subproduto indesejado, uma vez que o último decai para 232U com forte emissão gama. O cúrio é um material de partida comum para fazer elementos transurânicos e superpesados. Assim, bombardeando 248Cm com neon (22Ne), magnésio (26Mg) ou cálcio (48Ca) produz isótopos de seaborgium (< sup>265Sg), hassium (269Hs e 270Hs) e livermorium (292Lv, 293 Lv e possivelmente 294Lv). O califórnio foi descoberto quando um alvo de tamanho de micrograma de cúrio-242 foi irradiado com partículas alfa de 35 MeV usando o ciclotron de 60 polegadas (150 cm) em Berkeley:
- 242
96Cm
+ 4
2Ele.
→ 245
98Cf
+ 1
0n
Apenas cerca de 5.000 átomos de califórnio foram produzidos neste experimento.
Os isótopos de cúrio de massa ímpar 243Cm, 245Cm e 247Cm são altamente físseis e podem liberar energia adicional em um reator nuclear de espectro térmico. Todos os isótopos de cúrio são fissionáveis em reatores de nêutrons rápidos. Este é um dos motivos para a separação e transmutação de actinídeos menores no ciclo do combustível nuclear, ajudando a reduzir a radiotoxicidade de longo prazo do combustível nuclear usado ou irradiado.
Espectrômetro de raios X
A aplicação mais prática de 244Cm - embora bastante limitada em volume total - é como fonte de partículas α em espectrômetros de raios-X de partículas alfa (APXS). Esses instrumentos foram instalados no Sojourner, Mars, Mars 96, Mars Exploration Rovers e Philae, bem como no Mars Science Laboratory para analisar a composição e estrutura das rochas na superfície do planeta Marte. O APXS também foi usado nas sondas lunares Surveyor 5–7, mas com uma fonte 242Cm.
Uma configuração APXS elaborada tem uma cabeça de sensor contendo seis fontes de cúrio com uma taxa de decaimento total de várias dezenas de milicuries (aproximadamente um gigabecquerel). As fontes são colimadas em uma amostra e os espectros de energia das partículas alfa e prótons espalhados da amostra são analisados (a análise de prótons é feita apenas em alguns espectrômetros). Esses espectros contêm informações quantitativas sobre todos os principais elementos da amostra, exceto hidrogênio, hélio e lítio.
Segurança
Devido à sua radioatividade, o cúrio e seus compostos devem ser manuseados em laboratórios apropriados sob acordos especiais. Enquanto o próprio cúrio emite principalmente partículas α que são absorvidas por finas camadas de materiais comuns, alguns de seus produtos de decaimento emitem frações significativas de raios beta e gama, que requerem uma proteção mais elaborada. Se consumido, o cúrio é excretado em poucos dias e apenas 0,05% é absorvido no sangue. A partir daí, cerca de 45% vão para o fígado, 45% para os ossos e os 10% restantes são excretados. No osso, o cúrio acumula-se no interior das interfaces com a medula óssea e não se redistribui significativamente com o tempo; sua radiação destrói a medula óssea e, assim, impede a criação de glóbulos vermelhos. A meia-vida biológica do cúrio é de cerca de 20 anos no fígado e 50 anos nos ossos. O cúrio é absorvido pelo corpo muito mais fortemente por inalação, e a dose total permitida de 244Cm na forma solúvel é de 0,3 μCi. A injeção intravenosa de soluções contendo 242Cm e 244Cm em ratos aumentou a incidência de tumor ósseo, e a inalação promoveu câncer de pulmão e fígado.
Os isótopos de cúrio estão inevitavelmente presentes no combustível nuclear irradiado (cerca de 20 g/tonelada). Os isótopos 245Cm–248Cm têm tempos de decaimento de milhares de anos e devem ser removidos para neutralizar o combustível para descarte. Tal procedimento envolve várias etapas, onde o cúrio é primeiro separado e depois convertido por bombardeio de nêutrons em reatores especiais em nuclídeos de vida curta. Este procedimento, transmutação nuclear, embora bem documentado para outros elementos, ainda está sendo desenvolvido para o cúrio.
Contenido relacionado
Reação ácido-base
Lei das proporções múltiplas
Bicarbonato





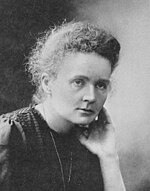





![{displaystyle {ce {^{238}_{92}U->[{ce {(n,gamma)}}]{^{239}_{92}U}->[beta ^{-}][23.5 {ce {min}}]_{93}^{239}Np->[beta ^{-}][2.3565 {ce {d}}]_{94}^{239}Pu}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c30c60d3b829e92822267f24b94337ce0d267d38)
![{displaystyle {ce {^{239}_{94}Pu->[{ce {2(n,gamma)}}]_{94}^{241}Pu->[beta ^{-}][14.35 {ce {yr}}]{^{241}_{95}Am}->[{ce {(n,gamma)}}]_{95}^{242}Am->[beta ^{-}][16.02{ce {h}}]_{96}^{242}Cm}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee8c743c87eab605b6f80f80388eeb9f462b4086)
![{displaystyle {ce {^{239}_{94}Pu->[{ce {4(n,gamma)}}]_{94}^{243}Pu->[beta ^{-}][4.956 {ce {h}}]_{95}^{243}Am->[({ce {n}},gamma)]_{95}^{244}Am->[beta ^{-}][10.1{ce {h}}]_{96}^{244}Cm->[alpha ][18.11 {ce {yr}}]_{94}^{240}Pu}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e202c162172b717f887b5f0bd06d3e01057ae924)

![{displaystyle {begin{matrix}{}\{ce {^{252}_{98}Cf ->[alpha][2.645 {ce {yr}}] ^{248}_{96}Cm}}\{}end{matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c6cc4394eb604706a66a7112cda30cf38f857380)
![{displaystyle {ce {^{249}_{97}Bk ->[beta^-][330 {ce {d}}] ^{249}_{98}Cf ->[alpha][351 {ce {yr}}] ^{245}_{96}Cm}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7ccddd548852fda4a6af794bec61eda1293ebdd8)


![{displaystyle {ce {4CmO2 ->[Delta T] 2Cm2O3 + O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d347ad5669ad313e0453be3c15f15e400c2d5ef8)