Cromatografia
Na análise química, a cromatografia é uma técnica de laboratório para a separação de uma mistura em seus componentes. A mistura é dissolvida em um solvente fluido (gás ou líquido) denominado fase móvel, que a transporta através de um sistema (uma coluna, um tubo capilar, uma placa ou uma folha) no qual um material chamada de fase estacionária é fixa. Como os diferentes constituintes da mistura tendem a ter diferentes afinidades pela fase estacionária e são retidos por diferentes períodos de tempo, dependendo de suas interações com seus locais de superfície, os constituintes viajam em diferentes velocidades aparentes no fluido móvel, fazendo com que se separem. A separação é baseada no particionamento diferencial entre as fases móvel e estacionária. Diferenças sutis no coeficiente de partição de um composto resultam em retenção diferencial na fase estacionária e, portanto, afetam a separação.
A cromatografia pode ser preparativa ou analítica. O propósito da cromatografia preparativa é separar os componentes de uma mistura para uso posterior, sendo assim uma forma de purificação. Este processo está associado a custos mais elevados devido ao seu modo de produção. A cromatografia analítica é feita normalmente com quantidades menores de material e serve para estabelecer a presença ou medir as proporções relativas de analitos em uma mistura. Os dois tipos não são mutuamente exclusivos.
Etimologia e pronúncia
Cromatografia, pronunciada é derivada do grego χρῶμα chroma, que significa "cor", e γράφειν graphein, que significa "escrever& #34;. A combinação desses dois termos foi herdada diretamente da invenção da técnica usada pela primeira vez para separar os pigmentos.
História
A cromatografia foi desenvolvida pela primeira vez na Universidade de Kazan pelo cientista russo nascido na Itália, Mikhail Tsvet, em 1900. Ele desenvolveu a técnica e cunhou o termo cromatografia na primeira década do século 20, principalmente para a separação de pigmentos vegetais, como clorofila, carotenos e xantofilas. Como esses componentes se separam em faixas de cores diferentes (verde, laranja e amarelo, respectivamente), inspiraram diretamente o nome da técnica. Novos tipos de cromatografia desenvolvidos durante as décadas de 1930 e 1940 tornaram a técnica útil para muitos processos de separação.
A técnica de cromatografia desenvolveu-se substancialmente como resultado do trabalho de Archer John Porter Martin e Richard Laurence Millington Synge durante as décadas de 1940 e 1950, pelo qual ganharam o Prêmio Nobel de Química de 1952. Eles estabeleceram os princípios e as técnicas básicas da cromatografia de partição e seu trabalho incentivou o rápido desenvolvimento de vários métodos cromatográficos: cromatografia em papel, cromatografia gasosa e o que se tornaria conhecido como cromatografia líquida de alta eficiência. Desde então, a tecnologia avançou rapidamente. Os pesquisadores descobriram que os principais princípios da cromatografia de Tsvet podem ser aplicados de muitas maneiras diferentes, resultando nas diferentes variedades de cromatografia descritas abaixo. Os avanços estão melhorando continuamente o desempenho técnico da cromatografia, permitindo a separação de moléculas cada vez mais semelhantes.
Termos de cromatografia
- Analisar – a substância a ser separada durante a cromatografia. Também é normalmente o que é necessário da mistura.
- cromatografia analítica – o uso da cromatografia para determinar a existência e, possivelmente, também a concentração de analito(s) em uma amostra.
- Fase ligada – uma fase estacionária que é covalentemente ligada às partículas de suporte ou à parede interna da tubulação da coluna.
- Cromatograma – a saída visual do cromatógrafo. No caso de uma separação ideal, diferentes picos ou padrões no cromatograma correspondem a diferentes componentes da mistura separada.
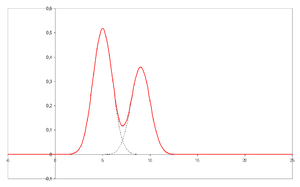
 Plotted no eixo x é o tempo de retenção e plotado no eixo y um sinal (por exemplo, obtido por um espectrofotômetro, espectrômetro de massa ou uma variedade de outros detectores) correspondente à resposta criada pelos analisados que saem do sistema. No caso de um sistema ideal o sinal é proporcional à concentração do analito específico separado.
Plotted no eixo x é o tempo de retenção e plotado no eixo y um sinal (por exemplo, obtido por um espectrofotômetro, espectrômetro de massa ou uma variedade de outros detectores) correspondente à resposta criada pelos analisados que saem do sistema. No caso de um sistema ideal o sinal é proporcional à concentração do analito específico separado. - Cromatografia – um instrumento que permite uma separação sofisticada, por exemplo, separação cromatografia gasosa ou cromatografia líquida.
- Cromatografia – um método físico de separação que distribui componentes para separar entre duas fases, uma estacionária (fase estacionária), a outra (fase móvel) movendo-se em uma direção definida.
- Eluent (às vezes escrito) elutante) – a fixação solvente ou solvente usada na cromatografia da elução e é sinônimo de fase móvel.
- Eluate – a mistura de soluto (ver Eluite) e solvente (veja Eluent) saindo da coluna.
- Efluente – o fluxo fluindo de uma coluna cromatografia. Na prática, é usado sinônimo de elua, mas o termo refere-se mais precisamente ao fluxo independente da separação que ocorre.
- Eluindo – um termo mais preciso para soluto ou Analisar. É um componente de amostra deixando a coluna cromatografia.
- Série Eluotrópica – uma lista de solventes classificados de acordo com seu poder de elução.
- Fase imobilizada – uma fase estacionária que está imobilizada nas partículas de suporte, ou na parede interna da tubulação da coluna.
- fase móvel – a fase que se move em uma direção definida. Pode ser um líquido (LC e eletrocromatografia capilar (CEC)), um gás (GC), ou um fluido supercrítico (cromatografia de fluido supercrítico-fluido, SFC). A fase móvel consiste na amostra separada/analisada e no solvente que move a amostra através da coluna. No caso de HPLC a fase móvel consiste em um solvente não-polar (s) como o hexano em fase normal ou um solvente polar, como o metanol na cromatografia de fase reversa e a amostra sendo separada. A fase móvel se move através da coluna de cromatografia (a fase estacionária) onde a amostra interage com a fase estacionária e é separada.
- Cromatografia preparatória – o uso de cromatografia para purificar quantidades suficientes de uma substância para uso posterior, em vez de análise.
- Tempo de retenção – o tempo característico que leva para um determinado analyte passar pelo sistema (da entrada da coluna ao detector) em condições definidas. Ver também: Índice de retenção de Kovats
- Amostra – a matéria analisada na cromatografia. Pode consistir de um único componente ou pode ser uma mistura de componentes. Quando a amostra é tratada no curso de uma análise, a fase ou as fases que contêm os analitos de interesse é/são referidas como a amostra, enquanto que tudo fora de interesse separado da amostra antes ou no curso da análise é referido como desperdício.
- Solute – os componentes da amostra na cromatografia de partição.
- Solvente – qualquer substância capaz de solubilizar outra substância, e especialmente a fase móvel líquida na cromatografia líquida.
- Fase estacionária – a substância fixa no lugar para o procedimento de cromatografia. Exemplos incluem a camada de sílica em cromatografia de camada fina
- Detector – o instrumento utilizado para detecção qualitativa e quantitativa de analitos após separação.
A cromatografia é baseada no conceito de coeficiente de partição. Qualquer partição de soluto entre dois solventes imiscíveis. Quando tornamos um solvente imóvel (por adsorção em uma matriz de suporte sólido) e outro móvel, isso resulta nas aplicações mais comuns da cromatografia. Se o suporte da matriz, ou fase estacionária, for polar (por exemplo, papel, sílica, etc.), é cromatografia de fase direta e, se for apolar (C-18), é fase reversa.
Técnicas por forma de leito cromatográfico
Cromatografia em coluna
A cromatografia em coluna é uma técnica de separação na qual o leito estacionário está dentro de um tubo. As partículas da fase estacionária sólida ou do suporte revestido com uma fase estacionária líquida podem preencher todo o volume interno do tubo (coluna empacotada) ou ser concentradas sobre ou ao longo da parede interna do tubo, deixando um caminho aberto e irrestrito para a fase móvel em a parte central do tubo (coluna tubular aberta). As diferenças nas taxas de movimento através do meio são calculadas para diferentes tempos de retenção da amostra. Em 1978, W. Clark Still introduziu uma versão modificada da cromatografia em coluna chamada cromatografia em coluna flash (flash). A técnica é muito semelhante à cromatografia em coluna tradicional, exceto que o solvente é conduzido através da coluna pela aplicação de pressão positiva. Isso permitiu que a maioria das separações fosse realizada em menos de 20 minutos, com separações aprimoradas em comparação com o método antigo. Os sistemas modernos de cromatografia flash são vendidos como cartuchos de plástico pré-embalados e o solvente é bombeado através do cartucho. Os sistemas também podem ser conectados a detectores e coletores de frações, fornecendo automação. A introdução de bombas de gradiente resultou em separações mais rápidas e menos uso de solvente.
Na adsorção em leito expandido, um leito fluidizado é usado, em vez de uma fase sólida feita por um leito compactado. Isso permite a omissão de etapas iniciais de limpeza, como centrifugação e filtração, para caldos de cultura ou pastas de células quebradas.
A cromatografia de fosfocelulose utiliza a afinidade de ligação de muitas proteínas de ligação ao DNA para a fosfocelulose. Quanto mais forte for a interação de uma proteína com o DNA, maior será a concentração de sal necessária para eluir essa proteína.
Cromatografia planar
Cromatografia planar é uma técnica de separação na qual a fase estacionária está presente como ou em um plano. O plano pode ser um papel, servindo como tal ou impregnado por uma substância como leito estacionário (cromatografia em papel) ou uma camada de partículas sólidas espalhadas sobre um suporte como uma placa de vidro (cromatografia em camada delgada). Diferentes compostos na mistura da amostra percorrem distâncias diferentes de acordo com a intensidade com que interagem com a fase estacionária em comparação com a fase móvel. O fator de retenção específico (Rf) de cada produto químico pode ser usado para auxiliar na identificação de uma substância desconhecida.
Cromatografia de papel
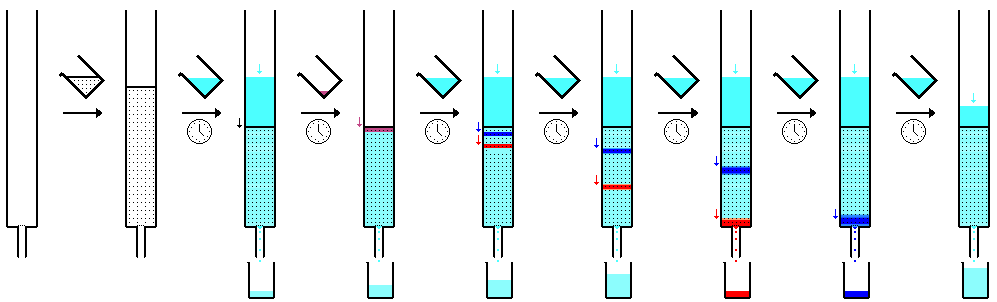
A cromatografia em papel é uma técnica que envolve a colocação de um pequeno ponto ou linha de solução de amostra em uma tira de papel de cromatografia. O papel é colocado em um recipiente com uma camada rasa de solvente e selado. À medida que o solvente sobe pelo papel, ele encontra a mistura da amostra, que começa a subir pelo papel com o solvente. Este papel é feito de celulose, uma substância polar, e os compostos dentro da mistura viajam mais longe se forem menos polares. Substâncias mais polares se ligam ao papel de celulose mais rapidamente e, portanto, não viajam tão longe
Cromatografia em camada fina (TLC)
A cromatografia em camada fina (TLC) é uma técnica de laboratório amplamente utilizada para separar diferentes compostos bioquímicos com base em suas atrações relativas às fases estacionária e móvel. É semelhante à cromatografia em papel. No entanto, em vez de usar uma fase estacionária de papel, envolve uma fase estacionária de uma fina camada de adsorvente como sílica gel, alumina ou celulose em um substrato plano e inerte. TLC é muito versátil; várias amostras podem ser separadas simultaneamente na mesma camada, tornando-a muito útil para aplicações de triagem, como testar níveis de drogas e pureza da água. A possibilidade de contaminação cruzada é baixa, pois cada separação é realizada em uma nova camada. Comparado ao papel, tem a vantagem de execuções mais rápidas, melhores separações, melhor análise quantitativa e a escolha entre diferentes adsorventes. Para resolução ainda melhor e separação mais rápida que utiliza menos solvente, TLC de alto desempenho pode ser usado. Um uso popular mais antigo era diferenciar cromossomos observando a distância em gel (a separação era uma etapa separada).
Cromatografia de deslocamento
O princípio básico da cromatografia de deslocamento é: Uma molécula com alta afinidade pela matriz de cromatografia (o deslocador) compete efetivamente pelos sítios de ligação e, portanto, desloca todas as moléculas com afinidades menores. Existem diferenças distintas entre a cromatografia de deslocamento e de eluição. No modo de eluição, as substâncias normalmente emergem de uma coluna em picos gaussianos estreitos. Uma ampla separação de picos, preferencialmente até a linha de base, é desejada para purificação máxima. A velocidade com que qualquer componente de uma mistura percorre a coluna no modo de eluição depende de muitos fatores. Mas para que duas substâncias viajem em velocidades diferentes e, assim, sejam resolvidas, deve haver diferenças substanciais em alguma interação entre as biomoléculas e a matriz cromatográfica. Os parâmetros operacionais são ajustados para maximizar o efeito dessa diferença. Em muitos casos, a separação da linha de base dos picos pode ser alcançada apenas com eluição de gradiente e baixas cargas de coluna. Assim, duas desvantagens para a cromatografia de modo de eluição, especialmente na escala preparativa, são a complexidade operacional, devido ao bombeamento de solvente gradiente, e baixo rendimento, devido a baixas cargas de coluna. A cromatografia de deslocamento tem vantagens sobre a cromatografia de eluição em que os componentes são resolvidos em zonas consecutivas de substâncias puras em vez de "picos". Como o processo aproveita a não linearidade das isotermas, uma alimentação de coluna maior pode ser separada em uma determinada coluna com os componentes purificados recuperados em concentrações significativamente mais altas.
Técnicas por estado físico da fase móvel
Cromatografia gasosa
A cromatografia gasosa (GC), também conhecida como cromatografia gás-líquido (GLC), é uma técnica de separação na qual a fase móvel é um gás. A separação por cromatografia gasosa é sempre realizada em uma coluna, que é tipicamente "empacotada" ou "capilar". As colunas empacotadas são os cavalos de trabalho rotineiros da cromatografia gasosa, sendo mais baratas e fáceis de usar e geralmente apresentando desempenho adequado. Colunas capilares geralmente fornecem resolução muito superior e, embora mais caras, estão se tornando amplamente utilizadas, especialmente para misturas complexas. Além disso, as colunas capilares podem ser divididas em três classes: colunas tubulares abertas de camada porosa (PLOT), tubulares abertas revestidas com parede (WCOT) e tubulares abertas revestidas com suporte (SCOT). As colunas PLOT são únicas de forma que a fase estacionária é adsorvida às paredes da coluna, enquanto as colunas WCOT têm uma fase estacionária que é quimicamente ligada às paredes. As colunas SCOT são, de certa forma, a combinação dos dois tipos mencionados, de forma que possuem partículas de suporte aderidas às paredes da coluna, mas essas partículas possuem fase líquida quimicamente ligada a elas. Ambos os tipos de coluna são feitos de materiais não adsorventes e quimicamente inertes. Aço inoxidável e vidro são os materiais usuais para colunas empacotadas e quartzo ou sílica fundida para colunas capilares.
A cromatografia gasosa é baseada em um equilíbrio de partição do analito entre uma fase estacionária líquida sólida ou viscosa (geralmente um material à base de silicone líquido) e um gás móvel (mais frequentemente hélio). A fase estacionária é aderida ao interior de um vidro de pequeno diâmetro (geralmente 0,53 – 0,18 mm de diâmetro interno) de vidro ou tubo de sílica fundida (uma coluna capilar) ou uma matriz sólida dentro de um tubo de metal maior (uma coluna empacotada). É amplamente utilizado em química analítica; embora as altas temperaturas usadas no GC o tornem inadequado para biopolímeros ou proteínas de alto peso molecular (o calor os desnatura), frequentemente encontrados em bioquímica, ele é adequado para uso na petroquímica, monitoramento e remediação ambiental e campos químicos industriais. Também é amplamente utilizado na pesquisa química.
Cromatografia líquida
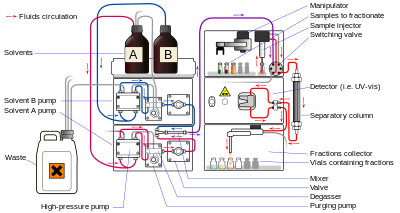
A cromatografia líquida (LC) é uma técnica de separação na qual a fase móvel é um líquido. Pode ser realizada em coluna ou plano. A cromatografia líquida atual, que geralmente utiliza partículas de embalagem muito pequenas e uma pressão relativamente alta, é chamada de cromatografia líquida de alto desempenho.
Em HPLC, a amostra é forçada por um líquido a alta pressão (a fase móvel) através de uma coluna que é preenchida com uma fase estacionária composta por partículas de formato irregular ou esférico, uma camada monolítica porosa ou uma membrana porosa. Monólitos são "meios cromatográficos semelhantes a esponjas" e são constituídos por um bloco interminável de partes orgânicas ou inorgânicas. O HPLC é historicamente dividido em duas subclasses diferentes com base na polaridade das fases móvel e estacionária. Métodos nos quais a fase estacionária é mais polar que a fase móvel (por exemplo, tolueno como fase móvel, sílica como fase estacionária) são denominados cromatografia líquida de fase normal (NPLC) e o oposto (por exemplo, mistura de água-metanol como fase móvel). fase e C18 (octadecilsilil) como a fase estacionária) é denominada cromatografia líquida de fase reversa (RPLC).
Técnicas específicas sob este título amplo estão listadas abaixo.
Cromatografia de afinidade
A cromatografia de afinidade é baseada na interação não covalente seletiva entre um analito e moléculas específicas. É muito específico, mas não muito robusto. É freqüentemente usado em bioquímica na purificação de proteínas ligadas a tags. Essas proteínas de fusão são marcadas com compostos como His-tags, biotina ou antígenos, que se ligam especificamente à fase estacionária. Após a purificação, essas tags geralmente são removidas e a proteína pura é obtida.
A cromatografia de afinidade geralmente utiliza a afinidade de uma biomolécula por um metal (Zn, Cu, Fe, etc.). As colunas geralmente são preparadas manualmente. As colunas de afinidade tradicionais são usadas como uma etapa preparatória para eliminar biomoléculas indesejadas.
No entanto, existem técnicas de cromatografia líquida que utilizam propriedades de cromatografia de afinidade. A cromatografia de afinidade de metal imobilizado (IMAC) é útil para separar as moléculas acima mencionadas com base na afinidade relativa para o metal. Freqüentemente, essas colunas podem ser carregadas com diferentes metais para criar uma coluna com uma afinidade direcionada.
Cromatografia de fluido supercrítico
A cromatografia de fluido supercrítico é uma técnica de separação na qual a fase móvel é um fluido acima e relativamente próximo de sua temperatura e pressão críticas.
Técnicas por mecanismo de separação
Cromatografia de troca iônica
A cromatografia de troca iônica (geralmente chamada de cromatografia iônica) usa um mecanismo de troca iônica para separar analitos com base em suas respectivas cargas. Geralmente é executado em colunas, mas também pode ser útil no modo planar. A cromatografia de troca iônica usa uma fase estacionária carregada para separar compostos carregados, incluindo ânions, cátions, aminoácidos, peptídeos e proteínas. Nos métodos convencionais, a fase estacionária é uma resina de troca iônica que carrega grupos funcionais carregados que interagem com grupos de cargas opostas do composto a ser retido. Existem dois tipos de cromatografia de troca iônica: troca catiônica e troca aniônica. Na Cromatografia de Troca Catiônica a fase estacionária tem carga negativa e o íon trocável é um cátion, enquanto na Cromatografia de Troca Aniônica a fase estacionária tem carga positiva e o íon trocável é um ânion. A cromatografia de troca iônica é comumente usada para purificar proteínas usando FPLC.
Cromatografia de exclusão de tamanho
A cromatografia de exclusão de tamanho (SEC) também é conhecida como cromatografia de permeação em gel (GPC) ou cromatografia de filtração em gel e separa moléculas de acordo com seu tamanho (ou mais precisamente de acordo ao seu diâmetro hidrodinâmico ou volume hidrodinâmico). Moléculas menores são capazes de entrar nos poros do meio e, portanto, moléculas são aprisionadas e removidas do fluxo da fase móvel. O tempo médio de residência nos poros depende do tamanho efetivo das moléculas do analito. No entanto, as moléculas que são maiores do que o tamanho médio dos poros do empacotamento são excluídas e, portanto, não sofrem praticamente nenhuma retenção; tais espécies são as primeiras a serem eluídas. Geralmente é uma técnica de cromatografia de baixa resolução e, portanto, muitas vezes é reservada para o acabamento final, "polimento" etapa de uma purificação. Também é útil para determinar a estrutura terciária e a estrutura quaternária de proteínas purificadas, especialmente porque pode ser realizada em condições de solução nativa.
Separação cromatográfica de adsorção em leito expandido
Uma coluna de adsorção cromatográfica de leito expandido (EBA) para um processo de separação bioquímica compreende um distribuidor de líquido de equalização de pressão com uma função de autolimpeza abaixo de uma placa de peneira de bloqueio porosa na parte inferior do leito expandido, um conjunto de bico de parte superior com um função de limpeza de retrolavagem na parte superior do leito expandido, uma melhor distribuição do licor de alimentação adicionado ao leito expandido, garantindo que o fluido passado pela camada do leito expandido exiba um estado de fluxo de pistão. A camada de leito expandido exibe um estado de fluxo de pistão. A coluna de separação cromatográfica de leito expandido tem vantagens de aumentar a eficiência de separação do leito expandido.
A cromatografia de adsorção em leito expandido (EBA) é uma técnica conveniente e eficaz para a captura de proteínas diretamente da amostra bruta não clarificada. Na cromatografia EBA, o leito sedimentado é primeiro expandido pelo fluxo ascendente do tampão de equilíbrio. A alimentação bruta, uma mistura de proteínas solúveis, contaminantes, células e detritos celulares, é então passada para cima através do leito expandido. As proteínas-alvo são capturadas no adsorvente, enquanto partículas e contaminantes passam. Uma alteração no tampão de eluição, mantendo o fluxo ascendente, resulta na dessorção da proteína alvo no modo de leito expandido. Alternativamente, se o fluxo for reverso, as partículas adsorvidas se assentarão rapidamente e as proteínas poderão ser dessorvidas por um tampão de eluição. O modo usado para eluição (leito expandido versus leito fixo) depende das características da alimentação. Após a eluição, o adsorvente é limpo com uma solução de limpeza no local (CIP) predefinida, com limpeza seguida de regeneração da coluna (para uso posterior) ou armazenamento.
Técnicas especiais
Cromatografia de fase reversa
A cromatografia de fase reversa (RPC) é qualquer procedimento de cromatografia líquida em que a fase móvel é significativamente mais polar do que a fase estacionária. É assim chamado porque na cromatografia líquida de fase normal, a fase móvel é significativamente menos polar do que a fase estacionária. Moléculas hidrofóbicas na fase móvel tendem a adsorver na fase estacionária relativamente hidrofóbica. Moléculas hidrofílicas na fase móvel tenderão a eluir primeiro. As colunas de separação compreendem tipicamente uma cadeia de carbono C8 ou C18 ligada a um substrato de partícula de sílica.
Cromatografia de interação hidrofóbica
A cromatografia de interação hidrofóbica (HIC) é uma técnica analítica e de purificação que separa analitos, como proteínas, com base em interações hidrofóbicas entre esse analito e a matriz cromatográfica. Ele pode fornecer uma abordagem ortogonal não desnaturante para a separação de fase reversa, preservando as estruturas nativas e potencialmente a atividade da proteína. Na cromatografia de interação hidrofóbica, o material da matriz é levemente substituído por grupos hidrofóbicos. Esses grupos podem variar de grupos metil, etil, propil, butil, octil ou fenil. Em altas concentrações de sal, as cadeias laterais não polares na superfície das proteínas "interagem" com os grupos hidrofóbicos; ou seja, ambos os tipos de grupos são excluídos pelo solvente polar (os efeitos hidrofóbicos são aumentados pelo aumento da força iônica). Assim, a amostra é aplicada à coluna em um tampão altamente polar, o que conduz a uma associação de manchas hidrofóbicas no analito com a fase estacionária. O eluente é tipicamente um tampão aquoso com concentrações decrescentes de sal, concentrações crescentes de detergente (que interrompe as interações hidrofóbicas) ou alterações no pH. De importância crítica é o tipo de sal usado, com mais sais kosmotrópicos, conforme definido pela série Hofmeister, fornecendo a maior estruturação da água ao redor da molécula e a pressão hidrofóbica resultante. O sulfato de amônio é freqüentemente usado para esse fim. A adição de solventes orgânicos ou outros constituintes menos polares pode ajudar a melhorar a resolução.
Em geral, a Cromatografia de Interação Hidrofóbica (HIC) é vantajosa se a amostra for sensível à mudança de pH ou a solventes agressivos normalmente usados em outros tipos de cromatografia, mas não a altas concentrações de sal. Normalmente, é a quantidade de sal no tampão que varia. Em 2012, Müller e Franzreb descreveram os efeitos da temperatura na HIC usando albumina sérica bovina (BSA) com quatro tipos diferentes de resina hidrofóbica. O estudo alterou a temperatura para efetuar a afinidade de ligação de BSA na matriz. Concluiu-se que a temperatura de ciclagem de 50 a 10 graus não seria adequada para lavar efetivamente todo o BSA da matriz, mas poderia ser muito eficaz se a coluna fosse usada apenas algumas vezes. Usar a temperatura para efetuar mudanças permite que os laboratórios cortem custos na compra de sal e economizem dinheiro.
Se as altas concentrações de sal junto com as flutuações de temperatura quiserem ser evitadas, você pode usar um mais hidrofóbico para competir com sua amostra para eluí-la. [fonte] Este chamado método independente de sal de HIC mostrou um isolamento direto da Imunoglobulina G Humana (IgG) do soro com rendimento satisfatório e usou Beta-ciclodextrina como um competidor para deslocar IgG da matriz. Isso abre amplamente a possibilidade de usar HIC com amostras que são sensíveis ao sal, pois sabemos que altas concentrações de sal precipitam proteínas.
Cromatografia hidrodinâmica
A cromatografia hidrodinâmica (HDC) é derivada do fenômeno observado que grandes gotículas se movem mais rápido do que as pequenas. Em uma coluna, isso acontece porque o centro de massa de gotículas maiores é impedido de ser tão perto dos lados da coluna como gotículas menores por causa de seu tamanho geral maior. As gotículas maiores eluirão primeiro do meio da coluna enquanto as gotículas menores ficam para os lados da coluna e elutam por último. Esta forma de cromatografia é útil para separar os analitos por massa molar, tamanho, forma e estrutura quando usado em conjunto com detectores de dispersão de luz, viscometers e refratômetros. Os dois tipos principais de HDC são tubo aberto e coluna embalado. O tubo aberto oferece tempos de separação rápidos para partículas pequenas, enquanto o HDC da coluna embalada pode aumentar a resolução e é mais adequado para partículas com uma massa molecular média maior do que 10.5{displaystyle 10^{5}} Daltons. HDC difere de outros tipos de cromatografia porque a separação só ocorre no volume intersticial, que é o volume que envolve e entre partículas em uma coluna embalada.
HDC compartilha a mesma ordem de eluição que a Cromatografia de Exclusão de Tamanho (SEC), mas os dois processos ainda variam de várias maneiras. Em um estudo comparando os dois tipos de separação, Isenberg, Brewer, Côté e Striegel usam ambos os métodos para caracterização de polissacarídeos e concluem que o HDC acoplado com dispersão de luz multiangular (MALS) alcança uma distribuição de massa molar mais precisa quando comparado ao MALS off-line do que SEC em muito menos tempo. Isso se deve em grande parte ao SEC ser uma técnica mais destrutiva por causa dos poros na coluna degradando o analito durante a separação, o que tende a afetar a distribuição de massa. No entanto, a principal desvantagem do HDC é a baixa resolução dos picos do analito, o que torna o SEC uma opção mais viável quando usado com produtos químicos que não são facilmente degradáveis e onde a eluição rápida não é importante.
O HDC desempenha um papel especialmente importante no campo da microfluídica. O primeiro aparelho bem-sucedido para o sistema HDC-on-a-chip foi proposto por Chmela, et al. em 2002. Seu projeto foi capaz de obter separações usando um canal de 80 mm de comprimento na escala de tempo de 3 minutos para partículas com diâmetros variando de 26 a 110 nm, mas os autores expressaram a necessidade de melhorar os parâmetros de retenção e dispersão. Em uma publicação de 2010 de Jellema, Markesteijn, Westerweel e Verpoorte, a implementação de HDC com um fluxo bidirecional recirculante resultou em separação baseada em tamanho de alta resolução com um canal de apenas 3 mm de comprimento. Ter um canal tão curto e alta resolução foi considerado especialmente impressionante, considerando que estudos anteriores usaram canais com 80 mm de comprimento. Para uma aplicação biológica, em 2007, Huh, et al. propuseram um dispositivo de classificação microfluídica baseado em HDC e gravidade, que foi útil para impedir que partículas potencialmente perigosas com diâmetro maior que 6 mícrons entrassem na corrente sanguínea ao injetar agentes de contraste em ultrassom. Este estudo também fez avanços para a sustentabilidade ambiental em microfluídica devido à falta de eletrônica externa conduzindo o fluxo, o que veio como uma vantagem de usar um dispositivo baseado em gravidade.
Cromatografia bidimensional
Em alguns casos, a seletividade fornecida pelo uso de uma coluna pode ser insuficiente para fornecer resolução de analitos em amostras complexas. A cromatografia bidimensional visa aumentar a resolução desses picos por meio de uma segunda coluna com diferentes propriedades físico-químicas (classificação química). Como o mecanismo de retenção neste novo suporte sólido é diferente da separação de primeira dimensão, pode ser possível separar por cromatografia bidimensional compostos indistinguíveis por cromatografia unidimensional. Além disso, a separação na segunda dimensão ocorre mais rapidamente do que na primeira dimensão. Um exemplo de separação bidimensional TLC é onde a amostra é colocada em um canto de uma placa quadrada, revelada, seca ao ar, depois girada em 90° e geralmente re-revelada em um segundo sistema de solvente. A cromatografia bidimensional pode ser aplicada a separações GC ou LC. Este método de separação também pode ser usado em uma abordagem de corte de coração, onde regiões específicas de interesse na primeira dimensão são selecionadas para separação pela segunda dimensão, ou em uma abordagem abrangente, onde todos os analitos da primeira dimensão passam pela segunda dimensão separação.
Cromatografia de leito móvel simulada
A técnica de leito móvel simulado (SMB) é uma variante da cromatografia líquida de alta performance; é usado para separar partículas e/ou compostos químicos que seriam difíceis ou impossíveis de resolver de outra forma. Essa separação aumentada é provocada por um arranjo de válvula e coluna que é usado para alongar a fase estacionária indefinidamente. Na técnica de leito móvel da cromatografia preparativa, a entrada de alimentação e a recuperação do analito são simultâneas e contínuas, mas devido a dificuldades práticas com um leito móvel contínuo, a técnica de leito móvel simulado foi proposta. Na técnica de leito móvel simulado, em vez de mover o leito, a entrada da amostra e as posições de saída do analito são movidas continuamente, dando a impressão de um leito móvel. A verdadeira cromatografia de leito móvel (TMBC) é apenas um conceito teórico. Sua simulação, SMBC, é obtida pelo uso de uma multiplicidade de colunas em série e um complexo arranjo de válvulas, que fornece alimentação de amostra e solvente, além de retirada de analito e resíduos em locais apropriados de qualquer coluna, permitindo a comutação em intervalos regulares a entrada da amostra em uma direção, a entrada do solvente na direção oposta, ao mesmo tempo em que muda as posições de retirada do analito e do resíduo de forma apropriada também.
Cromatografia de gás de pirólise
Pirólise–cromatografia gasosa–espectrometria de massa é um método de análise química no qual a amostra é aquecida até a decomposição para produzir moléculas menores que são separadas por cromatografia gasosa e detectadas usando espectrometria de massa.
A pirólise é a decomposição térmica de materiais em uma atmosfera inerte ou vácuo. A amostra é colocada em contato direto com um fio de platina ou colocada em um tubo de amostra de quartzo e aquecida rapidamente a 600–1000 °C. Dependendo da aplicação, temperaturas ainda mais altas são usadas. Três diferentes técnicas de aquecimento são usadas em pirolisadores reais: forno isotérmico, aquecimento indutivo (filamento Curie Point) e aquecimento resistivo usando filamentos de platina. Moléculas grandes se dividem em seus pontos mais fracos e produzem fragmentos menores e mais voláteis. Esses fragmentos podem ser separados por cromatografia gasosa. Os cromatogramas de pirólise GC são tipicamente complexos porque uma ampla gama de diferentes produtos de decomposição é formada. Os dados podem ser usados como impressões digitais para provar a identidade do material ou os dados GC/MS são usados para identificar fragmentos individuais para obter informações estruturais. Para aumentar a volatilidade dos fragmentos polares, vários reagentes de metilação podem ser adicionados a uma amostra antes da pirólise.
Além do uso de pirolisadores dedicados, a pirólise GC de amostras sólidas e líquidas pode ser realizada diretamente dentro dos injetores do vaporizador de temperatura programável (PTV) que fornecem aquecimento rápido (até 30°C/s) e altas temperaturas máximas de 600–650 ° C. Isso é suficiente para algumas aplicações de pirólise. A principal vantagem é que nenhum instrumento dedicado precisa ser adquirido e a pirólise pode ser realizada como parte da análise de GC de rotina. Nesse caso, devem ser usados revestimentos de entrada de GC de quartzo. Dados quantitativos podem ser adquiridos, e bons resultados de derivatização dentro do injetor PTV também são publicados.
Cromatografia líquida de proteína rápida
A cromatografia líquida de proteína rápida (FPLC) é uma forma de cromatografia líquida frequentemente usada para analisar ou purificar misturas de proteínas. Como em outras formas de cromatografia, a separação é possível porque os diferentes componentes de uma mistura têm diferentes afinidades por dois materiais, um fluido em movimento (a "fase móvel") e um sólido poroso (a fase estacionária). Em FPLC, a fase móvel é uma solução aquosa ou "tampão". A vazão do buffer é controlada por uma bomba de deslocamento positivo e normalmente é mantida constante, enquanto a composição do buffer pode ser variada extraindo fluidos em diferentes proporções de dois ou mais reservatórios externos. A fase estacionária é uma resina composta de esferas, geralmente de agarose reticulada, acondicionadas em uma coluna cilíndrica de vidro ou plástico. As resinas FPLC estão disponíveis em uma ampla variedade de tamanhos de grânulos e ligantes de superfície, dependendo da aplicação.
Cromatografia em contracorrente
A cromatografia em contracorrente (CCC) é um tipo de cromatografia líquido-líquido, em que as fases estacionária e móvel são líquidas e a fase estacionária líquida é mantida estagnada por uma forte força centrífuga.
Cromatografia hidrodinâmica em contracorrente (CCC)
O princípio operacional do instrumento CCC requer uma coluna que consiste em um tubo aberto enrolado em torno de uma bobina. A bobina é girada em um movimento giratório de eixo duplo (um cardióide), que faz com que um campo de gravidade variável (G) atue na coluna durante cada rotação. Este movimento faz com que a coluna tenha um passo de particionamento por revolução e os componentes da amostra se separem na coluna devido ao seu coeficiente de particionamento entre as duas fases líquidas imiscíveis usadas. Existem muitos tipos de CCC disponíveis hoje. Estes incluem HSCCC (High Speed CCC) e HPCCC (High Performance CCC). O HPCCC é a versão mais recente e com melhor desempenho da instrumentação disponível atualmente.
Cromatografia de partição centrífuga (CPC)
No instrumento CPC (cromatografia de partição centrífuga ou cromatografia hidrostática em contracorrente), a coluna consiste em uma série de células interligadas por dutos ligados a um rotor. Este rotor gira em seu eixo central criando o campo centrífugo necessário para manter a fase estacionária no lugar. O processo de separação no CPC é regido apenas pela partição de solutos entre as fases estacionária e móvel, cujo mecanismo pode ser facilmente descrito usando os coeficientes de partição (KD) de solutos. Os instrumentos CPC estão disponíveis comercialmente para separações em escala laboratorial, piloto e industrial com diferentes tamanhos de colunas variando de cerca de 10 mililitros a 10 litros de volume.
Cromatografia periódica em contracorrente
Em contraste com a cromatografia em contracorrente (veja acima), a cromatografia periódica em contracorrente (PCC) usa uma fase estacionária sólida e apenas uma fase móvel líquida. Assim, é muito mais semelhante à cromatografia de afinidade convencional do que à cromatografia de contracorrente. O PCC usa várias colunas, que durante a fase de carregamento são conectadas em linha. Este modo permite sobrecarregar a primeira coluna desta série sem perder produto, que já rompe a coluna antes que a resina esteja totalmente saturada. O produto inovador é capturado na(s) coluna(s) subsequente(s). Em uma próxima etapa, as colunas são desconectadas umas das outras. A primeira coluna é lavada e eluída, enquanto a(s) outra(s) coluna(s) ainda estão sendo carregadas. Uma vez que a (inicialmente) primeira coluna é reequilibrada, ela é reintroduzida no fluxo de carregamento, mas como última coluna. O processo então continua de forma cíclica.
Cromatografia quiral
A cromatografia quiral envolve a separação de estereoisômeros. No caso dos enantiômeros, estes não apresentam diferenças químicas ou físicas além de serem imagens especulares tridimensionais. Para permitir que as separações quirais ocorram, a fase móvel ou a fase estacionária devem se tornar quirais, dando diferentes afinidades entre os analitos. Colunas de HPLC de cromatografia quiral (com uma fase estacionária quiral) em fase normal e reversa estão disponíveis comercialmente.
A cromatografia convencional é incapaz de separar misturas racêmicas de enantiômeros. No entanto, em alguns casos, misturas não racêmicas de enantiômeros podem ser separadas inesperadamente por cromatografia líquida convencional (por exemplo, HPLC sem fase móvel quiral ou fase estacionária).
Cromatografia aquosa de fase normal
A cromatografia aquosa de fase normal (ANP) é caracterizada pelo comportamento de eluição do modo clássico de fase normal (ou seja, onde a fase móvel é significativamente menos polar do que a fase estacionária) em que a água é um dos componentes do sistema solvente da fase móvel. Distingue-se da cromatografia líquida de interação hidrofílica (HILIC) em que o mecanismo de retenção é devido à adsorção em vez de particionamento.
Aplicativos
A cromatografia é usada em muitos campos, incluindo a indústria farmacêutica, a indústria de alimentos e bebidas, a indústria química, a ciência forense, a análise ambiental e os hospitais.
Contenido relacionado
Molécula diatômica
Polissacarideo
Hidrófobo