Cristal
Um cristal ou sólido cristalino é um material sólido cujos constituintes (como átomos, moléculas ou íons) estão dispostos em uma estrutura microscópica altamente ordenada, formando um cristal treliça que se estende em todas as direções. Além disso, monocristais macroscópicos são geralmente identificáveis por sua forma geométrica, consistindo em faces planas com orientações específicas e características. O estudo científico de cristais e formação de cristais é conhecido como cristalografia. O processo de formação de cristais por meio de mecanismos de crescimento de cristais é chamado de cristalização ou solidificação.
A palavra cristal deriva da palavra grega antiga κρύσταλλος (krustallos), significando tanto & #34;gelo" e "cristal de rocha", do κρύος (kruos), "frio gelado, geada".
Exemplos de cristais grandes incluem flocos de neve, diamantes e sal de cozinha. A maioria dos sólidos inorgânicos não são cristais, mas policristais, ou seja, muitos cristais microscópicos fundidos em um único sólido. Os policristais incluem a maioria dos metais, rochas, cerâmica e gelo. Uma terceira categoria de sólidos são os sólidos amorfos, onde os átomos não possuem nenhuma estrutura periódica. Exemplos de sólidos amorfos incluem vidro, cera e muitos plásticos.
Apesar do nome, cristal de chumbo, vidro de cristal e produtos relacionados não são cristais, mas sim tipos de vidro, ou seja, sólidos amorfos.
Cristais, ou sólidos cristalinos, são freqüentemente usados em práticas pseudocientíficas como a cristaloterapia e, junto com pedras preciosas, às vezes são associados a feitiços nas crenças wiccanas e movimentos religiosos relacionados.
Estrutura cristalina (microscópica)
A definição científica de um "cristal" baseia-se no arranjo microscópico dos átomos dentro dele, chamado de estrutura cristalina. Um cristal é um sólido onde os átomos formam um arranjo periódico. (Os quasicristais são uma exceção, veja abaixo).
Nem todos os sólidos são cristais. Por exemplo, quando a água líquida começa a congelar, a mudança de fase começa com pequenos cristais de gelo que crescem até se fundirem, formando uma estrutura policristalina. No bloco final de gelo, cada um dos pequenos cristais (chamados "cristalitos" ou "grãos") é um verdadeiro cristal com um arranjo periódico de átomos, mas o policristal inteiro não não tem um arranjo periódico de átomos, porque o padrão periódico é quebrado nos contornos de grão. A maioria dos sólidos inorgânicos macroscópicos são policristalinos, incluindo quase todos os metais, cerâmica, gelo, rochas, etc. ou não cristalino. Estes não têm ordem periódica, mesmo microscopicamente. Existem diferenças distintas entre sólidos cristalinos e sólidos amorfos: mais notavelmente, o processo de formação de um vidro não libera o calor latente de fusão, mas a formação de um cristal sim.
Uma estrutura cristalina (um arranjo de átomos em um cristal) é caracterizada por sua célula unitária, uma pequena caixa imaginária contendo um ou mais átomos em um arranjo espacial específico. As células unitárias são empilhadas no espaço tridimensional para formar o cristal.
A simetria de um cristal é limitada pela exigência de que as células unitárias se empilhem perfeitamente sem lacunas. Existem 219 simetrias cristalinas possíveis (230 é comumente citada, mas trata os equivalentes quirais como entidades separadas), chamadas de grupos espaciais cristalográficos. Estes são agrupados em 7 sistemas de cristal, como sistema de cristal cúbico (onde os cristais podem formar cubos ou caixas retangulares, como a halita mostrada à direita) ou sistema de cristal hexagonal (onde os cristais podem formar hexágonos, como gelo de água comum).
Rostos e formas de cristal

Os cristais são comumente reconhecidos, macroscopicamente, por sua forma, constituída por faces planas com ângulos agudos. Essas características de forma não são necessárias para um cristal - um cristal é cientificamente definido por seu arranjo atômico microscópico, não por sua forma macroscópica - mas a forma macroscópica característica geralmente está presente e é fácil de ver.
Cristais euédricos são aqueles que têm faces planas óbvias e bem formadas. Cristais anédricos não, geralmente porque o cristal é um grão em um sólido policristalino.
As faces planas (também chamadas de facetas) de um cristal euédrico são orientadas de uma maneira específica em relação ao arranjo atômico subjacente do cristal: são planos de índice de Miller relativamente baixo. Isso ocorre porque algumas orientações de superfície são mais estáveis do que outras (menor energia de superfície). À medida que um cristal cresce, novos átomos ligam-se facilmente às partes mais ásperas e menos estáveis da superfície, mas com menos facilidade às superfícies planas e estáveis. Portanto, as superfícies planas tendem a ficar maiores e mais lisas, até que toda a superfície do cristal consista dessas superfícies planas. (Veja o diagrama à direita.)
Uma das técnicas mais antigas na ciência da cristalografia consiste em medir as orientações tridimensionais das faces de um cristal e usá-las para inferir a simetria do cristal subjacente.
As formas cristalográficas de um cristal são conjuntos de possíveis faces do cristal que estão relacionadas por uma das simetrias do cristal. Por exemplo, os cristais de galena geralmente assumem a forma de cubos, e as seis faces do cubo pertencem a uma forma cristalográfica que exibe uma das simetrias do sistema cristalino isométrico. Galena também às vezes cristaliza como octaedros, e as oito faces do octaedro pertencem a outra forma cristalográfica refletindo uma simetria diferente do sistema isométrico. Uma forma cristalográfica é descrita colocando os índices de Miller de uma de suas faces entre colchetes. Por exemplo, a forma octaédrica é escrita como {111}, e as outras faces na forma são indicadas pela simetria do cristal.
As formas podem ser fechadas, o que significa que a forma pode envolver completamente um volume de espaço, ou aberta, o que significa que não pode. As formas cúbica e octaédrica são exemplos de formas fechadas. Todas as formas do sistema isométrico são fechadas, enquanto todas as formas dos sistemas cristalinos monoclínicos e triclínicos são abertas. As faces de um cristal podem pertencer todas à mesma forma fechada ou podem ser uma combinação de múltiplas formas abertas ou fechadas.
O hábito de um cristal é sua forma externa visível. Isso é determinado pela estrutura do cristal (que restringe as possíveis orientações das facetas), pela química e ligação específicas do cristal (que podem favorecer alguns tipos de facetas em detrimento de outras) e pelas condições sob as quais o cristal se formou.
Ocorrência na natureza
Rochas
Em volume e peso, as maiores concentrações de cristais na Terra fazem parte de seu leito rochoso sólido. Cristais encontrados em rochas normalmente variam em tamanho de uma fração de milímetro a vários centímetros de diâmetro, embora cristais excepcionalmente grandes sejam ocasionalmente encontrados. Em 1999, o maior cristal de ocorrência natural conhecido no mundo é um cristal de berilo de Malakialina, Madagascar, com 18 m (59 pés) de comprimento e 3,5 m (11 pés) de diâmetro e pesando 380.000 kg (840.000 lb).
Alguns cristais formaram-se por processos magmáticos e metamórficos, dando origem a grandes massas de rocha cristalina. A grande maioria das rochas ígneas é formada a partir de magma fundido e o grau de cristalização depende principalmente das condições em que solidificaram. Rochas como o granito, que esfriam muito lentamente e sob grandes pressões, cristalizaram-se completamente; mas muitos tipos de lava foram despejados na superfície e resfriados muito rapidamente, e neste último grupo é comum uma pequena quantidade de matéria amorfa ou vítrea. Outras rochas cristalinas, as rochas metamórficas como mármores, micaxistos e quartzitos, são recristalizadas. Isso significa que eles eram inicialmente rochas fragmentárias como calcário, xisto e arenito e nunca estiveram em estado fundido nem totalmente em solução, mas as condições de alta temperatura e pressão do metamorfismo agiram sobre eles apagando suas estruturas originais e induzindo a recristalização em o estado sólido.
Outros cristais de rocha se formaram a partir da precipitação de fluidos, geralmente água, para formar drusas ou veios de quartzo. Evaporitos como halita, gesso e alguns calcários foram depositados a partir de soluções aquosas, principalmente devido à evaporação em climas áridos.
Gelo
Gelo à base de água na forma de neve, gelo marinho e geleiras são estruturas cristalinas/policristalinas comuns na Terra e em outros planetas. Um único floco de neve é um único cristal ou uma coleção de cristais, enquanto um cubo de gelo é um policristal.
Cristais organigênicos
Muitos organismos vivos são capazes de produzir cristais, por exemplo calcita e aragonita no caso da maioria dos moluscos ou hidroxiapatita no caso dos vertebrados.
Polimorfismo e alotropia
O mesmo grupo de átomos geralmente pode se solidificar de muitas maneiras diferentes. Polimorfismo é a capacidade de um sólido existir em mais de uma forma cristalina. Por exemplo, o gelo de água é normalmente encontrado na forma hexagonal Ice Ih, mas também pode existir como o Ice cúbico Ic, o gelo romboédrico II e muitas outras formas. Os diferentes polimorfos são geralmente chamados de diferentes fases.
Além disso, os mesmos átomos podem formar fases não cristalinas. Por exemplo, a água também pode formar gelo amorfo, enquanto o SiO2 pode formar sílica fundida (um vidro amorfo) e quartzo (um cristal). Da mesma forma, se uma substância pode formar cristais, também pode formar policristais.
Para elementos químicos puros, o polimorfismo é conhecido como alotropia. Por exemplo, diamante e grafite são duas formas cristalinas de carbono, enquanto o carbono amorfo é uma forma não cristalina. Os polimorfos, apesar de terem os mesmos átomos, podem ter propriedades muito diferentes. Por exemplo, o diamante está entre as substâncias mais duras conhecidas, enquanto o grafite é tão macio que é usado como lubrificante.
O poliamorfismo é um fenômeno semelhante em que os mesmos átomos podem existir em mais de uma forma sólida amorfa.
Cristalização
Cristalização é o processo de formação de uma estrutura cristalina a partir de um fluido ou de materiais dissolvidos em um fluido. (Mais raramente, os cristais podem ser depositados diretamente do gás; veja deposição de filme fino e epitaxia.)
A cristalização é um campo complexo e amplamente estudado, porque dependendo das condições, um único fluido pode se solidificar em muitas formas diferentes possíveis. Pode formar um único cristal, talvez com várias fases possíveis, estequiometrias, impurezas, defeitos e hábitos. Ou pode formar um policristal, com várias possibilidades de tamanho, disposição, orientação e fase de seus grãos. A forma final do sólido é determinada pelas condições sob as quais o fluido está sendo solidificado, como a química do fluido, a pressão ambiente, a temperatura e a velocidade com que todos esses parâmetros estão mudando.
Técnicas industriais específicas para produzir grandes monocristais (chamados boules) incluem o processo Czochralski e a técnica Bridgman. Outros métodos menos exóticos de cristalização podem ser usados, dependendo das propriedades físicas da substância, incluindo síntese hidrotérmica, sublimação ou simplesmente cristalização à base de solvente.
Grandes cristais individuais podem ser criados por processos geológicos. Por exemplo, cristais de selenita com mais de 10 m são encontrados na Caverna dos Cristais em Naica, México. Para mais detalhes sobre a formação de cristais geológicos, veja acima.
Os cristais também podem ser formados por processos biológicos, veja acima. Por outro lado, alguns organismos têm técnicas especiais para impedir a ocorrência de cristalização, como proteínas anticongelantes.
Defeitos, impurezas e geminação
Um cristal ideal tem cada átomo em um padrão perfeito e exatamente repetitivo. No entanto, na realidade, a maioria dos materiais cristalinos apresenta uma variedade de defeitos cristalográficos, locais onde o padrão do cristal é interrompido. Os tipos e estruturas desses defeitos podem ter um efeito profundo nas propriedades dos materiais.
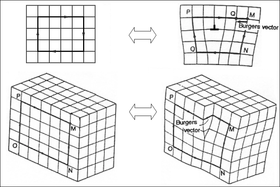
Alguns exemplos de defeitos cristalográficos incluem defeitos de vacância (um espaço vazio onde um átomo deveria caber), defeitos intersticiais (um átomo extra espremido onde não cabe) e deslocamentos (veja a figura à direita). As discordâncias são especialmente importantes na ciência dos materiais, porque ajudam a determinar a resistência mecânica dos materiais.
Outro tipo comum de defeito cristalográfico é uma impureza, o que significa que o "errado" tipo de átomo está presente em um cristal. Por exemplo, um cristal perfeito de diamante conteria apenas átomos de carbono, mas um cristal real talvez também pudesse conter alguns átomos de boro. Essas impurezas de boro mudam a cor do diamante para levemente azul. Da mesma forma, a única diferença entre rubi e safira é o tipo de impurezas presentes em um cristal de corindo.
Nos semicondutores, um tipo especial de impureza, chamado dopante, altera drasticamente as propriedades elétricas do cristal. Dispositivos semicondutores, como transistores, são possíveis em grande parte colocando diferentes dopantes semicondutores em lugares diferentes, em padrões específicos.
A geminação é um fenômeno em algum lugar entre um defeito cristalográfico e um limite de grão. Como um contorno de grão, um contorno gêmeo tem diferentes orientações de cristal em seus dois lados. Mas, ao contrário de um limite de grão, as orientações não são aleatórias, mas relacionadas de uma maneira específica, como uma imagem espelhada.
Mosaicidade é uma dispersão de orientações de planos cristalinos. Um cristal de mosaico consiste em unidades cristalinas menores que estão um pouco desalinhadas em relação umas às outras.
Ligações químicas
Em geral, os sólidos podem ser mantidos juntos por vários tipos de ligações químicas, como ligações metálicas, ligações iônicas, ligações covalentes, ligações de van der Waals e outras. Nenhum deles é necessariamente cristalino ou não cristalino. No entanto, existem algumas tendências gerais como segue.
Os metais são quase sempre policristalinos, embora existam exceções como metais amorfos e metais monocristalinos. Estes últimos são cultivados sinteticamente. (Um pedaço de metal microscopicamente pequeno pode se formar naturalmente em um único cristal, mas pedaços maiores geralmente não.) Os materiais compostos iônicos são geralmente cristalinos ou policristalinos. Na prática, grandes cristais de sal podem ser criados pela solidificação de um fluido fundido ou pela cristalização de uma solução. Sólidos ligados covalentemente (às vezes chamados de sólidos de rede covalente) também são muito comuns, sendo exemplos notáveis o diamante e o quartzo. As forças fracas de van der Waals também ajudam a manter unidos certos cristais, como sólidos moleculares cristalinos, bem como a ligação intercamadas no grafite. Os materiais poliméricos geralmente formam regiões cristalinas, mas os comprimentos das moléculas geralmente impedem a cristalização completa - e às vezes os polímeros são completamente amorfos.
Quasicristais
Um quasicristal consiste em matrizes de átomos que são ordenados, mas não estritamente periódicos. Eles têm muitos atributos em comum com os cristais comuns, como exibir um padrão discreto na difração de raios X e a capacidade de formar formas com faces planas e lisas.
Quasicristais são mais famosos por sua capacidade de mostrar simetria quíntupla, o que é impossível para um cristal periódico comum (ver teorema da restrição cristalográfica).
A União Internacional de Cristalografia redefiniu o termo "cristal" para incluir cristais periódicos comuns e quasicristais ("qualquer sólido com um diagrama de difração essencialmente discreto").
Os quasicristais, descobertos pela primeira vez em 1982, são bastante raros na prática. Apenas cerca de 100 sólidos são conhecidos por formar quasicristais, em comparação com cerca de 400.000 cristais periódicos conhecidos em 2004. O Prêmio Nobel de Química de 2011 foi concedido a Dan Shechtman pela descoberta de quasicristais.
Propriedades especiais da anisotropia
Os cristais podem ter certas propriedades elétricas, ópticas e mecânicas especiais que o vidro e os policristais normalmente não possuem. Essas propriedades estão relacionadas à anisotropia do cristal, ou seja, a falta de simetria rotacional em seu arranjo atômico. Uma dessas propriedades é o efeito piezoelétrico, em que uma tensão no cristal pode encolher ou esticá-lo. Outra é a birrefringência, onde uma imagem dupla aparece quando se olha através de um cristal. Além disso, várias propriedades de um cristal, incluindo condutividade elétrica, permissividade elétrica e módulo de Young, podem ser diferentes em diferentes direções em um cristal. Por exemplo, os cristais de grafite consistem em uma pilha de folhas e, embora cada folha individual seja mecanicamente muito forte, as folhas são frouxamente ligadas umas às outras. Portanto, a resistência mecânica do material é bastante diferente dependendo da direção da tensão.
Nem todos os cristais possuem todas essas propriedades. Por outro lado, essas propriedades não são exclusivas dos cristais. Eles podem aparecer em vidros ou policristais que se tornaram anisotrópicos por trabalho ou estresse - por exemplo, birrefringência induzida por estresse.
Cristalografia
Cristalografia é a ciência de medir a estrutura cristalina (em outras palavras, o arranjo atômico) de um cristal. Uma técnica de cristalografia amplamente utilizada é a difração de raios X. Um grande número de estruturas cristalinas conhecidas é armazenado em bancos de dados cristalográficos.
Galeria de imagens
Contenido relacionado
Lonsdaleite
Claude Louis Berthollet
Aminoácido