Composto aromático
Compostos aromáticos, também conhecidos como "hidrocarbonetos aromáticos mono e policíclicos", são compostos orgânicos que contêm um ou mais anéis aromáticos. O membro parental dos compostos aromáticos é o benzeno. A palavra "aromático" origina-se do agrupamento passado de moléculas com base no cheiro, antes que suas propriedades químicas gerais fossem compreendidas. A definição atual de compostos aromáticos não tem nenhuma relação com seu cheiro.
Heteroarenos estão intimamente relacionados, uma vez que pelo menos um átomo de carbono do grupo CH é substituído por um dos heteroátomos oxigênio, nitrogênio ou enxofre. Exemplos de compostos não benzênicos com propriedades aromáticas são o furano, um composto heterocíclico com um anel de cinco membros que inclui um único átomo de oxigênio, e a piridina, um composto heterocíclico com um anel de seis membros contendo um átomo de nitrogênio. Os hidrocarbonetos sem anel aromático são chamados de alifáticos.
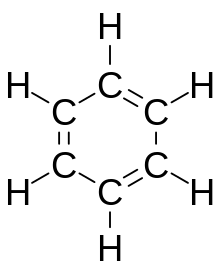
Modelo de anel de benzeno
Benzene, C6H. H. H.6(C6H6}}}, é o menos complexo hidrocarboneto aromático, e foi o primeiro nomeado como tal. A natureza de sua ligação foi reconhecida pela primeira vez por August Kekulé no século XIX. Cada átomo de carbono no ciclo hexagonal tem quatro elétrons para compartilhar. Um vai para o átomo de hidrogênio, e um para cada um dos dois carbonos vizinhos. Isso deixa um elétron para compartilhar com um dos dois átomos de carbono vizinhos, criando assim uma dupla ligação com um carbono e deixando uma única ligação com o outro, e é por isso que algumas representações da molécula de benzeno a retratam como um hexágono com ligações duplas e únicas alternadas.
Outras representações da estrutura retratam o hexágono com um círculo dentro dele, para indicar que os seis elétrons estão flutuando em orbitais moleculares deslocalizados do tamanho do próprio anel. Isso representa a natureza equivalente das seis ligações carbono-carbono todas de ordem de ligação 1,5; a equivalência é explicada por formas de ressonância. Os elétrons são visualizados flutuando acima e abaixo do anel, com os campos eletromagnéticos que eles geram agindo para manter o anel plano.
Propriedades gerais dos hidrocarbonetos aromáticos:
- Eles exibem aromática
- A relação carbono-hidrogênio é alta
- Eles queimam com uma forte chama amarela sooty por causa da alta relação carbono-hidrogênio
- Eles sofrem reações de substituição eletrofílica e substituições aromáticas nucleofílicas
O símbolo do círculo para aromaticidade foi introduzido por Sir Robert Robinson e seu aluno James Armit em 1925 e popularizado a partir de 1959 pela Morrison & Boyd livro de química orgânica. O uso apropriado do símbolo é debatido: algumas publicações o utilizam para qualquer sistema π cíclico, enquanto outras o utilizam apenas para aqueles sistemas π que obedecem à regra de Hückel. Jensen argumenta que, de acordo com a proposta original de Robinson, o uso do símbolo do círculo deve ser limitado a sistemas monocíclicos de 6 elétrons π. Dessa forma, o símbolo do círculo para uma ligação de seis centros e seis elétrons pode ser comparado ao símbolo Y para uma ligação de três centros e dois elétrons.
Reações
Sistemas de anéis aromáticos participam de muitas reações orgânicas.
Substituição aromática
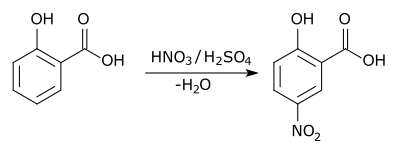
Na substituição aromática, um substituinte no anel areno, geralmente hidrogênio, é substituído por outro substituinte. Os dois tipos principais são a substituição eletrofílica aromática, quando o reagente ativo é um eletrófilo, e a substituição nucleofílica aromática, quando o reagente é um nucleófilo. Na substituição radical-nucleofílica aromática, o reagente ativo é um radical. Um exemplo de substituição eletrofílica aromática é a nitração do ácido salicílico:
Reações de acoplamento
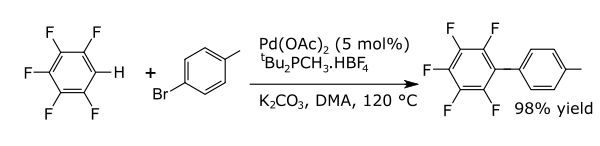
Nas reações de acoplamento, um metal catalisa um acoplamento entre dois fragmentos de radicais formais. Reações de acoplamento comuns com arenos resultam na formação de novas ligações carbono-carbono, por exemplo, alquilarenos, vinil arenos, biraris, novas ligações carbono-nitrogênio (anilinas) ou novas ligações carbono-oxigênio (compostos ariloxi). Um exemplo é uma arilação direta de perfluorobenzenos
Hidrogenação
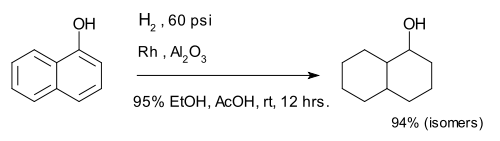
A hidrogenação de arenos cria anéis saturados. O composto 1-naftol é completamente reduzido a uma mistura de isômeros decalina-ol.
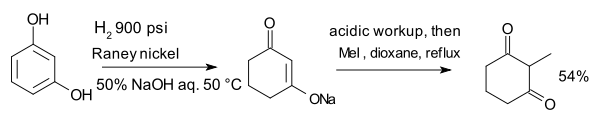
O composto resorcinol, hidrogenado com níquel de Raney na presença de hidróxido de sódio aquoso forma um enolato que é alquilado com iodeto de metila a 2-metil-1,3-ciclohexandiona:
Cicloadições
As reações de cicloadição não são comuns. A reatividade térmica incomum de Diels-Alder de arenos pode ser encontrada na reação de Wagner-Jauregg. Outras reações fotoquímicas de cicloadição com alcenos ocorrem através de excímeros.
Desaromatização
Nas reações de desaromatização, a aromaticidade do reagente é permanentemente perdida.
Benzeno e derivados do benzeno
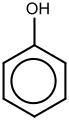
Os derivados do benzeno têm de um a seis substituintes ligados ao núcleo central do benzeno. Exemplos de compostos de benzeno com apenas um substituinte são o fenol, que carrega um grupo hidroxila, e o tolueno com um grupo metil. Quando há mais de um substituinte presente no anel, sua relação espacial torna-se importante para a qual os padrões de substituição de areno ortho, meta e para são concebidos. Por exemplo, existem três isômeros para o cresol porque o grupo metil e o grupo hidroxila podem ser colocados próximos um do outro (orto), uma posição removida um do outro (meta), ou duas posições afastadas uma da outra (para). O xilenol possui dois grupos metila além do grupo hidroxila, e, para esta estrutura, existem 6 isômeros.
- Compostos representativos de areno
O anel de arene tem a capacidade de estabilizar cargas. Isso é visto, por exemplo, no fenol (C6H5–OH), que é ácido na hidroxila (OH), pois uma carga nesse oxigênio (alcóxido –O−) é parcialmente deslocalizado no anel de benzeno.
Outro hidrocarboneto aromático monocíclico
Outros hidrocarbonetos aromáticos monocíclicos incluem Cyclotetradecaheptaene ou Cyclooctadecanonaene.
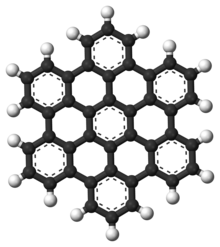
Hidrocarbonetos aromáticos policíclicos
Os hidrocarbonetos aromáticos polinucleares (PAHs) são hidrocarbonetos aromáticos que consistem em anéis aromáticos fundidos e não contêm heteroátomos ou transportam substituintes. O naftaleno é o exemplo mais simples de PAH. Os PAHs ocorrem em depósitos de petróleo, carvão e alcatrão e são produzidos como subprodutos da queima de combustível (seja combustível fóssil ou biomassa). Como poluentes, eles são motivo de preocupação porque alguns compostos foram identificados como carcinogênicos, mutagênicos e teratogênicos. Os PAHs também são encontrados em alimentos cozidos. Estudos demonstraram que altos níveis de PAHs são encontrados, por exemplo, em carnes cozidas em altas temperaturas, como grelhar ou grelhar, e em peixes defumados.
Eles também são encontrados no meio interestelar, em cometas e em meteoritos e são uma molécula candidata a atuar como base para as primeiras formas de vida. No grafeno, o motivo PAH é estendido para grandes folhas 2D.
Contenido relacionado
August Kekule
Equação de estado
Par base