Colágeno
Colágeno () é a principal proteína estrutural na matriz extracelular encontrada nos vários tecidos conjuntivos do corpo. Como o principal componente do tecido conjuntivo, é a proteína mais abundante nos mamíferos, perfazendo de 25% a 35% do conteúdo de proteína do corpo inteiro. O colágeno consiste em aminoácidos unidos para formar uma hélice tripla de fibrila alongada conhecida como hélice de colágeno. É encontrado principalmente no tecido conjuntivo, como cartilagem, ossos, tendões, ligamentos e pele.
Dependendo do grau de mineralização, os tecidos de colágeno podem ser rígidos (osso) ou complacentes (tendão) ou ter um gradiente de rígido para complacente (cartilagem). O colágeno também é abundante nas córneas, nos vasos sanguíneos, no intestino, nos discos intervertebrais e na dentina dos dentes. No tecido muscular, serve como um dos principais componentes do endomísio. O colágeno constitui um a dois por cento do tecido muscular e é responsável por 6% do peso do tecido muscular esquelético. O fibroblasto é a célula mais comum que cria colágeno. A gelatina, que é utilizada na alimentação e na indústria, é o colágeno que foi irreversivelmente hidrolisado pelo calor, soluções básicas ou ácidos fracos.
Etimologia
O nome colágeno vem do grego κόλλα (kólla), que significa "cola", e o sufixo -γέν, -gen, denotando "produzindo".
Tipos humanos
Mais de 90% do colágeno no corpo humano é colágeno tipo I. No entanto, até 2011, 28 tipos de colágeno humano foram identificados, descritos e divididos em vários grupos de acordo com a estrutura que formam. Todos os tipos contêm pelo menos uma hélice tripla. O número de tipos mostra a funcionalidade diversificada do colágeno.
- Fibrilar (Tipo I, II, III, V, XI)
- Não-fibrilar
- FACIT (Fibril Associated Collagens with Interrupted Triple Helices) (Tipo IX, XII, XIV, XIX, XXI)
- Cadeia curta (Tipo VIII, X)
- Membrana de base (Tipo IV)
- Multiplexin (multiple Triple Helix domínios com interrupções) (Tipo XV, XVIII)
- MACIT (Membrane Associated Collagens with Interrupted Triple Helices) (Tipo XIII, XVII)
- Formação microfibril (tipo VI)
- Fíbrilos de ancoragem (Tipo VII)
Os cinco tipos mais comuns são:
- Tipo I: pele, tendão, vasculatura, órgãos, osso (componente principal da parte orgânica do osso)
- Tipo II: cartilagem (componente colágeno principal da cartilagem)
- Tipo III: reticulado (componente principal de fibras reticulares), comumente encontrado ao lado do tipo I
- Tipo IV: forma lamina basal, a camada secreta do epitélio da membrana do porão
- Tipo V: superfícies celulares, cabelo e placenta
Na biologia humana
Cardíaco
O esqueleto cardíaco colagenoso, que inclui os quatro anéis das válvulas cardíacas, está histológica, elástica e exclusivamente ligado ao músculo cardíaco. O esqueleto cardíaco também inclui os septos de separação das câmaras cardíacas – o septo interventricular e o septo atrioventricular. A contribuição do colágeno para a medida do desempenho cardíaco representa sumariamente uma força de torção contínua oposta à mecânica dos fluidos da pressão sanguínea emitida pelo coração. A estrutura colagenosa que divide as câmaras superiores do coração das câmaras inferiores é uma membrana impermeável que exclui o sangue e os impulsos elétricos por meios fisiológicos típicos. Com o suporte do colágeno, a fibrilação atrial nunca se transforma em fibrilação ventricular. O colágeno é colocado em camadas em densidades variáveis com massa muscular lisa. A massa, distribuição, idade e densidade do colágeno contribuem para a complacência necessária para movimentar o sangue para frente e para trás. Folhetos valvulares cardíacos individuais são dobrados em forma por colágeno especializado sob pressão variável. A deposição gradual de cálcio no colágeno ocorre como uma função natural do envelhecimento. Pontos calcificados dentro das matrizes de colágeno mostram contraste em uma exibição em movimento de sangue e músculo, permitindo que os métodos de tecnologia de imagem cardíaca cheguem a proporções que indicam essencialmente entrada de sangue (entrada cardíaca) e saída de sangue (saída cardíaca). A patologia do colágeno subjacente ao coração é compreendida dentro da categoria de doença do tecido conjuntivo.
Enxertos ósseos
Como o esqueleto forma a estrutura do corpo, é vital que ele mantenha sua força, mesmo após fraturas e lesões. O colágeno é utilizado em enxertos ósseos por possuir estrutura em tripla hélice, o que o torna uma molécula muito forte. É ideal para uso em ossos, pois não compromete a integridade estrutural do esqueleto. A estrutura em tripla hélice do colágeno evita que ele seja degradado por enzimas, possibilita a adesividade das células e é importante para a montagem adequada da matriz extracelular.
Regeneração de tecidos
Scaffolds de colágeno são usados na regeneração de tecidos, seja em esponjas, lâminas finas, géis ou fibras. O colágeno possui propriedades favoráveis para a regeneração tecidual, como estrutura de poros, permeabilidade, hidrofilicidade e estabilidade in vivo. Os andaimes de colágeno também suportam a deposição de células, como osteoblastos e fibroblastos, e uma vez inseridos, facilitam o crescimento para prosseguir normalmente.
Usos cirúrgicos reconstrutivos
Os colágenos são amplamente empregados na construção de substitutos artificiais da pele usados no tratamento de queimaduras e feridas graves. Esses colágenos podem ser derivados de bovinos, equinos, suínos ou mesmo humanos; e às vezes são usados em combinação com silicones, glicosaminoglicanos, fibroblastos, fatores de crescimento e outras substâncias.
Curação de feridas
O colágeno é um dos principais recursos naturais do corpo e um componente do tecido da pele que pode beneficiar todos os estágios da cicatrização de feridas. Quando o colágeno é disponibilizado para o leito da ferida, pode ocorrer o fechamento. A deterioração da ferida, seguida por vezes de procedimentos como a amputação, pode assim ser evitada.
O colágeno é um produto natural e, portanto, é usado como curativo natural para feridas e possui propriedades que os curativos artificiais não possuem. É resistente contra bactérias, o que é de vital importância em um curativo. Ajuda a manter a ferida estéril, devido à sua capacidade natural de combater infecções. Quando o colágeno é usado como curativo para queimaduras, o tecido de granulação saudável é capaz de se formar muito rapidamente sobre a queimadura, ajudando-a a cicatrizar rapidamente.
Durante as quatro fases da cicatrização de feridas, o colágeno desempenha as seguintes funções:
- Função de guia: Fibras de colágeno servem para guiar fibroblastos. Fibroblastos migram ao longo de uma matriz de tecido conjuntivo.
- Propriedades químicas: A grande área de superfície disponível em fibras de colágeno pode atrair células fibrogênicas que ajudam na cura.
- Nucleação: O colágeno, na presença de certas moléculas de sal neutras, pode atuar como um agente nucleante causando a formação de estruturas fibrilares.
- Propriedades hemostáticas: As plaquetas de sangue interagem com o colágeno para fazer um plugue hemostático.
Pesquisa básica
O colágeno é utilizado em estudos laboratoriais para cultura de células, estudando o comportamento celular e as interações celulares com o meio extracelular. O colágeno também é amplamente utilizado como biotinta para bioimpressão 3D e biofabricação de modelos de tecido 3D.
Biologia
A proteína de colágeno é composta por uma tripla hélice, que geralmente consiste em duas cadeias idênticas (α1) e uma cadeia adicional que difere ligeiramente em sua composição química (α2). A composição de aminoácidos do colágeno é atípica para as proteínas, principalmente no que diz respeito ao seu alto teor de hidroxiprolina. Os motivos mais comuns na sequência de aminoácidos do colágeno são glicina-prolina-X e glicina-X-hidroxiprolina, onde X é qualquer aminoácido diferente de glicina, prolina ou hidroxiprolina. A composição média de aminoácidos para a pele de peixes e mamíferos é fornecida.
| Aminoácido | Abundância na pele mamífera (residues/1000) | Abundância na pele de peixe (residues/1000) |
|---|---|---|
| Glycine | 329 | 339 |
| Proline | 126 | 108 |
| Alanine. | 109 | 114 |
| Hidroxiprolina | 95 | 67 |
| Ácido glutâmico | 74 | 76 |
| Arginina | 49 | 52 |
| Ácido aspártico | 47 | 47 |
| Seri | 36 | 46. |
| Lysine. | 29 de Março | 26 |
| Leucina | 24. | 23 |
| Valine | 22 | 21 |
| Threonine | 19 | 26 |
| Phenylalanine | 13 | 14 |
| Isoleucina | 11 | 11 |
| Hidroxilisina | 6 | 8 |
| Metionine | 6 | 13 |
| Histiologia | 5 | 7 |
| Tyrosine | 3 | 3 |
| Cisteína | 1 | 1 |
| Tryptophan | 0 | 0 |
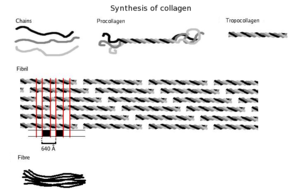
Síntese
Primeiro, uma estrutura em cadeia tridimensional é montada, com os aminoácidos glicina e prolina como seus componentes principais. Isso ainda não é colágeno, mas seu precursor, o procolágeno. O procolágeno é então modificado pela adição de grupos hidroxila aos aminoácidos prolina e lisina. Esta etapa é importante para posterior glicosilação e formação da estrutura de tripla hélice do colágeno. Como as enzimas hidroxilase que realizam essas reações requerem vitamina C como cofator, uma deficiência prolongada dessa vitamina resulta em síntese prejudicada de colágeno e escorbuto. Essas reações de hidroxilação são catalisadas por duas enzimas diferentes: prolil-4-hidroxilase e lisil-hidroxilase. A reação consome uma molécula de ascorbato por hidroxilação. A síntese de colágeno ocorre dentro e fora da célula. A formação de colágeno que resulta em colágeno fibrilar (forma mais comum) é discutida aqui. O colágeno em malha, que geralmente está envolvido na formação de sistemas de filtração, é a outra forma de colágeno. Todos os tipos de colágeno são hélices triplas, e as diferenças estão na composição dos peptídeos alfa criados na etapa 2.
- Transcrição de mRNA: Cerca de 44 genes estão associados à formação de colágeno, cada codificação para uma sequência de mRNA específica, e tipicamente têm o "COLOCAÇÃO" prefixo. O início da síntese de colágeno começa com a transformação de genes que estão associados à formação de um peptídeo alfa particular (tipicamente alfa 1, 2 ou 3).
- Formação pré-pro-peptídica: Uma vez que o mRNA final sai do núcleo celular e entra no citoplasma, ele liga com as subunidades ribossômicas e o processo de tradução ocorre. A primeira parte do novo peptide é conhecida como sequência de sinal. A sequência de sinal no N-terminal do peptídeo é reconhecida por uma partícula de reconhecimento de sinal no retículo endoplasmático, que será responsável por direcionar o pré-pro-peptídeo para o retículo endoplasmático. Portanto, uma vez que a síntese de novo peptídeo é concluída, ele vai diretamente para o retículo endoplasmático para o processamento pós-translacional. Agora é conhecido como preprocollagen.
- Pré-pro-peptídeo para pró-colágeno: Três modificações do pré-pro-peptídeo ocorrem levando à formação do peptídeo alfa:
- O peptídeo de sinal no terminal N é removido, e a molécula é agora conhecida como adereços (não procollagen).
- A hidroxilação de lisinas e prolines em propeptide pelas enzimas 'prolyl hydroxylase' e 'lysyl hydroxylase' (para produzir hidroxiprolina e hidroxilisina) ocorre para ajudar a ligação cruzada dos peptídeos alfa. Este passo enzimático requer vitamina C como cofactor. Em escavação, a falta de hidroxilação de prolinas e lisinas causa uma hélice tripla mais solta (que é formada por três peptídeos alfa).
- A glicosilação ocorre adicionando monômeros de glicose ou galactose nos grupos hidroxila que foram colocados em lisinas, mas não em prolines.
- Uma vez que essas modificações ocorreram, três dos propeptides hidroxilados e glicosilados torcem em uma hélice tripla formando procollagen. Procollagen ainda tem extremidades unwound, que será posteriormente guarnecido. Neste ponto, o procolágeno é embalado em um vesícula de transferência destinado ao aparelho Golgi.
- Modificação do aparelho Golgi: No aparelho Golgi, o procollagen passa por uma última modificação pós-translacional antes de ser secretado fora da célula. Nesta etapa, os oligossacarídeos (não monossacarídeos como na etapa 3) são adicionados, e então o procolágeno é embalado em uma vesícula secretora destinada ao espaço extracelular.
- Formação de tropocollagen: Uma vez fora da célula, enzimas ligadas à membrana conhecidas como peptidases de colágeno, remova as "extremidades soltas" da molécula de procolágeno. O que resta é conhecido como tropocollagen. Os defeitos nesta etapa produzem uma das muitas colagens conhecidas como síndrome de Ehlers-Danlos. Este passo está ausente ao sintetizar o tipo III, um tipo de colágeno fibrilar.
- Formação do fibril de colágeno: lysyl oxidase, uma enzima extracelular dependente de cobre, produz o passo final na via de síntese de colágeno. Esta enzima atua em lisinas e hidroxilisinas produzindo grupos aldeídos, que eventualmente sofrerão ligação covalente entre moléculas de tropocollagen. Este polímero de tropocollagen é conhecido como um fibril de colágeno.
Aminoácidos
O colágeno tem uma composição e sequência de aminoácidos incomuns:
- A glicina é encontrada em quase cada terceiro resíduo.
- Proline compõe cerca de 17% de colágeno.
- O colágeno contém dois aminoácidos derivados incomuns não inseridos diretamente durante a tradução. Estes aminoácidos são encontrados em locais específicos em relação ao glicina e são modificados pós-tralacionalmente por diferentes enzimas, ambas que exigem vitamina C como cofactor.
- Hidroxiprolina derivada de prolina
- Hidroxilisina derivada da lisina – dependendo do tipo de colágeno, os números variados de hidroxilisina são glicosilados (principalmente tendo desacarídeos anexados).
O cortisol estimula a degradação do colágeno (pele) em aminoácidos.
Formação de colágeno I
A maioria das formas de colágeno é semelhante, mas o seguinte processo é típico para o tipo I:
- Dentro da célula
- Dois tipos de cadeias alfa – alfa-1 e alfa 2, são formados durante a tradução em ribossomas ao longo do retículo endoplasmático áspero (RER). Estas cadeias peptídicas conhecidas como preprocollagen, têm peptídeos de registro em cada extremidade e um peptídeo de sinal.
- As cadeias de polipeptídeos são liberadas no lúmen do RER.
- Os peptídeos de sinal são clivados dentro do RER e as correntes são agora conhecidas como cadeias pró-alfa.
- A hidroxilação de lisina e aminoácidos prolina ocorre dentro do lúmen. Este processo depende e consome ácido ascórbico (vitamina C) como cofactor.
- A glicosilação de resíduos específicos de hidroxilisina ocorre.
- A estrutura helicoidal alfa tripla é formada dentro do retículo endoplasmático de duas cadeias alfa-1 e uma cadeia alfa-2.
- Procollagen é enviado para o aparelho Golgi, onde é embalado e secretado em espaço extracelular por exocitose.
- Fora da célula
- Os peptídeos de registro são clivados e o tropocollagen é formado por peptidase procollagen.
- Múltiplas moléculas de tropocollagen formam fibrils de colágeno, através de ligação cruzada covalente (reação de aldol) por oxidase de lisil que liga os resíduos de hidroxilisina e lisina. Vários fibrilos de colágeno formam-se em fibras de colágeno.
- O colágeno pode ser ligado às membranas celulares através de vários tipos de proteína, incluindo fibronectina, laminina, fibulina e integrina.
Patogênese sintética
A deficiência de vitamina C causa escorbuto, uma doença grave e dolorosa na qual o colágeno defeituoso impede a formação de tecido conjuntivo forte. As gengivas se deterioram e sangram, com perda de dentes; a pele descolora e as feridas não cicatrizam. Antes do século XVIII, essa condição era notória em expedições militares de longa duração, principalmente navais, durante as quais os participantes eram privados de alimentos contendo vitamina C.
Uma doença autoimune, como lúpus eritematoso ou artrite reumatoide, pode atacar as fibras de colágeno saudáveis.
Muitas bactérias e vírus secretam fatores de virulência, como a enzima colagenase, que destrói o colágeno ou interfere em sua produção.
Estrutura molecular
Uma única molécula de colágeno, tropocolágeno, é usada para formar agregados de colágeno maiores, como fibrilas. Tem aproximadamente 300 nm de comprimento e 1,5 nm de diâmetro e é composto por três cadeias polipeptídicas (chamadas de peptídeos alfa, consulte a etapa 2), cada uma com a conformação de uma hélice esquerda - isso não deve ser confundido com a hélice alfa destra. Essas três hélices canhotas são torcidas juntas em uma hélice tripla destra ou "super hélice", uma estrutura quaternária cooperativa estabilizada por muitas ligações de hidrogênio. Com o colágeno tipo I e possivelmente todos os colágenos fibrilares, se não todos os colágenos, cada hélice tripla associa-se em uma super-super-espiral destra conhecida como microfibrila de colágeno. Cada microfibrila é interdigitada com as microfibrilas vizinhas em um grau que pode sugerir que sejam individualmente instáveis, embora dentro das fibrilas de colágeno elas sejam tão bem ordenadas que sejam cristalinas.
Uma característica distintiva do colágeno é o arranjo regular de aminoácidos em cada uma das três cadeias dessas subunidades de colágeno. A sequência geralmente segue o padrão Gly-Pro-X ou Gly-X-Hyp, onde X pode ser qualquer um dos vários outros resíduos de aminoácidos. A prolina ou a hidroxiprolina constituem cerca de 1/6 da sequência total. Com a glicina respondendo por 1/3 da sequência, isso significa que aproximadamente metade da sequência de colágeno não é glicina, prolina ou hidroxiprolina, um fato frequentemente perdido devido à distração do incomum GX1X2 caracteres de alfa-peptídeos de colágeno. O alto teor de glicina do colágeno é importante no que diz respeito à estabilização da hélice de colágeno, pois permite a associação muito próxima das fibras de colágeno dentro da molécula, facilitando a ligação de hidrogênio e a formação de ligações cruzadas intermoleculares. Esse tipo de repetição regular e alto teor de glicina é encontrado em apenas algumas outras proteínas fibrosas, como a fibroína da seda.
O colágeno não é apenas uma proteína estrutural. Devido ao seu papel fundamental na determinação do fenótipo celular, adesão celular, regulação de tecidos e infraestrutura, muitas seções de suas regiões não ricas em prolina têm funções de associação/regulação de células ou matrizes. O conteúdo relativamente alto de anéis de prolina e hidroxiprolina, com seus grupos carboxila e amino (secundários) geometricamente restritos, juntamente com a rica abundância de glicina, explica a tendência das fitas polipeptídicas individuais de formar hélices canhotas espontaneamente, sem qualquer intracadeia ligação de hidrogênio.
Como a glicina é o menor aminoácido sem cadeia lateral, ela desempenha um papel único nas proteínas estruturais fibrosas. No colágeno, o Gly é necessário a cada três posições porque a montagem da tripla hélice coloca esse resíduo no interior (eixo) da hélice, onde não há espaço para um grupo lateral maior do que o único átomo de hidrogênio da glicina. Pela mesma razão, os anéis do Pro e do Hyp devem apontar para fora. Esses dois aminoácidos ajudam a estabilizar a tripla hélice – Hyp ainda mais do que Pro; uma concentração mais baixa deles é necessária em animais como peixes, cujas temperaturas corporais são mais baixas do que a maioria dos animais de sangue quente. Conteúdos mais baixos de prolina e hidroxiprolina são característicos de peixes de água fria, mas não de água quente; os últimos tendem a ter conteúdos de prolina e hidroxiprolina semelhantes aos dos mamíferos. O conteúdo mais baixo de prolina e hidroxiprolina de peixes de água fria e outros animais pecilotérmicos faz com que seu colágeno tenha uma estabilidade térmica mais baixa do que o colágeno de mamíferos. Essa menor estabilidade térmica significa que a gelatina derivada do colágeno de peixe não é adequada para muitas aplicações alimentícias e industriais.
As subunidades de tropocolágeno se automontam espontaneamente, com extremidades regularmente escalonadas, em arranjos ainda maiores nos espaços extracelulares dos tecidos. A montagem adicional de fibrilas é guiada por fibroblastos, que depositam fibrilas totalmente formadas a partir de fibripositores. Nos colágenos fibrilares, as moléculas são escalonadas para moléculas adjacentes em cerca de 67 nm (uma unidade que é referida como 'D' e muda dependendo do estado de hidratação do agregado). Em cada repetição do período D da microfibrila, há uma parte contendo cinco moléculas em seção transversal, chamada de "overlap", e uma parte contendo apenas quatro moléculas, chamada de "gap".;. Essas regiões de sobreposição e lacuna são retidas à medida que as microfibrilas se agrupam em fibrilas e, portanto, podem ser visualizadas usando microscopia eletrônica. Os tropocolágenos helicoidais triplos nas microfibrilas estão dispostos em um padrão de empacotamento quase hexagonal.
Existe alguma reticulação covalente dentro das hélices triplas e uma quantidade variável de reticulação covalente entre as hélices de tropocolágeno formando agregados bem organizados (como fibrilas). Feixes fibrilares maiores são formados com a ajuda de várias classes diferentes de proteínas (incluindo diferentes tipos de colágeno), glicoproteínas e proteoglicanos para formar os diferentes tipos de tecidos maduros a partir de combinações alternadas dos mesmos atores-chave. A insolubilidade do colágeno foi uma barreira para o estudo do colágeno monomérico até que se descobriu que o tropocolágeno de animais jovens pode ser extraído porque ainda não está totalmente reticulado. No entanto, os avanços nas técnicas de microscopia (ou seja, microscopia eletrônica (EM) e microscopia de força atômica (AFM)) e difração de raios-X permitiram aos pesquisadores obter imagens cada vez mais detalhadas da estrutura do colágeno in situ. Esses avanços posteriores são particularmente importantes para entender melhor a maneira como a estrutura do colágeno afeta a comunicação célula-célula e célula-matriz e como os tecidos são construídos no crescimento e reparo e alterados no desenvolvimento e na doença. Por exemplo, usando nanoindentação baseada em AFM, foi demonstrado que uma única fibrila de colágeno é um material heterogêneo ao longo de sua direção axial com propriedades mecânicas significativamente diferentes em suas regiões de lacunas e sobreposições, correlacionando-se com suas diferentes organizações moleculares nessas duas regiões.
As fibrilas/agregados de colágeno são arranjadas em diferentes combinações e concentrações em vários tecidos para fornecer propriedades de tecido variadas. No osso, hélices triplas de colágeno inteiras estão em uma disposição paralela e escalonada. Intervalos de 40 nm entre as extremidades das subunidades de tropocolágeno (aproximadamente iguais à região do intervalo) provavelmente servem como locais de nucleação para a deposição de cristais longos, duros e finos do componente mineral, que é hidroxilapatita (aproximadamente) Ca10(OH)2(PO4)6. O colágeno tipo I dá ao osso sua resistência à tração.
Distúrbios associados
As doenças relacionadas ao colágeno geralmente surgem de defeitos genéticos ou deficiências nutricionais que afetam a biossíntese, montagem, modificação pós-translacional, secreção ou outros processos envolvidos na produção normal de colágeno.
| Tipo | Notas | Gene(s) | Distúrbios |
| Eu... | Este é o colágeno mais abundante do corpo humano. Está presente no tecido de cicatriz, o produto final quando o tecido cura por reparo. Ele é encontrado em tendões, pele, paredes artérias, córnea, o endomio em torno de fibras musculares, fibrocartilagem, e a parte orgânica de ossos e dentes. | COL1A, COL1A2 | Osteogenesis imperfecta, Síndrome de Ehlers–Danlos, hiperostose cortical infantil a.k.a. Doença de Caffey |
| II | Cartilagem hialina, compõe 50% de toda a proteína de cartilagem. Humor violento do olho. | COL2A1 | Colagenopatia, tipos II e XI |
| III. | Este é o colágeno do tecido de granulação e é produzido rapidamente por fibroblastos jovens antes que o colágeno tipo I mais resistente é sintetizado. Fibra reticular. Também encontrado em paredes da artéria, pele, intestinos e o útero | COL3A1 | Síndrome de Ehlers-Danlos, contratura de Dupuytren |
| IV | Lamina basal; lente ocular. Também serve como parte do sistema de filtração em capilares e o glomeruli de nefron no rim. | COL4A1, COL4A2, COL4A3, COL4A4, COL4A5, COL4A6 | Síndrome de Alport, Síndrome de Goodpasture |
| V | Tecido mais intersticial, assoc. com tipo I, associado com placenta | COL5A1, COL5A2, COL5A3 | Síndrome de Ehlers–Danlos (clássico) |
| VI | Tecido mais intersticial, assoc. com tipo I | COL6A1, COL6A2, COL6A3, COL6A5 | Miopatia de Ulrich, miopatia de Bethlem, dermatite atópica |
| VII | Formas de ancoragem de fibrilas em junções dermoepidermal | COL7A1 | Epidermolysis bullosa distrophica |
| VIII | Algumas células endoteliais | COL8A1, COL8A2 | Distrofia corneal polimorfo pós-erior 2 |
| IX | Colágeno FACIT, cartilagem, assoc. com fibrils tipo II e XI | COL9A1, COL9A2, COL9A3 | EDM2 e EDM3 |
| X | Cartilagem hipertrófica e mineralizante | COL10A1 | Displasia metafísica de Schmid |
| XI | Cartilagem | COL11A, COL11A2 | Colagenopatia, tipos II e XI |
| XII | FACIT colágeno, interage com tipo I contendo fibrils, decorina e glicosaminoglicans | COL12A1 | – |
| XIII | Colágeno transmembrano, interage com integrin a1b1, fibronectina e componentes de membranas do porão como nidogen e perlecan. | COL13A1 | – |
| XIV | FACIT collagen, também conhecido como undulin | COL14A1 | – |
| XV | – | COL15A1 | – |
| XVI | – | COL16A1 | – |
| XVII | Colágeno transmembrano, também conhecido como BP180, uma proteína de 180 kDa | COL17A1 | Pemphigoid e certas formas de epidermolise juncional bullosa |
| XVIII | Fonte de endostatin | COL18A1 | – |
| XIX | Colágeno de FACIT | COL19A1 | – |
| XXVIII | – | COL20A1 | – |
| XXIII | Colágeno de FACIT | COL21A | – |
| XXII | – | COL22A1 | – |
| XXIII | MACIT collagen | COL23A1 | – |
| XXIV | – | COL24A1 | – |
| XXV | – | COL25A1 | – |
| XXVII | – | EMID2 | – |
| XXVII | – | COL27A1 | – |
| XXVIII | – | COL28A1 | – |
| XXIX | Colágeno epidérmico | COL29A1 | Dermatite atópica |
Além dos distúrbios mencionados acima, ocorre deposição excessiva de colágeno na esclerodermia.
Doenças
Foram identificadas mil mutações em 12 dos mais de 20 tipos de colágeno. Essas mutações podem levar a várias doenças no nível do tecido.
Osteogênese imperfeita – Causada por uma mutação no colágeno tipo 1, doença autossômica dominante, resulta em ossos fracos e tecido conjuntivo irregular, alguns casos podem ser leves, enquanto outros podem ser letais. Os casos leves diminuíram os níveis de colágeno tipo 1, enquanto os casos graves apresentam defeitos estruturais no colágeno.
Condrodisplasias - Desordem esquelética que se acredita ser causada por uma mutação no colágeno tipo 2, mais pesquisas estão sendo realizadas para confirmar isso.
Síndrome de Ehlers-Danlos – São conhecidos treze tipos diferentes desta doença, que levam a deformidades no tecido conjuntivo. Alguns dos tipos mais raros podem ser letais, levando à ruptura das artérias. Cada síndrome é causada por uma mutação diferente. Por exemplo, o tipo vascular (vEDS) desse distúrbio é causado por uma mutação no colágeno tipo 3.
Síndrome de Alport – Pode ser transmitida geneticamente, geralmente como dominante ligada ao cromossomo X, mas também como um distúrbio autossômico dominante e autossômico recessivo. anos da adolescência.
Síndrome de Knobloch – Causada por uma mutação no gene COL18A1 que codifica a produção de colágeno XVIII. Os pacientes apresentam protrusão do tecido cerebral e degeneração da retina; um indivíduo que tem membros da família que sofrem do distúrbio corre um risco maior de desenvolvê-lo, pois existe um vínculo hereditário.
Características
O colágeno é uma das proteínas estruturais longas e fibrosas cujas funções são bastante diferentes das proteínas globulares, como as enzimas. Feixes resistentes de colágeno chamados fibras de colágeno são um componente importante da matriz extracelular que sustenta a maioria dos tecidos e dá estrutura às células do lado de fora, mas o colágeno também é encontrado dentro de certas células. O colágeno tem grande resistência à tração e é o principal componente da fáscia, cartilagem, ligamentos, tendões, ossos e pele. Juntamente com a elastina e a queratina macia, é responsável pela força e elasticidade da pele, e sua degradação leva a rugas que acompanham o envelhecimento. Fortalece os vasos sanguíneos e desempenha um papel no desenvolvimento dos tecidos. Está presente na córnea e na lente do olho na forma cristalina. Pode ser uma das proteínas mais abundantes no registro fóssil, visto que parece fossilizar com frequência, mesmo em ossos do Mesozóico e Paleozóico.
Usos
O colágeno tem uma ampla variedade de aplicações, desde alimentos até medicinais. Na indústria médica, é usado em cirurgia estética e cirurgia de queimaduras. No setor de alimentos, um exemplo de uso é em tripas para salsichas.
Se o colágeno estiver sujeito a desnaturação suficiente, como por aquecimento, as três fitas de tropocolágeno se separam parcial ou completamente em domínios globulares, contendo uma estrutura secundária diferente da poliprolina II de colágeno normal (PPII) de bobinas aleatórias. Este processo descreve a formação de gelatina, que é usada em muitos alimentos, incluindo sobremesas de gelatina com sabor. Além de alimentos, a gelatina tem sido utilizada nas indústrias farmacêutica, cosmética e fotográfica. Também é usado como um suplemento dietético.
Do grego para cola, kolla, a palavra colágeno significa "produtor de cola" e refere-se ao processo inicial de ferver a pele e os tendões de cavalos e outros animais para obter cola. O adesivo de colágeno foi usado pelos egípcios há cerca de 4.000 anos, e os nativos americanos o usavam em arcos há cerca de 1.500 anos. Descobriu-se que a cola mais antiga do mundo, datada de carbono com mais de 8.000 anos, era o colágeno - usado como revestimento protetor em cestas de corda e tecidos bordados, para manter utensílios juntos e em decorações cruzadas em crânios humanos. O colágeno normalmente se converte em gelatina, mas sobreviveu devido às condições secas. As colas animais são termoplásticas, voltando a amolecer com o reaquecimento, por isso ainda são utilizadas na fabricação de instrumentos musicais como finos violinos e violões, que podem precisar ser reabertos para reparos – aplicação incompatível com adesivos plásticos sintéticos e resistentes, que são permanentes. Tendões e peles de animais, incluindo couro, têm sido usados para fazer artigos úteis por milênios.
Cola de gelatina-resorcinol-formaldeído (e com formaldeído substituído por pentanedial e etanedial menos tóxicos) tem sido usada para reparar incisões experimentais em pulmões de coelhos.
Cosméticos
O colágeno bovino é amplamente utilizado em preenchimentos dérmicos para correção estética de rugas e envelhecimento cutâneo. Os cremes de colágeno também são amplamente vendidos, embora o colágeno não possa penetrar na pele porque suas fibras são muito grandes. A maioria das pesquisas sobre suplementos de colágeno foi financiada por indústrias que poderiam se beneficiar de um resultado positivo do estudo.
História
As estruturas moleculares e de empacotamento do colágeno enganaram os cientistas ao longo de décadas de pesquisa. A primeira evidência de que possui uma estrutura regular no nível molecular foi apresentada em meados da década de 1930. A pesquisa então se concentrou na conformação do monômero de colágeno, produzindo vários modelos concorrentes, embora lidando corretamente com a conformação de cada cadeia peptídica individual. O triplo-helicoidal "Madras" modelo, proposto por G. N. Ramachandran em 1955, forneceu um modelo preciso da estrutura quaternária do colágeno. Este modelo foi apoiado por estudos posteriores de maior resolução no final do século XX.
A estrutura de empacotamento do colágeno não foi definida no mesmo grau fora dos tipos de colágeno fibrilar, embora há muito se saiba que é hexagonal. Tal como acontece com a sua estrutura monomérica, vários modelos conflitantes propõem que o arranjo de empacotamento das moléculas de colágeno é 'semelhante a uma folha' ou é microfibrilar. A estrutura microfibrilar das fibrilas de colágeno no tendão, córnea e cartilagem foi visualizada diretamente por microscopia eletrônica no final do século 20 e início do século 21. A estrutura microfibrilar do tendão da cauda do rato foi modelada como sendo a mais próxima da estrutura observada, embora tenha simplificado demais a progressão topológica das moléculas de colágeno vizinhas e, portanto, não previa a conformação correta do arranjo pentamérico D-periódico descontínuo denominado microfibril.
Contenido relacionado
Bronze
Reprodução assexuada
Apolo 15