Clorofila
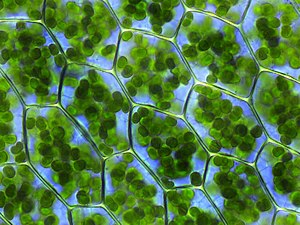
Clorofila (também clorofila) é um dos vários pigmentos verdes relacionados encontrados em cianobactérias e nos cloroplastos de algas e plantas. Seu nome é derivado das palavras gregas χλωρός, khloros ("verde pálido") e φύλλον, phyllon ("folha"). A clorofila permite que as plantas absorvam energia da luz.
As clorofilas absorvem a luz mais fortemente na porção azul do espectro eletromagnético, bem como na porção vermelha. Por outro lado, é um absorvedor pobre de porções verdes e quase verdes do espectro. Portanto, os tecidos contendo clorofila parecem verdes porque a luz verde, refletida de forma difusa por estruturas como as paredes celulares, é menos absorvida. Existem dois tipos de clorofila nos fotossistemas das plantas verdes: clorofila a e b.
História
A clorofila foi isolada e nomeada pela primeira vez por Joseph Bienaimé Caventou e Pierre Joseph Pelletier em 1817. A presença de magnésio na clorofila foi descoberta em 1906 e foi a primeira detecção desse elemento em tecidos vivos.
Após o trabalho inicial feito pelo químico alemão Richard Willstätter, de 1905 a 1915, a estrutura geral da clorofila a foi elucidada por Hans Fischer em 1940. Em 1960, quando a maior parte da estereoquímica da clorofila a era conhecido, Robert Burns Woodward publicou uma síntese total da molécula. Em 1967, a última elucidação estereoquímica restante foi concluída por Ian Fleming e, em 1990, Woodward e co-autores publicaram uma síntese atualizada. A clorofila f foi anunciada como presente em cianobactérias e outros microrganismos oxigenados que formam estromatólitos em 2010; uma fórmula molecular de C55H70O6N4Mg e uma estrutura de (2-formil) -clorofila a foram deduzidos com base em espectros de NMR, óptico e de massa.
Fotossíntese
A clorofila é vital para a fotossíntese, que permite que as plantas absorvam energia da luz.
As moléculas de clorofila estão dispostas dentro e ao redor de fotossistemas que estão embutidos nas membranas tilacoides dos cloroplastos. Nesses complexos, a clorofila desempenha três funções:
- A função da grande maioria da clorofila (até várias centenas de moléculas por fotosistema) é absorver a luz.
- Tendo feito isso, esses mesmos centros executam sua segunda função: A transferência dessa energia por transferência de energia de ressonância para um par específico de clorofila no centro de reação dos fotosistemas.
- Este par específico executa a função final de clorofilas: Separação de carga, que produz os prótons não aderentes (H+) e elétrons (e- Sim.) que favorecem separadamente a biossíntese.
As duas unidades de fotossistema atualmente aceitas são fotosistema I e fotosistema II, que possuem seus próprios centros de reação distintos, denominados P700 e P680, respectivamente. Esses centros recebem o nome do comprimento de onda (em nanômetros) de seu máximo de absorção de pico vermelho. A identidade, função e propriedades espectrais dos tipos de clorofila em cada fotossistema são distintas e determinadas umas pelas outras e pela estrutura da proteína que as rodeia.
A função do centro de reação da clorofila é absorver a energia da luz e transferi-la para outras partes do fotossistema. A energia absorvida do fóton é transferida para um elétron em um processo chamado separação de carga. A remoção do elétron da clorofila é uma reação de oxidação. A clorofila doa o elétron de alta energia para uma série de intermediários moleculares chamados de cadeia de transporte de elétrons. O centro de reação carregado da clorofila (P680+) é então reduzido de volta ao seu estado fundamental ao aceitar um elétron retirado da água. O elétron que reduz P680+ vem da oxidação da água em O2 e H+ por meio de vários intermediários. Esta reação é como organismos fotossintéticos, como plantas, produzem gás O2 e é a fonte de praticamente todo o O2 na atmosfera da Terra. O fotossistema I normalmente funciona em série com o fotossistema II; assim, o P700+ do Fotossistema I geralmente é reduzido à medida que aceita o elétron, por meio de muitos intermediários na membrana tilacóide, por elétrons vindos, em última análise, do Fotossistema II. Entretanto, as reações de transferência de elétrons nas membranas tilacóides são complexas e a fonte de elétrons usada para reduzir P700+ pode variar.
O fluxo de elétrons produzido pelos pigmentos de clorofila do centro de reação é usado para bombear íons H+ através da membrana tilacóide, estabelecendo uma força protônica motriz um potencial quimiosmótico usado principalmente na produção de ATP (energia química armazenada) ou para reduzir NADP+ a NADPH. NADPH é um agente universal usado para reduzir CO2 em açúcares, bem como outras reações biossintéticas.
Os complexos clorofila-proteína do centro de reação são capazes de absorver luz diretamente e realizar eventos de separação de carga sem a ajuda de outros pigmentos de clorofila, mas a probabilidade de isso acontecer sob uma determinada intensidade de luz é pequena. Assim, as outras clorofilas no fotossistema e as proteínas do pigmento da antena absorvem e canalizam cooperativamente a energia da luz para o centro de reação. Além da clorofila a, existem outros pigmentos, chamados de pigmentos acessórios, que ocorrem nesses complexos antena de pigmento-proteína.
Estrutura química
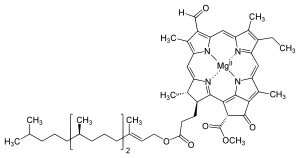
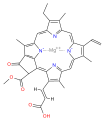
Várias clorofilas são conhecidas. Todos são definidos como derivados da clorina original pela presença de um quinto anel contendo cetona além dos quatro anéis semelhantes a pirróis. A maioria das clorofilas são classificadas como clorinas, que são parentes reduzidos das porfirinas (encontradas na hemoglobina). Eles compartilham uma via biossintética comum com as porfirinas, incluindo o precursor uroporfirinogênio III. Ao contrário dos hemes, que contêm ferro ligado ao centro N4, a maioria das clorofilas liga-se ao magnésio. Os ligantes axiais ligados ao centro Mg2+ são frequentemente omitidos para maior clareza. Anexadas ao anel de clorina estão várias cadeias laterais, geralmente incluindo uma longa cadeia fitila (C20H39O). A forma mais amplamente distribuída nas plantas terrestres é a clorofila a. A única diferença entre a clorofila a e a clorofila b é que a primeira tem um grupo metil enquanto a última tem um grupo formil. Essa diferença causa uma diferença considerável no espectro de absorção, permitindo que as plantas absorvam uma parcela maior da luz visível.
As estruturas das clorofilas estão resumidas abaixo:
| Chlorophyll a | Clorofila b | Chlorophyll c1 | C2 de clorofila | Clorofila | Chlorophyll f | |
|---|---|---|---|---|---|---|
| Fórmula molecular | C55H. H. H.72O5N4Mg | C55H. H. H.70O6N4Mg | C35H. H. H.30O5N4Mg | C35H. H. H.28O5N4Mg | C54H. H. H.70O6N4Mg | C55H. H. H.70O6N4Mg |
| Grupo C2 | - CH3 | - O quê?3 | - O quê?3 | - O quê?3 | - O quê?3 | - CHO |
| Grupo C3 | -CH=CH2 | -CH=CH2 | -CH=CH2 | -CH=CH2 | - CHO | -CH=CH2 |
| Grupo C7 | - O quê?3 | - CHO | - O quê?3 | - O quê?3 | - O quê?3 | - O quê?3 |
| Grupo C8 | - CH2CH3 | - O quê?2CH3 | - O quê?2CH3 | -CH=CH2 | - O quê?2CH3 | - O quê?2CH3 |
| Grupo C17 | - O quê?2CH2COO-Phytyl | - O quê?2CH2COO-Phytyl | - CHCOOH | - CHCOOH | - O quê?2CH2COO-Phytyl | - O quê?2CH2COO-Phytyl |
| Ligação C17-C18 | Único (cloro) | Único (cloro) | Duplo (porfirina) | Duplo (porfirina) | Único (cloro) | Único (cloro) |
| Ocorrência | Universal | Principalmente plantas | Várias algas | Várias algas | Cyanobacteria | Cyanobacteria |
- Estruturas de clorofila
Clorofila e é reservada para um pigmento que foi extraído de algas em 1966, mas não descrito quimicamente. Além das clorofilas com letras, uma grande variedade de modificações nas cadeias laterais das estruturas da clorofila é conhecida na natureza. Por exemplo, Prochlorococcus, uma cianobactéria, usa 8-vinil Chl a e b.
Medição do teor de clorofila
As clorofilas podem ser extraídas da proteína em solventes orgânicos. Desta forma, a concentração de clorofila dentro de uma folha pode ser estimada. Também existem métodos para separar a clorofila a da clorofila b.
No éter dietílico, a clorofila a tem máximas de absorção aproximadas de 430 nm e 662 nm, enquanto a clorofila b tem máximas aproximadas de 453 nm e 642 nm. Os picos de absorção da clorofila a estão em 465 nm e 665 nm. A clorofila a fluoresce a 673 nm (máximo) e 726 nm. O coeficiente de absorção molar de pico da clorofila a excede 105 M−1 cm−1, que está entre os maior para compostos orgânicos de moléculas pequenas. Em 90% de acetona-água, os comprimentos de onda de absorção de pico da clorofila a são 430 nm e 664 nm; picos para clorofila b são 460 nm e 647 nm; picos para clorofila c1 são 442 nm e 630 nm; picos para clorofila c2 são 444 nm e 630 nm; os picos de clorofila d são 401 nm, 455 nm e 696 nm.
A taxa de emissão de fluorescência pode ser usada para medir o conteúdo de clorofila. Ao excitar a fluorescência da clorofila a em um comprimento de onda mais baixo, a taxa de emissão de fluorescência da clorofila em 705 ±10 nm e 735±10 nm pode fornecer uma relação linear de teor de clorofila quando comparação com testes químicos. A razão F735/F700 forneceu um valor de correlação de r2 0,96 em comparação com testes químicos na faixa de 41 mg m−2 até 675 mg m−2. Gitelson também desenvolveu uma fórmula para leitura direta do conteúdo de clorofila em mg m−2. A fórmula forneceu um método confiável para medir o conteúdo de clorofila de 41 mg m−2 até 675 mg m−2 com uma correlação r2 valor de 0,95.
Biossíntese
Em algumas plantas, a clorofila é derivada do glutamato e é sintetizada ao longo de uma via biossintética ramificada que é compartilhada com heme e siroheme. A clorofila sintase é a enzima que completa a biossíntese da clorofila a:
- clorofila um + phytyl diphosphate ? ? {displaystyle rightleftharpoons } clorofila um + difosfato
Esta conversão forma um éster do grupo ácido carboxílico na clorofilida a com o diterpeno álcool fitol de 20 carbonos. A clorofila b é produzida pela mesma enzima que atua na clorofilida b. O mesmo é conhecido para a clorofila d e f, ambas produzidas a partir das clorofilidas correspondentes, em última análise, produzidas a partir da clorofilida a.
Nas plantas angiospermas, as etapas posteriores na via biossintética dependem da luz. Essas plantas são pálidas (estioladas) se cultivadas na escuridão. As plantas não vasculares e as algas verdes têm uma enzima adicional independente da luz e crescem verdes mesmo na escuridão.
A clorofila está ligada às proteínas. A protoclorofilida, um dos intermediários biossintéticos, ocorre principalmente na forma livre e, sob condições de luz, atua como um fotossensibilizador, formando radicais livres, que podem ser tóxicos para a planta. Assim, as plantas regulam a quantidade desse precursor da clorofila. Nas angiospermas, essa regulação é realizada na etapa do ácido aminolevulínico (ALA), um dos compostos intermediários na via de biossíntese. Plantas que são alimentadas por ALA acumulam níveis altos e tóxicos de protoclorofilida; o mesmo acontece com os mutantes com um sistema regulatório danificado.
A senescência e o ciclo da clorofila
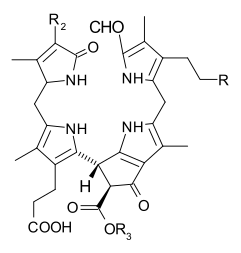
O processo de senescência da planta envolve a degradação da clorofila: por exemplo, a enzima clorofilase (EC 3.1.1.14) hidrolisa a cadeia lateral do fitilo para reverter a reação na qual as clorofilas são biossintetizadas a partir da clorofilida a ou b. Uma vez que a clorofilida a pode ser convertida em clorofilida b e esta última pode ser reesterificada em clorofila b, esses processos permitem o ciclo entre as clorofilas a e b. Além disso, a clorofila b pode ser reduzida diretamente (via 71-hidroxiclorofila a) de volta à clorofila a, completando o ciclo. Nos estágios posteriores da senescência, os clorofilídeos são convertidos em um grupo de tetrapirróis incolores conhecidos como catabólitos de clorofila não fluorescentes (NCC's) com a estrutura geral:
Esses compostos também foram identificados em frutas maduras e dão cores características de outono a plantas decíduas.
Distribuição
Os mapas de clorofila mostram miligramas de clorofila por metro cúbico de água do mar a cada mês. Locais onde as quantidades de clorofila eram muito baixas, indicando números muito baixos de fitoplâncton, são azuis. Os locais onde as concentrações de clorofila eram altas, o que significa que muitos fitoplânctons estavam crescendo, são amarelos. As observações vêm do espectrorradiômetro de imagem de resolução moderada (MODIS) no satélite Aqua da NASA. A terra é cinza escuro e os lugares onde o MODIS não pôde coletar dados por causa do gelo marinho, escuridão polar ou nuvens são cinza claro. As maiores concentrações de clorofila, onde pequenas plantas oceânicas que vivem na superfície estão prosperando, estão em águas polares frias ou em locais onde as correntes oceânicas trazem água fria para a superfície, como ao redor do equador e ao longo das costas dos continentes. Não é a água fria em si que estimula o fitoplâncton. Em vez disso, as temperaturas baixas costumam ser um sinal de que a água subiu à superfície das profundezas do oceano, carregando nutrientes que se acumularam ao longo do tempo. Nas águas polares, os nutrientes se acumulam nas águas superficiais durante os meses escuros de inverno, quando as plantas não podem crescer. Quando a luz solar retorna na primavera e no verão, as plantas florescem em altas concentrações.
Uso culinário
A clorofila sintética é registrada como corante aditivo alimentar e seu número E é E140. Chefs usam clorofila para colorir uma variedade de alimentos e bebidas verdes, como massas e bebidas espirituosas. O absinto ganha sua cor verde naturalmente a partir da clorofila introduzida através da grande variedade de ervas utilizadas em sua produção. A clorofila não é solúvel em água, sendo primeiro misturada com uma pequena quantidade de óleo vegetal para obter a solução desejada.
Uso biológico
Um estudo de 2002 descobriu que "folhas expostas a luz forte continham proteínas de antena principais degradadas, ao contrário daquelas mantidas no escuro, o que é consistente com estudos sobre a iluminação de proteínas isoladas". Isso apareceu aos autores como suporte para a hipótese de que "espécies ativas de oxigênio desempenham um papel in vivo" no comportamento de curto prazo das plantas.
Contenido relacionado
Cucurbitáceas
Bronze
Reprodução assexuada