Bioquímica
Bioquímica ou química biológica é o estudo de processos químicos dentro e relacionados a organismos vivos. Uma subdisciplina da química e da biologia, a bioquímica pode ser dividida em três campos: biologia estrutural, enzimologia e metabolismo. Nas últimas décadas do século 20, a bioquímica tornou-se bem-sucedida em explicar os processos vivos por meio dessas três disciplinas. Quase todas as áreas das ciências da vida estão sendo descobertas e desenvolvidas por meio de metodologia e pesquisa bioquímica. A bioquímica se concentra na compreensão da base química que permite que as moléculas biológicas dêem origem aos processos que ocorrem dentro das células vivas e entre as células, por sua vez, relacionando-se muito com a compreensão dos tecidos e órgãos, bem como da estrutura e função do organismo. A bioquímica está intimamente relacionada à biologia molecular, que é o estudo dos mecanismos moleculares dos fenômenos biológicos.
Grande parte da bioquímica lida com as estruturas, ligações, funções e interações de macromoléculas biológicas, como proteínas, ácidos nucléicos, carboidratos e lipídios. Eles fornecem a estrutura das células e executam muitas das funções associadas à vida. A química da célula também depende das reações de pequenas moléculas e íons. Estes podem ser inorgânicos (por exemplo, água e íons metálicos) ou orgânicos (por exemplo, os aminoácidos, que são usados para sintetizar proteínas). Os mecanismos usados pelas células para aproveitar a energia de seu ambiente por meio de reações químicas são conhecidos como metabolismo. As descobertas da bioquímica são aplicadas principalmente na medicina, nutrição e agricultura. Na medicina, os bioquímicos investigam as causas e curas das doenças. Nutrição estuda como manter a saúde e o bem-estar e também os efeitos das deficiências nutricionais. Na agricultura, os bioquímicos investigam o solo e os fertilizantes. Melhorar o cultivo, o armazenamento e o controle de pragas também são objetivos. A bioquímica é extremamente importante, pois ajuda os indivíduos a aprender sobre tópicos complicados, como príons.
História
Em sua definição mais abrangente, a bioquímica pode ser vista como um estudo dos componentes e composição dos seres vivos e como eles se unem para se tornar a vida. Nesse sentido, a história da bioquímica pode, portanto, remontar aos antigos gregos. No entanto, a bioquímica como disciplina científica específica começou em algum momento do século XIX, ou um pouco antes, dependendo de qual aspecto da bioquímica está sendo focado. Alguns argumentaram que o início da bioquímica pode ter sido a descoberta da primeira enzima, diastase (agora chamada de amilase), em 1833 por Anselme Payen, enquanto outros consideraram a primeira demonstração de Eduard Buchner de um complexo processo bioquímico de fermentação alcoólica em células -free extracts em 1897 para ser o nascimento da bioquímica. Alguns também podem apontar como seu início para o influente trabalho de 1842 de Justus von Liebig, Animal Chemical, or, Organic Chemistry in its Applications to Physiology and Pathology, que apresentou uma teoria química do metabolismo, ou mesmo anterior aos estudos do século XVIII sobre fermentação e respiração de Antoine Lavoisier. Muitos outros pioneiros no campo que ajudaram a descobrir as camadas de complexidade da bioquímica foram proclamados fundadores da bioquímica moderna. Emil Fischer, que estudou a química das proteínas, e F. Gowland Hopkins, que estudou as enzimas e a natureza dinâmica da bioquímica, representam dois exemplos dos primeiros bioquímicos.
O termo "bioquímica" em si é derivado de uma combinação de biologia e química. Em 1877, Felix Hoppe-Seyler usou o termo (biochemie em alemão) como sinônimo de química fisiológica no prefácio da primeira edição do Zeitschrift für Physiologische Chemie (Journal of Química Fisiológica) onde defendeu a criação de institutos dedicados a esta área de estudo. O químico alemão Carl Neuberg, no entanto, é frequentemente citado por ter cunhado a palavra em 1903, enquanto alguns a creditaram a Franz Hofmeister.
Acreditava-se geralmente que a vida e seus materiais tinham alguma propriedade ou substância essencial (muitas vezes referida como o "princípio vital") distinta de qualquer outra encontrada na matéria inanimada, e pensava-se que apenas os seres vivos poderiam produzir as moléculas da vida. Em 1828, Friedrich Wöhler publicou um artigo sobre sua síntese fortuita de uréia a partir de cianato de potássio e sulfato de amônio; alguns consideraram isso uma derrubada direta do vitalismo e o estabelecimento da química orgânica. No entanto, a síntese de Wöhler gerou polêmica, pois alguns rejeitam a morte do vitalismo em suas mãos. Desde então, a bioquímica avançou, principalmente a partir de meados do século XX, com o desenvolvimento de novas técnicas como cromatografia, difração de raios X, interferometria de dupla polarização, espectroscopia de RMN, marcação radioisotópica, microscopia eletrônica e simulações de dinâmica molecular. Essas técnicas permitiram a descoberta e análise detalhada de muitas moléculas e vias metabólicas da célula, como a glicólise e o ciclo de Krebs (ciclo do ácido cítrico), e levaram ao entendimento da bioquímica em nível molecular.
Outro evento histórico significativo na bioquímica é a descoberta do gene e seu papel na transferência de informações na célula. Na década de 1950, James D. Watson, Francis Crick, Rosalind Franklin e Maurice Wilkins foram fundamentais para resolver a estrutura do DNA e sugerir sua relação com a transferência genética de informações. Em 1958, George Beadle e Edward Tatum receberam o Prêmio Nobel pelo trabalho em fungos mostrando que um gene produz uma enzima. Em 1988, Colin Pitchfork foi a primeira pessoa condenada por assassinato com evidências de DNA, o que levou ao crescimento da ciência forense. Mais recentemente, Andrew Z. Fire e Craig C. Mello receberam o Prêmio Nobel de 2006 por descobrir o papel da interferência do RNA (RNAi), no silenciamento da expressão gênica.
Matérias primas: os elementos químicos da vida
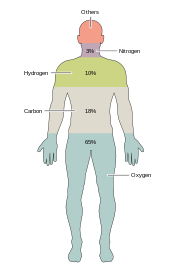
Cerca de duas dezenas de elementos químicos são essenciais para vários tipos de vida biológica. A maioria dos elementos raros na Terra não são necessários para a vida (com exceção do selênio e do iodo), enquanto alguns poucos comuns (alumínio e titânio) não são usados. A maioria dos organismos compartilha necessidades de elementos, mas existem algumas diferenças entre plantas e animais. Por exemplo, as algas oceânicas usam bromo, mas as plantas e animais terrestres parecem não precisar de bromo. Todos os animais requerem sódio, mas não é um elemento essencial para as plantas. As plantas precisam de boro e silício, mas os animais podem não (ou podem precisar de quantidades ultrapequenas).
Apenas seis elementos - carbono, hidrogênio, nitrogênio, oxigênio, cálcio e fósforo - compõem quase 99% da massa das células vivas, incluindo as do corpo humano (veja composição do corpo humano para uma lista completa). Além dos seis principais elementos que compõem a maior parte do corpo humano, os humanos requerem quantidades menores de possivelmente 18 a mais.
Biomoléculas
As 4 classes principais de moléculas em bioquímica (muitas vezes chamadas de biomoléculas) são carboidratos, lipídios, proteínas e ácidos nucléicos. Muitas moléculas biológicas são polímeros: nesta terminologia, os monômeros são macromoléculas relativamente pequenas que são ligadas entre si para criar grandes macromoléculas conhecidas como polímeros. Quando os monômeros são ligados entre si para sintetizar um polímero biológico, eles passam por um processo chamado de síntese por desidratação. Diferentes macromoléculas podem se agrupar em complexos maiores, muitas vezes necessários para a atividade biológica.
Carboidratos
Duas das principais funções dos carboidratos são o armazenamento de energia e o fornecimento de estrutura. Um dos açúcares comuns conhecidos como glicose é um carboidrato, mas nem todos os carboidratos são açúcares. Existem mais carboidratos na Terra do que qualquer outro tipo conhecido de biomolécula; eles são usados para armazenar energia e informações genéticas, bem como desempenhar papéis importantes nas interações e comunicações entre células.
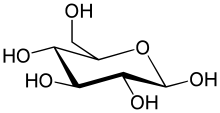
O tipo mais simples de carboidrato é um monossacarídeo, que entre outras propriedades contém carbono, hidrogênio e oxigênio, principalmente na proporção de 1:2:1 (fórmula generalizada CnH2nOn, onde n é pelo menos 3). A glicose (C6H12O6) é um dos carboidratos mais importantes; outros incluem frutose (C6H12O6), o açúcar comumente associado ao sabor doce das frutas e desoxirribose (C >5H10O4), um componente do DNA. Um monossacarídeo pode alternar entre a forma acíclica (de cadeia aberta) e uma forma cíclica. A forma de cadeia aberta pode ser transformada em um anel de átomos de carbono ligados por um átomo de oxigênio criado a partir do grupo carbonila de uma extremidade e o grupo hidroxila de outra. A molécula cíclica tem um grupo hemiacetal ou hemicetal, dependendo se a forma linear era uma aldose ou uma cetose.
Nessas formas cíclicas, o anel geralmente tem 5 ou 6 átomos. Essas formas são chamadas de furanoses e piranoses, respectivamente — por analogia com o furano e o pirano, os compostos mais simples com o mesmo anel carbono-oxigênio (embora não tenham as duplas ligações carbono-carbono dessas duas moléculas). Por exemplo, a glicose aldohexose pode formar uma ligação hemiacetal entre a hidroxila no carbono 1 e o oxigênio no carbono 4, produzindo uma molécula com um anel de 5 membros, chamada glucofuranose. A mesma reação pode ocorrer entre os carbonos 1 e 5 para formar uma molécula com um anel de 6 membros, chamada glucopiranose. Formas cíclicas com um anel de 7 átomos chamadas heptoses são raras.
Dois monossacarídeos podem ser unidos por uma ligação glicosídica ou éster em um dissacarídeo por meio de uma reação de desidratação durante a qual uma molécula de água é liberada. A reação inversa na qual a ligação glicosídica de um dissacarídeo é quebrada em dois monossacarídeos é denominada hidrólise. O dissacarídeo mais conhecido é a sacarose ou açúcar comum, que consiste em uma molécula de glicose e uma molécula de frutose unidas. Outro dissacarídeo importante é a lactose encontrada no leite, consistindo de uma molécula de glicose e uma molécula de galactose. A lactose pode ser hidrolisada pela lactase, e a deficiência dessa enzima resulta em intolerância à lactose.
Quando alguns (cerca de três a seis) monossacarídeos são unidos, é chamado de oligossacarídeo (oligo- significando "poucos"). Essas moléculas tendem a ser usadas como marcadores e sinais, além de terem outros usos. Muitos monossacarídeos unidos formam um polissacarídeo. Eles podem ser unidos em uma longa cadeia linear ou podem ser ramificados. Dois dos polissacarídeos mais comuns são a celulose e o glicogênio, ambos constituídos por monômeros de glicose repetidos. A celulose é um importante componente estrutural das paredes celulares das plantas e o glicogênio é usado como uma forma de armazenamento de energia em animais.
O açúcar pode ser caracterizado por ter pontas redutoras ou não redutoras. Uma extremidade redutora de um carboidrato é um átomo de carbono que pode estar em equilíbrio com a forma de aldeído (aldose) ou ceto (cetose) de cadeia aberta. Se a união de monômeros ocorrer em tal átomo de carbono, o grupo hidroxi livre da forma piranose ou furanose é trocado por uma cadeia lateral OH de outro açúcar, produzindo um acetal completo. Isso evita a abertura da cadeia para a forma de aldeído ou ceto e torna o resíduo modificado não redutor. A lactose contém uma extremidade redutora em sua porção de glicose, enquanto a porção de galactose forma um acetal completo com o grupo C4-OH da glicose. A sacarose não tem uma extremidade redutora devido à formação completa de acetal entre o carbono aldeído da glicose (C1) e o carbono ceto da frutose (C2).
Lípidos
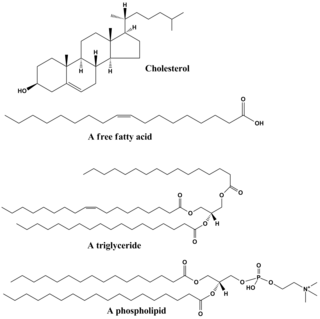
Os lipídios compreendem uma gama diversificada de moléculas e, até certo ponto, são um conjunto de compostos relativamente insolúveis em água ou não polares de origem biológica, incluindo ceras, ácidos graxos, fosfolipídios derivados de ácidos graxos, esfingolipídios, glicolipídios e terpenóides (por exemplo, retinóides e esteróides). Alguns lipídios são moléculas alifáticas lineares de cadeia aberta, enquanto outros têm estruturas em anel. Alguns são aromáticos (com uma estrutura cíclica [anel] e planar [plana]), enquanto outros não. Alguns são flexíveis, enquanto outros são rígidos.
Os lipídios geralmente são feitos de uma molécula de glicerol combinada com outras moléculas. Nos triglicerídeos, o principal grupo de lipídeos a granel, há uma molécula de glicerol e três ácidos graxos. Os ácidos graxos são considerados o monômero nesse caso e podem ser saturados (sem ligações duplas na cadeia carbônica) ou insaturados (uma ou mais ligações duplas na cadeia carbônica).
A maioria dos lipídios tem algum caráter polar, além de ser amplamente apolar. Em geral, a maior parte de sua estrutura é apolar ou hidrofóbica ("com medo de água"), o que significa que não interage bem com solventes polares como a água. Outra parte de sua estrutura é polar ou hidrofílica ("amorosa") e tenderá a se associar a solventes polares como a água. Isso os torna moléculas anfifílicas (com porções hidrofóbicas e hidrofílicas). No caso do colesterol, o grupo polar é um mero –OH (hidroxila ou álcool). No caso dos fosfolipídios, os grupos polares são consideravelmente maiores e mais polares, conforme descrito a seguir.
Os lipídios são parte integrante de nossa dieta diária. A maioria dos óleos e produtos lácteos que usamos para cozinhar e comer, como manteiga, queijo, ghee, etc., são compostos de gorduras. Os óleos vegetais são ricos em vários ácidos graxos poliinsaturados (PUFA). Alimentos contendo lipídios passam por digestão dentro do corpo e são quebrados em ácidos graxos e glicerol, que são os produtos finais da degradação de gorduras e lipídios. Os lípidos, especialmente os fosfolípidos, são também utilizados em vários produtos farmacêuticos, quer como co-solubilizantes (por exemplo, em infusões parentéricas) quer como componentes transportadores de fármacos (por exemplo, num lipossoma ou transfersoma).
Proteínas
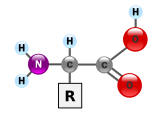
As proteínas são moléculas muito grandes — macrobiopolímeros — feitas de monômeros chamados aminoácidos. Um aminoácido consiste em um átomo de carbono alfa ligado a um grupo amino, –NH2, um grupo de ácido carboxílico, –COOH (embora existam como –NH3+ e –COO− sob condições fisiológicas), um simples átomo de hidrogênio e uma cadeia lateral comumente denotada como "–R". A cadeia lateral "R" é diferente para cada aminoácido, dos quais existem 20 padrões. É este "R" grupo que tornou cada aminoácido diferente, e as propriedades das cadeias laterais influenciam grandemente a conformação tridimensional geral de uma proteína. Alguns aminoácidos possuem funções isoladas ou de forma modificada; por exemplo, o glutamato funciona como um importante neurotransmissor. Os aminoácidos podem ser unidos através de uma ligação peptídica. Nesta síntese de desidratação, uma molécula de água é removida e a ligação peptídica conecta o nitrogênio do grupo amino de um aminoácido ao carbono do grupo ácido carboxílico do outro. A molécula resultante é chamada de dipeptídeo, e trechos curtos de aminoácidos (geralmente, menos de trinta) são chamados de peptídeos ou polipeptídeos. Trechos mais longos merecem o título proteínas. Como exemplo, a importante proteína albumina do soro sanguíneo contém 585 resíduos de aminoácidos.
As proteínas podem ter papéis estruturais e/ou funcionais. Por exemplo, os movimentos das proteínas actina e miosina são responsáveis pela contração do músculo esquelético. Uma propriedade que muitas proteínas têm é que elas se ligam especificamente a uma determinada molécula ou classe de moléculas - elas podem ser extremamente seletivas no que se ligam. Os anticorpos são um exemplo de proteínas que se ligam a um tipo específico de molécula. Os anticorpos são compostos de cadeias pesadas e leves. Duas cadeias pesadas estariam ligadas a duas cadeias leves por meio de ligações dissulfeto entre seus aminoácidos. Os anticorpos são específicos por variação com base em diferenças no domínio N-terminal.
O ensaio imunoenzimático (ELISA), que usa anticorpos, é um dos testes mais sensíveis que a medicina moderna usa para detectar várias biomoléculas. Provavelmente as proteínas mais importantes, no entanto, são as enzimas. Praticamente toda reação em uma célula viva requer uma enzima para diminuir a energia de ativação da reação. Essas moléculas reconhecem moléculas reagentes específicas chamadas substratos; eles então catalisam a reação entre eles. Ao diminuir a energia de ativação, a enzima acelera essa reação em uma taxa de 1011 ou mais; uma reação que normalmente levaria mais de 3.000 anos para se completar espontaneamente pode levar menos de um segundo com uma enzima. A própria enzima não é consumida no processo e fica livre para catalisar a mesma reação com um novo conjunto de substratos. Usando vários modificadores, a atividade da enzima pode ser regulada, permitindo o controle da bioquímica da célula como um todo.
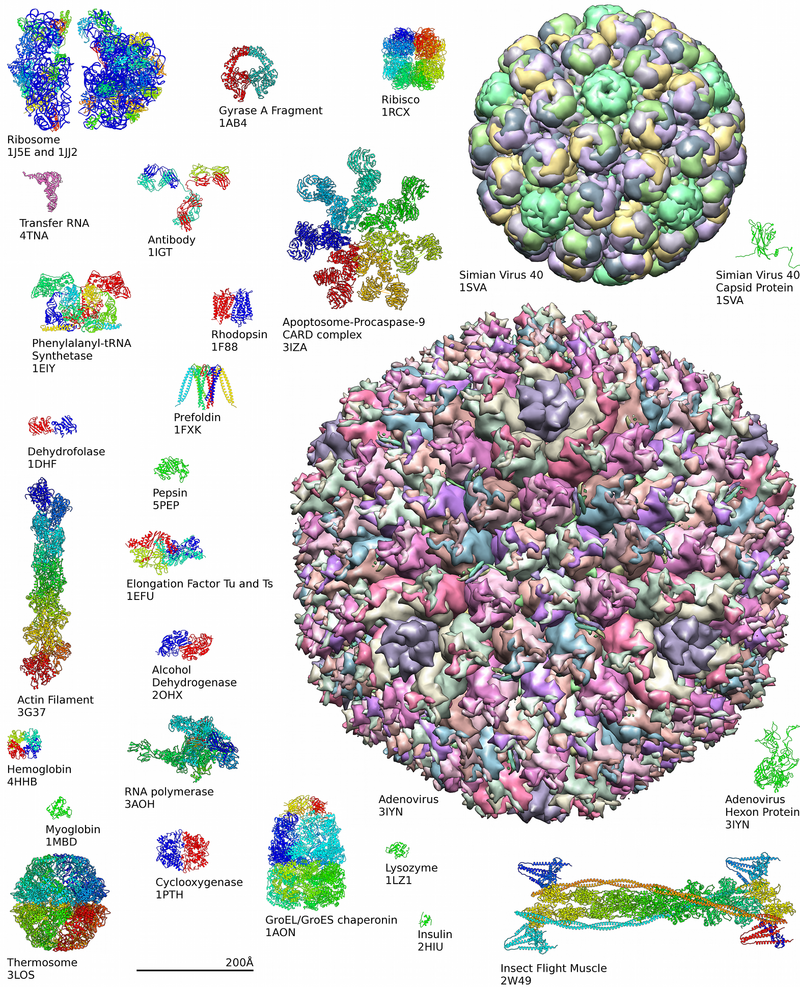
A estrutura das proteínas é tradicionalmente descrita em uma hierarquia de quatro níveis. A estrutura primária de uma proteína consiste em sua sequência linear de aminoácidos; por exemplo, "alanina-glicina-triptofano-serina-glutamato-asparagina-glicina-lisina-…". A estrutura secundária está preocupada com a morfologia local (sendo a morfologia o estudo da estrutura). Algumas combinações de aminoácidos tendem a se enrolar em uma espiral chamada α-hélice ou em uma folha chamada β-folha; algumas α-hélices podem ser vistas no esquema da hemoglobina acima. A estrutura terciária é toda a forma tridimensional da proteína. Esta forma é determinada pela sequência de aminoácidos. Na verdade, uma única mudança pode mudar toda a estrutura. A cadeia alfa da hemoglobina contém 146 resíduos de aminoácidos; a substituição do resíduo de glutamato na posição 6 por um resíduo de valina altera tanto o comportamento da hemoglobina que resulta na doença falciforme. Finalmente, a estrutura quaternária está relacionada com a estrutura de uma proteína com múltiplas subunidades peptídicas, como a hemoglobina com suas quatro subunidades. Nem todas as proteínas têm mais de uma subunidade.
As proteínas ingeridas geralmente são quebradas em aminoácidos únicos ou dipeptídeos no intestino delgado e depois absorvidas. Eles podem então se unir para formar novas proteínas. Os produtos intermediários da glicólise, o ciclo do ácido cítrico e a via das pentoses fosfato podem ser usados para formar todos os vinte aminoácidos, e a maioria das bactérias e plantas possui todas as enzimas necessárias para sintetizá-los. Humanos e outros mamíferos, no entanto, podem sintetizar apenas metade deles. Eles não podem sintetizar isoleucina, leucina, lisina, metionina, fenilalanina, treonina, triptofano e valina. Porque eles devem ser ingeridos, estes são os aminoácidos essenciais. Os mamíferos possuem as enzimas para sintetizar alanina, asparagina, aspartato, cisteína, glutamato, glutamina, glicina, prolina, serina e tirosina, os aminoácidos não essenciais. Embora possam sintetizar arginina e histidina, eles não podem produzi-las em quantidades suficientes para animais jovens em crescimento e, portanto, são frequentemente considerados aminoácidos essenciais.
Se o grupo amino for removido de um aminoácido, ele deixará para trás um esqueleto de carbono chamado α-cetoácido. Enzimas chamadas transaminases podem facilmente transferir o grupo amino de um aminoácido (tornando-o um α-cetoácido) para outro α-cetoácido (tornando-o um aminoácido). Isso é importante na biossíntese de aminoácidos, pois para muitas das vias, os intermediários de outras vias bioquímicas são convertidos no esqueleto de α-cetoácido e, em seguida, um grupo amino é adicionado, frequentemente por meio de transaminação. Os aminoácidos podem então ser ligados entre si para formar uma proteína.
Um processo semelhante é usado para quebrar as proteínas. É primeiro hidrolisado em seus aminoácidos componentes. A amônia livre (NH3), existente como íon amônio (NH4+) no sangue, é tóxica para as formas de vida. Portanto, deve existir um método adequado para excretá-lo. Diferentes táticas evoluíram em diferentes animais, dependendo do comportamento dos animais. precisa. Organismos unicelulares liberam a amônia no meio ambiente. Da mesma forma, os peixes ósseos podem liberar a amônia na água, onde ela é rapidamente diluída. Em geral, os mamíferos convertem a amônia em uréia, por meio do ciclo da uréia.
Para determinar se duas proteínas estão relacionadas ou, em outras palavras, para decidir se são homólogas ou não, os cientistas usam métodos de comparação de sequências. Métodos como alinhamentos de sequência e alinhamentos estruturais são ferramentas poderosas que ajudam os cientistas a identificar homologias entre moléculas relacionadas. A relevância de encontrar homologias entre proteínas vai além de formar um padrão evolutivo de famílias de proteínas. Ao descobrir o quão semelhantes são duas sequências de proteínas, adquirimos conhecimento sobre sua estrutura e, portanto, sua função.
Ácidos nucleicos
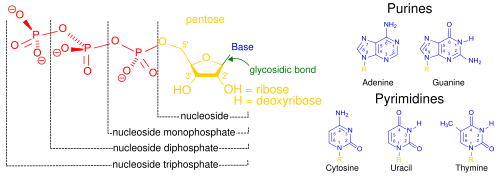
Os ácidos nucleicos, assim chamados devido à sua prevalência nos núcleos celulares, é o nome genérico da família dos biopolímeros. Eles são macromoléculas bioquímicas complexas e de alto peso molecular que podem transmitir informações genéticas em todas as células vivas e vírus. Os monômeros são chamados de nucleotídeos e cada um consiste em três componentes: uma base heterocíclica nitrogenada (uma purina ou uma pirimidina), uma pentose de açúcar e um grupo fosfato.
Os ácidos nucléicos mais comuns são o ácido desoxirribonucléico (DNA) e o ácido ribonucléico (RNA). O grupo fosfato e o açúcar de cada nucleotídeo se ligam para formar a espinha dorsal do ácido nucléico, enquanto a sequência de bases nitrogenadas armazena as informações. As bases nitrogenadas mais comuns são adenina, citosina, guanina, timina e uracila. As bases nitrogenadas de cada fita de um ácido nucleico formarão pontes de hidrogênio com algumas outras bases nitrogenadas em uma fita complementar de ácido nucleico (semelhante a um zíper). A adenina liga-se à timina e ao uracilo, a timina liga-se apenas à adenina e a citosina e a guanina podem ligar-se apenas entre si. Adenina e Timina & Adenina e Uracil contém duas ligações de hidrogênio, enquanto as ligações de hidrogênio formadas entre citosina e guanina são em número de três.
Além do material genético da célula, os ácidos nucleicos muitas vezes desempenham um papel como segundos mensageiros, bem como formam a molécula base para o trifosfato de adenosina (ATP), a principal molécula transportadora de energia encontrada em todos os organismos vivos. Além disso, as bases nitrogenadas possíveis nos dois ácidos nucléicos são diferentes: adenina, citosina e guanina ocorrem tanto no RNA quanto no DNA, enquanto a timina ocorre apenas no DNA e a uracila ocorre no RNA.
Metabolismo
Carboidratos como fonte de energia
A glicose é uma fonte de energia na maioria das formas de vida. Por exemplo, os polissacarídeos são decompostos em seus monômeros por enzimas (a glicogênio fosforilase remove os resíduos de glicose do glicogênio, um polissacarídeo). Dissacarídeos como lactose ou sacarose são clivados em seus dois monossacarídeos componentes.
Glicólise (anaeróbica)
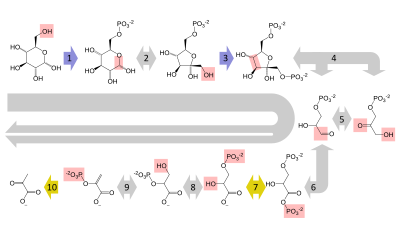
A glicose é metabolizada principalmente por uma importante via de dez etapas chamada glicólise, cujo resultado líquido é a quebra de uma molécula de glicose em duas moléculas de piruvato. Isso também produz duas moléculas líquidas de ATP, a moeda energética das células, juntamente com dois equivalentes redutores da conversão de NAD+ (nicotinamida adenina dinucleotídeo: forma oxidada) em NADH (nicotinamida adenina dinucleotídeo: forma reduzida). Isso não requer oxigênio; se não houver oxigênio disponível (ou a célula não puder usar oxigênio), o NAD é restaurado pela conversão do piruvato em lactato (ácido lático) (por exemplo, em humanos) ou em etanol mais dióxido de carbono (por exemplo, em levedura). Outros monossacarídeos como galactose e frutose podem ser convertidos em intermediários da via glicolítica.
Aeróbico
Em células aeróbicas com oxigênio suficiente, como na maioria das células humanas, o piruvato é ainda mais metabolizado. Ele é irreversivelmente convertido em acetil-CoA, liberando um átomo de carbono como produto residual dióxido de carbono, gerando outro equivalente redutor como NADH. As duas moléculas de acetil-CoA (de uma molécula de glicose) então entram no ciclo do ácido cítrico, produzindo duas moléculas de ATP, mais seis moléculas de NADH e duas (ubi)quinonas reduzidas (via FADH2 como cofator ligado à enzima) e liberando o átomos de carbono restantes como dióxido de carbono. As moléculas de NADH e quinol produzidas alimentam os complexos enzimáticos da cadeia respiratória, um sistema de transporte de elétrons que transfere os elétrons para o oxigênio e conserva a energia liberada na forma de um gradiente de prótons sobre uma membrana (membrana mitocondrial interna em eucariotos). Assim, o oxigênio é reduzido a água e os aceptores originais de elétrons NAD+ e quinona são regenerados. É por isso que os humanos inspiram oxigênio e expiram dióxido de carbono. A energia liberada pela transferência de elétrons de estados de alta energia em NADH e quinol é conservada primeiro como gradiente de prótons e convertida em ATP via ATP sintase. Isso gera 28 moléculas adicionais de ATP (24 dos 8 NADH + 4 dos 2 quinóis), totalizando 32 moléculas de ATP conservadas por glicose degradada (duas da glicólise + duas do ciclo do citrato). É claro que usar oxigênio para oxidar completamente a glicose fornece a um organismo muito mais energia do que qualquer recurso metabólico independente de oxigênio, e acredita-se que essa seja a razão pela qual a vida complexa apareceu somente depois que a atmosfera da Terra acumulou grandes quantidades de oxigênio..
Gliconeogênese
Nos vertebrados, os músculos esqueléticos que se contraem vigorosamente (durante levantamento de peso ou corrida, por exemplo) não recebem oxigênio suficiente para atender à demanda de energia e, portanto, mudam para o metabolismo anaeróbico, convertendo glicose em lactato. A combinação de glicose de origem não carboidrato, como gordura e proteína. Isso só acontece quando os suprimentos de glicogênio no fígado estão esgotados. A via é uma reversão crucial da glicólise de piruvato para glicose e pode usar muitas fontes como aminoácidos, glicerol e ciclo de Krebs. Proteína em grande escala e catabolismo de gordura geralmente ocorrem quando aqueles sofrem de fome ou certos distúrbios endócrinos. O fígado regenera a glicose, usando um processo chamado gliconeogênese. Esse processo não é exatamente o oposto da glicólise e, na verdade, requer três vezes a quantidade de energia obtida na glicólise (seis moléculas de ATP são usadas, em comparação com as duas obtidas na glicólise). De forma análoga às reações acima, a glicose produzida pode sofrer glicólise em tecidos que precisam de energia, ser armazenada como glicogênio (ou amido nas plantas) ou ser convertida em outros monossacarídeos ou unida em di ou oligossacarídeos. As vias combinadas de glicólise durante o exercício, passagem do lactato através da corrente sanguínea para o fígado, subsequente gliconeogênese e liberação de glicose na corrente sanguínea são chamadas de ciclo de Cori.
Relação com outras "escala molecular" ciências biológicas
Pesquisadores em bioquímica usam técnicas específicas nativas da bioquímica, mas cada vez mais as combinam com técnicas e ideias desenvolvidas nos campos da genética, biologia molecular e biofísica. Não há uma linha definida entre essas disciplinas. A bioquímica estuda a química necessária para a atividade biológica das moléculas, a biologia molecular estuda sua atividade biológica, a genética estuda sua hereditariedade, que passa a ser transmitida por seu genoma. Isso é mostrado no esquema a seguir, que descreve uma visão possível das relações entre os campos:
- Bioquímica é o estudo das substâncias químicas e processos vitais que ocorrem em organismos vivos. Os bioquímicos se concentram fortemente no papel, função e estrutura de biomoléculas. O estudo da química por trás dos processos biológicos e a síntese de moléculas biologicamente ativas são aplicações da bioquímica. A bioquímica estuda a vida no nível atômico e molecular.
- Genética é o estudo do efeito das diferenças genéticas nos organismos. Isso muitas vezes pode ser inferido pela ausência de um componente normal (por exemplo, um gene). O estudo de "mutantes" – organismos que não possuem um ou mais componentes funcionais em relação ao chamado "tipo selvagem" ou fenótipo normal. As interações genéticas (epistasis) podem muitas vezes confundir interpretações simples de tais estudos "knockout".
- Biologia molecular é o estudo de underpinnings moleculares dos fenômenos biológicos, com foco na síntese molecular, modificação, mecanismos e interações. O dogma central da biologia molecular, onde o material genético é transcrito em RNA e depois traduzido em proteína, apesar de ser supersimplificado, ainda fornece um bom ponto de partida para a compreensão do campo. Este conceito foi revisado à luz de novos papéis emergentes para RNA.
- Biologia química procura desenvolver novas ferramentas com base em moléculas pequenas que permitem uma perturbação mínima dos sistemas biológicos, fornecendo informações detalhadas sobre sua função. Além disso, a biologia química emprega sistemas biológicos para criar híbridos não naturais entre biomoléculas e dispositivos sintéticos (por exemplo, capsídeos virais esvaziados que podem fornecer terapia genética ou moléculas de drogas).
Contenido relacionado
Polimorfismo
Gesso
DNA ligase
Kary Mullis
Adenilil ciclase