Beta-lactâmico
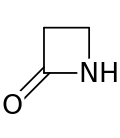
Um anel beta-lactâmico (β-lactâmico) é um lactâmico de quatro membros. Uma lactama é uma amida cíclica, e as beta-lactamas são assim denominadas porque o átomo de nitrogênio está ligado ao átomo de carbono β em relação à carbonila. O β-lactâmico mais simples possível é a 2-azetidinona. Os β-lactâmicos são unidades estruturais significativas de medicamentos, conforme manifestado em muitos antibióticos β-lactâmicos. Até 1970, a maior parte da pesquisa de β-lactâmicos estava preocupada com os grupos de penicilina e cefalosporina, mas desde então, uma grande variedade de estruturas foi descrita.
Significado clínico
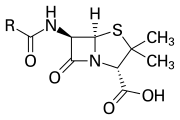
O anel β-lactâmico faz parte da estrutura central de várias famílias de antibióticos, sendo as principais as penicilinas, cefalosporinas, carbapenêmicos e monobactâmicos, que são, portanto, também chamados de antibióticos β-lactâmicos. Quase todos esses antibióticos funcionam inibindo a biossíntese da parede celular bacteriana. Isso tem um efeito letal sobre as bactérias, embora qualquer população de bactérias normalmente contenha um subgrupo que é resistente a antibióticos β-lactâmicos. A resistência bacteriana ocorre como resultado da expressão de um dos muitos genes para a produção de β-lactamases, uma classe de enzimas que quebram o anel β-lactâmico. Mais de 1.800 diferentes enzimas β-lactamase foram documentadas em várias espécies de bactérias. Essas enzimas variam amplamente em sua estrutura química e eficiência catalítica. Quando as populações bacterianas têm esses subgrupos resistentes, o tratamento com β-lactâmicos pode fazer com que a cepa resistente se torne mais prevalente e, portanto, mais virulenta. Os antibióticos derivados de β-lactâmicos podem ser considerados uma das classes de antibióticos mais importantes, mas propensos à resistência clínica. O β-lactâmico exibe suas propriedades antibióticas ao imitar o substrato natural d-Ala-d-Ala para o grupo de enzimas conhecidas como proteínas de ligação à penicilina (PBP), que têm como função reticular a parte peptidoglicana da parede celular de as bactérias.
O anel β-lactâmico também é encontrado em alguns outros medicamentos, como o inibidor de absorção de colesterol Ezetimiba.
Síntese
O primeiro β-lactâmico sintético foi preparado por Hermann Staudinger em 1907 pela reação da base Schiff de anilina e benzaldeído com difenilceteno em uma cicloadição [2+2] (Ph indica um grupo fenil funcional):
Muitos métodos foram desenvolvidos para a síntese de β-lactâmicos.
A síntese de β-lactama Breckpot produz β-lactamas substituídos pela ciclização de ésteres de aminoácidos beta usando um reagente de Grignard. O reagente de Mukaiyama também é usado na síntese de Breckpot modificada.
Reações
Devido à tensão do anel, os β-lactâmicos são mais facilmente hidrolisados do que as amidas lineares ou lactâmicos maiores. Essa cepa é ainda aumentada pela fusão a um segundo anel, como encontrado na maioria dos antibióticos β-lactâmicos. Essa tendência se deve ao fato de o caráter amida do β-lactâmico ser reduzido pela aplanaridade do sistema. O átomo de nitrogênio de uma amida ideal é sp2-hibridizado devido à ressonância, e os átomos sp2-hibridizados têm geometria de ligação planar trigonal. Como uma geometria de ligação piramidal é forçada sobre o átomo de nitrogênio pela tensão do anel, a ressonância da ligação amida é reduzida e a carbonila se torna mais semelhante à cetona. O Prêmio Nobel Robert Burns Woodward descreveu um parâmetro h como uma medida da altura da pirâmide trigonal definida pelo nitrogênio (como o ápice) e seus três átomos adjacentes. h corresponde à força da ligação β-lactama com números mais baixos (mais planar; mais como amidas ideais) sendo mais forte e menos reativo. Monobactams têm valores h entre 0,05 e 0,10 angstroms (Å). Cephems têm valores h de 0,20–0,25 Å. Os penames têm valores na faixa de 0,40 a 0,50 Å, enquanto os carbapenêmicos e os clavams têm valores de 0,50 a 0,60 Å, sendo os mais reativos dos β-lactâmicos à hidrólise.
Contenido relacionado
Glicosídeo cardíaco
Kary Mullis
Katal
Hidrocodona
Anfetamina