Bacteriófago
Um bacteriófago (), também conhecido informalmente como fago (), é um vírus duplodnaviria que infecta e se replica dentro de bactérias e archaea. O termo foi derivado de "bactéria" e o grego φαγεῖν (phagein), que significa "devorar". Os bacteriófagos são compostos de proteínas que encapsulam um genoma de DNA ou RNA e podem ter estruturas simples ou elaboradas. Seus genomas podem codificar apenas quatro genes (por exemplo, MS2) e até centenas de genes. Os fagos se replicam dentro da bactéria após a injeção de seu genoma em seu citoplasma.
Os bacteriófagos estão entre as entidades mais comuns e diversas da biosfera. Bacteriófagos são vírus ubíquos, encontrados onde quer que existam bactérias. Estima-se que existam mais de 1031 bacteriófagos no planeta, mais do que qualquer outro organismo na Terra, incluindo bactérias, juntos. Os vírus são a entidade biológica mais abundante na coluna de água dos oceanos do mundo e o segundo maior componente da biomassa depois dos procariontes, onde até 9x108 virions por mililitro foram encontrados em microrganismos tapetes na superfície, e até 70% das bactérias marinhas podem ser infectadas por fagos.
Os fagos têm sido usados desde o final do século 20 como uma alternativa aos antibióticos na antiga União Soviética e na Europa Central, bem como na França. Eles são vistos como uma possível terapia contra cepas multirresistentes de muitas bactérias (ver terapia fágica).
Sabe-se que os fagos interagem com o sistema imunológico indiretamente através da expressão bacteriana de proteínas codificadas por fagos e diretamente influenciando a imunidade inata e a eliminação bacteriana. As interações fago-hospedeiro estão se tornando áreas de pesquisa cada vez mais importantes.
Classificação
Os bacteriófagos ocorrem em abundância na biosfera, com diferentes genomas e estilos de vida. Os fagos são classificados pelo Comitê Internacional de Taxonomia de Vírus (ICTV) de acordo com a morfologia e o ácido nucléico.
| Ordem | Família | Morfologia | Ácido núcleo | Exemplos |
|---|---|---|---|---|
| Produtos agrícolas | Turriviridae | Enveloped, isométrico | Linear dsDNA | |
| Recursos | Ackermannviridae | Nonenveloped, rabo contratual | Linear dsDNA | |
| Autorização | Nonenveloped, cauda não contractil (curto) | Linear dsDNA | ||
| Perseguição | Linear dsDNA | |||
| Desencadernação | Linear dsDNA | |||
| Drexlerviridae | Linear dsDNA | |||
| Guenliving | Linear dsDNA | |||
| Aquisição | Nonenveloped, rabo contratual | Linear dsDNA | ||
| A minha agenda | Nonenveloped, rabo contratual | Linear dsDNA | T4, Mu, P1, P2 | |
| Siphoviridae | Nonenveloped, cauda sem contraste (longo) | Linear dsDNA | λ, T5, HK97, N15 | |
| Podoviridae | Nonenveloped, cauda não contractil (curto) | Linear dsDNA | T7, T3, Φ29, P22 | |
| Revisão: | Linear dsDNA | |||
| Salas de Imprensa | Linear dsDNA | |||
| Schitoviridae | Linear dsDNA | |||
| Zobellviridae | Linear dsDNA | |||
| Halopanivira | Sphaerolipoviridae | Enveloped, isométrico | Linear dsDNA | |
| O que fazer? | Enveloped, isométrico | Linear dsDNA | ||
| Matshushitaviridae | Enveloped, isométrico | Linear dsDNA | ||
| Haloruvirales | Pleolipoviridae | Enveloped, pleomorphic | SsDNA circular, dsDNA circular ou dsDNA linear | |
| Kalamavira | Tecnologia | Nonenveloped, isométrico | Linear dsDNA | |
| Ligações | Linha de produção | Enveloped, em forma de haste | Linear dsDNA | Vírus filamentoso ácido 1 |
| Rudiviridae | Nonenveloped, em forma de haste | Linear dsDNA | Sulfolobus vírus em forma de haste islandicus 1 | |
| Mindivirales | Cicloviridae | Enveloped, esférico | DRNA linear | Φ6 |
| Norzivira | Atkinsviridae | Nonenveloped, isométrico | SRNA linear | |
| Duinviridae | Nonenveloped, isométrico | SRNA linear | ||
| Fiersviridae | Nonenveloped, isométrico | SRNA linear | MS2, Qβ | |
| Solspiviridae | Nonenveloped, isométrico | SRNA linear | ||
| Petitvirales | Microviridas | Nonenveloped, isométrico | Circular ssDNA | ΦX174 |
| Primárias | Tristromaviridae | Enveloped, em forma de haste | Linear dsDNA | |
| Timóteo | Informação relacionada | Nonenveloped, isométrico | SRNA linear | |
| Steitzviridae | Nonenveloped, isométrico | SRNA linear | ||
| Tubulações | Inoviridae | Nonenveloped, filamentoso | Circular ssDNA | M13 |
| Paulinoviridae | Nonenveloped, filamentoso | Circular ssDNA | ||
| Plectroviridae | Nonenveloped, filamentoso | Circular ssDNA | ||
| Vinavirales | Corticoviridae | Nonenveloped, isométrico | Circular dsDNA | PM2 |
| Durnaviras | São Paulo (proposta) | Nonenveloped, isométrico | DRNA linear | |
| Não atribuído | Ampullaviridae | Envelope, em forma de garrafa | Linear dsDNA | |
| Autolykiviridae | Nonenveloped, isométrico | Linear dsDNA | ||
| Bicaudaviridae | Nonenveloped, em forma de limão | Circular dsDNA | ||
| Clavaviridae | Nonenveloped, em forma de haste | Circular dsDNA | ||
| Revisão de Finnlake | Nonenveloped, isométrico | Circular ssDNA | FLiP | |
| Fuselloviridae | Nonenveloped, em forma de limão | Circular dsDNA | ||
| Globuloviridae | Enveloped, isométrico | Linear dsDNA | ||
| Guttaviridae | Nonenveloped, ovoid | Circular dsDNA | ||
| Esquemas de saúde | Nonenveloped, em forma de limão | Linear dsDNA | ||
| Plasmaviridae | Enveloped, pleomorphic | Circular dsDNA | ||
| Portogloboviridae | Enveloped, isométrico | Circular dsDNA | ||
| Tópicos | Nonenveloped, em forma de limão | Linear dsDNA | ||
| Produtos de plástico | Nonnveloped, em forma de haste | Circular ssDNA |
Tem sido sugerido que membros de Picobirnaviridae infectam bactérias, mas não mamíferos.
Existem também muitos gêneros não atribuídos da classe Leviviricetes: Chimpavirus, Hohglivirus, Mahrahvirus, Meihzavirus, Nicedsevirus, Sculuvirus, Skrubnovirus, Tetipavirus e Winunavirus contendo genomas ssRNA lineares e o gênero não atribuído Lilyvirus da ordem Caudovirales contendo um genoma dsDNA linear.
História
Em 1896, Ernest Hanbury Hankin relatou que algo nas águas dos rios Ganges e Yamuna na Índia tinha uma ação antibacteriana marcante contra o cólera e podia passar por um filtro de porcelana muito fino. Em 1915, o bacteriologista britânico Frederick Twort, superintendente da Brown Institution de Londres, descobriu um pequeno agente que infectava e matava bactérias. Ele acreditava que o agente deveria ser um dos seguintes:
- um estágio no ciclo de vida das bactérias
- uma enzima produzida pelas próprias bactérias, ou
- um vírus que cresceu e destruiu as bactérias
A pesquisa de Twort foi interrompida pelo início da Primeira Guerra Mundial, bem como pela falta de financiamento e pelas descobertas de antibióticos.
Independentemente, o microbiologista franco-canadense Félix d'Hérelle, trabalhando no Instituto Pasteur em Paris, anunciou em 3 de setembro de 1917 que havia descoberto "um micróbio antagônico invisível do bacilo da disenteria". Para d'Hérelle, não havia dúvida quanto à natureza de sua descoberta: "Num piscar de olhos eu entendi: o que causava minhas manchas claras era na verdade um micróbio invisível... um vírus parasita de bactérias." " D'Hérelle chamou o vírus de bacteriófago, um comedor de bactérias (do grego phagein, que significa "devorar"). Ele também registrou um relato dramático de um homem que sofria de disenteria e teve sua saúde restaurada pelos bacteriófagos. Foi d'Hérelle quem conduziu muitas pesquisas sobre bacteriófagos e introduziu o conceito de terapia fágica.
Prêmios Nobel concedidos à pesquisa de fagos
Em 1969, Max Delbrück, Alfred Hershey e Salvador Luria receberam o Prêmio Nobel de Fisiologia ou Medicina por suas descobertas sobre a replicação de vírus e sua estrutura genética. Especificamente, o trabalho de Hershey, como colaborador do experimento Hershey-Chase em 1952, forneceu evidências convincentes de que o DNA, e não a proteína, era o material genético da vida. Delbrück e Luria realizaram o experimento Luria-Delbrück, que demonstrou estatisticamente que as mutações nas bactérias ocorrem aleatoriamente e, portanto, seguem os princípios darwinianos e não lamarckianos.
Usos
Fagoterapia
Descobriu-se que os fagos eram agentes antibacterianos e foram usados na antiga República Soviética da Geórgia (inicialmente lá por Giorgi Eliava com a ajuda do co-descobridor de bacteriófagos, Félix d'Hérelle) durante as décadas de 1920 e 1930 para tratar Infecções bacterianas. Eles tiveram uso generalizado, incluindo o tratamento de soldados do Exército Vermelho. No entanto, eles foram abandonados para uso geral no Ocidente por vários motivos:
- Os antibióticos foram descobertos e comercializados amplamente. Eles eram mais fáceis de fazer, armazenar e prescrever.
- Ensaios médicos de fagos foram realizados, mas uma falta básica de compreensão de fagos levantou questões sobre a validade desses ensaios.
- A publicação de pesquisas na União Soviética foi principalmente nas línguas russa ou georgiana e por muitos anos, não foi seguida internacionalmente.
O uso de fagos continuou desde o fim da Guerra Fria na Rússia, na Geórgia e em outros lugares da Europa Central e Oriental. O primeiro ensaio clínico duplo-cego randomizado e regulamentado foi relatado no Journal of Wound Care em junho de 2009, avaliando a segurança e a eficácia de um coquetel de bacteriófagos para tratar úlceras venosas infectadas da perna em humanos pacientes. A FDA aprovou o estudo como um ensaio clínico de Fase I. Os resultados do estudo demonstraram a segurança da aplicação terapêutica de bacteriófagos, mas não demonstraram eficácia. Os autores explicaram que o uso de certos produtos químicos que fazem parte do tratamento padrão de feridas (por exemplo, lactoferrina ou prata) pode ter interferido na viabilidade do bacteriófago. Pouco depois, outro ensaio clínico controlado na Europa Ocidental (tratamento de infecções de ouvido causadas por Pseudomonas aeruginosa) foi relatado na revista Clinical Otolaryngology em agosto de 2009. O estudo conclui que as preparações de bacteriófagos foram seguras e eficazes para o tratamento de infecções crônicas de ouvido em humanos. Além disso, houve numerosos ensaios clínicos experimentais com animais e outros avaliando a eficácia de bacteriófagos para várias doenças, como queimaduras e feridas infectadas e infecções pulmonares associadas à fibrose cística, entre outras. Por outro lado, foi demonstrado que fagos de Inoviridae complicam biofilmes envolvidos em pneumonia e fibrose cística e protegem as bactérias de drogas destinadas a erradicar a doença, promovendo assim a infecção persistente.
Enquanto isso, os pesquisadores de bacteriófagos têm desenvolvido vírus modificados para superar a resistência a antibióticos e manipulado os genes fágicos responsáveis por codificar enzimas que degradam a matriz do biofilme, as proteínas estruturais do fago e as enzimas responsáveis pela lise da parede celular bacteriana. Houve resultados mostrando que os fagos T4 que são pequenos em tamanho e de cauda curta podem ser úteis na detecção de E. coli no corpo humano.
A eficácia terapêutica de um coquetel de fagos foi avaliada em um modelo de camundongo com infecção nasal de multirresistente (MDR) A. baumannii. Camundongos tratados com o coquetel de fagos mostraram uma taxa de sobrevivência 2,3 vezes maior em comparação com aqueles não tratados sete dias após a infecção. Em 2017, um paciente com pâncreas comprometido por MDR A. baumannii recebeu vários antibióticos; apesar disso, a saúde do paciente continuou a piorar durante um período de quatro meses. Sem antibióticos eficazes, o paciente foi submetido a terapia fágica usando um coquetel de fagos contendo nove fagos diferentes que demonstraram ser eficazes contra MDR A. baumannii. Uma vez nesta terapia, a trajetória clínica descendente do paciente reverteu e voltou à saúde.
D'Herelle "aprendeu rapidamente que os bacteriófagos são encontrados onde quer que as bactérias prosperem: nos esgotos, nos rios que captam o escoamento de resíduos dos canos e nas fezes de pacientes convalescentes." Isso inclui rios tradicionalmente considerados como tendo poderes curativos, incluindo o rio Ganges, na Índia.
Outro
Indústria de alimentos – Os fagos têm sido cada vez mais usados para proteger produtos alimentícios e prevenir bactérias deteriorantes. Desde 2006, a Administração de Alimentos e Medicamentos dos Estados Unidos (FDA) e o Departamento de Agricultura dos Estados Unidos (USDA) aprovaram vários produtos bacteriófagos. O LMP-102 (Intralytix) foi aprovado para tratar produtos de carne e aves prontos para consumo (RTE). Nesse mesmo ano, o FDA aprovou o LISTEX (desenvolvido e produzido pela Micreos) usando bacteriófagos em queijo para matar bactérias Listeria monocytogenes, a fim de dar a elas o status geralmente reconhecido como seguro (GRAS). Em julho de 2007, o mesmo bacteriófago foi aprovado para uso em todos os produtos alimentícios. Em 2011, o USDA confirmou que o LISTEX é um auxiliar de processamento de rótulo limpo e está incluído no USDA. A pesquisa no campo da segurança alimentar continua para ver se os fagos líticos são uma opção viável para controlar outros patógenos de origem alimentar em vários produtos alimentícios.
Diagnóstico – Em 2011, o FDA liberou o primeiro produto baseado em bacteriófago para uso em diagnóstico in vitro. O teste de cultura sanguínea KeyPath MRSA/MSSA usa um coquetel de bacteriófagos para detectar Staphylococcus aureus em hemoculturas positivas e determinar a resistência ou suscetibilidade à meticilina. O teste retorna os resultados em cerca de cinco horas, em comparação com dois a três dias para identificação microbiana padrão e métodos de teste de suscetibilidade. Foi o primeiro teste acelerado de suscetibilidade a antibióticos aprovado pela FDA.
Combatendo armas biológicas e toxinas – As agências governamentais no Ocidente há vários anos procuram a Geórgia e a ex-União Soviética para obter ajuda na exploração de fagos para neutralizar armas biológicas e toxinas, como antraz e botulismo. Os desenvolvimentos continuam entre os grupos de pesquisa nos Estados Unidos. Outros usos incluem a aplicação de spray na horticultura para proteger plantas e produtos hortícolas da decomposição e propagação de doenças bacterianas. Outras aplicações para bacteriófagos são como biocidas para superfícies ambientais, por exemplo, em hospitais, e como tratamentos preventivos para cateteres e dispositivos médicos antes do uso em ambientes clínicos. A tecnologia para fagos a serem aplicados em superfícies secas, por exemplo, uniformes, cortinas ou mesmo suturas para cirurgia já existe. Ensaios clínicos relatados em Clinical Otolaryngology mostram sucesso no tratamento veterinário de cães de estimação com otite.
O método de detecção e identificação de bactérias SEPTIC usa a emissão de íons e sua dinâmica durante a infecção do fago e oferece alta especificidade e velocidade para detecção.
Exibição de fagos é um uso diferente de fagos envolvendo uma biblioteca de fagos com um peptídeo variável ligado a uma proteína de superfície. Cada genoma de fago codifica a variante da proteína exibida em sua superfície (daí o nome), fornecendo uma ligação entre a variante do peptídeo e seu gene codificador. Fagos variantes da biblioteca podem ser selecionados por meio de sua afinidade de ligação a uma molécula imobilizada (por exemplo, toxina do botulismo) para neutralizá-la. Os fagos selecionados ligados podem ser multiplicados pela reinfecção de uma cepa bacteriana suscetível, permitindo assim que eles recuperem os peptídeos codificados neles para estudos adicionais.
Descoberta de drogas antimicrobianas – Proteínas de fagos geralmente têm atividade antimicrobiana e podem servir como pistas para peptidomiméticos, ou seja, drogas que imitam peptídeos. A tecnologia de fago-ligando faz uso de proteínas de fago para várias aplicações, como ligação de bactérias e componentes bacterianos (por exemplo, endotoxina) e lise de bactérias.
Pesquisa básica – Bacteriófagos são importantes organismos modelo para estudar princípios de evolução e ecologia.
Detrimentos
Indústria de laticínios
Os bacteriófagos presentes no ambiente podem fazer com que o queijo não fermente. Para evitar isso, podem ser usadas culturas iniciadoras de cepas mistas e regimes de rotação de culturas. A engenharia genética de micróbios de cultura – especialmente Lactococcus lactis e Streptococcus thermophilus – foi estudada para análise genética e modificação para melhorar a resistência do fago. Isso se concentrou especialmente em modificações cromossômicas recombinantes e plasmídicas.
Algumas pesquisas se concentraram no potencial dos bacteriófagos como antimicrobianos contra patógenos transmitidos por alimentos e formação de biofilme na indústria de laticínios. Como a disseminação da resistência a antibióticos é uma das principais preocupações da indústria de laticínios, os fagos podem servir como uma alternativa promissora.
Replicação
O ciclo de vida dos bacteriófagos tende a ser um ciclo lítico ou um ciclo lisogênico. Além disso, alguns fagos exibem comportamentos pseudolisogênicos.
Com fagos líticos como o fago T4, as células bacterianas são abertas (lisadas) e destruídas após a replicação imediata do virion. Assim que a célula é destruída, a progênie do fago pode encontrar novos hospedeiros para infectar. Os fagos líticos são mais adequados para terapia fágica. Alguns fagos líticos sofrem um fenômeno conhecido como inibição de lise, onde a progênie completa do fago não será lise imediatamente para fora da célula se as concentrações extracelulares de fagos forem altas. Este mecanismo não é idêntico ao do fago temperado que entra em dormência e geralmente é temporário.
Em contraste, o ciclo lisogênico não resulta na lise imediata da célula hospedeira. Esses fagos capazes de sofrer lisogenia são conhecidos como fagos temperados. Seu genoma viral se integrará ao DNA do hospedeiro e se replicará junto com ele, de forma relativamente inofensiva, ou pode até se estabelecer como um plasmídeo. O vírus permanece dormente até que as condições do hospedeiro se deteriorem, talvez devido ao esgotamento de nutrientes, então, os fagos endógenos (conhecidos como profagos) tornam-se ativos. Nesse ponto, eles iniciam o ciclo reprodutivo, resultando na lise da célula hospedeira. Como o ciclo lisogênico permite que a célula hospedeira continue a sobreviver e se reproduzir, o vírus é replicado em todos os descendentes da célula. Um exemplo de um bacteriófago conhecido por seguir o ciclo lisogênico e o ciclo lítico é o fago lambda de E. coli.
Às vezes, os profagos podem fornecer benefícios à bactéria hospedeira enquanto estão dormentes, adicionando novas funções ao genoma bacteriano, em um fenômeno chamado conversão lisogênica. Exemplos são a conversão de cepas inofensivas de Corynebacterium diphtheriae ou Vibrio cholerae por bacteriófagos, em altamente virulentas que causam difteria ou cólera, respectivamente. Foram propostas estratégias para combater certas infecções bacterianas visando esses profagos codificadores de toxinas.
Anexo e penetração
As células bacterianas são protegidas por uma parede celular de polissacarídeos, que são importantes fatores de virulência que protegem as células bacterianas contra as defesas imunológicas do hospedeiro e antibióticos. Para entrar em uma célula hospedeira, os bacteriófagos se ligam a receptores específicos na superfície das bactérias, incluindo lipopolissacarídeos, ácidos teicóicos, proteínas ou mesmo flagelos. Essa especificidade significa que um bacteriófago pode infectar apenas certas bactérias com receptores aos quais eles podem se ligar, o que, por sua vez, determina a gama de hospedeiros do fago. As enzimas que degradam polissacarídeos são proteínas associadas a vírions que degradam enzimaticamente a camada externa capsular de seus hospedeiros na etapa inicial de um processo de infecção de fago fortemente programado. As condições de crescimento do hospedeiro também influenciam a capacidade do fago de anexá-lo e invadi-lo. Como os virions do fago não se movem independentemente, eles devem contar com encontros aleatórios com os receptores corretos quando em solução, como sangue, circulação linfática, irrigação, água do solo, etc.
Os bacteriófagos de miovírus usam um movimento semelhante ao de uma seringa hipodérmica para injetar seu material genético na célula. Depois de entrar em contato com o receptor apropriado, as fibras da cauda se flexionam para aproximar a placa de base da superfície da célula. Isso é conhecido como ligação reversível. Uma vez aderido completamente, a ligação irreversível é iniciada e a cauda se contrai, possivelmente com a ajuda do ATP presente na cauda, injetando material genético através da membrana bacteriana. A injeção é realizada por meio de uma espécie de movimento de flexão no eixo, indo para o lado, contraindo mais perto da célula e empurrando para cima. Os podovírus não possuem uma bainha de cauda alongada como a de um miovírus, então, em vez disso, eles usam suas pequenas fibras de cauda semelhantes a dentes enzimaticamente para degradar uma porção da membrana celular antes de inserir seu material genético.
Síntese de proteínas e ácido nucleico
Em minutos, os ribossomos bacterianos começam a traduzir o mRNA viral em proteína. Para fagos baseados em RNA, a replicase de RNA é sintetizada no início do processo. As proteínas modificam a RNA polimerase bacteriana para que ela transcreva preferencialmente o mRNA viral. A síntese normal de proteínas e ácidos nucléicos do hospedeiro é interrompida e, em vez disso, ele é forçado a fabricar produtos virais. Esses produtos passam a fazer parte de novos vírions dentro da célula, proteínas auxiliares que contribuem para a montagem de novos vírions ou proteínas envolvidas na lise celular. Em 1972, Walter Fiers (Universidade de Ghent, Bélgica) foi o primeiro a estabelecer a sequência completa de nucleotídeos de um gene e, em 1976, do genoma viral do bacteriófago MS2. Alguns bacteriófagos dsDNA codificam proteínas ribossômicas, que são pensadas para modular a tradução de proteínas durante a infecção por fagos.
Montagem do Virion
No caso do fago T4, a construção de novas partículas virais envolve a assistência de proteínas auxiliares que atuam cataliticamente durante a morfogênese do fago. As placas de base são montadas primeiro, com as caudas sendo construídas sobre elas posteriormente. Os capsídeos da cabeça, construídos separadamente, se unirão espontaneamente com as caudas. Durante a montagem do virion do fago T4, as proteínas morfogenéticas codificadas pelos genes do fago interagem umas com as outras em uma sequência característica. A manutenção de um equilíbrio adequado nas quantidades de cada uma dessas proteínas produzidas durante a infecção viral parece ser crítica para a morfogênese normal do fago T4. O DNA é empacotado eficientemente dentro das cabeças. Todo o processo leva cerca de 15 minutos.
Liberação de vírions
Os fagos podem ser liberados por lise celular, por extrusão ou, em alguns casos, por brotamento. A lise, por fagos com cauda, é conseguida por uma enzima chamada endolisina, que ataca e quebra o peptidoglicano da parede celular. Um tipo de fago completamente diferente, o fago filamentoso, faz com que a célula hospedeira secreta continuamente novas partículas virais. Os vírions liberados são descritos como livres e, a menos que sejam defeituosos, são capazes de infectar uma nova bactéria. A brotação está associada a certos fagos Mycoplasma. Em contraste com a liberação de vírions, os fagos que exibem um ciclo lisogênico não matam o hospedeiro e, em vez disso, tornam-se residentes de longo prazo como profagos.
Comunicação
Pesquisas em 2017 revelaram que o bacteriófago Φ3T produz uma proteína viral curta que sinaliza outros bacteriófagos para ficarem dormentes em vez de matar a bactéria hospedeira. Arbitrium é o nome dado a essa proteína pelos pesquisadores que a descobriram.
Estrutura do genoma
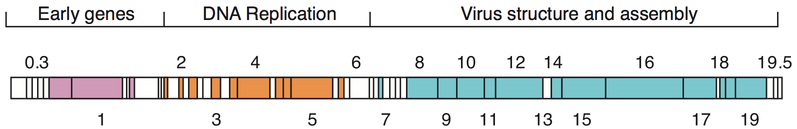
Dados os milhões de fagos diferentes no ambiente, os genomas de fagos vêm em uma variedade de formas e tamanhos. Fagos de RNA, como MS2, têm os menores genomas, com apenas alguns kilobases. No entanto, alguns fagos de DNA, como T4, podem ter genomas grandes com centenas de genes; o tamanho e a forma do capsídeo variam junto com o tamanho do genoma. Os maiores genomas de bacteriófagos atingem um tamanho de 735 kb.
Os genomas de bacteriófagos podem ser altamente mosaicos, ou seja, o genoma de muitas espécies de fagos parece ser composto de vários módulos individuais. Esses módulos podem ser encontrados em outras espécies de fagos em diferentes arranjos. Micobacteriófagos, bacteriófagos com hospedeiros micobacterianos, forneceram excelentes exemplos desse mosaicismo. Nesses micobacteriófagos, a variedade genética pode ser o resultado de instâncias repetidas de recombinação específica do local e recombinação ilegítima (o resultado da aquisição do genoma do fago de sequências genéticas do hospedeiro bacteriano). Os mecanismos evolutivos que moldam os genomas dos vírus bacterianos variam entre as diferentes famílias e dependem do tipo de ácido nucleico, das características da estrutura do virião, bem como do modo do ciclo de vida viral.
Alguns fagos de roseobacter marinhos contêm desoxiuridina (dU) em vez de desoxitimidina (dT) em seu DNA genômico. Há alguma evidência de que esse componente incomum é um mecanismo para escapar dos mecanismos de defesa bacteriana, como endonucleases de restrição e sistemas CRISPR/Cas, que evoluíram para reconhecer e clivar sequências dentro de fagos invasores, inativando-os. Há muito se sabe que outros fagos usam nucleotídeos incomuns. Em 1963, Takahashi e Marmur identificaram um fago Bacillus que tinha dU substituindo dT em seu genoma e, em 1977, Kirnos et al. identificou um cianófago contendo 2-aminoadenina (Z) em vez de adenina (A).
Biologia de sistemas
O campo da biologia de sistemas investiga as redes complexas de interações dentro de um organismo, geralmente usando ferramentas computacionais e modelagem. Por exemplo, um genoma de fago que entra em uma célula hospedeira bacteriana pode expressar centenas de proteínas de fago que afetarão a expressão de numerosos genes do hospedeiro ou o metabolismo do hospedeiro. Todas essas interações complexas podem ser descritas e simuladas em modelos de computador.
Por exemplo, a infecção de Pseudomonas aeruginosa pelo fago temperado PaP3 alterou a expressão de 38% (2160/5633) dos genes de seu hospedeiro. Muitos desses efeitos são provavelmente indiretos, portanto, o desafio é identificar as interações diretas entre bactérias e fagos.
Várias tentativas foram feitas para mapear as interações proteína-proteína entre o fago e seu hospedeiro. Por exemplo, descobriu-se que o bacteriófago lambda interage com seu hospedeiro, E. coli, por dezenas de interações. Novamente, o significado de muitas dessas interações permanece obscuro, mas esses estudos sugerem que provavelmente existem várias interações-chave e muitas interações indiretas cujo papel permanece não caracterizado.
Resistência do hospedeiro
Os bacteriófagos são uma grande ameaça para as bactérias e os procariotos desenvolveram vários mecanismos para bloquear a infecção ou para bloquear a replicação de bacteriófagos dentro das células hospedeiras. O sistema CRISPR é um desses mecanismos, assim como os retrons e o sistema antitoxina codificado por eles. O sistema de defesa Thoeris é conhecido por implantar uma estratégia única para a resistência antifágica bacteriana por meio da degradação de NAD+.
Simbiose bacteriófago-hospedeiro
Os fagos temperados são bacteriófagos que integram seu material genético no hospedeiro como epissomos extracromossômicos ou como profago durante um ciclo lisogênico. Alguns fagos temperados podem conferir vantagens de aptidão para seu hospedeiro de várias maneiras, incluindo dando resistência a antibióticos através da transferência ou introdução de genes de resistência a antibióticos (ARGs), protegendo os hospedeiros da fagocitose, protegendo os hospedeiros da infecção secundária através da exclusão da superinfecção, aumentando a patogenicidade do hospedeiro ou aumentando o metabolismo ou crescimento bacteriano. A simbiose bacteriófago-hospedeiro pode beneficiar as bactérias, fornecendo vantagens seletivas enquanto replica passivamente o genoma do fago.
No ambiente
A metagenômica permitiu a detecção de bacteriófagos na água que não era possível anteriormente.
Além disso, bacteriófagos têm sido usados em rastreamento hidrológico e modelagem em sistemas fluviais, especialmente onde ocorrem interações entre águas superficiais e subterrâneas. O uso de fagos é preferido ao marcador de corante mais convencional porque eles são significativamente menos absorvidos ao passar pelas águas subterrâneas e são prontamente detectados em concentrações muito baixas. A água não poluída pode conter aproximadamente 2×108 bacteriófagos por ml.
Acredita-se que os bacteriófagos contribuam extensivamente para a transferência horizontal de genes em ambientes naturais, principalmente via transdução, mas também via transformação. Estudos baseados em metagenômica também revelaram que viromas de uma variedade de ambientes abrigam genes de resistência a antibióticos, incluindo aqueles que podem conferir resistência a múltiplas drogas.
Em humanos
Embora os fagos não infectem humanos, existem inúmeras partículas de fagos no corpo humano, devido ao nosso extenso microbioma. Nossa população de fagos foi chamada de fagoma humano, incluindo o "fagoma intestinal saudável" (HGP) e o "fagoma humano doente" (DPH). Estima-se que o fagoma ativo de um ser humano saudável (ou seja, replicando ativamente em oposição ao profago integrado não replicante) inclua dezenas a milhares de vírus diferentes. Há evidências de que bacteriófagos e bactérias interagem no microbioma intestinal humano de forma antagônica e benéfica.
Estudos preliminares indicaram que bacteriófagos comuns são encontrados em 62% dos indivíduos saudáveis, em média, enquanto sua prevalência foi reduzida em 42% e 54%, em média, em pacientes com colite ulcerosa (UC) e doença de Crohn (CD). A abundância de fagos também pode diminuir nos idosos.
Os fagos mais comuns no intestino humano, encontrados em todo o mundo, são os crAssfagos. Os CrAssfagos são transmitidos de mãe para filho logo após o nascimento, e há algumas evidências sugerindo que eles podem ser transmitidos localmente. Cada pessoa desenvolve seus próprios clusters únicos de crassfagos. Fagos do tipo CrAss também podem estar presentes em primatas além dos humanos.
Bacteriófago comumente estudado
Entre os inúmeros fagos, apenas alguns foram estudados em detalhes, incluindo alguns fagos historicamente importantes que foram descobertos nos primeiros dias da genética microbiana. Estes, especialmente o T-fago, ajudaram a descobrir princípios importantes da estrutura e função do gene.
- 186 phage
- λ phage
- Φ6 phage
- Φ29 phage
- ΦX174
- Bacteriophage φCb5
- G4
- Filha de M13
- MS2 phage (23–28 nm em tamanho)
- N4 phage
- P1 phage
- phage P2
- Filha P4
- R17 phage
- phage T2
- T4 phage (169 kbp genoma, 200 nm de comprimento)
- T7 phage
- T12 phage
Contenido relacionado
Estresse abiótico
John Eccles (neurofisiologista)
Morte