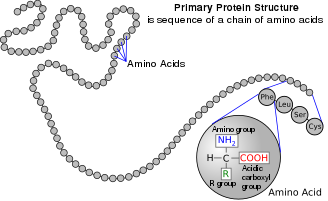
Aminoácido
Aminoácidos são compostos orgânicos que contêm grupos funcionais de aminoácidos e ácidos carboxílicos. Embora existam centenas de aminoácidos na natureza, de longe os mais importantes são os alfa-aminoácidos, que compreendem as proteínas. Apenas 22 aminoácidos alfa aparecem no código genético.
Os aminoácidos podem ser classificados de acordo com as localizações dos grupos funcionais estruturais centrais, como alfa- (α-), beta- (β-), gama- (γ-) ou delta- (δ-) aminoácidos; outras categorias referem-se à polaridade, ionização e tipo de grupo de cadeia lateral (alifático, acíclico, aromático, contendo hidroxila ou enxofre, etc.). Na forma de proteínas, os resíduos de aminoácidos formam o segundo maior componente (sendo a água o maior) dos músculos e outros tecidos humanos. Além de seu papel como resíduos nas proteínas, os aminoácidos participam de vários processos, como transporte e biossíntese de neurotransmissores. Acredita-se que eles tenham desempenhado um papel fundamental ao possibilitar a vida na Terra e seu surgimento.
Os aminoácidos são formalmente nomeados pela Comissão Conjunta IUPAC-IUBMB sobre Nomenclatura Bioquímica em termos do fictício "neutro" estrutura mostrada na ilustração. Por exemplo, o nome sistemático da alanina é ácido 2-aminopropanoico, baseado na fórmula CH3−CH(NH2)−COOH. A Comissão justificou esta abordagem da seguinte forma:
Os nomes e fórmulas sistemáticos apresentados referem-se a formas hipotéticas em que os grupos aminados são não prototonados e os grupos carboxílicos não são associados. Esta convenção é útil para evitar vários problemas nomenclaturais, mas não deve ser tomada para implicar que essas estruturas representam uma fração apreciável das moléculas amino-ácidas.
História
Os primeiros aminoácidos foram descobertos no início do século XIX. Em 1806, os químicos franceses Louis-Nicolas Vauquelin e Pierre Jean Robiquet isolaram um composto do aspargo que posteriormente foi denominado asparagina, o primeiro aminoácido a ser descoberto. A cistina foi descoberta em 1810, embora seu monômero, cisteína, tenha permanecido desconhecido até 1884. A glicina e a leucina foram descobertas em 1820. O último dos 20 aminoácidos comuns a ser descoberto foi a treonina em 1935 por William Cumming Rose, que também determinou os aminoácidos essenciais aminoácidos e estabeleceu as necessidades diárias mínimas de todos os aminoácidos para um crescimento ideal.
A unidade da categoria química foi reconhecida por Wurtz em 1865, mas ele não lhe deu um nome específico. O primeiro uso do termo "aminoácido" no idioma inglês data de 1898, enquanto o termo alemão, Aminosäure, foi usado anteriormente. Verificou-se que as proteínas produzem aminoácidos após digestão enzimática ou hidrólise ácida. Em 1902, Emil Fischer e Franz Hofmeister propuseram independentemente que as proteínas são formadas a partir de muitos aminoácidos, em que as ligações são formadas entre o grupo amino de um aminoácido com o grupo carboxila de outro, resultando em uma estrutura linear que Fischer denominou " peptídeo".
Estrutura geral
Na estrutura mostrada no topo da página, R representa uma cadeia lateral específica para cada aminoácido. O átomo de carbono próximo ao grupo carboxila é chamado de carbono α. Os aminoácidos contendo um grupo amino ligado diretamente ao carbono α são referidos como α-aminoácidos. Estes incluem prolina e hidroxiprolina, que são aminas secundárias. No passado, eles eram frequentemente chamados de iminoácidos, um nome impróprio porque não contêm um agrupamento de iminas HN=C.
Isomerismo
As formas naturais comuns de aminoácidos têm a estrutura −NH+3 (−NH+2 - no caso de prolina) e -CO- 2 grupos funcionais ligados ao mesmo átomo C e, portanto, são α-aminoácidos. Com exceção da glicina aquiral, os aminoácidos naturais possuem a configuração L e são os únicos encontrados nas proteínas durante a tradução no ribossomo.
A convenção L e D para configuração de aminoácidos refere-se não à atividade óptica do próprio aminoácido, mas sim à atividade óptica do isômero de gliceraldeído do qual esse aminoácido pode, em teoria, ser sintetizado (D-gliceraldeído é dextrógiro; L-gliceraldeído é levógiro).
Uma convenção alternativa é usar os designadores (S) e (R) para especificar a configuração absoluta. Quase todos os aminoácidos nas proteínas são (S) no carbono α, sendo a cisteína (R) e a glicina não quirais. A cisteína tem sua cadeia lateral na mesma localização geométrica dos outros aminoácidos, mas a terminologia R/S é invertida porque o enxofre tem maior número atômico em comparação com o oxigênio carboxílico que dá à cadeia lateral uma prioridade mais alta pelas regras de sequência de Cahn-Ingold-Prelog, enquanto os átomos na maioria das outras cadeias laterais dão a eles prioridade mais baixa em comparação com o grupo carboxila.
Raramente, resíduos de D-aminoácidos são encontrados em proteínas e são convertidos do l-aminoácido como uma modificação pós-traducional.
Correntes laterais
Os aminoácidos são designados como α- quando o átomo de nitrogênio do amino está ligado ao carbono α, o átomo de carbono adjacente ao grupo carboxilato.
Em todos os casos abaixo nesta seção, pKKum{displaystyle mathrm {p} K_{mathrm {a} }} valores (se houver) referem-se à ionização dos grupos como resíduos de aminoácidos em proteínas. Eles não são pKKum{displaystyle mathrm {p} K_{mathrm {a} }} valores para os aminoácidos livres (que são de pouca importância bioquímica).
Cadeias laterais alifáticas
Sete (dos 21 proteinogênicos) aminoácidos possuem cadeias laterais que contêm apenas H e C. Estes, portanto, não se ionizam. Eles são os seguintes (com símbolos de três e uma letra entre parênteses):
- Glycine (Gly, G): H...
- Alanine (Ala, A): CH3- Sim.
- Valine (Val, V): (CH)3)2CH...
- Isoleucina (Ile, I): CH3CH2CH (CH)3)
- Leucine (Leu, L): (CH)3)2CH2- Sim.
- Phenylalanine (Phe, F): C6H. H. H.5CH2- Sim.
- Proline (Pro, P): - O quê?2CH2CH2- Sim. ciclizado sobre a amina
Cadeias laterais neutras polares
Dois aminoácidos contêm cadeias laterais de álcool. Estes não se ionizam em condições normais, embora um, a serina, fique desprotonado durante a catálise pelas serina proteases: este é um exemplo de perturbação severa e não é característico de resíduos de serina em geral.
- Serine (Ser, S, no pKKum{displaystyle mathrm {p} K_{mathrm {a} }} quando não severamente perturbedo): HOMEM2- Sim.
- Threonine (Thr, T, no pKKum{displaystyle mathrm {p} K_{mathrm {a} }}: CH3CHOH-
A treonina tem dois centros quirais, não apenas o centro quiral L (2S) no carbono α compartilhado por todos os aminoácidos exceto a glicina aquiral, mas também (3R) no carbono β. A especificação estereoquímica completa é L-treonina (2S,3R).
Cadeias laterais de amida
Dois aminoácidos possuem cadeias laterais de amida, como segue:
- Asparagine (Asn, N): NH2COCHA2- Sim.
- Glutamina (Gln, Q): NH2COCHA2CH2- Sim.
Essas cadeias laterais não ionizam na faixa normal de pH.
Cadeias laterais contendo enxofre
Duas cadeias laterais contêm átomos de enxofre, dos quais uma ioniza na faixa normal (com pKKum{displaystyle mathrm {p} K_{mathrm {a} }} indicado) e o outro não:
- Cisteína (Cys, C, pKKum= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =8.3{displaystyle mathrm {p} K_{mathrm {a} }=8.3}: HSCH2- Sim.
- Metionine (Met, M, no pKKum{displaystyle mathrm {p} K_{mathrm {a} }}: CH3SCH2CH2- Sim.
Cadeias laterais aromáticas
Três aminoácidos têm estruturas de anéis aromáticos como cadeias laterais, conforme ilustrado. Destes, a tirosina ioniza na faixa normal; os outros dois não).
- Phenylalanine (Phe, F, não) pKKum{displaystyle mathrm {p} K_{mathrm {a} }}): esquerda na ilustração
- Tyrosine (Tyr, Y, pKKum= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =9.6{displaystyle mathrm {p} K_{mathrm {a} }=9,6}): meio na ilustração
- Tryptophan (Trp, W, no pKKum{displaystyle mathrm {p} K_{mathrm {a} }}): direito na ilustração
Cadeias laterais aniônicas
Dois aminoácidos têm cadeias laterais que são ânions em pH normal. Esses aminoácidos são freqüentemente chamados de ácidos carboxílicos, mas são mais corretamente chamados de carboxilatos, pois são desprotonados nos valores de pH mais relevantes. Os grupos carboxilato aniônicos se comportam como bases de Brønsted em todas as circunstâncias, exceto para enzimas como a pepsina que atuam em ambientes de pH muito baixo como o estômago dos mamíferos.
- Aspartato ("ácido aspartico", Asp, D, pKKum= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =4.1{displaystyle mathrm {p} K_{mathrm {a} }=4.1}: - O quê?2CO- Sim.2
- Glutamato ("ácido glútmico", Glu, E, pKKum= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =4,5{displaystyle mathrm {p} K_{mathrm {a} }=4.5}: - O quê?2CH2CO- Sim.2
Cadeias laterais catiônicas
Existem três aminoácidos com cadeias laterais que são cátions em pH neutro (embora em um, histidina, formas catiônicas e neutras existam). Eles são comumente chamados de aminoácidos básicos, mas esse termo é enganoso: a histidina pode atuar tanto como um ácido de Brønsted quanto como uma base de Brønsted em pH neutro, a lisina atua como um ácido de Brønsted e a arginina tem um carga positiva e não ioniza em condições neutras. Os nomes histidinium, lysinium e argininium seriam nomes mais precisos para as estruturas, mas essencialmente não são usados.
- Histiologia (O seu, H, pKKum= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =6.3{displaystyle mathrm {p} K_{mathrm {a} }=6.3}): Formas prototonadas e deprotonadas em equilíbrio são mostradas à esquerda da imagem
- Lysine (Lys, K, pKKum= = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = = =10.4{displaystyle mathrm {p} K_{mathrm {a} }=10.4}): Mostrado no meio da imagem
- Arginina (Arg, R, 12}" xmlns="http://www.w3.org/1998/Math/MathML">pKKum>12{displaystyle mathrm {p} K_{mathrm {a} }>12}}
12}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/12800c62933286ebd1c508fd2852919b87140694" style="vertical-align: -0.671ex; width:9.743ex; height:2.509ex;"/>): Mostrado à direita da imagem
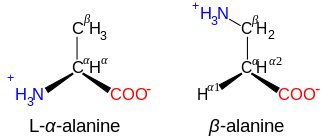
Β- e γ-aminoácidos
Aminoácidos com a estrutura NH+3 −CXY−CXY−CO-2, como β-alanina, um componente da carnosina e alguns outros peptídeos, são β-aminoácidos. Aqueles com a estrutura NH+3−CXY−CXY −CXY−CO−2 são γ-aminoácidos, e assim por diante, onde X e Y são dois substituintes (um dos quais é normalmente H).
Zwitterions
Em solução aquosa em pH próximo à neutralidade, os aminoácidos existem como zwitterions, ou seja, como íons dipolares com ambos NH+ 3 e CO-2 em estados carregados, então a estrutura geral é NH+3−CHR−CO−2 . Em pH fisiológico, as chamadas "formas neutras" −NH2−CHR−CO2H não estão presentes em nenhum grau mensurável. Embora as duas cargas na estrutura do zwitterion somem zero, é enganoso chamar uma espécie com uma carga líquida de zero de "sem carga".
Em condições fortemente ácidas (pH abaixo de 3), o grupo carboxilato torna-se protonado e a estrutura torna-se um ácido amônia carboxílico, NH+3−CHR−CO2H. Isso é relevante para enzimas como a pepsina, que são ativas em ambientes ácidos, como o estômago e lisossomos de mamíferos, mas não se aplica significativamente a enzimas intracelulares. Em condições altamente básicas (pH maior que 10, normalmente não visto em condições fisiológicas), o grupo amônia é desprotonado para dar NH2-CHR-CO-2.
Embora várias definições de ácidos e bases sejam usadas em química, a única que é útil para a química em solução aquosa é a de Brønsted: um ácido é uma espécie que pode doar um próton para outra espécie, e uma base é uma que pode aceitar um próton. Este critério é usado para rotular os grupos na ilustração acima. As cadeias laterais de carboxilato dos resíduos de aspartato e glutamato são as principais bases de Brønsted nas proteínas. Da mesma forma, lisina, tirosina e cisteína normalmente atuam como um ácido de Brønsted. A histidina nessas condições pode atuar tanto como um ácido de Brønsted quanto como uma base.
Ponto isoelétrico
Para aminoácidos com cadeias laterais não carregadas, o zwitterion predomina em valores de pH entre os dois valores de pKa, mas coexiste em equilíbrio com pequenas quantidades de líquido negativo e íons positivos líquidos. No ponto médio entre os dois valores de pKa, a quantidade de traço de saldo líquido negativo e traço de íons positivos líquidos, de modo que a carga líquida média de todas as formas presentes seja zero. Esse pH é conhecido como ponto isoelétrico pI, então pI = 1/2(pKa1 + pKa2).
Para aminoácidos com cadeias laterais carregadas, o pKa da cadeia lateral está envolvido. Assim, para aspartato ou glutamato com cadeias laterais negativas, o grupo amino terminal está essencialmente na forma carregada NH+3, mas essa carga positiva precisa ser balanceada pelo estado com apenas um grupo carboxilato C-terminal carregado negativamente. Isso ocorre a meio caminho entre os dois valores pKa do carboxilato: pI = 1/2(p Ka1 + pKa(R)), onde pKa (R) é a cadeia lateral pKa.
Considerações semelhantes se aplicam a outros aminoácidos com cadeias laterais ionizáveis, incluindo não apenas o glutamato (semelhante ao aspartato), mas também cisteína, histidina, lisina, tirosina e arginina com cadeias laterais positivas
Os aminoácidos têm mobilidade zero na eletroforese em seu ponto isoelétrico, embora esse comportamento seja mais comumente explorado para peptídeos e proteínas do que para aminoácidos individuais. Zwitterions têm solubilidade mínima em seu ponto isoelétrico, e alguns aminoácidos (em particular, com cadeias laterais apolares) podem ser isolados por precipitação da água ajustando o pH ao ponto isoelétrico necessário.
Propriedades físico-químicas
Os 20 aminoácidos canônicos podem ser classificados de acordo com suas propriedades. Fatores importantes são carga, hidrofilicidade ou hidrofobicidade, tamanho e grupos funcionais. Essas propriedades influenciam a estrutura da proteína e as interações proteína-proteína. As proteínas solúveis em água tendem a ter seus resíduos hidrofóbicos (Leu, Ile, Val, Phe e Trp) enterrados no meio da proteína, enquanto as cadeias laterais hidrofílicas são expostas ao solvente aquoso. (Em bioquímica, um resíduo se refere a um monômero específico dentro da cadeia polimérica de um polissacarídeo, proteína ou ácido nucléico.) As proteínas integrais da membrana tendem a ter anéis externos de aminoácidos hidrofóbicos expostos que os ancoram em a bicamada lipídica. Algumas proteínas periféricas da membrana têm um remendo de aminoácidos hidrofóbicos em sua superfície que adere à membrana. De maneira semelhante, as proteínas que precisam se ligar a moléculas carregadas positivamente têm superfícies ricas em aminoácidos carregados negativamente, como glutamato e aspartato, enquanto as proteínas que se ligam a moléculas carregadas negativamente têm superfícies ricas em aminoácidos carregados positivamente, como lisina e arginina. Por exemplo, a lisina e a arginina estão presentes em grandes quantidades nas regiões de baixa complexidade das proteínas de ligação ao ácido nucleico. Existem várias escalas de hidrofobicidade de resíduos de aminoácidos.
Alguns aminoácidos têm propriedades especiais. A cisteína pode formar ligações dissulfeto covalentes com outros resíduos de cisteína. A prolina forma um ciclo para o esqueleto polipeptídico e a glicina é mais flexível do que outros aminoácidos.
Glicina e prolina estão fortemente presentes em regiões de baixa complexidade de proteínas eucarióticas e procarióticas, enquanto o oposto é o caso com cisteína, fenilalanina, triptofano, metionina, valina, leucina, isoleucina, que são altamente reativas, ou complexas, ou hidrofóbico.
Muitas proteínas sofrem uma série de modificações pós-traducionais, em que grupos químicos adicionais são ligados às cadeias laterais de resíduos de aminoácidos, às vezes produzindo lipoproteínas (que são hidrofóbicas) ou glicoproteínas (que são hidrofílicas), permitindo que a proteína se ligue temporariamente a uma membrana. Por exemplo, uma proteína de sinalização pode se ligar e depois se desprender de uma membrana celular, porque contém resíduos de cisteína que podem ter o ácido graxo ácido palmítico adicionado a eles e posteriormente removidos.
Tabela de abreviações e propriedades padrão de aminoácidos
Embora os símbolos de uma letra estejam incluídos na tabela, a IUPAC–IUBMB recomenda que "O uso de símbolos de uma letra deve ser restrito à comparação de sequências longas".
| Aminoácido | Símbolos de 3 e 1 letras | Cadeia lateral | Índice de hidropatia | Absorção mole | Massa molecular | Abundância em proteínas (%) | Codificação genética normal, Notação do IUPAC | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 | 1 | Classe | Polaridade | Carga líquida em pH 7.4 | Comprimento de onda, λmáx. (nm) | Coeficiente ε (M)- Sim.·cm- Sim.) | |||||
| Alanine. | Ala | A | Alifático | Não poluente | Neutral | 1. | 89.094 | 8.76 | GNC | ||
| Arginina | Arg | R | Cação fixa | Polar básico | Positivo | -4,5. | 174.203 | 5.78 | MGR, CGY | ||
| Asparagine | Asn | N | Amide | Polar | Neutral | - 3.5. | 132.119 | 3.93 | AGORA | ||
| Assinatura | Asp | D | Anion | Base de dados | Negativo | - 3.5. | 133.104 | 5.49 | GAY | ||
| Cisteína | Ciclos | C | Thiol | Ácido fervoroso | Neutral | 2.5. | 250 | 0 | 121.154 | 1.38 | UGY |
| Glutamina | Gln | Q | Amide | Polar | Neutral | - 3.5. | 146.146 | 3.9 | Carcaça | ||
| Gluta! | Glu | E | Anion | Base de dados | Negativo | - 3.5. | 147.131 | 6.32 | GAR | ||
| Glycine | Gly! | G | Alifático | Não poluente | Neutral | -0.4 | 75.067 | 7.03 | GRANG | ||
| Histiologia | O seu | H. H. H. | Cação aromática | Ácido fervoroso e base | Positivo, 10% Neutral, 90% | -3.2 | 211 | 5.9 | 155.156 | 2.26 | CAY |
| Isoleucina | Ile | Eu... | Alifático | Não poluente | Neutral | 4,5 | 131.175 | 5.49 | AUH | ||
| Leucina | Leu. | L | Alifático | Não poluente | Neutral | 3.8 | 131.175 | 9.68 | YUR, CUY | ||
| Lysine. | Lys. | KK | Cation | Ácido fervoroso | Positivo | -3.9 | 146.189 | 5.19 | AAR | ||
| Metionine | Met | M | Mais | Não poluente | Neutral | 1. | 149.208 | 2.32 | AUG | ||
| Phenylalanine | P. | F | Aromática | Não poluente | Neutral | 2. | 257, 206, 188 | 0,2, 9,3, 60,0 | 165.192 | 3.87 | Uau! |
| Proline | Pro | P | Ciclo | Não poluente | Neutral | - 1.6. | 115.132 | 5.02 | CCN | ||
| Seri | Ser | S | Hidroxilicidade | Polar | Neutral | -0.8 | 105.093 | 7.14 | UCN, AGY | ||
| Threonine | Thr | T | Hidroxilicidade | Polar | Neutral | -0.7 | 119.119 | 5.53 | ACN | ||
| Tryptophan | Trânsito | W | Aromática | Não poluente | Neutral | -0.9 | 280, 219 | 5.6, 47.0 | 204.228 | 1.25 | UGGG |
| Tyrosine | Tyr | Y | Aromática | Ácido fervoroso | Neutral | -1.3. | 274, 222, 193 | 1.4, 8.0, 48.0 | 18.11.1991 | 2.91 | Uau. |
| Valine | Val | V | Alifático | Não poluente | Neutral | - Sim. | 117.148 | 6.73 | GUN | ||
Dois aminoácidos adicionais estão em algumas espécies codificados por códons que geralmente são interpretados como códons de parada:
| 21o e 22o aminoácidos | 3 letras | 1 letra | Massa molecular |
|---|---|---|---|
| Selenocysteine | Secções | U | 168.064 |
| Pyrrolysine | POLÍTICA | O | 255.313 |
Além dos códigos de aminoácidos específicos, os espaços reservados são usados nos casos em que a análise química ou cristalográfica de um peptídeo ou proteína não pode determinar conclusivamente a identidade de um resíduo. Eles também são usados para resumir motivos de sequências de proteínas conservadas. O uso de letras simples para indicar conjuntos de resíduos semelhantes é semelhante ao uso de códigos de abreviação para bases degeneradas.
| Aminoácidos ambíguos | 3 letras | 1 letra | Aminoácidos incluídos | Codons incluídos |
|---|---|---|---|---|
| Qualquer / desconhecido | Xaaa | X | Todos | N. |
| Asparagina ou aspartato | Asx | B | D, N | RAY |
| Glutamina ou glutamato | Glx | Z. | E, Q | SAR |
| Leucina ou isoleucina | Xle | JJ | Eu, L | YTR, ATH, CTY |
| Hidrofóbica | Φ | V, I, L, F, W, Y, M | NTN, TAY, TGG | |
| Aromática | Ω | F, W, Y, H | TTY, TGG | |
| Alifático (não-aromático) | Telecomunicações | V, I, L, M | VTN, TTR | |
| Pequeno | D | P, G, A, S | BCN, RGY, GGR | |
| Hidrofilia | ζ | S, T, H, N, Q, E, D, K, R | VAN, WCN, CGN, AGY | |
| Positivamente carregado | + | K, R, H | ARR, CRY, CGR | |
| Negativomente carregado | - Sim. | D, E | GAN |
Unk às vezes é usado em vez de Xaa, mas é menos padrão.
Ter ou * (de terminação) é usado em notação para mutações em proteínas quando ocorre um códon de parada. Não corresponde a nenhum aminoácido.
Além disso, muitos aminoácidos fora do padrão têm um código específico. Por exemplo, vários medicamentos peptídicos, como Bortezomibe e MG132, são sintetizados artificialmente e retêm seus grupos protetores, que possuem códigos específicos. Bortezomibe é Pyz–Phe–boroLeu e MG132 é Z–Leu–Leu–Leu–al. Para auxiliar na análise da estrutura da proteína, estão disponíveis análogos de aminoácidos fotorreativos. Estes incluem fotoleucina (pLeu) e fotometionina (pMet).
Ocorrência e funções em bioquímica
Os aminoácidos que possuem o grupo amina ligado ao átomo de carbono (alfa-) próximo ao grupo carboxila têm importância primordial nos organismos vivos, pois participam da síntese de proteínas. Eles são conhecidos como 2-, alfa- ou α-aminoácidos (fórmula genérica H2NCHRCOOH na maioria dos casos, onde R é um substituinte orgânico conhecido como "cadeia lateral"); muitas vezes o termo "aminoácido" é usado para se referir especificamente a eles. Eles incluem os 22 aminoácidos proteinogênicos ("construtores de proteínas"), que se combinam em cadeias peptídicas ("polipeptídeos") para formar os blocos de construção de uma vasta gama de proteínas. Estes são todos L-estereoisômeros (enantiômeros "destros"), embora alguns aminoácidos D ("destros" 34;) ocorrem em envelopes bacterianos, como neuromodulador (D-serina) e em alguns antibióticos.
Muitos aminoácidos proteinogênicos e não proteinogênicos têm funções biológicas. Por exemplo, no cérebro humano, o glutamato (ácido glutâmico padrão) e o ácido gama-aminobutírico ("GABA", gama-aminoácido não padrão) são, respectivamente, os principais neurotransmissores excitatórios e inibitórios. A hidroxiprolina, um dos principais componentes do colágeno do tecido conjuntivo, é sintetizada a partir da prolina. A glicina é um precursor biossintético das porfirinas usadas nos glóbulos vermelhos. A carnitina é usada no transporte de lipídeos. Nove aminoácidos proteinogênicos são chamados de "essenciais" para os humanos, porque eles não podem ser produzidos a partir de outros compostos pelo corpo humano e, portanto, devem ser ingeridos como alimento. Outros podem ser condicionalmente essenciais para certas idades ou condições médicas. Os aminoácidos essenciais também podem variar de espécie para espécie. Devido ao seu significado biológico, os aminoácidos são importantes na nutrição e são comumente usados em suplementos nutricionais, fertilizantes, rações e tecnologia alimentar. Os usos industriais incluem a produção de medicamentos, plásticos biodegradáveis e catalisadores quirais.
Aminoácidos proteinogênicos
Os aminoácidos são os precursores das proteínas. Eles se unem por reações de condensação para formar cadeias poliméricas curtas chamadas peptídeos ou cadeias mais longas chamadas polipeptídeos ou proteínas. Essas cadeias são lineares e não ramificadas, com cada resíduo de aminoácido dentro da cadeia ligado a dois aminoácidos vizinhos. Na natureza, o processo de produção de proteínas codificadas pelo material genético de DNA/RNA é chamado de tradução e envolve a adição passo a passo de aminoácidos a uma cadeia de proteína crescente por uma ribozima chamada ribossomo. A ordem em que os aminoácidos são adicionados é lida no código genético de um modelo de mRNA, que é uma cópia de RNA de um dos genes do organismo.
Vinte e dois aminoácidos são naturalmente incorporados aos polipeptídeos e são chamados de aminoácidos proteinogênicos ou naturais. Destes, 20 são codificados pelo código genético universal. Os 2 restantes, selenocisteína e pirrolisina, são incorporados às proteínas por mecanismos sintéticos únicos. A selenocisteína é incorporada quando o mRNA que está sendo traduzido inclui um elemento SECIS, que faz com que o códon UGA codifique a selenocisteína em vez de um códon de parada. A pirrolisina é usada por algumas archaeas metanogênicas em enzimas que elas usam para produzir metano. É codificado com o códon UAG, que normalmente é um códon de parada em outros organismos. Este códon UAG é seguido por uma sequência downstream PYLIS.
Vários estudos evolutivos independentes sugeriram que Gly, Ala, Asp, Val, Ser, Pro, Glu, Leu, Thr podem pertencer a um grupo de aminoácidos que constituíam o código genético inicial, enquanto Cys, Met, Tyr, Trp, His, Phe pode pertencer a um grupo de aminoácidos que constituíram acréscimos posteriores do código genético.
Aminoácidos padrão x não padrão
Os 20 aminoácidos que são codificados diretamente pelos códons do código genético universal são chamados de aminoácidos padrão ou canônicos. Uma forma modificada de metionina (N-formilmetionina) é frequentemente incorporada no lugar da metionina como o aminoácido inicial de proteínas em bactérias, mitocôndrias e cloroplastos. Outros aminoácidos são chamados de não padronizados ou não canônicos. A maioria dos aminoácidos não padronizados também são não proteinogênicos (ou seja, não podem ser incorporados às proteínas durante a tradução), mas dois deles são proteinogênicos, pois podem ser incorporados translacionalmente às proteínas, explorando informações não codificadas no código genético universal.
Os dois aminoácidos proteinogênicos não padronizados são a selenocisteína (presente em muitos não eucariontes, bem como na maioria dos eucariotos, mas não codificados diretamente pelo DNA) e pirrolisina (encontrada apenas em algumas archaea e pelo menos uma bactéria). A incorporação desses aminoácidos fora do padrão é rara. Por exemplo, 25 proteínas humanas incluem selenocisteína em sua estrutura primária, e as enzimas caracterizadas estruturalmente (selenoenzimas) empregam selenocisteína como a porção catalítica em seus sítios ativos. Pirrolisina e selenocisteína são codificadas por meio de códons variantes. Por exemplo, a selenocisteína é codificada pelo códon de parada e pelo elemento SECIS.
N-formilmetionina (que geralmente é o aminoácido inicial de proteínas em bactérias, mitocôndrias e cloroplastos) é geralmente considerada como uma forma de metionina, e não como um aminoácido proteinogênico separado. As combinações códon-tRNA não encontradas na natureza também podem ser usadas para "expandir" o código genético e formam novas proteínas conhecidas como aloproteínas incorporando aminoácidos não proteinogênicos.
Aminoácidos não proteinogênicos
Além dos 22 aminoácidos proteinogênicos, muitos aminoácidos não proteinogênicos são conhecidos. Aqueles não são encontrados em proteínas (por exemplo, carnitina, GABA, levotiroxina) ou não são produzidos diretamente e isoladamente pela maquinaria celular padrão (por exemplo, hidroxiprolina e selenometionina).
Os aminoácidos não proteinogênicos encontrados nas proteínas são formados por modificação pós-traducional, que é a modificação após a tradução durante a síntese de proteínas. Essas modificações são muitas vezes essenciais para a função ou regulação de uma proteína. Por exemplo, a carboxilação do glutamato permite uma melhor ligação dos cátions de cálcio, e o colágeno contém hidroxiprolina, gerada pela hidroxilação da prolina. Outro exemplo é a formação de hipusina no fator de iniciação da tradução EIF5A, por meio da modificação de um resíduo de lisina. Tais modificações também podem determinar a localização da proteína, por exemplo, a adição de longos grupos hidrofóbicos pode fazer com que uma proteína se ligue a uma membrana fosfolipídica.
Alguns aminoácidos não proteinogênicos não são encontrados nas proteínas. Exemplos incluem o ácido 2-aminoisobutírico e o neurotransmissor ácido gama-aminobutírico. Aminoácidos não proteinogênicos geralmente ocorrem como intermediários nas vias metabólicas para aminoácidos padrão - por exemplo, ornitina e citrulina ocorrem no ciclo da ureia, parte do catabolismo de aminoácidos (veja abaixo). Uma rara exceção ao domínio dos α-aminoácidos na biologia é o β-aminoácido beta alanina (ácido 3-aminopropanóico), que é usado em plantas e microorganismos na síntese do ácido pantotênico (vitamina B5), um componente da coenzima A.
Na nutrição humana
Quando absorvidos pelo corpo humano a partir da dieta, os 20 aminoácidos padrão são usados para sintetizar proteínas, outras biomoléculas, ou são oxidados em ureia e dióxido de carbono como fonte de energia. A via de oxidação começa com a remoção do grupo amino por uma transaminase; o grupo amino é então alimentado no ciclo da ureia. O outro produto da transamidação é um cetoácido que entra no ciclo do ácido cítrico. Aminoácidos glicogênicos também podem ser convertidos em glicose, através da gliconeogênese. Dos 20 aminoácidos padrão, nove (His, Ile, Leu, Lys, Met, Phe, Thr, Trp e Val) são chamados de aminoácidos essenciais porque o corpo humano não pode sintetizá-los a partir de outros compostos no nível necessário para o crescimento normal, então eles devem ser obtidos a partir de alimentos. Além disso, cisteína, tirosina e arginina são considerados aminoácidos semi-essenciais e a taurina um ácido aminossulfônico semi-essencial em crianças. As vias metabólicas que sintetizam esses monômeros não estão totalmente desenvolvidas. As quantidades necessárias também dependem da idade e da saúde do indivíduo, por isso é difícil fazer afirmações gerais sobre a necessidade dietética de alguns aminoácidos. A exposição alimentar ao aminoácido não padrão BMAA tem sido associada a doenças neurodegenerativas humanas, incluindo ALS.
• PA: ácido fosfatídico
• mTOR: alvo mecânico de rapamycin
• AMP: monofosfato de adenosina
• ATP: trifosfato de adenosina
• AMPK: proteína quinase ativada por AMP
• PGC‐1α: coativador de gamma de receptor ativado por proliferador peroxisome-1α
• S6K1: p70S6 quinase
• 4EBP1: proteína de iniciação de tradução eucariótica 4E-binding 1
• eIF4E: fator de iniciação de tradução eucariótica 4E
• RPS6: proteína ribosomal S6
• eEF2: fator de alongamento eucariótico 2
• RE: exercício de resistência; EE: exercício de resistência
• Myo: myofibrillar; Mito: mitocondrial
• AA: aminoácidos
• HMB: ácido β-hidroxi β-metilbutírico
• ↑ representa ativação
• O TT representa a inibição
Funções não proteicas
Caminhos biossintéticos para catecolaminas e vestígios de aminas no cérebro humano |
Em humanos, os aminoácidos não protéicos também têm papéis importantes como intermediários metabólicos, como na biossíntese do neurotransmissor ácido gama-aminobutírico (GABA). Muitos aminoácidos são usados para sintetizar outras moléculas, por exemplo:
- Tryptophan é um precursor da serotonina do neurotransmissor.
- A tirosina (e sua fenilalanina precursora) são precursores da catecolamina neurotransmissores dopamina, epinefrina e norepinefrina e várias aminas de traço.
- Phenilalanina é um precursor de fenetilamina e tirosina em humanos. Nas plantas, é um precursor de vários fenilpropanoides, que são importantes no metabolismo vegetal.
- Glycine é um precursor de porfirinas como o heme.
- Arginina é um precursor de óxido nítrico.
- Ornitina e S-adenosilmetionina são precursores de poliaminas.
- Aspartato, glicina e glutamina são precursores de nucleotídeos. No entanto, nem todas as funções de outros aminoácidos não padronizados abundantes são conhecidas.
Alguns aminoácidos fora do padrão são usados como defesa contra herbívoros nas plantas. Por exemplo, a canavanina é um análogo da arginina que é encontrada em muitas leguminosas, e em quantidades particularmente grandes em Canavalia gladiata (feijão espada). Este aminoácido protege as plantas de predadores como insetos e pode causar doenças nas pessoas se alguns tipos de leguminosas forem consumidos sem processamento. O aminoácido não protéico mimosina é encontrado em outras espécies de leguminosas, em particular na Leucaena leucocephala. Este composto é um análogo da tirosina e pode envenenar os animais que pastam nessas plantas.
Usos na indústria
Fertilizante
A capacidade quelante dos aminoácidos às vezes é usada em fertilizantes para facilitar a entrega de minerais às plantas, a fim de corrigir deficiências minerais, como a clorose de ferro. Esses fertilizantes também são usados para prevenir a ocorrência de deficiências e melhorar a saúde geral das plantas.
Ração para animais
Às vezes, os aminoácidos são adicionados à ração animal porque alguns dos componentes dessas rações, como a soja, têm baixos níveis de alguns dos aminoácidos essenciais, especialmente de lisina, metionina, treonina e triptofano. Da mesma forma, os aminoácidos são usados para quelar os cátions metálicos, a fim de melhorar a absorção de minerais dos suplementos alimentares.
Comida
A indústria alimentícia é uma grande consumidora de aminoácidos, principalmente o ácido glutâmico, utilizado como intensificador de sabor, e o aspartame (aspartilfenilalanina 1-metil éster), utilizado como adoçante artificial. Às vezes, os aminoácidos são adicionados aos alimentos pelos fabricantes para aliviar os sintomas de deficiências minerais, como anemia, melhorando a absorção de minerais e reduzindo os efeitos colaterais negativos da suplementação de minerais inorgânicos.
Produtos farmacêuticos e cosméticos
Da mesma forma, alguns derivados de aminoácidos são usados na indústria farmacêutica. Eles incluem 5-HTP (5-hidroxitriptofano) usado para o tratamento experimental da depressão, L-DOPA (L-diidroxifenilalanina) para o tratamento de Parkinson e a droga eflornitina que inibe a ornitina descarboxilase e usada em o tratamento da doença do sono. Os aminoácidos são utilizados na síntese de alguns cosméticos.
Código genético expandido
Desde 2001, 40 aminoácidos não naturais foram adicionados à proteína, criando um códon único (recodificação) e um correspondente par de transferência-RNA:aminoacil - tRNA-sintetase para codificá-lo com diversas propriedades físico-químicas e biológicas, a fim de ser usado como uma ferramenta para explorar a estrutura e função da proteína ou para criar proteínas novas ou aprimoradas.
Nulômeros
Nulômeros são códons que em teoria codificam um aminoácido, porém, na natureza existe um viés seletivo contra o uso deste códon em favor de outro, por exemplo bactérias preferem usar CGA em vez de AGA para codificar arginina. Isso cria algumas sequências que não aparecem no genoma. Essa característica pode ser aproveitada e usada para criar novas drogas seletivas de combate ao câncer e para evitar a contaminação cruzada de amostras de DNA de investigações de cenas de crime.
Blocos de construção químicos
Os aminoácidos são importantes como matérias-primas de baixo custo. Esses compostos são usados na síntese de pool quiral como blocos de construção enantiomericamente puros.
Os aminoácidos têm sido investigados como precursores de catalisadores quirais, como para reações de hidrogenação assimétrica, embora não existam aplicações comerciais.
Plásticos biodegradáveis
Os aminoácidos têm sido considerados como componentes de polímeros biodegradáveis, que têm aplicações como embalagens ecologicamente corretas e na medicina, na administração de medicamentos e na construção de implantes protéticos. Um exemplo interessante de tais materiais é o poliaspartato, um polímero biodegradável solúvel em água que pode ter aplicações em fraldas descartáveis e na agricultura. Devido à sua solubilidade e capacidade de quelar íons metálicos, o poliaspartato também está sendo usado como agente antiincrustante biodegradável e inibidor de corrosão. Além disso, o aminoácido aromático tirosina tem sido considerado um possível substituto para fenóis como o bisfenol A na fabricação de policarbonatos.
Síntese
Síntese química
A produção comercial de aminoácidos geralmente depende de bactérias mutantes que superproduzem aminoácidos individuais usando glicose como fonte de carbono. Alguns aminoácidos são produzidos por conversões enzimáticas de intermediários sintéticos. O ácido 2-aminotiazolina-4-carboxílico é um intermediário em uma síntese industrial de L-cisteína, por exemplo. O ácido aspártico é produzido pela adição de amônia ao fumarato usando uma liase.
Biossíntese
Nas plantas, o nitrogênio é primeiro assimilado em compostos orgânicos na forma de glutamato, formado a partir de alfa-cetoglutarato e amônia na mitocôndria. Para outros aminoácidos, as plantas usam transaminases para mover o grupo amino do glutamato para outro alfa-cetoácido. Por exemplo, a aspartato aminotransferase converte glutamato e oxaloacetato em alfa-cetoglutarato e aspartato. Outros organismos também usam transaminases para a síntese de aminoácidos.
Aminoácidos não padronizados são geralmente formados através de modificações em aminoácidos padrão. Por exemplo, a homocisteína é formada pela via de transsulfuração ou pela desmetilação da metionina por meio do metabólito intermediário S-adenosilmetionina, enquanto a hidroxiprolina é produzida por uma modificação pós-translacional da prolina.
Microorganismos e plantas sintetizam muitos aminoácidos incomuns. Por exemplo, alguns micróbios produzem ácido 2-aminoisobutírico e lantionina, que é um derivado da alanina ligado por sulfeto. Ambos os aminoácidos são encontrados em lantibióticos peptídicos, como alameticina. No entanto, nas plantas, o ácido 1-aminociclopropano-1-carboxílico é um pequeno aminoácido cíclico dissubstituído que é um intermediário na produção do hormônio vegetal etileno.
Síntese primordial
Supõe-se que a formação de aminoácidos e peptídeos precede e talvez induza o surgimento da vida na Terra. Os aminoácidos podem se formar a partir de precursores simples sob várias condições. O metabolismo químico superficial de aminoácidos e compostos muito pequenos pode ter levado ao acúmulo de aminoácidos, coenzimas e pequenas moléculas de carbono baseadas em fosfato. Aminoácidos e blocos de construção semelhantes podem ter sido elaborados em protopeptídeos, com os peptídeos sendo considerados peças-chave na origem da vida.
No famoso experimento de Urey-Miller, a passagem de um arco elétrico através de uma mistura de metano, hidrogênio e amônia produz um grande número de aminoácidos. Desde então, os cientistas descobriram uma variedade de formas e componentes pelos quais a formação potencialmente prebiótica e a evolução química de peptídeos podem ter ocorrido, como agentes de condensação, o design de peptídeos autorreplicantes e vários mecanismos não enzimáticos pelos quais aminoácidos ácidos poderiam ter emergido e elaborado em peptídeos. Várias hipóteses invocam a síntese de Strecker em que o cianeto de hidrogênio, aldeídos simples, amônia e água produzem aminoácidos.
De acordo com uma revisão, aminoácidos e até mesmo peptídeos "aparecem regularmente em vários caldos experimentais que foram preparados com produtos químicos simples". Isso ocorre porque os nucleotídeos são muito mais difíceis de sintetizar quimicamente do que os aminoácidos." Para uma ordem cronológica, sugere que deve ter havido um 'mundo da proteína' ou pelo menos um 'mundo polipeptídico', possivelmente mais tarde seguido pelo 'mundo do RNA' e o 'mundo do DNA'. Os mapeamentos códon-aminoácidos podem ser o sistema de informação biológica na origem primordial da vida na Terra. Embora os aminoácidos e, consequentemente, os peptídeos simples devam ter se formado em diferentes cenários geoquímicos testados experimentalmente, a transição de um mundo abiótico para as primeiras formas de vida ainda não foi resolvida.
Reações
Os aminoácidos sofrem as reações esperadas dos grupos funcionais constituintes.
Formação de ligação peptídica
Como os grupos amina e ácido carboxílico dos aminoácidos podem reagir para formar ligações amida, uma molécula de aminoácido pode reagir com outra e se unir por meio de uma ligação amida. Essa polimerização de aminoácidos é o que cria as proteínas. Essa reação de condensação produz a ligação peptídica recém-formada e uma molécula de água. Nas células, essa reação não ocorre diretamente; em vez disso, o aminoácido é primeiro ativado por ligação a uma molécula de RNA de transferência por meio de uma ligação éster. Este aminoacil-tRNA é produzido em uma reação dependente de ATP realizada por uma aminoacil-tRNA sintetase. Este aminoacil-tRNA é então um substrato para o ribossomo, que catalisa o ataque do grupo amino da cadeia protéica em alongamento na ligação éster. Como resultado desse mecanismo, todas as proteínas produzidas pelos ribossomos são sintetizadas começando em seu terminal N e movendo-se em direção ao terminal C.
No entanto, nem todas as ligações peptídicas são formadas dessa maneira. Em alguns casos, os peptídeos são sintetizados por enzimas específicas. Por exemplo, o tripeptídeo glutationa é parte essencial das defesas das células contra o estresse oxidativo. Este peptídeo é sintetizado em duas etapas a partir de aminoácidos livres. Na primeira etapa, a gama-glutamilcisteína sintetase condensa cisteína e glutamato através de uma ligação peptídica formada entre a cadeia carboxila lateral do glutamato (o carbono gama desta cadeia lateral) e o grupo amino da cisteína. Este dipeptídeo é então condensado com glicina pela glutationa sintetase para formar glutationa.
Na química, os peptídeos são sintetizados por uma variedade de reações. Um dos mais usados na síntese de peptídeos em fase sólida usa os derivados aromáticos oxima de aminoácidos como unidades ativadas. Estes são adicionados em sequência à cadeia crescente de peptídeos, que é anexada a um suporte sólido de resina. Bibliotecas de peptídeos são usadas na descoberta de medicamentos por meio de triagem de alto rendimento.
A combinação de grupos funcionais permite que os aminoácidos sejam ligantes polidentados eficazes para quelatos de metal-aminoácido. As múltiplas cadeias laterais de aminoácidos também podem sofrer reações químicas.
Catabolismo

* Glucogênico, com os produtos que têm a capacidade de formar a glicose por gluconeoneogenesis
* Ketogênico, com os produtos que não têm a capacidade de formar a glicose. Estes produtos ainda podem ser usados para a cetogênese ou síntese lipídica.
* Ácidos aminados catabolizados em produtos glucogênicos e quetogênicos.
A degradação de um aminoácido geralmente envolve a desaminação, movendo seu grupo amino para alfa-cetoglutarato, formando o glutamato. Esse processo envolve transaminases, geralmente as mesmas usadas na aminação durante a síntese. Em muitos vertebrados, o grupo amino é então removido através do ciclo da uréia e é excretado na forma de uréia. No entanto, a degradação de aminoácidos pode produzir ácido úrico ou amônia. Por exemplo, a serina desidratase converte serina em piruvato e amônia. Após a remoção de um ou mais grupos amino, o restante da molécula às vezes pode ser usado para sintetizar novos aminoácidos ou pode ser usado para energia entrando na glicólise ou no ciclo do ácido cítrico, conforme detalhado na imagem à direita.
Complexação
Os aminoácidos são ligantes bidentados, formando complexos de aminoácidos de metais de transição.
Análise química
O conteúdo total de nitrogênio da matéria orgânica é formado principalmente pelos grupos amino nas proteínas. O Nitrogênio Total Kjeldahl (TKN) é uma medida de nitrogênio amplamente utilizada na análise de água (residual), solo, alimentos, rações e matéria orgânica em geral. Como o nome sugere, o método Kjeldahl é aplicado. Métodos mais sensíveis estão disponíveis.
Contenido relacionado
Cromatografia
Francelho comum
Justus von Liebig