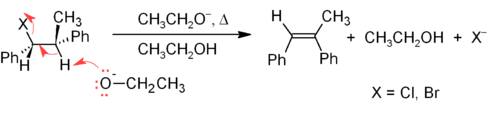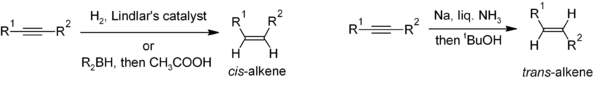Alceno
Em química orgânica, um alceno é um hidrocarboneto contendo uma ligação dupla carbono-carbono.
Alceno é frequentemente usado como sinônimo de olefina, ou seja, qualquer hidrocarboneto contendo uma ou mais ligações duplas. Dois tipos gerais de monoalcenos são distinguidos: terminal e interno. Também chamados de α-olefinas, os alcenos terminais são mais úteis.
No entanto, a União Internacional de Química Pura e Aplicada (IUPAC) recomenda o uso do nome "alceno" apenas para hidrocarbonetos acíclicos com apenas uma ligação dupla; alcadieno, alcatrieno, etc., ou polieno para hidrocarbonetos acíclicos com duas ou mais ligações duplas; cicloalceno, cicloalcadieno, etc. para os cíclicos; e "olefina" para a classe geral – cíclicos ou acíclicos, com uma ou mais ligações duplas.
Alcenos acíclicos, com apenas uma ligação dupla e sem outros grupos funcionais (também conhecidos como mono-enos) formam uma série homóloga de hidrocarbonetos com a fórmula geral CnH2n com n sendo 2 ou mais (que é dois hidrogênios a menos que o alcano correspondente). Quando n é quatro ou mais, isômeros são possíveis, distinguidos pela posição e conformação da ligação dupla.
Os alcenos são geralmente compostos apolares incolores, um pouco semelhantes aos alcanos, mas mais reativos. Os primeiros membros da série são gases ou líquidos à temperatura ambiente. O alceno mais simples, etileno (C2H4) (ou "eteno" na nomenclatura IUPAC) é o composto orgânico produzido em maior escala industrialmente.
Compostos aromáticos são muitas vezes desenhados como alcenos cíclicos, no entanto, sua estrutura e propriedades são suficientemente distintas para que não sejam classificados como alcenos ou olefinas. Hidrocarbonetos com duas ligações duplas sobrepostas (C=C=C) são chamados de alenos — o composto mais simples é chamado de aleno — e aqueles com três ou mais ligações sobrepostas (C=C=C=C, C=C=C=C=C, etc.) são chamados cumulenos. Alguns autores não consideram os alenos e cumulenos como "alcenos".
Isomerismo estrutural
Alcenos com quatro ou mais átomos de carbono podem formar diversos isômeros estruturais. A maioria dos alcenos também são isômeros de cicloalcanos. Seguem os isômeros estruturais de alceno acíclico com apenas uma ligação dupla:
- C2H. H. H.4: somente etileno
- C3H. H. H.6: somente de propileno
- C4H. H. H.8: 3 isômeros: 1-buteno, 2-buteno, e isobutileno
- C5H. H. H.10.: 5 isômeros: 1-penteno, 2-penteno, 2-metil-1-buteno, 3-metil-1-buteno, 2-metil-2-buteno
- C6H. H. H.12: 13 isômeros: 1-hexeno, 2-hexeno, 3-hexeno, 2-metil-1-penteno, 3-metil-1-penteno, 4-metil-1-penteno, 2-metil-2-penteno, 3-metil-2-penteno, 4-metil-2-penteno, 2,3-dimetil-1-buteno, 3,3-dimetil-1-buteno
- C7H. H. H.14: 27 isômeros (calculados)
- C12H. H. H.24.: 2,281 isômeros (calculados)
- C31H. H. H.62: 193,706,542,776 isômeros (calculados)
Muitas dessas moléculas exibem isomerismo cis-trans. Também pode haver átomos de carbono quirais particularmente dentro das moléculas maiores (de C5). O número de isômeros potenciais aumenta rapidamente com átomos de carbono adicionais.
Estrutura e ligação
Vínculo
Uma ligação dupla carbono-carbono consiste em uma ligação sigma e uma ligação pi. Essa ligação dupla é mais forte que uma ligação covalente simples (611 kJ/mol para C=C vs. 347 kJ/mol para C–C), mas não duas vezes mais forte. As ligações duplas são mais curtas do que as ligações simples com um comprimento médio de ligação de 1,33 Å (133 pm) vs 1,53 Å para uma ligação simples C-C típica.
Cada átomo de carbono da ligação dupla usa seus três orbitais híbridos sp2 para formar ligações sigma com três átomos (o outro átomo de carbono e dois átomos de hidrogênio). Os orbitais atômicos 2p não hibridizados, que ficam perpendiculares ao plano criado pelos eixos dos três orbitais híbridos sp², combinam-se para formar a ligação pi. Essa ligação fica fora do eixo C-C principal, com metade da ligação em um lado da molécula e metade no outro. Com uma força de 65 kcal/mol, a ligação pi é significativamente mais fraca que a ligação sigma.
A rotação em torno da ligação dupla carbono-carbono é restrita porque incorre em um custo energético para quebrar o alinhamento dos orbitais p nos dois átomos de carbono. Conseqüentemente, os isômeros cis ou trans se interconvertem tão lentamente que podem ser manipulados livremente em condições ambientais sem isomerização. Alcenos mais complexos podem ser nomeados com a notação E-Z para moléculas com três ou quatro substituintes diferentes (grupos laterais). Por exemplo, dos isômeros do buteno, os dois grupos metil do (Z)-but-2-eno (também conhecido como cis-2-buteno) aparecem do mesmo lado da ligação dupla, e em (E)-but-2-eno (também conhecido como trans-2-buteno) os grupos metil aparecem em lados opostos. Esses dois isômeros do buteno têm propriedades distintas.
Forma
Conforme previsto pelo modelo VSEPR de repulsão de pares de elétrons, a geometria molecular dos alcenos inclui ângulos de ligação em torno de cada átomo de carbono em uma ligação dupla de cerca de 120°. O ângulo pode variar devido à tensão estérica introduzida por interações não ligadas entre grupos funcionais ligados aos átomos de carbono da ligação dupla. Por exemplo, o ângulo de ligação C–C–C no propileno é 123,9°.
Para alcenos em ponte, a regra de Bredt afirma que uma ligação dupla não pode ocorrer na ponte de um sistema de anéis em ponte, a menos que os anéis sejam grandes o suficiente. Seguindo Fawcett e definindo S como o número total de átomos não ponte nos anéis, sistemas bicíclicos requerem S ≥ 7 para estabilidade e sistemas tricíclicos requerem S ≥ 11.
Propriedades físicas
Muitas das propriedades físicas de alcenos e alcanos são semelhantes: eles são incolores, apolares e combustíveis. O estado físico depende da massa molecular: como os hidrocarbonetos saturados correspondentes, os alcenos mais simples (etileno, propileno e buteno) são gases à temperatura ambiente. Alcenos lineares de aproximadamente cinco a dezesseis átomos de carbono são líquidos e alcenos superiores são sólidos cerosos. O ponto de fusão dos sólidos também aumenta com o aumento da massa molecular.
Alcenos geralmente têm cheiros mais fortes do que seus alcanos correspondentes. O etileno tem um odor doce e mofado. A ligação do íon cúprico à olefina no receptor olfativo de mamífero MOR244-3 está implicada no cheiro de alcenos (bem como de tióis). Alcenos tensos, em particular, como norborneno e trans-cicloocteno, são conhecidos por terem odores fortes e desagradáveis, um fato consistente com os complexos π mais fortes que eles formam com íons metálicos, incluindo cobre.
Reações
Os alcenos são compostos relativamente estáveis, mas são mais reativos que os alcanos. A maioria das reações de alcenos envolve adições a essa ligação pi, formando novas ligações simples. Os alcenos servem como matéria-prima para a indústria petroquímica, pois podem participar de uma ampla variedade de reações, destacando-se a polimerização e a alquilação.
Exceto para o etileno, os alcenos têm dois locais de reatividade: a ligação pi carbono-carbono e a presença de centros CH alílicos. O primeiro domina, mas os sítios alílicos também são importantes.
Reações de adição
Os alcenos reagem em muitas reações de adição, que ocorrem abrindo a ligação dupla. A maioria dessas reações de adição segue o mecanismo de adição eletrofílica. Exemplos são hidrohalogenação, halogenação, formação de haloidrina, oximercuração, hidroboração, adição de diclorocarbeno, reação de Simmons-Smith, hidrogenação catalítica, epoxidação, polimerização radicalar e hidroxilação.
Hidrogenação e hidroelementações relacionadas
A hidrogenação de alcenos produz os alcanos correspondentes. A reação às vezes é realizada sob pressão e em temperatura elevada. Catalisadores metálicos são quase sempre necessários. Catalisadores industriais comuns são baseados em platina, níquel e paládio. Uma aplicação em larga escala é a produção de margarina.
Além da adição de H−H através da ligação dupla, muitos outros H−X's podem ser adicionados. Estes processos são muitas vezes de grande importância comercial. Um exemplo é a adição de H-SiR3, ou seja, hidrosililação. Esta reação é usada para gerar compostos de organossilício. Outra reação é a hidrocianação, a adição de H−CN através da ligação dupla.
Hidratação
A hidratação, a adição de água através da dupla ligação dos alcenos, produz álcoois. A reação é catalisada por ácido fosfórico ou ácido sulfúrico. Essa reação é realizada em escala industrial para a produção de etanol sintético.
Alcenos também podem ser convertidos em álcoois através da reação de oximercuração-desmercuração, reação de hidroboração-oxidação ou por hidratação de Mukaiyama.
Halogenação
Na halogenação eletrofílica, a adição de bromo elementar ou cloro a alcenos produz dibromo e dicloroalcanos vicinais (1,2-di-halogenetos ou di-halogenetos de etileno), respectivamente. A descoloração de uma solução de bromo em água é um teste analítico para a presença de alcenos:
As reações relacionadas também são usadas como medidas quantitativas de insaturação, expressas como o número de bromo e o número de iodo de um composto ou mistura.
Hidroalogenação
A hidroalogenação é a adição de haletos de hidrogênio, como HCl ou HI, a alcenos para produzir os haloalcanos correspondentes:
Se os dois átomos de carbono na ligação dupla estiverem ligados a um número diferente de átomos de hidrogênio, o halogênio é encontrado preferencialmente no carbono com menos substituintes de hidrogênio. Esse padrão é conhecido como regra de Markovnikov. O uso de iniciadores de radicais ou outros compostos pode levar ao resultado do produto oposto. O ácido bromídrico, em particular, é propenso a formar radicais na presença de várias impurezas ou mesmo de oxigênio atmosférico, levando à reversão do resultado de Markovnikov:
Formação de haloidrina
Alcenos reagem com água e halogênios para formar haloidrinas por uma reação de adição. Ocorre regioquímica e antiestereoquímica de Markovnikov.
Oxidação
Os alcenos reagem com ácidos percarboxílicos e até com peróxido de hidrogênio para produzir epóxidos:
Para o etileno, a epoxidação é conduzida em grande escala industrialmente usando oxigênio na presença de catalisadores:
Os alcenos reagem com o ozônio, levando à cisão da ligação dupla. O processo é chamado de ozonólise. Freqüentemente, o procedimento de reação inclui um redutor suave, como dimetilsulfeto (SMe2):
Quando tratados com uma solução acidificada e concentrada a quente de KMnO4, os alcenos são clivados para formar cetonas e/ou ácidos carboxílicos. A estequiometria da reação é sensível às condições. Esta reação e a ozonólise podem ser usadas para determinar a posição de uma ligação dupla em um alceno desconhecido.
A oxidação pode ser interrompida no diol vicinal em vez da clivagem completa do alceno usando tetróxido de ósmio ou outros oxidantes:
Essa reação é chamada de diidroxilação.
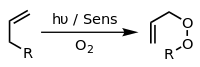
Na presença de um fotossensibilizador apropriado, como azul de metileno e luz, os alcenos podem reagir com espécies reativas de oxigênio geradas pelo fotossensibilizador, como radicais hidroxila, oxigênio singleto ou íon superóxido. As reações do sensibilizador excitado podem envolver transferência de elétrons ou hidrogênio, geralmente com um substrato redutor (reação Tipo I) ou interação com oxigênio (reação Tipo II). Esses vários processos e reações alternativos podem ser controlados pela escolha de condições de reação específicas, levando a uma ampla gama de produtos. Um exemplo comum é a [4+2]-cicloadição de oxigênio singleto com um dieno como o ciclopentadieno para produzir um endoperóxido:
Outro exemplo é a reação do eno de Schenck, na qual o oxigênio singleto reage com uma estrutura alílica para dar um peróxido de alila transposto:
Polimerização
Os alcenos terminais são precursores de polímeros por meio de processos denominados polimerização. Algumas polimerizações são de grande importância econômica, pois geram como plásticos o polietileno e o polipropileno. Polímeros de alceno são geralmente referidos como poliolefinas embora não contenham olefinas. A polimerização pode prosseguir através de diversos mecanismos. dienos conjugados como buta-1,3-dieno e isopreno (2-metilbuta-1,3-dieno) também produzem polímeros, sendo um exemplo a borracha natural.
Complexação de metais
Alcenos são ligantes em complexos de alcenos de metais de transição. Os dois centros de carbono ligam-se ao metal usando os orbitais pi e pi* C−C. Mono e diolefinas são freqüentemente usadas como ligantes em complexos estáveis. Ciclooctadieno e norbornadieno são agentes quelantes populares, e até mesmo o próprio etileno às vezes é usado como ligante, por exemplo, no sal de Zeise. Além disso, os complexos metal-alceno são intermediários em muitas reações catalisadas por metais, incluindo hidrogenação, hidroformilação e polimerização.
Visão geral da reação
| Nome da reação | Produto | Comentário |
|---|---|---|
| Hidrogenação | Países Baixos | adição de hidrogênio |
| Hidroligações | Alkenes | hidrometalação / inserção / eliminação beta por catalisador de metal |
| Reação de adição de Halogen | 1.2-dihalide | adição eletrofílica de halogênios |
| Hydrohalogenation (Markovnikov) | Estados Unidos da América | adição de ácidos hidrohalic |
| Anti-Markovnikov hidrohalogenia | Estados Unidos da América | radicais livres mediated adição de ácidos hidrohalic |
| Hidroaminação | aminas | adição de N−H ligação C-C dupla ligação |
| Hidroformulação | Aldeídos | processo industrial, adição de CO e H. H. H.2 |
| Reação de hidrocarboxilação e Koch | ácido carboxílico | processo industrial, adição de CO e H. H. H.2O. |
| Carboalkoxylation | Ester | processo industrial, adição de CO e álcool. |
| alquilação | Ester | processo industrial: ácido carboxílico alcalino com ácido silicotungstic o catalisador. |
| Bishidroxila aguda | Diols | oxidação, reagente: tetróxido de ósmio, ligante quiral |
| Cis-hidroxilação de madeira | Diols | oxidação, reagentes: iodo, acetato de prata |
| Ozonoli | aldeídos ou cetonas | reagente: ozônio |
| Metatese olefina | Alkenes | dois alkenes rearranjam para formar dois novos alkenes |
| Diels-Alder reação | Cicloohexes | cycloaddition com um diene |
| Reação de Pauson–Khand | Ciclopentenones | cycloaddition com um alkyne e CO |
| Hidroborização–oxidação | álcool | reagentes: borane, então um peróxido |
| Redução de Oxymercuration | álcool | adição eletrofílica de acetato mercúrio, em seguida, redução |
| Reação de prins | 1,3-diols | adição eletrofílica com aldeído ou cetona |
| Reação Paterno-Büchi | Oxigênios | reação fotoquímica com aldeído ou cetona |
| Epoxidação | Epoxide | adição eletrofílica de um peróxido |
| Cyclopropanation | ciclopropano | adição de berbenos ou carbenóides |
| Hidroaculação | Cetonas | adição oxidativa / eliminação redutora por catalisador de metal |
| Hidrofosphina | fosfinhas |
Síntese
Métodos industriais
Alcenos são produzidos por craqueamento de hidrocarbonetos. As matérias-primas são principalmente componentes do condensado de gás natural (principalmente etano e propano) nos EUA e no Oriente Médio e nafta na Europa e na Ásia. Os alcanos são quebrados em altas temperaturas, muitas vezes na presença de um catalisador zeólito, para produzir uma mistura de alcenos principalmente alifáticos e alcanos de baixo peso molecular. A mistura depende da matéria-prima e da temperatura e é separada por destilação fracionada. Isso é usado principalmente para a fabricação de pequenos alcenos (até seis carbonos).
Relacionado a isso está a desidrogenação catalítica, onde um alcano perde hidrogênio em altas temperaturas para produzir um alceno correspondente. Este é o inverso da hidrogenação catalítica de alcenos.
Esse processo também é conhecido como reforma. Ambos os processos são endotérmicos e são direcionados para o alceno em altas temperaturas pela entropia.
A síntese catalítica de α-alcenos superiores (do tipo RCH=CH2) também pode ser alcançada por uma reação de etileno com o composto organometálico trietilalumínio na presença de níquel, cobalto ou platina.
Reações de eliminação
Um dos principais métodos para a síntese de alceno no laboratório é a eliminação ambiente de haletos de alquila, álcoois e compostos semelhantes. A mais comum é a eliminação β através do mecanismo E2 ou E1, mas também são conhecidas eliminações α.
O mecanismo E2 fornece um método de eliminação β mais confiável do que E1 para a maioria das sínteses de alcenos. A maioria das eliminações de E2 começa com um haleto de alquila ou éster de sulfonato de alquila (como um tosilato ou triflato). Quando um haleto de alquila é usado, a reação é chamada de desidroalogenação. Para produtos assimétricos, os alcenos mais substituídos (aqueles com menos hidrogênios ligados ao C=C) tendem a predominar (ver regra de Zaitsev). Dois métodos comuns de reações de eliminação são a desidroalogenação de haletos de alquila e a desidratação de álcoois. Um exemplo típico é mostrado abaixo; observe que, se possível, o H é anti para o grupo abandonador, mesmo que isso leve ao isômero Z menos estável.
Alcenos podem ser sintetizados a partir de álcoois por desidratação, caso em que a água é perdida por meio do mecanismo E1. Por exemplo, a desidratação do etanol produz etileno:
- CH3CH2OH → H2C.2 + H2O
Um álcool também pode ser convertido em um grupo de saída melhor (por exemplo, xantato), de modo a permitir uma eliminação sin mais suave, como a eliminação de Chugaev e a eliminação de Grieco. As reações relacionadas incluem eliminações por β-haloéteres (a síntese de olefinas de Boord) e ésteres (pirólise de ésteres).
Os alcenos podem ser preparados indiretamente a partir de alquilaminas. A amina ou amônia não é um grupo de partida adequado, então a amina é primeiro alquilada (como na eliminação de Hofmann) ou oxidada a um óxido de amina (a reação de Cope) para possibilitar uma eliminação suave. A reação de Cope é uma eliminação sin que ocorre em ou abaixo de 150 °C, por exemplo:
A eliminação de Hofmann é incomum porque o alceno menos substituído (não-Zaitsev) é geralmente o produto principal.
Os alcenos são gerados a partir de α-halosulfonas na reação de Ramberg-Bäcklund, por meio de um anel intermediário de sulfona de três membros.
Síntese de compostos carbonílicos
Outro método importante para a síntese de alceno envolve a construção de uma nova ligação dupla carbono-carbono por acoplamento de um composto carbonílico (como um aldeído ou cetona) a um carbânion equivalente. Tais reações às vezes são chamadas de olefinações. O mais conhecido desses métodos é a reação de Wittig, mas outros métodos relacionados são conhecidos, incluindo a reação de Horner-Wadsworth-Emmons.
A reação de Wittig envolve a reação de um aldeído ou cetona com um reagente de Wittig (ou fosforano) do tipo Ph3P=CHR para produzir um alceno e Ph3P=O. O próprio reagente de Wittig é preparado facilmente a partir de trifenilfosfina e um haleto de alquila. A reação é bastante geral e muitos grupos funcionais são tolerados, até ésteres, como neste exemplo:
Relacionada à reação de Wittig está a olefinação de Peterson, que usa reagentes à base de silício no lugar do fosforano. Esta reação permite a seleção de produtos E- ou Z. Se um produto E for desejado, outra alternativa é a olefinação de Julia, que usa o carbânion gerado a partir de uma fenilsulfona. A olefinação Takai baseada em um intermediário de organocromo também fornece produtos eletrônicos. Um composto de titânio, reagente de Tebbe, é útil para a síntese de compostos de metileno; neste caso, até ésteres e amidas reagem.
Um par de cetonas ou aldeídos pode ser desoxigenado para gerar um alceno. Alcenos simétricos podem ser preparados a partir de um único aldeído ou cetona acoplado a si mesmo, usando redução de titânio metálico (a reação de McMurry). Se diferentes cetonas devem ser acopladas, é necessário um método mais complicado, como a reação de Barton-Kellogg.
Uma única cetona também pode ser convertida no alceno correspondente por meio de sua tosilhidrazona, usando metóxido de sódio (a reação de Bamford-Stevens) ou um alquil-lítio (a reação de Shapiro).
Síntese de alcenos
A formação de alcenos mais longos por meio da polimerização gradual de outros menores é atraente, pois o etileno (o menor alceno) é barato e prontamente disponível, com centenas de milhões de toneladas produzidas anualmente. O processo Ziegler-Natta permite a formação de cadeias muito longas, por exemplo, aquelas usadas para polietileno. Onde são desejadas cadeias mais curtas, como para a produção de tensoativos, então os processos que incorporam uma etapa de metátese de olefina, como o processo de olefina superior Shell, são importantes.
A metátese de olefina também é usada comercialmente para a interconversão de etileno e 2-buteno em propileno. Catálise heterogênea contendo rênio e molibdênio é usada neste processo:
- CH2- CH2 + CH3CH3 → 2 CH2- CHCH3
A hidrovinilação catalisada por metais de transição é outro importante processo de síntese de alceno a partir do próprio alceno. Envolve a adição de um hidrogênio e um grupo vinil (ou um grupo alquenil) através de uma ligação dupla.
De alcinos
A redução de alcinos é um método útil para a síntese estereosseletiva de alcenos dissubstituídos. Se o cis-alceno for desejado, a hidrogenação na presença do catalisador de Lindlar (um catalisador heterogêneo que consiste em paládio depositado sobre carbonato de cálcio e tratado com várias formas de chumbo) é comumente usada, embora a hidroboração seguida de hidrólise forneça uma abordagem alternativa. A redução do alcino por sódio metálico em amônia líquida dá origem ao trans-alceno.
Para a preparação de alcenos multissubstituídos, a carbometalação de alcinos pode dar origem a uma grande variedade de derivados de alcenos.
Rearranjos e reações relacionadas
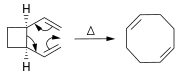
Os alcenos podem ser sintetizados a partir de outros alcenos por meio de reações de rearranjo. Além da metátese de olefinas (descrita acima), muitas reações pericíclicas podem ser usadas, como a reação ene e o rearranjo de Cope.
Na reação de Diels-Alder, um derivado de ciclohexeno é preparado a partir de um dieno e um alceno reativo ou deficiente em elétrons.
Nomenclatura IUPAC
Embora a nomenclatura não seja amplamente seguida, de acordo com a IUPAC, um alceno é um hidrocarboneto acíclico com apenas uma ligação dupla entre os átomos de carbono. As olefinas compreendem uma coleção maior de alcenos cíclicos e acíclicos, bem como dienos e polienos.
Para formar a raiz dos nomes IUPAC para alcenos de cadeia linear, altere o infixo -an- do pai para -en-. Por exemplo, CH3-CH3 é o alcano ethANe. O nome de CH2=CH2 é, portanto, ethENe.
Para alcenos de cadeia linear com 4 ou mais átomos de carbono, esse nome não identifica completamente o composto. Para esses casos, e para alcenos acíclicos ramificados, aplicam-se as seguintes regras:
- Encontra a cadeia de carbono mais longa da molécula. Se essa cadeia não contiver a dupla ligação, nomeie o composto de acordo com as regras de nomeação do alcano. Caso contrário:
- Numerar os carbonos nessa cadeia a partir do fim que é mais próximo da dupla ligação.
- Defina o local k da dupla ligação como sendo o número de seu primeiro carbono.
- Nomeie os grupos laterais (excepto o hidrogênio) de acordo com as regras apropriadas.
- Defina a posição de cada grupo lateral como o número do carbono de cadeia a que está ligado.
- Escreva a posição e o nome de cada grupo lateral.
- Escreva os nomes do alcano com a mesma cadeia, substituindo o sufixo "-ane" por "k-ene.
A posição da ligação dupla geralmente é inserida antes do nome da cadeia (por exemplo, "2-penteno"), e não antes do sufixo ("pent-2-eno").
As posições não precisam ser indicadas se forem únicas. Observe que a ligação dupla pode implicar em uma numeração de cadeia diferente daquela usada para o alcano correspondente: (H
3C)
3C–CH
2–CH
3 é "2,2-dimetil pentano", enquanto (H
3C)
3C– CH=CH
2 é "3,3-dimetil 1-penteno".
Regras mais complexas se aplicam a polienos e cicloalcenos.
Isomerismo cis-trans
Se a ligação dupla de um monoeno acíclico não for a primeira ligação da cadeia, o nome construído acima ainda não identifica completamente o composto, devido ao isomerismo cis-trans. Então deve-se especificar se as duas ligações simples C–C adjacentes à ligação dupla estão no mesmo lado de seu plano ou em lados opostos. Para monoalcenos, a configuração geralmente é indicada pelos prefixos cis- (do latim "deste lado de") ou trans- (" transversalmente", "do outro lado de") antes do nome, respectivamente; como em cis-2-penteno ou trans-2-buteno.
Em geral, o isomerismo cis–trans existirá se cada um dos dois carbonos na ligação dupla tiver dois átomos ou grupos diferentes ligados a ele. Levando em consideração esses casos, a IUPAC recomenda a notação E-Z mais geral, em vez dos prefixos cis e trans. Esta notação considera o grupo com maior prioridade CIP em cada um dos dois carbonos. Se esses dois grupos estiverem em lados opostos do plano da ligação dupla, a configuração é rotulada como E (do alemão entgegen que significa "oposto"); se estiverem do mesmo lado, é rotulado como Z (do alemão zusammen, "juntos"). Esta rotulagem pode ser ensinada com o mnemônico "Z significa 'on ze zame zide'".
Grupos contendo ligações duplas C=C
A IUPAC reconhece dois nomes para grupos de hidrocarbonetos contendo ligações duplas carbono-carbono, o grupo vinil e o grupo alilo.
Links de nomenclatura
- Regra A-3. Compostos Insaturados e Radicais Univalentes [1] Livro Azul IUPAC.
- Regra A-4. Radicals Bivalentes e Multivalentes [2] Livro Azul IUPAC.
- Regras A-11.3, A-11.4, A-11.5 Hidrocarbonetos monocíclicos insaturados e substituintes [3] Livro Azul IUPAC.
- Regra A-23. Compostos Hidrogenados de Hidrocarbonetos Policíclicos Fusados [4] Livro Azul IUPAC.
Contenido relacionado
Polimerização
Magnésio
Cristal líquido


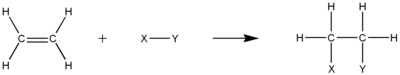










![Generation of singlet oxygen and its [4+2]-cycloaddition with cyclopentadiene](https://upload.wikimedia.org/wikipedia/commons/thumb/1/12/4%2B2_cycloaddition_cyclopentadiene_O2.svg/350px-4%2B2_cycloaddition_cyclopentadiene_O2.svg.png)