Actinídeo
A série actinídeo () ou actinóide () engloba os 15 elementos químicos metálicos com números atômicos de 89 a 103, do actínio ao laurêncio. A série dos actinídeos deriva seu nome do primeiro elemento da série, o actínio. O símbolo químico informal An é usado em discussões gerais sobre a química dos actinídeos para se referir a qualquer actinídeo.
O Livro Vermelho da IUPAC de 1985 recomenda que actinóide seja usado em vez de actinídeo, uma vez que o sufixo -ide normalmente indica um íon negativo. No entanto, devido ao amplo uso atual, o actinídeo ainda é permitido. Uma vez que actinoide significa literalmente semelhante ao actínio (cf. humanoide ou android), tem sido argumentado por razões semânticas esse actínio não pode ser logicamente um actinóide, mas a IUPAC reconhece sua inclusão com base no uso comum.
Todos os actinídeos são elementos do bloco f, exceto o último (laurêncio) que é um elemento do bloco d: com base nisso, a inclusão do laurêncio entre os actinídeos foi algumas vezes questionada, pois também é um metal de transição. A série corresponde principalmente ao preenchimento da camada eletrônica 5f, embora no estado fundamental muitos tenham configurações anômalas envolvendo o preenchimento da camada 6d devido à repulsão intereletrônica. Em comparação com os lantanídeos, também principalmente elementos do bloco f, os actinídeos mostram valência muito mais variável. Todos eles têm raios atômicos e iônicos muito grandes e exibem uma gama extraordinariamente grande de propriedades físicas. Enquanto o actínio e os actinídeos tardios (do amerício em diante) se comportam de maneira semelhante aos lantanídeos, os elementos tório, protactínio e urânio são muito mais semelhantes aos metais de transição em sua química, com o neptúnio e o plutônio ocupando uma posição intermediária.
Todos os actinídeos são radioativos e liberam energia após o decaimento radioativo; O urânio e o tório naturais e o plutônio produzido sinteticamente são os actinídeos mais abundantes na Terra. Estes são usados em reatores nucleares e armas nucleares. O urânio e o tório também têm diversos usos atuais ou históricos, e o amerício é usado nas câmaras de ionização da maioria dos detectores de fumaça modernos.
Dos actinídeos, o tório e o urânio primordiais ocorrem naturalmente em quantidades substanciais. O decaimento radioativo do urânio produz quantidades transitórias de actínio e protactínio, e átomos de neptúnio e plutônio são ocasionalmente produzidos a partir de reações de transmutação em minérios de urânio. Os outros actinídeos são elementos puramente sintéticos. Testes de armas nucleares liberaram pelo menos seis actinídeos mais pesados que o plutônio no meio ambiente; a análise dos detritos da explosão de uma bomba de hidrogênio em 1952 mostrou a presença de amerício, cúrio, berquélio, califórnio, einstênio e férmio.
Nas apresentações da tabela periódica, os elementos do bloco f são geralmente mostrados como duas linhas adicionais abaixo do corpo principal da tabela. Essa convenção é inteiramente uma questão de estética e praticidade de formatação; uma tabela periódica de formato amplo raramente usada insere as séries 4f e 5f em seus devidos lugares, como partes da sexta e sétima linhas (períodos) da tabela.
| Actinium89Ac [227] | DIRECÇÃO | Protactinium91Pa 231.04 | Uranium92U 238.03 | Neptunio93Np [237] | Plutão 94Pu [244] | Ameri-cium95Am [243] | Curium96Cm [247] | Berkel-ium97Bk [247] | Californium98Cf [251] | Einstei-nium99E [252] | Fermium100Fm [257] | Mende-levium101Md [258] | Nobel 102No [259] | Lawrencium103Lr [266] |
Primordial Da decadência SintéticoFronteira mostra a ocorrência natural do elemento
Descoberta, isolamento e síntese
| Elemento | Ano | Método |
|---|---|---|
| Neptuno | 1940 | Bombardagem 238U por neutrões |
| Plutão | 1941 | Bombardagem 238U por deuterons |
| Americium | 1944 | Bombardagem 239Pu por neutrões |
| Curium | 1944 | Bombardagem 239Pu por α-particles |
| Berkelium | 1949 | Bombardagem 241Am por α-particles |
| Califorme | 1950 | Bombardagem 242Cm por α-particles |
| Einsteinium | 1952 | Como produto de explosão nuclear |
| Fermium | 1952 | Como produto de explosão nuclear |
| Mendelevium | 1955 | Bombardagem 253Es por α-particles |
| Nobel | 1965 | Bombardagem 243Am por 15N ou 238U com 22Ne |
| Direito | 1961 –1971 | Bombardagem 252Cf por 10B ou 11B de 243Estou com 18.O |
Assim como os lantanídeos, os actinídeos formam uma família de elementos com propriedades semelhantes. Dentro dos actinídeos, existem dois grupos sobrepostos: elementos transurânicos, que seguem o urânio na tabela periódica; e elementos transplutônio, que seguem o plutônio. Em comparação com os lantanídeos, que (exceto o promécio) são encontrados na natureza em quantidades apreciáveis, a maioria dos actinídeos é rara. A maioria não ocorre na natureza e, dos que ocorrem, apenas o tório e o urânio o fazem em mais do que vestígios. Os actinídeos mais abundantes ou facilmente sintetizados são urânio e tório, seguidos por plutônio, amerício, actínio, protactínio, neptúnio e cúrio.
A existência de elementos transurânicos foi sugerida em 1934 por Enrico Fermi, com base em seus experimentos. No entanto, embora quatro actinídeos fossem conhecidos naquela época, ainda não se sabia que eles formavam uma família semelhante aos lantanídeos. A visão predominante que dominou as primeiras pesquisas sobre os transurânicos era que eles eram elementos regulares no 7º período, com tório, protactínio e urânio correspondendo ao háfnio, tântalo e tungstênio do 6º período, respectivamente. A síntese de transurânicos minou gradualmente esse ponto de vista. Em 1944, uma observação de que o cúrio falhou em exibir estados de oxidação acima de 4 (enquanto seu suposto homólogo do 6º período, a platina, pode atingir o estado de oxidação de 6) levou Glenn Seaborg a formular uma "hipótese dos actinídeos". Estudos de actinídeos conhecidos e descobertas de outros elementos transurânicos forneceram mais dados para apoiar esta posição, mas a frase "hipótese dos actinídeos" (a implicação é que uma "hipótese" é algo que não foi provado de forma decisiva) permaneceu em uso ativo por cientistas até o final dos anos 1950.
Atualmente, existem dois métodos principais de produção de isótopos de elementos transplutônio: (1) irradiação dos elementos mais leves com nêutrons; (2) irradiação com partículas carregadas aceleradas. O primeiro método é mais importante para aplicações, pois apenas a irradiação de nêutrons usando reatores nucleares permite a produção de quantidades consideráveis de actinídeos sintéticos; no entanto, é limitado a elementos relativamente leves. A vantagem do segundo método é que podem ser obtidos elementos mais pesados que o plutônio, bem como isótopos deficientes em nêutrons, que não são formados durante a irradiação de nêutrons.
Em 1962–1966, houve tentativas nos Estados Unidos de produzir isótopos de transplutônio usando uma série de seis explosões nucleares subterrâneas. Pequenas amostras de rocha foram extraídas da área da explosão imediatamente após o teste para estudar os produtos da explosão, mas nenhum isótopo com número de massa maior que 257 pôde ser detectado, apesar das previsões de que tais isótopos teriam meias-vidas relativamente longas de decaimento α. Essa não observação foi atribuída à fissão espontânea devido à grande velocidade dos produtos e a outros canais de decaimento, como emissão de nêutrons e fissão nuclear.
Do actínio ao urânio
O urânio e o tório foram os primeiros actinídeos descobertos. O urânio foi identificado em 1789 pelo químico alemão Martin Heinrich Klaproth no minério de pechblenda. Ele o nomeou em homenagem ao planeta Urano, que havia sido descoberto oito anos antes. Klaproth foi capaz de precipitar um composto amarelo (provavelmente diuranato de sódio) dissolvendo pechblenda em ácido nítrico e neutralizando a solução com hidróxido de sódio. Ele então reduziu o pó amarelo obtido com carvão e extraiu uma substância preta que confundiu com metal. Sessenta anos depois, o cientista francês Eugène-Melchior Péligot o identificou como óxido de urânio. Ele também isolou a primeira amostra de urânio metálico aquecendo o tetracloreto de urânio com potássio metálico. A massa atômica do urânio foi então calculada como 120, mas Dmitri Mendeleev em 1872 a corrigiu para 240 usando suas leis de periodicidade. Este valor foi confirmado experimentalmente em 1882 por K. Zimmerman.
O óxido de tório foi descoberto por Friedrich Wöhler no mineral torianita, encontrado na Noruega (1827). Jöns Jacob Berzelius caracterizou este material com mais detalhes em 1828. Pela redução do tetracloreto de tório com potássio, ele isolou o metal e o nomeou tório em homenagem ao deus nórdico do trovão e do relâmpago Thor. O mesmo método de isolamento foi posteriormente usado por Péligot para o urânio.
O actínio foi descoberto em 1899 por André-Louis Debierne, um assistente de Marie Curie, nos resíduos de pechblenda deixados após a remoção do rádio e do polônio. Ele descreveu a substância (em 1899) como semelhante ao titânio e (em 1900) como semelhante ao tório. A descoberta do actínio por Debierne foi questionada em 1971 e 2000, argumentando que as publicações de Debierne em 1904 contradiziam seu trabalho anterior de 1899-1900. Em vez disso, essa visão credita o trabalho de 1902 de Friedrich Oskar Giesel, que descobriu um elemento radioativo chamado emanium que se comportava de maneira semelhante ao lantânio. O nome actínio vem do grego antigo: ακτίς, ακτίνος (aktis, aktinos), significando viga ou raio. Este metal foi descoberto não por sua própria radiação, mas pela radiação dos produtos derivados. Devido à grande semelhança entre actínio e lantânio e baixa abundância, o actínio puro só pôde ser produzido em 1950. O termo actinídeo foi provavelmente introduzido por Victor Goldschmidt em 1937.
Protactínio foi possivelmente isolado em 1900 por William Crookes. Foi identificado pela primeira vez em 1913, quando Kasimir Fajans e Oswald Helmuth Göhring encontraram o isótopo de vida curta 234mPa (meia-vida de 1,17 minutos) durante seus estudos do 238U decair. Eles chamaram o novo elemento de brevium (do latim brevis que significa breve); o nome foi mudado para protoactinium (do grego πρῶτος + ἀκτίς que significa "primeiro elemento de feixe") em 1918, quando dois grupos de cientistas, liderados pelo austríaco Lise Meitner e Otto Hahn da Alemanha e Frederick Soddy e John Cranston, da Grã-Bretanha, descobriram independentemente o 231Pa de vida muito mais longa. O nome foi abreviado para protactínio em 1949. Esse elemento foi pouco caracterizado até 1960, quando A. G. Maddock e seus colegas de trabalho no Reino Unido isolaram 130 gramas de protactínio de 60 toneladas de resíduos deixados após a extração de urânio de seu minério.
Netúnio e acima
Neptúnio (nomeado para o planeta Netuno, o próximo planeta fora de Urano, após o qual o urânio foi nomeado) foi descoberto por Edwin McMillan e Philip H. Abelson em 1940 em Berkeley, Califórnia. Eles produziram o isótopo 239Np (meia-vida = 2,4 dias) bombardeando o urânio com nêutrons lentos. Foi o primeiro elemento transurânico produzido sinteticamente.
Elementos transurânicos não ocorrem em quantidades consideráveis na natureza e são comumente sintetizados por meio de reações nucleares conduzidas com reatores nucleares. Por exemplo, sob irradiação com nêutrons do reator, o urânio-238 converte-se parcialmente em plutônio-239:
- {}_{92}^{239}U->[beta ^{-}][23.5 {ce {min}}]{}_{93}^{239}Np->[beta ^{-}][2.3 {ce {days}}]{}_{94}^{239}Pu}}left({ce {->[alpha ][2.4cdot 10^{4} {ce {years}}]}}right){ce {^{235}_{92}U}}}" xmlns="http://www.w3.org/1998/Math/MathML">U92238+n01⟶ ⟶ ⟶ ⟶ U92239→Países Baixosminβ β - Sim. - Sim. Np93239→2.3.diasβ β - Sim. - Sim. Puxa.94239(→2.)) 10.4anosα α )U92235Não. {{^{238}_{92}U}+{}_{0}^{1}n->_{92}^{239}U-> [beta ^{-}][23.5 {ce {min}}]{}_{93}^{239}Np->[beta ^{-}][2.3 {ce {days}}]{}_{94}^{239}Pu}}left({ce {->[alpha ][2.4cdot 10^{4} {ce {years}}]}}right){ce {^{235}_{92}U}}}
{}_{92}^{239}U->[beta ^{-}][23.5 {ce {min}}]{}_{93}^{239}Np->[beta ^{-}][2.3 {ce {days}}]{}_{94}^{239}Pu}}left({ce {->[alpha ][2.4cdot 10^{4} {ce {years}}]}}right){ce {^{235}_{92}U}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/e7a95dee843f1cf5e9156013e8ca01c30870d896" style="vertical-align: -2.484ex; margin-top: -0.415ex; margin-bottom: -0.521ex; width:66.818ex; height:6.843ex;"/>
Essa reação de síntese foi usada por Fermi e seus colaboradores no projeto dos reatores localizados em Hanford Site, que produziram quantidades significativas de plutônio-239 para as armas nucleares do Projeto Manhattan e dos Estados Unidos. arsenal nuclear do pós-guerra.
Os actinídeos com os maiores números de massa são sintetizados bombardeando urânio, plutônio, cúrio e califórnio com íons de nitrogênio, oxigênio, carbono, néon ou boro em um acelerador de partículas. Assim, o nobélio foi produzido pelo bombardeio de urânio-238 com neon-22 como
- _{102}^{256}No + 4_0^1n}}}" xmlns="http://www.w3.org/1998/Math/MathML">U92238+Não.10.22⟶ ⟶ ⟶ ⟶ Não.102256.+401nNão. O quê? {_{92}^{238}U + _{10}^{22}Ne -> _{102}^{256}No + 4_0^1n}}}
_{102}^{256}No + 4_0^1n}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/a088d7acb65b797289a44aedbbe486b6d7d79d83" style="vertical-align: -1.005ex; width:29.196ex; height:3.343ex;"/>.
Os primeiros isótopos dos elementos transplutônio, amerício-241 e cúrio-242, foram sintetizados em 1944 por Glenn T. Seaborg, Ralph A. James e Albert Ghiorso. O cúrio-242 foi obtido bombardeando plutônio-239 com partículas α de 32-MeV
- _{96}^{242}Cm + _0^1n}}}" xmlns="http://www.w3.org/1998/Math/MathML">Puxa.94239+Ele.24⟶ ⟶ ⟶ ⟶ Cm96242+n01Não. O quê? {_{94}^{239}Pu + _2^4He -> _{96}^{242}Cm + _0^1n}}}
_{96}^{242}Cm + _0^1n}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/8c838b89bc27612ebf04eda49688958e0cf2d117" style="vertical-align: -1.005ex; width:28.607ex; height:3.343ex;"/>.
Os isótopos amerício-241 e cúrio-242 também foram produzidos pela irradiação de plutônio em um reator nuclear. O último elemento recebeu o nome de Marie Curie e seu marido Pierre, que são conhecidos por descobrir o rádio e por seu trabalho em radioatividade.
O bombardeio de cúrio-242 com partículas α resultou em um isótopo de califórnio 245Cf (1950), e um procedimento semelhante produziu em 1949 o berquélio-243 a partir do amerício-241. Os novos elementos receberam o nome de Berkeley, Califórnia, por analogia com seu homólogo lantanídeo térbio, que recebeu o nome da vila de Ytterby, na Suécia.
Em 1945, B. B. Cunningham obteve o primeiro composto químico a granel de um elemento transplutônio, ou seja, hidróxido de amerício. Ao longo dos anos, quantidades de miligramas de amerício e quantidades de microgramas de cúrio foram acumuladas, o que permitiu a produção de isótopos de berquélio (Thomson, 1949) e califórnio (Thomson, 1950). Quantidades consideráveis desses elementos foram produzidas em 1958 (Burris B. Cunningham e Stanley G. Thomson), e o primeiro composto de califórnio (0,3 µg de CfOCl) foi obtido em 1960 por B. B. Cunningham e J. C. Wallmann.
O einstênio e o férmio foram identificados em 1952–1953 na precipitação radioativa do "Ivy Mike" teste nuclear (1 de novembro de 1952), o primeiro teste bem-sucedido de uma bomba de hidrogênio. A exposição instantânea de urânio-238 a um grande fluxo de nêutrons resultante da explosão produziu isótopos pesados de urânio, incluindo urânio-253 e urânio-255, e seu decaimento β produziu einstênio-253 e férmio-255. A descoberta dos novos elementos e os novos dados sobre a captura de nêutrons foram inicialmente mantidos em segredo por ordem dos militares dos EUA até 1955 devido às tensões da Guerra Fria. No entanto, a equipe de Berkeley conseguiu preparar einstênio e férmio por meios civis, por meio do bombardeio de nêutrons de plutônio-239, e publicou este trabalho em 1954 com a ressalva de que não eram os primeiros estudos realizados sobre esses elementos. O "Ivy Mike" os estudos foram desclassificados e publicados em 1955. As primeiras quantidades significativas (submicrogramas) de einstênio foram produzidas em 1961 por Cunningham e colegas, mas isso ainda não foi feito para o férmio.
O primeiro isótopo do mendelévio, 256Md (meia-vida 87 min), foi sintetizado por Albert Ghiorso, Glenn T. Seaborg, Gregory R. Choppin, Bernard G. Harvey e Stanley G. Thompson quando bombardearam um 253Es alvo com partículas alfa no ciclotron de 60 polegadas do Berkeley Radiation Laboratory; este foi o primeiro isótopo de qualquer elemento a ser sintetizado um átomo de cada vez.
Houve várias tentativas de obtenção de isótopos de nobélio por grupos suecos (1957) e americanos (1958), mas o primeiro resultado confiável foi a síntese de 256No pelo grupo russo (Georgy Flyorov et al.) em 1965, conforme reconhecido pela IUPAC em 1992. Em seus experimentos, Flyorov et al. bombardeou urânio-238 com neon-22.
Em 1961, Ghiorso et al. obteve o primeiro isótopo de laurêncio irradiando califórnio (principalmente califórnio-252) com íons boro-10 e boro-11. O número de massa deste isótopo não foi claramente estabelecido (possivelmente 258 ou 259) na época. Em 1965, 256Lr foi sintetizado por Flyorov et al. a partir de 243Am e 18O. Assim, a IUPAC reconheceu as equipes de física nuclear de Dubna e Berkeley como co-descobridoras do laurêncio.
Isótopos
| Nuclear properties of isotopes of the most important transplutonium isotopes | ||||||
|---|---|---|---|---|---|---|
| Isotope | Half-life | Probability of spontaneousfission in % |
Emission energy (MeV) (yield in %) |
Specific activity (Bq/kg) of | ||
| α | γ | α, β-particles | fission | |||
| 241Am | 432.2(7) y | 4.3(18)×10−10 | 5.485 (84.8) 5.442 (13.1) 5.388 (1.66) |
0.059 (35.9) 0.026 (2.27) |
1.27×1014 | 546.1 |
| 243Am | 7.37(4)×103 y | 3.7(2)×10−9 | 5.275 (87.1) 5.233 (11.2) 5.181 (1.36) |
0.074 (67.2) 0.043 (5.9) |
7.39×1012 | 273.3 |
| 242Cm | 162.8(2) d | 6.2(3)×10−6 | 6.069 (25.92) 6.112 (74.08) |
0.044 (0.04) 0.102 (4×10−3) |
1.23×1017 | 7.6×109 |
| 244Cm | 18.10(2) y | 1.37(3)×10−4 | 5.762 (23.6) 5.804 (76.4) |
0.043 (0.02) 0.100 (1.5×10−3) |
2.96×1015 | 4.1×109 |
| 245Cm | 8.5(1)×103 y | 6.1(9)×10−7 | 5.529 (0.58) 5.488 (0.83) 5.361 (93.2) |
0.175 (9.88) 0.133 (2.83) |
6.35×1012 | 3.9×104 |
| 246Cm | 4.76(4)×103 y | 0.02615(7) | 5.343 (17.8) 5.386 (82.2) |
0.045 (19) | 1.13×1013 | 2.95×109 |
| 247Cm | 1.56(5)×107 y | — | 5.267 (13.8) 5.212 (5.7) 5.147 (1.2) |
0.402 (72) 0.278 (3.4) |
3.43×109 | — |
| 248Cm | 3.48(6)×105 y | 8.39(16) | 5.034 (16.52) 5.078 (75) |
— | 1.40×1011 | 1.29×1010 |
| 249Bk | 330(4) d | 4.7(2)×10−8 | 5.406 (1×10−3) 5.378 (2.6×10−4) |
0.32 (5.8×10−5) | 5.88×1016 | 2.76×107 |
| 249Cf | 351(2) y | 5.0(4)×10−7 | 6.193 (2.46) 6.139 (1.33) 5.946 (3.33) |
0.388 (66) 0.333 (14.6) |
1.51×1014 | 7.57×105 |
| 250Cf | 13.08(9) y | 0.077(3) | 5.988 (14.99) 6.030 (84.6) |
0.043 | 4.04×1015 | 3.11×1012 |
| 251Cf | 900(40) y | ? | 6.078 (2.6) 5.567 (0.9) 5.569 (0.9) |
0.177 (17.3) 0.227 (6.8) |
5.86×1013 | — |
| 252Cf | 2.645(8) y | 3.092(8) | 6.075 (15.2) 6.118 (81.6) |
0.042 (1.4×10−2) 0.100 (1.3×10−2) |
1.92×1016 | 6.14×1014 |
| 254Cf | 60.5(2) d | ≈100 | 5.834 (0.26) 5.792 (5.3×10−2) |
— | 9.75×1014 | 3.13×1017 |
| 253Es | 20.47(3) d | 8.7(3)×10−6 | 6.540 (0.85) 6.552 (0.71) 6.590 (6.6) |
0.387 (0.05) 0.429 (8×10−3) |
9.33×1017 | 8.12×1010 |
| 254Es | 275.7(5) d | < 3×10−6 | 6.347 (0.75) 6.358 (2.6) 6.415 (1.8) |
0.042 (100) 0.034 (30) |
6.9×1016 | — |
| 255Es | 39.8(12) d | 0.0041(2) | 6.267 (0.78) 6.401 (7) |
— | 4.38×1017(β) 3.81×1016(α) |
1.95×1013 |
| 255Fm | 20.07(7) h | 2.4(10)×10−5 | 7.022 (93.4) 6.963 (5.04) 6.892 (0.62) |
0.00057 (19.1) 0.081 (1) |
2.27×1019 | 5.44×1012 |
| 256Fm | 157.6(13) min | 91.9(3) | 6.872 (1.2) 6.917 (6.9) |
— | 1.58×1020 | 1.4×1019 |
| 257Fm | 100.5(2) d | 0.210(4) | 6.752 (0.58) 6.695 (3.39) 6.622 (0.6) |
0.241 (11) 0.179 (8.7) |
1.87×1017 | 3.93×1014 |
| 256Md | 77(2) min | — | 7.142 (1.84) 7.206 (5.9) |
— | 3.53×1020 | — |
| 257Md | 5.52(5) h | — | 7.074 (14) | 0.371 (11.7) 0.325 (2.5) |
8.17×1019 | — |
| 258Md | 51.5(3) d | — | 6.73 | — | 3.64×1017 | — |
| 255No | 3.1(2) min | — | 8.312 (1.16) 8.266 (2.6) 8.121 (27.8) |
0.187 (3.4) | 8.78×1021 | — |
| 259No | 58(5) min | — | 7.455 (9.8) 7.500 (29.3) 7.533 (17.3) |
— | 4.63×1020 | — |
| 256Lr | 27(3) s | < 0.03 | 8.319 (5.4) 8.390 (16) 8.430 (33) |
— | 5.96×1022 | — |
| 257Lr | 646(25) ms | — | 8.796 (18) 8.861 (82) |
— | 1.54×1024 | — |
32 isótopos de actínio e oito estados isoméricos excitados de alguns de seus nuclídeos foram identificados até 2016. Três isótopos, 225Ac, 227Ac e 228Ac, foram encontrados na natureza e os demais foram produzidos em laboratório; apenas os três isótopos naturais são usados em aplicações. O actínio-225 é um membro da série radioativa do neptúnio; foi descoberto pela primeira vez em 1947 como um produto de decaimento do urânio-233, é um emissor α com uma meia-vida de 10 dias. O actínio-225 está menos disponível que o actínio-228, mas é mais promissor em aplicações de radiofármacos. Actinium-227 (meia-vida 21,77 anos) ocorre em todos os minérios de urânio, mas em pequenas quantidades. Um grama de urânio (em equilíbrio radioativo) contém apenas 2×10-10 grama de 227Ac. O actínio-228 é um membro da série do tório radioativo formado pelo decaimento do 228Ra; é um emissor β− com meia-vida de 6,15 horas. Em uma tonelada de tório há 5×10-8 grama de 228Ac. Foi descoberto por Otto Hahn em 1906.
Existem 31 isótopos conhecidos de tório variando em número de massa de 208 a 238. Destes, o mais duradouro é 232Th, cuja meia-vida de 1,4×1010 anos significa que ainda existe na natureza como um nuclídeo primordial. O próximo de vida mais longa é 230Th, um produto de decaimento intermediário de 238U com uma meia-vida de 75.400 anos. Vários outros isótopos de tório têm meias-vidas ao longo de um dia; todos eles também são transitórios nas cadeias de decaimento de 232Th, 235U e 238U.
28 isótopos de protactínio são conhecidos com números de massa 212-239, bem como três estados isoméricos excitados. Apenas 231Pa e 234Pa foram encontrados na natureza. Todos os isótopos têm vida útil curta, exceto o protactínio-231 (meia-vida de 32.760 anos). Os isótopos mais importantes são 231Pa e 233Pa, que é um produto intermediário na obtenção de urânio-233 e é o mais acessível entre os isótopos artificiais de protactínio. 233Pa tem meia-vida conveniente e energia de radiação γ e, portanto, foi usado na maioria dos estudos da química do protactínio. O protactínio-233 é um emissor β com meia-vida de 26,97 dias.
Existem 26 isótopos conhecidos de urânio, com números de massa 215–242 (exceto 220 e 241). Três deles, 234U, 235U e 238U, estão presentes em quantidades apreciáveis na natureza. Entre outros, o mais importante é o 233U, que é um produto final da transformação do 232Th irradiado por nêutrons lentos. 233U tem uma eficiência de fissão muito maior por nêutrons de baixa energia (térmicos), em comparação, por exemplo, com 235U. A maioria dos estudos de química de urânio foi realizada em urânio-238 devido à sua longa meia-vida de 4,4×10 9 anos.
Existem 24 isótopos de neptúnio com números de massa de 219, 220 e 223–244; todos eles são altamente radioativos. Os mais populares entre os cientistas são os de longa duração 237Np (t1/2 = 2,20× 106 anos) e vida curta 239Np, 238Np (t1/2 ~ 2 dias).
Dezoito isótopos de amerício são conhecidos com números de massa de 229 a 247 (com exceção de 231). Os mais importantes são 241Am e 243Am, que são emissores alfa e também emitem raios γ suaves, mas intensos; ambos podem ser obtidos em uma forma isotopicamente pura. As propriedades químicas do amerício foram inicialmente estudadas com 241Am, mas depois mudaram para 243Am, que é quase 20 vezes menos radioativo. A desvantagem de 243Am é a produção do isótopo filho de vida curta 239Np, que deve ser considerado na análise de dados.
Entre 19 isótopos de cúrio, variando em número de massa de 233 a 251, os mais acessíveis são 242Cm e 244Cm; eles são emissores α, mas com tempo de vida muito mais curto do que os isótopos de amerício. Esses isótopos quase não emitem radiação γ, mas sofrem fissão espontânea com a emissão associada de nêutrons. Mais isótopos de vida longa de cúrio (245–248Cm, todos emissores α) são formados como uma mistura durante a irradiação de nêutrons de plutônio ou amerício. Após irradiação curta, esta mistura é dominada por 246Cm, e então 248Cm começa a se acumular. Ambos os isótopos, especialmente 248Cm, têm uma meia-vida mais longa (3,48×105 anos) e são muito mais convenientes para realizar pesquisas químicas do que 242Cm e 244Cm, mas também têm uma taxa bastante alta de fissão espontânea. 247Cm tem o maior tempo de vida entre os isótopos de cúrio (1,56×107 anos), mas não é formado em grandes quantidades por causa da forte fissão induzida por nêutrons térmicos.
Dezessete isótopos de berquélio foram identificados com números de massa 233–234, 236, 238 e 240–252. Apenas 249Bk está disponível em grandes quantidades; tem uma meia-vida relativamente curta de 330 dias e emite principalmente partículas β moles, que são inconvenientes para detecção. Sua radiação alfa é bastante fraca (1,45×10−3% em relação à radiação β), mas às vezes é usado para detectar esse isótopo. 247Bk é um emissor alfa com uma longa meia-vida de 1.380 anos, mas é difícil de obter em quantidades apreciáveis; não é formado por irradiação de nêutrons de plutônio por causa da estabilidade β de isótopos de isótopos de cúrio com número de massa abaixo de 248.
Os 20 isótopos do califórnio com números de massa 237–256 são formados em reatores nucleares; californium-253 é um emissor β e o resto são emissores α. Os isótopos com número de massa par (250Cf, 252Cf e 254Cf) têm alta taxa de fissão espontânea, especialmente 254 Cf dos quais 99,7% decai por fissão espontânea. O califórnio-249 tem meia-vida relativamente longa (352 anos), fissão espontânea fraca e forte emissão γ que facilita sua identificação. 249Cf não é formado em grandes quantidades em um reator nuclear devido ao lento decaimento β do isótopo pai 249Bk e uma grande seção transversal de interação com nêutrons, mas ele pode ser acumulado na forma isotopicamente pura como o produto de decaimento β de (pré-selecionado) 249Bk. O califórnio produzido por radiação de reator de plutônio consiste principalmente de 250Cf e 252Cf, sendo este último predominante para grandes fluências de nêutrons, e seu estudo é dificultado pela forte radiação de nêutrons.
| Pai isótopo | )1/2-2001 | Filha isótopo | )1/2-2001 | Hora de estabelecer equilíbrio radioativo |
|---|---|---|---|---|
| 243Am | 7370 anos | 239Np | 2.35 dias | 47.3 dias |
| 245Cm | 8265 anos | 241Puxa. | 14 anos | 129 anos |
| 247Cm | 1.6.4×10.7 anos | 243Puxa. | 4.95 horas | 7.2 dias |
| 254E | 270 dias | 250Bk. | 3.2 horas | 35,2 horas |
| 255E | 39,8 dias | 255F m | 22 horas | 5 dias |
| 257F m | 79 dias | 253Cf | 17.6 dias | 49 dias |
Entre os 18 isótopos conhecidos de einstênio com números de massa de 240 a 257, o mais acessível é 253Es. É um emissor α com uma meia-vida de 20,47 dias, uma emissão γ relativamente fraca e uma pequena taxa de fissão espontânea em comparação com os isótopos do califórnio. A irradiação prolongada de nêutrons também produz um isótopo de vida longa 254Es (t1/2 = 275,5 dias).
Vinte isótopos de férmio são conhecidos com números de massa de 241–260. 254Fm, 255Fm e 256Fm são emissores α com meia-vida curta (horas), que podem ser isolados em quantidades significativas. 257Fm (t1/2 = 100 dias) pode se acumular após irradiação forte e prolongada. Todos esses isótopos são caracterizados por altas taxas de fissão espontânea.
Entre os 17 isótopos conhecidos do mendelévio (números de massa de 244 a 260), o mais estudado é o 256Md, que decai principalmente pela captura de elétrons (a radiação α é ≈10%) com a meia-vida de 77 minutos. Outro emissor alfa, 258Md, tem uma meia-vida de 53 dias. Ambos os isótopos são produzidos a partir do raro einstênio (253Es e 255Es, respectivamente), o que limita sua disponibilidade.
Isótopos de vida longa de nobélio e isótopos de laurêncio (e de elementos mais pesados) têm meias-vidas relativamente curtas. Para o nobélio, 11 isótopos são conhecidos com números de massa 250–260 e 262. As propriedades químicas do nobélio e do laurêncio foram estudadas com 255No (t1/2 = 3 min) e 256Lr (t1/2 = 35 s). O isótopo de nobélio de vida mais longa, 259No, tem uma meia-vida de aproximadamente 1 hora. O laurêncio tem 13 isótopos conhecidos com números de massa 251–262 e 266. O mais estável de todos é 266Lr com uma meia-vida de 11 horas.
Entre todos estes, os únicos isótopos que ocorrem em quantidades suficientes na natureza para serem detectados em algo mais do que vestígios e têm uma contribuição mensurável para os pesos atômicos dos actinídeos são os primordiais 232Th, 235U e 238U, e três produtos de decaimento de vida longa de urânio natural, 230Th, 231Pa e 234U. O tório natural consiste em 0,02(2)% 230Th e 99,98(2)% 232Th; protactínio natural consiste em 100% 231Pa; e o urânio natural consiste em 0,0054(5)% 234U, 0,7204(6)% 235U e 99,2742(10)% 238U.
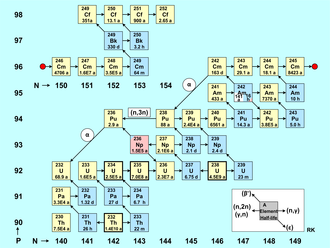
Formação em reatores nucleares
A figura acumulação de actinídeos é uma tabela de nuclídeos com o número de nêutrons no eixo horizontal (isótopos) e o número de prótons no eixo vertical (elementos). O ponto vermelho divide os nuclídeos em dois grupos, então a figura é mais compacta. Cada nuclídeo é representado por um quadrado com o número de massa do elemento e sua meia-vida. Os isótopos de actinídeos existentes naturalmente (Th, U) são marcados com uma borda em negrito, os emissores alfa têm uma cor amarela e os emissores beta têm uma cor azul. Rosa indica captura de elétrons (236Np), enquanto branco representa um estado metaestável de longa duração (242Am).
A formação de nuclídeos de actinídeos é caracterizada principalmente por:
- Neutron captura reações (n,γ), que são representadas na figura por uma flecha direita curta.
- As reações (n,2n) e as reações menos frequentes (γ,n) também são levadas em conta, ambas marcadas por uma flecha esquerda curta.
- Ainda mais raramente e apenas desencadeada por neutrões rápidos, a reação (n,3n) ocorre, que é representada na figura com um exemplo, marcado por uma seta esquerda longa.
Além dessas reações nucleares induzidas por nêutrons ou gama, a conversão radioativa de nuclídeos de actinídeos também afeta o estoque de nuclídeos em um reator. Esses tipos de decaimento são marcados na figura por setas diagonais. O decaimento beta-menos, marcado com uma seta apontando para cima e para a esquerda, desempenha um papel importante no equilíbrio das densidades de partículas dos nuclídeos. Nuclídeos que decaem por emissão de pósitrons (decaimento beta-mais) ou captura de elétrons (ϵ) não ocorrem em um reator nuclear, exceto como produtos de reações nocaute; suas decadências são marcadas com setas apontando para baixo e para a direita. Devido às longas meias-vidas dos nuclídeos fornecidos, o decaimento alfa quase não desempenha nenhum papel na formação e decaimento dos actinídeos em um reator de potência, pois o tempo de residência do combustível nuclear no núcleo do reator é bastante curto (alguns anos). As exceções são os dois nuclídeos de vida relativamente curta 242Cm (T1/2 = 163 d) e 236Pu (T1 /2 = 2,9 anos). Somente para esses dois casos, o decaimento α é marcado no mapa de nuclídeos por uma longa seta apontando para baixo e para a esquerda. Alguns isótopos de actinídeos de vida longa, como 244Pu e 250Cm, não podem ser produzidos em reatores porque a captura de nêutrons não ocorre com rapidez suficiente para contornar o beta de vida curta -nuclídeos em decomposição 243Pu e 249Cm; eles podem, no entanto, ser gerados em explosões nucleares, que têm fluxos de nêutrons muito mais altos.
Distribuição na natureza
Tório e urânio são os actinídeos mais abundantes na natureza com as respectivas concentrações de massa de 16 ppm e 4 ppm. O urânio ocorre principalmente na crosta terrestre como uma mistura de seus óxidos no mineral uraninita, também chamado de pechblenda por causa de sua cor preta. Existem várias dezenas de outros minerais de urânio, como carnotita (KUO2VO4·3H2O) e autunita (Ca(UO2)2(PO4)2·nH2O). A composição isotópica do urânio natural é 238U (abundância relativa 99,2742%), 235U (0,7204%) e 234U (0,0054%); destes 238U tem a maior meia-vida de 4,51×109 anos. A produção mundial de urânio em 2009 foi de 50.572 toneladas, das quais 27,3% foram extraídas no Cazaquistão. Outros importantes países mineradores de urânio são Canadá (20,1%), Austrália (15,7%), Namíbia (9,1%), Rússia (7,0%) e Níger (6,4%).
| Ore | Localização | Uranium conteúdo, % | Relação em massa 239Pu/ore | Rácio 239Pu/U (×10.12) |
|---|---|---|---|---|
| Uraninite | Canadá | 13.5 | 9.1×10.-12. | 7.1 |
| Uraninite | Congo | 38 | 4.8×10.-12. | 12 |
| Uraninite | Colorado, EUA | 50 | 3.8×10.-12. | 7.7 |
| Mosteiro | Brasil | 0,24 | 2.×10.-14 | 8.3 |
| Mosteiro | Carolina do Norte, EUA | 1.6.4 | 5.9×10.-14 | 3.6 |
| Fergusonite | - Não. | 0,25 | <×10.-14 | <4 |
| Carnotite | - Não. | 10. | <4×10.-14 | <0,4 |
Os minerais de tório mais abundantes são torianita (ThO2), torita (ThSiO4) e monazita, ((Th,Ca,Ce)PO4). A maioria dos minerais de tório contém urânio e vice-versa; e todos eles têm fração significativa de lantanídeos. Ricos depósitos de minerais de tório estão localizados nos Estados Unidos (440.000 toneladas), Austrália e Índia (~300.000 toneladas cada) e Canadá (~100.000 toneladas).
A abundância de actínio na crosta terrestre é de apenas cerca de 5×10-15%. O actínio está presente principalmente em urânio, mas também em outros minerais, embora em quantidades muito menores. O conteúdo de actínio na maioria dos objetos naturais corresponde ao equilíbrio isotópico do isótopo pai 235U, e não é afetado pela fraca migração de Ac. O protactínio é mais abundante (10-12%) na crosta terrestre do que o actínio. Foi descoberto no minério de urânio em 1913 por Fajans e Göhring. Assim como o actínio, a distribuição do protactínio segue a do 235U.
A meia-vida do isótopo de vida mais longa do neptúnio, 237Np, é insignificante em comparação com a idade da Terra. Assim, o neptúnio está presente na natureza em quantidades insignificantes produzidas como produtos intermediários de decaimento de outros isótopos. Traços de plutônio em minerais de urânio foram encontrados pela primeira vez em 1942, e os resultados mais sistemáticos em 239Pu estão resumidos na tabela (nenhum outro isótopo de plutônio pôde ser detectado nessas amostras). O limite superior de abundância do isótopo de vida mais longa do plutônio, 244Pu, é 3×10-20%. O plutônio não pôde ser detectado em amostras de solo lunar. Devido à sua escassez na natureza, a maior parte do plutônio é produzida sinteticamente.
Extração
Devido à baixa abundância de actinídeos, sua extração é um processo complexo de várias etapas. Fluoretos de actinídeos são geralmente usados porque são insolúveis em água e podem ser facilmente separados com reações redox. Os fluoretos são reduzidos com cálcio, magnésio ou bário:
- [{ce {1150-1350^{circ }C}}]3BaF2{}+2Am}}\{ce {PuF4{}+2Ba->[{ce {1200^{circ }C}}]2BaF2{}+Pu}}\{ce {UF4{}+2Mg->[{ce {>500^{circ }C}}]U{}+2MgF2}}\{}end{array}}}" xmlns="http://www.w3.org/1998/Math/MathML">2AmF3+3Bando→1150- Sim. - Sim. 1350∘ ∘ C3Baf2+2AmPuf4+2Bando→1200∘ ∘ C2Baf2+Puxa.FOI4+2Mg→>500.∘ ∘ CU+2MgF2{displaystyle {begin{array}{l}{}\{ce {2AmF3{}+3Ba->[{ce {1150-1350^{circ }C}}]3BaF2{}+2Am}}\{ce {PuF4{}+2Ba->[{ce {1200^{circ }C}}]2BaF2{}+Pu}}{ce {UF4{}+2Mg->[{ce {>500^{circ }C}}]U{}+2MgF2}}{}end{array}}}}}}
[{ce {1150-1350^{circ }C}}]3BaF2{}+2Am}}\{ce {PuF4{}+2Ba->[{ce {1200^{circ }C}}]2BaF2{}+Pu}}\{ce {UF4{}+2Mg->[{ce {>500^{circ }C}}]U{}+2MgF2}}\{}end{array}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/057c8209f7427fca3331e574fa79f36c0e2a81db" style="vertical-align: -9.505ex; width:44.009ex; height:20.176ex;"/>
Entre os actinídeos, o tório e o urânio são os mais fáceis de isolar. O tório é extraído principalmente da monazita: o pirofosfato de tório (ThP2O7) é reagido com ácido nítrico e o nitrato de tório produzido é tratado com fosfato de tributil. As impurezas de terras raras são separadas pelo aumento do pH na solução de sulfato.
Em outro método de extração, a monazita é decomposta com uma solução aquosa de hidróxido de sódio a 45% a 140°C. Hidróxidos metálicos mistos são extraídos primeiro, filtrados a 80°C, lavados com água e dissolvidos com ácido clorídrico concentrado. Em seguida, a solução ácida é neutralizada com hidróxidos para pH = 5,8 que resulta na precipitação de hidróxido de tório (Th(OH)4) contaminado com ~3% de hidróxidos de terras raras; o restante dos hidróxidos de terras raras permanece em solução. O hidróxido de tório é dissolvido em um ácido inorgânico e depois purificado dos elementos de terras raras. Um método eficiente é a dissolução do hidróxido de tório em ácido nítrico, pois a solução resultante pode ser purificada por extração com solventes orgânicos:
- Th(OH)4 + 4 HNO3 → Th (NO3)4 + 4 H2O
O tório metálico é separado do óxido anidro, cloreto ou flúor por sua reação com o cálcio em uma atmosfera inerte:
- O quê?2 + 2 Ca → 2 CaO + O quê?
Às vezes, o tório é extraído por eletrólise de um flúor em uma mistura de cloreto de sódio e potássio a 700–800 °C em um cadinho de grafite. O tório altamente puro pode ser extraído de seu iodeto com o processo de barra de cristal.
O urânio é extraído de seus minérios de várias maneiras. Em um método, o minério é queimado e então reagido com ácido nítrico para converter o urânio em um estado dissolvido. Tratar a solução com uma solução de tributil fosfato (TBP) em querosene transforma o urânio em uma forma orgânica UO2(NO3)2(TBP)2. As impurezas insolúveis são filtradas e o urânio é extraído por reação com hidróxidos como (NH4)2U2O7 ou com peróxido de hidrogênio como UO4·2H2O.
Quando o minério de urânio é rico em minerais como dolomita, magnesita, etc., esses minerais consomem muito ácido. Neste caso, o método do carbonato é usado para extração de urânio. Seu principal componente é uma solução aquosa de carbonato de sódio, que converte o urânio em um complexo [UO2(CO3)3] 4−, que é estável em soluções aquosas em baixas concentrações de íons hidróxido. As vantagens do método do carbonato de sódio são que os produtos químicos têm baixa corrosividade (em comparação com os nitratos) e que a maioria dos metais não urânio precipita da solução. A desvantagem é que os compostos de urânio tetravalente também precipitam. Portanto, o minério de urânio é tratado com carbonato de sódio em temperatura elevada e sob pressão de oxigênio:
- 2 UO2 + O2 + 6 CO2-
3 → 2 [UO]2(CO)3)3]4...
Esta equação sugere que o melhor solvente para o processamento do carbonato de urânio é uma mistura de carbonato com bicarbonato. Em pH alto, isso resulta na precipitação de diuranato, que é tratado com hidrogênio na presença de níquel produzindo um tetracarbonato de urânio insolúvel.
Outro método de separação usa resinas poliméricas como polieletrólito. Os processos de troca iônica nas resinas resultam na separação do urânio. O urânio das resinas é lavado com uma solução de nitrato de amônio ou ácido nítrico que produz nitrato de uranila, UO2(NO3)2·6H2O. Quando aquecido, ele se transforma em UO3, que é convertido em UO2 com hidrogênio:
- UO3 + H2 → UO2 + H2O
A reação do dióxido de urânio com o ácido fluorídrico o transforma em tetrafluoreto de urânio, que produz urânio metálico após a reação com o magnésio metálico:
- 4 HF + UO2 UF →4 + 2 H2O
Para extrair o plutônio, o urânio irradiado com nêutrons é dissolvido em ácido nítrico e um agente redutor (FeSO4 ou H2O2) é adicionado à solução resultante. Esta adição altera o estado de oxidação do plutônio de +6 para +4, enquanto o urânio permanece na forma de nitrato de uranila (UO2(NO3)2). A solução é tratada com um agente redutor e neutralizada com carbonato de amônio para pH = 8 que resulta na precipitação de compostos Pu4+.
Em outro método, Pu4+ e UO2 +
2 são extraídos primeiro com fosfato de tributil, em seguida, reagiu com hidrazina lavando o plutônio recuperado.
A maior dificuldade na separação do actínio é a semelhança de suas propriedades com as do lantânio. Assim, o actínio é sintetizado em reações nucleares a partir de isótopos de rádio ou separado usando procedimentos de troca iônica.
Propriedades
Os actinídeos têm propriedades semelhantes aos lantanídeos. As camadas eletrônicas 6d e 7s são preenchidas com actínio e tório, e a camada 5f está sendo preenchida com aumento adicional no número atômico; a camada 4f é preenchida nos lantanídeos. A primeira evidência experimental para o preenchimento da camada 5f em actinídeos foi obtida por McMillan e Abelson em 1940. Como nos lantanídeos (veja contração dos lantanídeos), o raio iônico dos actinídeos diminui monotonicamente com o número atômico (ver também princípio de Aufbau).
| Element | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Core charge (Z) | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 |
| atomic mass | [227] | 232.0377(4) | 231.03588(2) | 238.02891(3) | [237] | [244] | [243] | [247] | [247] | [251] | [252] | [257] | [258] | [259] | [266] |
| Number of natural isotopes | 3 | 7 | 3 | 8 | 3 | 4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Natural isotopes | 225, 227–228 | 227–232, 234 | 231, 233–234 | 233–240 | 237, 239–240 | 238–240, 244 | — | — | — | — | — | — | — | — | — |
| Natural quantity isotopes | — | 230, 232 | 231 | 234, 235, 238 | — | — | — | — | — | — | — | — | — | — | — |
| Longest-lived isotope | 227 | 232 | 231 | 238 | 237 | 244 | 243 | 247 | 247 | 251 | 252 | 257 | 258 | 259 | 266 |
| Half-life of the longest-lived isotope | 21.8 years | 14 billion years | 32,500 years | 4.47 billion years | 2.14 million years | 80.8 million years | 7,370 years | 15.6 million years | 1,380 years | 900 years | 1.29 years | 100.5 days | 52 days | 58 min | 11 hours |
| Most common isotope | 227 | 232 | 231 | 238 | 237 | 239 | 241 | 244 | 249 | 252 | 253 | 255 | 256 | 255 | 260 |
| Half-life of the most common isotope | 21.8 years | 14 billion years | 32,500 years | 4.47 billion years | 2.14 million years | 24,100 years | 433 years | 18.1 years | 320 days | 2.64 years | 20.47 days | 20.07 hours | 78 min | 3.1 min | 2.7 min |
| Electronic configuration in the ground state (gas phase) |
6d17s2 | 6d27s2 | 5f26d17s2 | 5f36d17s2 | 5f46d17s2 | 5f67s2 | 5f77s2 | 5f76d17s2 | 5f97s2 | 5f107s2 | 5f117s2 | 5f127s2 | 5f137s2 | 5f147s2 | 5f147s27p1 |
| Oxidation states | 2, 3 | 2, 3, 4 | 2, 3, 4, 5 | 2, 3, 4, 5, 6 | 3, 4, 5, 6, 7 | 3, 4, 5, 6, 7 | 2, 3, 4, 5, 6, 7 | 2, 3, 4, 6 | 2, 3, 4 | 2, 3, 4 | 2, 3, 4 | 2, 3 | 2, 3 | 2, 3 | 3 |
| Metallic radius (nm) | 0.203 | 0.180 | 0.162 | 0.153 | 0.150 | 0.162 | 0.173 | 0.174 | 0.170 | 0.186 | 0.186 | ? 0.198 | ? 0.194 | ? 0.197 | ? 0.171 |
| Ionic radius (nm): An4+ An3+ |
— 0.126 |
0.114 — |
0.104 0.118 |
0.103 0.118 |
0.101 0.116 |
0.100 0.115 |
0.099 0.114 |
0.099 0.112 |
0.097 0.110 |
0.096 0.109 |
0.085 0.098 |
0.084 0.091 |
0.084 0.090 |
0.084 0.095 |
0.083 0.088 |
| Temperature (°C): melting boiling |
1050 3198 |
1842 4788 |
1568 ? 4027 |
1132.2 4131 |
639 ? 4174 |
639.4 3228 |
1176 ? 2607 |
1340 3110 |
986 2627 |
900 ? 1470 |
860 ? 996 |
1530 — |
830 — |
830 — |
1630 — |
| Density, g/cm3 | 10.07 | 11.78 | 15.37 | 19.06 | 20.45 | 19.84 | 11.7 | 13.51 | 14.78 | 15.1 | 8.84 | ? 9.7 | ? 10.3 | ? 9.9 | ? 14.4 |
| Standard electrode potential (V): E° (An4+/An0) E° (An3+/An0) |
— −2.13 |
−1.83 — |
−1.47 — |
−1.38 −1.66 |
−1.30 −1.79 |
−1.25 −2.00 |
−0.90 −2.07 |
−0.75 −2.06 |
−0.55 −1.96 |
−0.59 −1.97 |
−0.36 −1.98 |
−0.29 −1.96 |
— −1.74 |
— −1.20 |
— −2.10 |
| Color: [M(H2O)n]4+ [M(H2O)n]3+ |
— Colorless |
Colorless Blue |
Yellow Dark blue |
Green Purple |
Yellow-green Purple |
Brown Violet |
Red Rose |
Yellow Colorless |
Beige Yellow-green |
Green Green |
— Pink |
— — |
— — |
— — |
— — |
| Cores aproximadas de íons actinídeos em solução aquosa Cores para os actinídeos 100-103 são desconhecidas como quantidades suficientes ainda não foram sintetizadas. A cor da CmO2+2 também não foi registrado. | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Actinide (em inglês)Z.) | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100. | 101 | 102 | 103 |
| Estado de oxidação | |||||||||||||||
| + | F m2+ | Md.2+ | Não.2+ | ||||||||||||
| +3 | Acções3+ | O quê?3+ | Pai.3+ | U3+ | Np3+ | Puxa.3+ | Am3+ | Cm3+ | Bk.3+ | Cf3+ | E3+ | F m3+ | Md.3+ | Não.3+ | Lr.3+ |
| + | O quê?4+ | Pai.4+ | U4+ | Np4+ | Puxa.4+ | Am4+ | Cm4+ | Bk.4+ | Cf4+ | ||||||
| +5 | Pao+ 2 | UO+ 2 | NpO+ 2 | Pue!+ 2 | AmO+ 2 | ||||||||||
| +6 | UO2+ 2 | NpO2+ 2 | Pue!2+ 2 | AmO2+ 2 | CmO2+ 2 | ||||||||||
| +7 | NpO3+ 2 | Pue!3+ 2 | AmO3... 5 | ||||||||||||
Propriedades físicas
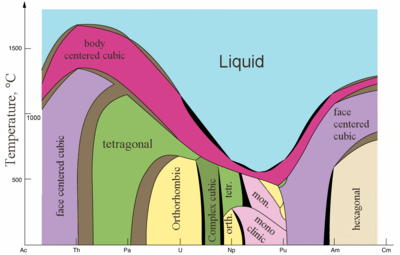 | 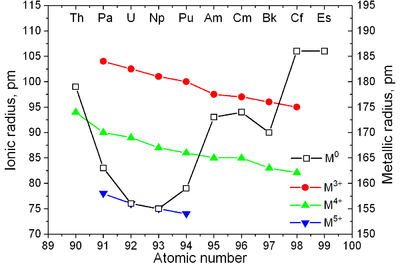 |
| Principais estruturas de cristal de alguns actinides vs. temperatura | Radii metálico e iônico de actinides |

Os actinídeos são metais típicos. Todos eles são macios e têm uma cor prateada (mas mancham no ar), densidade e plasticidade relativamente altas. Alguns deles podem ser cortados com uma faca. Sua resistividade elétrica varia entre 15 e 150 µΩ·cm. A dureza do tório é semelhante à do aço macio, de modo que o tório puro aquecido pode ser enrolado em folhas e transformado em arame. O tório tem quase a metade da densidade do urânio e do plutônio, mas é mais duro do que qualquer um deles. Todos os actinídeos são radioativos, paramagnéticos e, com exceção do actínio, possuem várias fases cristalinas: o plutônio tem sete e o urânio, neptúnio e califórnio três. As estruturas cristalinas do protactínio, urânio, neptúnio e plutônio não possuem análogos claros entre os lantanídeos e são mais semelhantes às dos metais de transição 3d.
Todos os actinídeos são pirofóricos, especialmente quando finamente divididos, ou seja, inflamam-se espontaneamente ao reagir com o ar à temperatura ambiente. O ponto de fusão dos actinídeos não tem uma dependência clara do número de elétrons f. O ponto de fusão incomumente baixo de neptúnio e plutônio (~640 °C) é explicado pela hibridização dos orbitais 5f e 6d e pela formação de ligações direcionais nesses metais.
| Lanthanides | Ln3+Å | Actos | Um3+Å | Um4+Å |
|---|---|---|---|---|
| Lanthanum | 1.061 | Acto | 1.11 | – |
| Cerium | 1.034 | Thorium | 1.08 | 0,99 |
| Praseodymium | 1.013 | Protactinium | 1.05 | 0,93 |
| Neodímio | 0,995 | Uranium | 1.03 | 0,93 |
| Promethium | 0,979 | Neptuno | 1.01 | 0,92 |
| Samarium | 0,964 | Plutão | 1.00 | 0,90 |
| Europium | 0.950 | Americium | 0,99 | 0,809 |
| Gadolinium | 0,938 | Curium | 0,98 | 0,8 |
| Terbium | 0.923 | Berkelium | – | – |
| Dysproium | 0.908 | Califorme | – | – |
| Holmium | 0,94 | Einsteinium | – | – |
| Erbium | 0,81 | Fermium | – | – |
| Thulium | 0,86 | Mendelevium | – | – |
| Ytterbium | 0,58 | Nobel | – | – |
| Lutetium | 0,48 | Direito | – | – |
Propriedades químicas
Como os lantanídeos, todos os actinídeos são altamente reativos com halogênios e calcogênios; no entanto, os actinídeos reagem mais facilmente. Os actinídeos, especialmente aqueles com um pequeno número de elétrons 5f, são propensos à hibridação. Isso é explicado pela similaridade das energias dos elétrons nas camadas 5f, 7s e 6d. A maioria dos actinídeos exibe uma variedade maior de estados de valência, e os mais estáveis são +6 para urânio, +5 para protactínio e neptúnio, +4 para tório e plutônio e +3 para actínio e outros actinídeos.
O actínio é quimicamente semelhante ao lantânio, o que é explicado por seus raios iônicos e estruturas eletrônicas semelhantes. Como o lantânio, o actínio quase sempre tem um estado de oxidação de +3 em compostos, mas é menos reativo e tem propriedades básicas mais pronunciadas. Entre outros actinídeos trivalentes, Ac3+ é menos ácido, ou seja, tem a tendência mais fraca de hidrolisar em soluções aquosas.
O tório é bastante ativo quimicamente. Devido à falta de elétrons nos orbitais 6d e 5f, os compostos de tório tetravalente são incolores. Em pH < 3, as soluções de sais de tório são dominadas pelos cátions [Th(H2O)8]4+. O íon Th4+ é relativamente grande, e dependendo do número de coordenação pode ter um raio entre 0,95 e 1,14 Å. Como resultado, os sais de tório têm uma tendência fraca para hidrolisar. A habilidade distintiva dos sais de tório é sua alta solubilidade tanto em água quanto em solventes orgânicos polares.
O protactínio exibe dois estados de valência; o +5 é estável, e o estado +4 oxida-se facilmente a protactínio(V). Assim, o protactínio tetravalente em soluções é obtido pela ação de agentes redutores fortes em uma atmosfera de hidrogênio. O protactínio tetravalente é quimicamente semelhante ao urânio (IV) e ao tório (IV). Fluoretos, fosfatos, hipofosfato, iodato e fenilarsonatos de protactínio(IV) são insolúveis em água e ácidos diluídos. O protactínio forma carbonatos solúveis. As propriedades hidrolíticas do protactínio pentavalente são próximas às do tântalo(V) e do nióbio(V). O complexo comportamento químico do protactínio é consequência do início do preenchimento da camada 5f desse elemento.
O urânio tem uma valência de 3 a 6, sendo a última a mais estável. No estado hexavalente, o urânio é muito semelhante aos elementos do grupo 6. Muitos compostos de urânio(IV) e urânio(VI) não são estequiométricos, ou seja, têm composição variável. Por exemplo, a fórmula química real do dióxido de urânio é UO2+x, onde x varia entre −0,4 e 0,32. Os compostos de urânio (VI) são oxidantes fracos. A maioria deles contém o linear "uranyl" grupo, UO2+
2. Entre 4 e 6 ligantes podem ser acomodados em um plano equatorial perpendicular ao grupo uranila. O grupo uranila atua como um ácido duro e forma complexos mais fortes com ligantes doadores de oxigênio do que com ligantes doadores de nitrogênio. NpO2+
2 e PuO2+
2 também são a forma comum de Np e Pu no estado de oxidação +6. Os compostos de urânio(IV) exibem propriedades redutoras, por exemplo, são facilmente oxidados pelo oxigênio atmosférico. O urânio(III) é um agente redutor muito forte. Devido à presença de d-shell, o urânio (assim como muitos outros actinídeos) forma compostos organometálicos, como UIII(C5H5)3 e UIV(C5H5)4.
Neptúnio tem estados de valência de 3 a 7, que podem ser observados simultaneamente em soluções. O estado mais estável em solução é +5, mas a valência +4 é preferida em compostos sólidos de neptúnio. Neptúnio metálico é muito reativo. Os íons de netúnio são propensos à hidrólise e à formação de compostos de coordenação.
O plutônio também exibe estados de valência entre 3 e 7 inclusive e, portanto, é quimicamente semelhante ao neptúnio e ao urânio. É altamente reativo e forma rapidamente um filme de óxido no ar. O plutônio reage com o hidrogênio mesmo em temperaturas tão baixas quanto 25–50 °C; também forma facilmente haletos e compostos intermetálicos. As reações de hidrólise de íons de plutônio de diferentes estados de oxidação são bastante diversas. Plutônio(V) pode entrar em reações de polimerização.
A maior diversidade química entre os actinídeos é observada no amerício, que pode ter valência entre 2 e 6. O amerício bivalente é obtido apenas em compostos secos e soluções não aquosas (acetonitrila). Os estados de oxidação +3, +5 e +6 são típicos para soluções aquosas, mas também no estado sólido. O amerício tetravalente forma compostos sólidos estáveis (dióxido, flúor e hidróxido), bem como complexos em soluções aquosas. Foi relatado que em solução alcalina o amerício pode ser oxidado ao estado heptavalente, mas esses dados se mostraram errôneos. A valência mais estável do amerício é 3 nas soluções aquosas e 3 ou 4 nos compostos sólidos.
A valência 3 é dominante em todos os elementos subseqüentes até o laurêncio (com exceção do nobélio). O cúrio pode ser tetravalente em sólidos (fluoreto, dióxido). O berquélio, juntamente com uma valência de +3, apresenta também a valência de +4, mais estável que a do cúrio; a valência 4 é observada em flúor e dióxido sólidos. A estabilidade do Bk4+ em solução aquosa é próxima à do Ce4+. Apenas a valência 3 foi observada para califórnio, einstênio e férmio. O estado divalente é comprovado para mendelévio e nobélio, sendo que no nobélio é mais estável que o estado trivalente. O laurêncio mostra valência 3 tanto em soluções quanto em sólidos.
O potencial redox EM4+AnO22+(em inglês) Não. {M^{4}+}{AnO2^{2}+}}}}}}}}} aumentos de -0,32 V em urânio, através de 0,34 V (Np) e 1,04 V (Pu) para 1,34 V em americium revelando a crescente capacidade de redução do An4+ íon de americium a urânio. Todos os actinides formam AnH3 hidretos de cor preta com propriedades semelhantes a sal. Actinides também produzem carbonetos com a fórmula geral de AnC ou AnC2 (U)2C3 para urânio) bem como sulfitos An2S3 e AnS2.
Compostos
Óxidos e hidróxidos
| Composto | Cor | Simetria de cristal, tipo | Constantes de treino, Å | Densidade, g/cm3 | Temperatura, °C | ||
|---|---|---|---|---|---|---|---|
| um | b) | c | |||||
| Acções2O3 | Branco | Hexagonal, La2O3 | 4.07 | - Não. | 6.29 | 9.19 | – |
| Pao2 | - Não. | Cúbico, CaF2 | 5.505 | - Não. | - Não. | - Não. | - Não. |
| Pai.2O5 | Branco | Cubic, CaF2 Cubic Tetragonal Hexagonal Rhombohedral Ortodoxo | 5.446 10.891 5.429 3.817 5.425 6.92 | - Não. - Não. - Não. - Não. - Não. 4.02 | - Não. 10.992 5.503 13.22 - Não. 4. | - Não. | 700 700–1100 1000 1000–1200 1240–1400 – |
| O quê?2 | Sem cor | Cubic | 5.59 | - Não. | - Não. | 9.87 | – |
| UO2 | Preto-marrom | Cubic | 5.47 | - Não. | - Não. | 10.9 | – |
| NpO2 | Castanho verde | Cúbico, CaF2 | 5.424 | - Não. | - Não. | 1 de Janeiro | – |
| Pue! | Preto | Cubic, NaCl | 4.96 | - Não. | - Não. | 13.9 | – |
| Pue!2 | Azeite verde | Cubic | 5.39 | - Não. | - Não. | 11.44 | – |
| Am2O3 | Vermelho-marrom Vermelho-marrom | Cubic, Mn2O3 Hexagonal, La2O3 | 11.03 3.817 | - Não. | - Não. 5.971 | 10.57 1,7 | – |
| AmO2 | Preto | Cúbico, CaF2 | 5.376 | - Não. | - Não. | - Não. | - Não. |
| Cm2O3 | Branco - Não. - Não. | Cubic, Mn2O2 Hexagonal, LaCl3 Monoclínica, Sm2O3 | 11.01 3.80 14.28 | - Não. - Não. 3.65 | - Não. 6 8.9 | 1,7 | – |
| CmO2 | Preto | Cúbico, CaF2 | 5.37 | - Não. | - Não. | - Não. | - Não. |
| Bk.2O3 | Castanho claro | Cubic, Mn2O3 | 10.886 | - Não. | - Não. | - Não. | - Não. |
| BkO2 | Vermelho-marrom | Cúbico, CaF2 | 5.33 | - Não. | - Não. | - Não. | - Não. |
| Cf2O3 | Sem cor Amarelo - Não. | Cubic, Mn2O3 Monoclínica, Sm2O3 Hexagonal, La2O3 | 10.79 14.12 3.72 | - Não. 3.59 - Não. | - Não. 8.80 5.96 | - Não. | - Não. |
| CfO2 | Preto | Cubic | 5.31 | - Não. | - Não. | - Não. | - Não. |
| E2O3 | - Não. | Cubic, Mn2O3 Monoclínico Hexagonal, La2O3 | 10.07 14.1 3.7 | - Não. 3.59 - Não. | - Não. 8.80 6 | - Não. | - Não. |
| Estado de oxidação | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| +3 | Puxa.2O3 | Am2O3 | Cm2O3 | Bk.2O3 | Cf2O3 | E2O3 | |||||
| + | O quê?2 | Pao2 | UO2 | NpO2 | Pue!2 | AmO2 | CmO2 | BkO2 | CfO2 | ||
| +5 | Pai.2O5 | U2O5 | Np2O5 | ||||||||
| +5,+6 | U3O8 | ||||||||||
| +6 | UO3 |
- Um – Actinide
**Dependendo nos isótopos
Alguns actinídeos podem existir em várias formas de óxido, como An2O3, AnO2, An2O5 e AnO3. Para todos os actinídeos, os óxidos AnO3 são anfóteros e An2O3, AnO2 e An 2O5 são básicos, reagem facilmente com a água, formando bases:
- Um2O3 + 3 H2O → 2 An(OH)3.
Essas bases são pouco solúveis em água e por sua atividade estão próximas dos hidróxidos de metais de terras raras. Np(OH)3 ainda não foi sintetizado, Pu(OH)3 tem uma cor azul enquanto Am(OH)3 é rosa e hidróxido de cúrio Cm(OH)3 é incolor. Bk(OH)3 e Cf(OH)3 também são conhecidos, assim como os hidróxidos tetravalentes para Np, Pu e Am e pentavalentes para Np e Am.
A base mais forte é de actínio. Todos os compostos de actínio são incolores, exceto o sulfeto de actínio preto (Ac2S3). Dióxidos de actinídeos tetravalentes cristalizam no sistema cúbico, assim como no fluoreto de cálcio.
O tório reagindo com o oxigênio forma exclusivamente o dióxido:
- [{ce {1000^{circ }C}}]overbrace {ThO2} ^{Thorium~dioxide}}}}" xmlns="http://www.w3.org/1998/Math/MathML">O quê?+O2→1000∘ ∘ CO quê?2⏞ ⏞ Thoriumdióxido de titânioNão. {Th{}+O2->[{ce {1000^{circ }C}}overbrace {ThO2} ^{Thorium~dioxide}}}}}}}}
[{ce {1000^{circ }C}}]overbrace {ThO2} ^{Thorium~dioxide}}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/13e4a27b9ed3d03fc5420ed4a04020bf77562406" style="vertical-align: -1.005ex; width:29.031ex; height:6.343ex;"/>
O dióxido de tório é um material refratário com o ponto de fusão mais alto entre todos os óxidos conhecidos (3390°C). Adicionar 0,8–1% ThO2 ao tungstênio estabiliza sua estrutura, de modo que os filamentos dopados tenham melhor estabilidade mecânica às vibrações. Para dissolver ThO2 em ácidos, ele é aquecido a 500–600 °C; o aquecimento acima de 600 °C produz uma forma muito resistente a ácidos e outros reagentes de ThO2. A pequena adição de íons de flúor catalisa a dissolução do bióxido de tório em ácidos.
Foram obtidos dois óxidos de protactínio: PaO2 (preto) e Pa2O5 (branco); o primeiro é isomórfico com ThO2 e o último é mais fácil de obter. Ambos os óxidos são básicos e Pa(OH)5 é uma base fraca e pouco solúvel.
Decomposição de certos sais de urânio, por exemplo UO2(NO3)·6H2O no ar a 400 °C, produz UO laranja ou amarelo3. Este óxido é anfótero e forma vários hidróxidos, sendo o mais estável o hidróxido de uranilo UO2(OH)2. A reação do óxido de urânio(VI) com o hidrogênio resulta em dióxido de urânio, que é semelhante em suas propriedades com ThO2. Este óxido também é básico e corresponde ao hidróxido de urânio (U(OH)4).
Plutônio, neptúnio e amerício formam dois óxidos básicos: An2O3 e AnO2. O trióxido de netúnio é instável; assim, apenas Np3O8 pôde ser obtido até agora. No entanto, os óxidos de plutônio e neptúnio com a fórmula química AnO2 e An2O3 são bem caracterizados.
Sais
- *Um – Actinide
**Dependendo nos isótopos
| Composto | Cor | Simetria de cristal, tipo | Constantes de treino, Å | Densidade, g/cm3 | ||
|---|---|---|---|---|---|---|
| um | b) | c | ||||
| AcF3 | Branco | Hexagonal, LaF3 | 4.27 | - Não. | 7.53 | 7.88 |
| Pai.4 | Castanho escuro | Monoclínico | 12.7 | 10,7 | 8.42 | – |
| Pai.5 | Preto | Tetragonal, β-UF5 | 11.53 | - Não. | 5.19 | – |
| O4 | Sem cor | Monoclínico | 13 | 10.99 | 8.58 | 5.71 |
| FOI3 | Reddish-purple | Hexagonal | 7.18 | - Não. | 7.34 | 8.54 |
| FOI4 | Verde | Monoclínico | 11.27 | 10,75 | 8.40 | 6.72 |
| α-UF5 | Blusa | Tetragonal | 6.52 | - Não. | 4.47 | 5.81 |
| β-UF5 | Blusa | Tetragonal | 11.47 | - Não. | 5.20 | 6.45 |
| FOI6 | Amarelo | Ortodoxo | 9.92 | 8.95 | 5.19 | 5.06 |
| NpF3 | Preto ou roxo | Hexagonal | 7.129 | - Não. | 7.288 | 9.12 |
| NpF4 | Luz verde | Monoclínico | 12.67 | 10.62 | 8.41 | 6.8 |
| NpF6 | Laranja | Ortodoxo | 9.91 | 8.97 | 5.21 | 5 |
| Puf3 | Violeta azul | Trigonal | 7.09 | - Não. | 7.25 | 9.32 |
| Puf4 | Pale marrom | Monoclínico | 12.59 | 10.57 | 8.28 | 6.96 |
| Puf6 | Vermelho-marrom | Ortodoxo | 9,95 | 9.02 | 3.26 | 4.86 |
| AmF3 | Bege rosa ou luz | hexagonal, LaF3 | 7.04 | - Não. | 7.255 | 9.53 |
| AmF4 | Laranja-vermelho | Monoclínico | 12.53 | 10.51 | 8.20 | – |
| CmF3 | De marrom a branco | Hexagonal | 4.041 | - Não. | 7.179 | 9,7 |
| CmF4 | Amarelo | Monoclínica, UF4 | 12.51 | 10.51 | 8.20 | – |
| BkF3 | Amarelo-verde | Trigonal, LaF3 Ortopedia, YF3 | 6.97 6.7 | - Não. 7.09 | 7.14 4.41 | 10.15 9,7 |
| BkF4 | - Não. | Monoclínica, UF4 | 12.47 | 10.58 | 8.17 | – |
| CfF3 | - Não. - Não. | Trigonal, LaF3 Ortopedia, YF3 | 6.94 6.65 | - Não. 7.04 | 7.10 4.39 | – |
| CfF4 | - Não. - Não. | Monoclínica, UF4 Monoclínica, UF4 | 1.242. 1.233 | 1.047 1.040 | 8.126 8.113 | – |
Os actinídeos reagem facilmente com halogênios formando sais com as fórmulas MX3 e MX4 (X = halogênio). Assim, o primeiro composto de berquélio, BkCl3, foi sintetizado em 1962 com uma quantidade de 3 nanogramas. Como os halogênios dos elementos de terras raras, os cloretos, brometos e iodetos de actinídeos são solúveis em água e os fluoretos são insolúveis. O urânio produz facilmente um hexafluoreto incolor, que sublima a uma temperatura de 56,5 °C; devido à sua volatilidade, é utilizado na separação de isótopos de urânio com centrífuga de gás ou difusão gasosa. Os hexafluoretos de actinídeos têm propriedades próximas dos anidridos. Eles são muito sensíveis à umidade e hidrolisam formando AnO2F2. O pentacloreto e o hexacloreto negro de urânio foram sintetizados, mas ambos são instáveis.
A ação dos ácidos nos actinídeos produz sais e, se os ácidos não são oxidantes, o actinídeo no sal está no estado de baixa valência:
- U + 2 H2Então...4 → U (SO)4)2 + 2 H2
- 2 Pu + 6 HCl → 2 PuCl3 + 3 H2
No entanto, nessas reações, o hidrogênio em regeneração pode reagir com o metal, formando o hidreto correspondente. O urânio reage com ácidos e água muito mais facilmente do que o tório.
Os sais de actinídeos também podem ser obtidos pela dissolução dos hidróxidos correspondentes em ácidos. Nitratos, cloretos, sulfatos e percloratos de actinídeos são solúveis em água. Ao cristalizar a partir de soluções aquosas, esses sais formam hidratos, como Th(NO3)4·6H2O, Th(SO4)2·9H2O e Pu2(SO4)3·7H2O. Sais de actinídeos de alta valência hidrolisam facilmente. Assim, sulfato incolor, cloreto, perclorato e nitrato de tório se transformam em sais básicos com as fórmulas Th(OH)2SO4 e Th(OH)3NÃO3. A solubilidade e insolubilidade dos actinídeos trivalentes e tetravalentes é semelhante à dos sais de lantanídeos. Portanto fosfatos, fluoretos, oxalatos, iodatos e carbonatos de actinidas são fracamente solúveis em água; eles precipitam como hidratos, como ThF4·3H2O e Th(CrO4)2·3H 2O.
Actinídeos com estado de oxidação +6, exceto os cátions do tipo AnO22+, forma [AnO4] 2−, [An2O7]2− e outros ânions complexos. Por exemplo, urânio, neptúnio e plutônio formam sais de Na2UO4 (uranato) e (NH4)2U2O7 tipos (diuranato). Em comparação com os lantanídeos, os actinídeos formam mais facilmente compostos de coordenação, e essa capacidade aumenta com a valência do actinídeo. Os actinídeos trivalentes não formam compostos de coordenação de flúor, enquanto o tório tetravalente forma K2ThF6, KThF5 e até K5ThF9 complexos. O tório também forma os sulfatos correspondentes (por exemplo Na2SO4·Th(SO4)2·5H 2O), nitratos e tiocianatos. Sais com a fórmula geral An2Th(NO3)6·nH2O são de natureza de coordenação, com o número de coordenação do tório igual a 12. Ainda mais fácil é produzir sais complexos de actinídeos pentavalentes e hexavalentes. Os compostos de coordenação mais estáveis dos actinídeos – tório tetravalente e urânio – são obtidos em reações com dicetonas, por ex. acetilacetona.
Aplicativos
Embora os actinídeos tenham algumas aplicações estabelecidas na vida diária, como em detectores de fumaça (amerício) e mantos de gás (tório), eles são usados principalmente em armas nucleares e como combustível em reatores nucleares. As duas últimas áreas exploram a propriedade dos actinídeos de liberar enorme energia em reações nucleares, que sob certas condições podem se tornar reações em cadeia autossustentáveis.
O isótopo mais importante para aplicações de energia nuclear é o urânio-235. É utilizado no reator térmico, e sua concentração em urânio natural não ultrapassa 0,72%. Este isótopo absorve fortemente os nêutrons térmicos liberando muita energia. Um ato de fissão de 1 grama de 235U se converte em cerca de 1 MW·dia. O mais importante é que 235
92U
emite mais nêutrons do que absorve; ao atingir a massa crítica, 235
92U
entra em uma reação em cadeia autossustentável. Normalmente, o núcleo de urânio é dividido em dois fragmentos com a liberação de 2 a 3 nêutrons, por exemplo:
- 23592U + 10. ⟶ ⟶ 115
45Rh
+ 118
47Agrupamento
+ 310.
Outros isótopos de actinídeos promissores para a energia nuclear são o tório-232 e seu produto do ciclo do combustível do tório, o urânio-233.
| Reator nuclear |
| O núcleo da maioria dos reatores nucleares da Geração II contém um conjunto de hastes de metal ocas, geralmente feitas de ligas de zircônio, cheias de pellets de combustível nuclear sólido – principalmente óxido, carboneto, nitreto ou monossulfeto de urânio, plutônio ou tório, ou sua mistura (o chamado combustível MOX). O combustível mais comum é o óxido de urânio-235. Os neutrões rápidos são retardados por moderadores, que contêm água, carbono, deutério ou berílio, como neutrões térmicos para aumentar a eficiência de sua interação com urânio-235. A taxa de reação nuclear é controlada introduzindo hastes adicionais feitas de boro ou cádmio ou um líquido absorvente, geralmente ácido bórico. Os reatores para a produção de plutônio são chamados de reator de criadores ou criadores; eles têm um projeto diferente e usam neutrões rápidos. |
A emissão de nêutrons durante a fissão do urânio é importante não apenas para manter a reação nuclear em cadeia, mas também para a síntese dos actinídeos mais pesados. O urânio-239 converte-se via decaimento β em plutônio-239, que, como o urânio-235, é capaz de fissão espontânea. Os primeiros reatores nucleares do mundo foram construídos não para energia, mas para produzir plutônio-239 para armas nucleares.
Cerca de metade do tório produzido é usado como material emissor de luz de mantos de gás. O tório também é adicionado em ligas multicomponentes de magnésio e zinco. Assim, as ligas Mg-Th são leves e fortes, mas também possuem alto ponto de fusão e ductilidade e, portanto, são amplamente utilizadas na indústria da aviação e na produção de mísseis. O tório também possui boas propriedades de emissão de elétrons, com longa vida útil e baixa barreira potencial para a emissão. O conteúdo relativo de isótopos de tório e urânio é amplamente utilizado para estimar a idade de vários objetos, incluindo estrelas (ver datação radiométrica).
A principal aplicação do plutônio tem sido em armas nucleares, onde o isótopo plutônio-239 foi um componente chave devido à sua facilidade de fissão e disponibilidade. Projetos baseados em plutônio permitem reduzir a massa crítica para cerca de um terço daquela do urânio-235. As bombas de plutônio tipo "Fat Man" produzidas durante o Projeto Manhattan usaram compressão explosiva de plutônio para obter densidades significativamente mais altas que o normal, combinadas com uma fonte central de nêutrons para iniciar a reação e aumentar a eficiência. Assim, apenas 6,2 kg de plutônio foram necessários para um rendimento explosivo equivalente a 20 quilotons de TNT. (Consulte também Projeto de armas nucleares.) Hipoteticamente, apenas 4 kg de plutônio - e talvez até menos - poderiam ser usados para fazer uma única bomba atômica usando projetos de montagem muito sofisticados.
O plutônio-238 é um isótopo potencialmente mais eficiente para reatores nucleares, pois tem massa crítica menor que o urânio-235, mas continua liberando muita energia térmica (0,56 W/g) por decaimento mesmo quando a reação de fissão em cadeia é interrompida por hastes de controle. Sua aplicação é limitada pelo alto preço (cerca de US$ 1.000/g). Este isótopo tem sido utilizado em termopilhas e sistemas de destilação de água de alguns satélites e estações espaciais. Assim, as espaçonaves Galileo e Apollo (por exemplo, Apollo 14) tinham aquecedores alimentados por quilogramas de óxido de plutônio-238; esse calor também é transformado em eletricidade com termopilhas. O decaimento do plutônio-238 produz partículas alfa relativamente inofensivas e não é acompanhada por radiação gama. Portanto, esse isótopo (~160 mg) é usado como fonte de energia em marcapassos cardíacos, onde dura cerca de 5 vezes mais que as baterias convencionais.
Actinium-227 é usado como fonte de nêutrons. Sua alta energia específica (14,5 W/g) e a possibilidade de obtenção de quantidades significativas de compostos termicamente estáveis são atrativos para uso em geradores termoelétricos de longa duração para uso remoto. 228Ac é usado como indicador de radioatividade em pesquisas químicas, pois emite elétrons de alta energia (2,18 MeV) que podem ser facilmente detectados. As misturas de 228Ac-228Ra são amplamente utilizadas como uma fonte gama intensa na indústria e na medicina.
O desenvolvimento de materiais autobrilhantes dopados com actinídeos com matrizes cristalinas duráveis é uma nova área de utilização de actinídeos, pois a adição de radionuclídeos emissores de alfa a alguns vidros e cristais pode conferir luminescência.
Toxicidade
Substâncias radioativas podem prejudicar a saúde humana através de (i) contaminação local da pele, (ii) exposição interna devido à ingestão de isótopos radioativos e (iii) superexposição externa por atividade β e radiação γ. Juntamente com os elementos rádio e transurânio, o actínio é um dos venenos radioativos mais perigosos com alta atividade α específica. A característica mais importante do actínio é sua capacidade de acumular e permanecer na camada superficial dos esqueletos. No estágio inicial do envenenamento, o actínio se acumula no fígado. Outro perigo do actínio é que ele sofre decaimento radioativo mais rápido do que é excretado. A adsorção do trato digestivo é muito menor (~0,05%) para o actínio do que para o rádio.
O protactínio no corpo tende a se acumular nos rins e nos ossos. A dose máxima segura de protactínio no corpo humano é de 0,03 µCi que corresponde a 0,5 microgramas de 231Pa. Este isótopo, que pode estar presente no ar como aerossol, é 2,5×108 vezes mais tóxico que o ácido cianídrico.
O plutônio, quando entra no corpo através do ar, comida ou sangue (por exemplo, uma ferida), se instala principalmente nos pulmões, fígado e ossos, com apenas cerca de 10% indo para outros órgãos, e permanece lá por décadas. O longo tempo de residência do plutônio no corpo é parcialmente explicado por sua baixa solubilidade em água. Alguns isótopos de plutônio emitem radiação α ionizante, que danifica as células circundantes. A dose letal média (LD50) por 30 dias em cães após injeção intravenosa de plutônio é de 0,32 miligrama por kg de massa corporal e, portanto, a dose letal para humanos é de aproximadamente 22 mg para uma pessoa com 70 anos kg; a quantidade para exposição respiratória deve ser aproximadamente quatro vezes maior. Outra estimativa assume que o plutônio é 50 vezes menos tóxico que o rádio e, portanto, o conteúdo permitido de plutônio no corpo deve ser de 5 µg ou 0,3 µCi. Tal quantidade é quase invisível ao microscópio. Após testes em animais, essa dose máxima permitida foi reduzida para 0,65 µg ou 0,04 µCi. Estudos em animais também revelaram que a rota mais perigosa de exposição ao plutônio é a inalação, após a qual 5 a 25% das substâncias inaladas são retidas no corpo. Dependendo do tamanho das partículas e da solubilidade dos compostos de plutônio, o plutônio é localizado nos pulmões ou no sistema linfático, ou é absorvido no sangue e depois transportado para o fígado e os ossos. A contaminação via alimentos é a forma menos provável. Neste caso, apenas cerca de 0,05% dos compostos solúveis e 0,01% insolúveis de plutônio são absorvidos pelo sangue e o restante é excretado. A exposição da pele danificada ao plutônio reteria quase 100% dele.
O uso de actinídeos em combustível nuclear, fontes radioativas seladas ou materiais avançados, como cristais autobrilhantes, traz muitos benefícios potenciais. No entanto, uma séria preocupação é a radiotoxicidade extremamente alta dos actinídeos e sua migração no ambiente. O uso de formas quimicamente instáveis de actinídeos em MOX e fontes radioativas seladas não é apropriado pelos padrões de segurança modernos. Há um desafio para desenvolver materiais contendo actinídeos estáveis e duráveis, que forneçam armazenamento, uso e disposição final seguros. Uma necessidade chave é a aplicação de soluções sólidas de actinídeos em fases hospedeiras cristalinas duráveis.
Propriedades nucleares
| Nuclide | Meio-vida | Modo de decadência | Fração de ramificação | Fonte |
|---|---|---|---|---|
| 206 81? | 4.202 ± 0,011 m | β- Sim. | 1.0. | LNHB |
| 208 81? | 3.060 ± 0,008 m | β- Sim. | 1.0. | BIPM-5 |
| 210 82PB | 22.20 ± 0,22 y | β- Sim. | 1.0. | FED |
| α | (1.9 ± 0,4 x 10)-8 | |||
| 211 82PB | 36.1 ± 0,2 m | β- Sim. | 1.0. | FED |
| 212 82PB | 10,64 ± 0,01 h | β- Sim. | 1.0. | BIPM-5 |
| 214 82PB | 26.8 ± 0,9 m | β- Sim. | 1.0. | FED |
| 211 83B. | 2.14 ± 0,02 m | β- Sim. | 0,00276 ± 0,00004 | FED |
| α | 0,99724 ± 0,00004 | |||
| 212 83B. | 60,54 ± 0,06 m | α | 0,353 ± 0,0007 | BIPM-5 |
| β- Sim. | 0,6407 ± 0,0007 | |||
| 214 83B. | 19.9 ± 0,4 m | α | 0,00021 ± 0,00001 | FED |
| β- Sim. | 0,99979 ± 0,00001 | |||
| 210 84Po | 138.376 ± 0,002 d | α | 1.0. | FED |
| 219 86RN | 3.96 ± 0,01 s | α | 1.0. | FED |
| 220 220 86RN | 55,8 ± 0,3 s | α | 1.0. | BIPM-5 |
| 221 87Pe. | 4.9 ± 0,2 m | β- Sim. | 0,00005 ± 0,00003 | FED |
| α | 0,99995 ± 0,00003 | |||
| 223 88Ra | 11,43 ± 0,05 d | α | 1.0. | FED |
| 14C | (8,9 ± 0,4 x 10)- Sim. | |||
| 224 88Ra | 3.627 ± 0,007 d | α | 1.0. | BIPM-5 |
| 225 88Ra | 14,9 ± 0,2 d | β- Sim. | 1.0. | FED |
| 226 88Ra | (1.600 ± 0,007) x 103 Sim. | α | 1.0. | BIPM-5 |
| 228 88Ra | 5.75 ± 0,03 y | β- Sim. | 1.0. | FED |
| 224 89Acções | 2.78 ± 0,17 h | α | +0.020 -0.014 | FED |
| CE | +0.014 -0.020 | |||
| 225 89Acções | 10,0 ± 0,1 d | α | 1.0. | FED |
| 227 89Acções | 21.772 ± 0,003 y | α | 0,01380 ± 0,00004 | FED |
| β- Sim. | 0,98620 ± 0,00004 | |||
| 228 89Acções | 6.15 ± 0,02 h | β- Sim. | 1.0. | FED |
| 227 90O quê? | 18.718 ± 0,005 d | α | 1.0. | BIPM-5 |
| 228 90O quê? | 698.60 ± 0,23 d | α | 1.0. | BIPM-5 |
| 229 90O quê? | (7,34 ± 0,16) x 103 Sim. | α | 1.0. | FED |
| 230 90O quê? | (7.538 ± 0,030) x 104 Sim. | α | 1.0. | FED |
| SF | ≤ 4 x 10-13 | |||
| 231 90O quê? | 25,52 ± 0,01 h | β- Sim. | 1.0. | FED |
| α | 4 x 10-13 | |||
| 232 90O quê? | (1.405 ± 0,006) x 1010. Sim. | α | 1.0. | FED |
| SF | (1.1 ± 0,4 x 10)- Sim. | |||
| 233 90O quê? | 22,15 ± 0,15 m | β- Sim. | 1.0. | LNHB |
| 234 90O quê? | 24,10 ± 0,03 d | β- Sim. | 1.0. | FED |
| 231 91Pai. | (3.276 ± 0,011) x 104 Sim. | α | 1.0. | FED |
| SF | ≤ 3 x 10-12. | |||
| 232 91Pai. | 1,32 ± 0,02 d | CE | 0,00003 ± 0,00001 | FED |
| β- Sim. | 0,99997 ± 0,00001 | |||
| 233 91Pai. | 26.98 ± 0,02 d | β- Sim. | 1.0. | LNHB |
| 234 91Pai. | 6.70 ± 0,05 h | β- Sim. | 1.0. | FED |
| 234 m 91Pai. | 1.159 ± 0,016 m | - Sim. | 0.0016 ± 0,0002 | IAEA-CRP-XG |
| β- Sim. | 0,9984 ± 0,0002 | |||
| 232 92U | 68,9 ± 0,4 y | α | 1.0. | FED |
| SF | ||||
| 233 92U | (1.592 ± 0,002) x 105 Sim. | α | 1.0. | FED |
| SF | ||||
| 234 92U | (2.455 ± 0,006) x 105 Sim. | α | 1.0. | LNHB |
| SF | (1.6 ± 0,2) x 10- Sim. | |||
| 235m 92U | 26 ± 1 m | - Sim. | 1.0. | FED |
| 235 92U | (7.038 ± 0,005) x 108 Sim. | α | 1.0. | FED |
| SF | (7 ± 2) x 10- Sim. | |||
| 236 92U | (2.342 ± 0,004) x 107 Sim. | α | 1.0. | FED |
| SF | (9,4 ± 0,4 x 10)- Sim. | |||
| 237 92U | 6.749 ± 0,016 d | β- Sim. | 1.0. | LNHB |
| 238 92U | (4.468 ± 0,005) x 109 Sim. | α | 1.0. | LNHB |
| SF | (5,45 ± 0,04) x 10-7 | |||
| 239 92U | 23,45 ± 0,02 m | β- Sim. | 1.0. | FED |
| 236 93Np | (1,55 ± 0,08) x 105 Sim. | α | 0.0016 ± 0,0006 | LNHB |
| β- Sim. | 0,120 ± 0,006 | |||
| CE | 0,78 ± 0,006 | |||
| 236 m 93Np | 22.5 ± 0,4 h | β- Sim. | 0,47 ± 0,01 | LNHB |
| CE | 0,53 ± 0,01 | |||
| 237 93Np | (2.144 ± 0,007) x 106 Sim. | α | 1.0. | FED |
| SF | ||||
| 238 93Np | 2.117 ± 0,002 d | β- Sim. | 1.0. | FED |
| 239 93Np | 2.356 ± 0,003 d | β- Sim. | 1.0. | FED |
| 236 94Puxa. | 2,858 ± 0,008 y | α | 1.0. | FED |
| LNHB | Laboratoire Nacional Henri Becquerel, Dados recomendados,
http://www.nucleide.org/DDEP_WG/DDEPdata.htm, 3 de Outubro de 2006. |
| BIPM-5 | M.-M. Bé, V. Chisté, C. Dulieu, E. Browne, V. Chechev, N. Kuzmenko, R. Helmer,
A. Nichols, E. Schönfeld, R. Dersch, Monographie BIPM-5, Tabela de Radionuclides, Vol. 2 – A = 151 a 242, 2004. |
| FED | «Evaluated Nuclear Structure Data File» (em inglês). Laboratório Nacional de Brookhaven. Retrieved 15 de Novembro 2006. |
| IAEA-CRP-XG | M.-M. Bé, V. P. Chechev, R. Dersch, O. A. M. Helene, R. G. Helmer, M. Herman,
S. Hlavác, A. Marcinkowski, G. L. Molnár, A. L. Nichols, E. Schönfeld, V. R. Vanin, M. J. Woods, IAEA CRP "Update of X Ray and Gamma Ray Decay Data Standards for Detector Calibration and Other Applications", IAEA Scientific and Technical Information report STI/PUB/1287, May 2007, International Atomic Energy Agency, Vienna, Austria, ISBN 92-0-113606-4. |
Contenido relacionado
Citrato de lítio
Isomeria cis-trans
Bronze