Yoduro de cobre (I)
Copper(I) iodide es el compuesto inorgánico con la fórmula CuI. También se conoce como iodide glorioso. Es útil en una variedad de aplicaciones que van desde la síntesis orgánica a la siembra de nubes.
El yoduro de cobre (I) es blanco, pero las muestras a menudo tienen un aspecto tostado o incluso, cuando se encuentra en la naturaleza como mineral raro de pantano, marrón rojizo, pero ese color se debe a la presencia de impurezas. Es común que las muestras de compuestos que contienen yoduro se decoloren debido a la fácil oxidación aeróbica del anión yoduro a yodo molecular.
Estructura
El yoduro de cobre (I), como la mayoría de los haluros metálicos binarios (que contienen solo dos elementos), es un polímero inorgánico. Tiene un rico diagrama de fases, lo que significa que existe en varias formas cristalinas. Adopta una estructura de blenda de zinc por debajo de 390 °C (γ-CuI), una estructura de wurtzita entre 390 y 440 °C (β-CuI) y una estructura de sal gema por encima de 440 °C (α-CuI). Los iones están coordinados tetraédricamente cuando están en la blenda de zinc o en la estructura de wurtzita, con una distancia Cu-I de 2,338 Å. El bromuro de cobre (I) y el cloruro de cobre (I) también se transforman de la estructura de blenda de zinc a la estructura de wurtzita a 405 y 435 °C, respectivamente. Por lo tanto, cuanto mayor sea la longitud del enlace de haluro de cobre, menor debe ser la temperatura para cambiar la estructura de la estructura de blenda de zinc a la estructura de wurtzita. Las distancias interatómicas en el bromuro de cobre (I) y el cloruro de cobre (I) son 2,173 y 2,051 Å, respectivamente. De acuerdo con su covalencia, CuI es un semiconductor de tipo p.
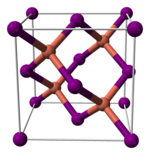 | 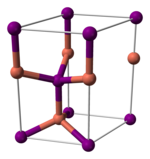 |  |
| γ-CuI | β-CuI | α-CuI |
Preparación
El yoduro de cobre (I) se puede preparar calentando yodo y cobre en ácido yodhídrico concentrado.
Sin embargo, en el laboratorio, el yoduro de cobre (I) se prepara simplemente mezclando una solución acuosa de yoduro de potasio y una sal de cobre (II) soluble, como el sulfato de cobre (II).
- Cu2+ + 2I− → CuI + 0.5 I2
Reacciones
El yoduro de cobre (I) reacciona con los vapores de mercurio para formar tetrayodomercurato de cobre:
- 4 CuI + Hg → Cu2HgI4 + 2 Cu
Esta reacción se puede utilizar para la detección de mercurio ya que el cambio de color del blanco (CuI) al marrón (Cu2HgI4) es dramático.
El yoduro de cobre(I) se utiliza en la síntesis de grupos de Cu(I) como Cu6I−7.
El yoduro de cobre (I) se disuelve en acetonitrilo, produciendo diversos complejos. Tras la cristalización, se pueden aislar compuestos moleculares o poliméricos. También se observa disolución cuando se utiliza una solución del agente complejante apropiado en acetona o cloroformo. Por ejemplo, se pueden utilizar tiourea y sus derivados. Los sólidos que cristalizan a partir de esas soluciones están compuestos de cadenas inorgánicas híbridas.
Usos
En combinación con ligandos 1,2- o 1,3-diamina, CuI cataliza la conversión de bromuros de arilo, heteroarilo y vinilo en los yoduros correspondientes. El NaI es la fuente típica de yoduro y el dioxano es un disolvente típico (ver reacción aromática de Finkelstein).
CuI se utiliza como cocatalizador con catalizador de paladio en el acoplamiento Sonogashira.
El CuI se utiliza en la siembra de nubes, alterando la cantidad o el tipo de precipitación de una nube, o su estructura, dispersando sustancias en la atmósfera que aumentan la capacidad del agua para formar gotas o cristales. CuI proporciona una esfera para que la humedad de la nube se condense, lo que provoca que la precipitación aumente y la densidad de las nubes disminuya.
Las propiedades estructurales del CuI le permiten estabilizar el calor del nailon en industrias de alfombras comerciales y residenciales, accesorios de motores de automóviles y otros mercados donde la durabilidad y el peso son un factor.
El CuI se utiliza como fuente de yodo dietético en la sal de mesa y en los piensos.
Contenido relacionado
Selenocisteína
Estados de la materia
Svante Arrhenius
Plasma (física)
Materia